GO/Cu2O硅烷复合涂层对水泥基材料微生物污损防护效果的研究
2023-02-02李绍纯刘彦岑段玉莹
张 浩,李绍纯,刘 昂,刘彦岑,段玉莹
(青岛理工大学土木工程学院,山东青岛 266033)
0 引言
在海洋和污水等富含微生物的环境中,混凝土结构不仅会受到常规的物理和化学因素破坏,还会遭受严重的微生物腐蚀破坏[1]。微生物容易在混凝土表面附着、生长,造成污损。此外,微生物代谢产生的生物酸会分解混凝土中的水化产物,生成膨胀性的石膏和钙矾石,从而导致混凝土表层损伤、脱落,甚至引起开裂和钢筋锈蚀,对混凝土结构的稳定性造成极大的威胁[2]。
为了应对混凝土微生物腐蚀,当今主流的保护措施包括表面涂层保护、生物灭杀技术以及混凝土改性处理,其中表面涂层保护是最简单有效的方法之一[3]。硅烷是一种新型的混凝土涂层材料,可以在混凝土表面形成渗透性防护涂层,通过其低表面能和高疏水性的特点来抑制微生物附着[4]。此外,硅烷涂层具有较强的抗化学侵蚀能力,能够在恶劣的海洋环境中长期使用。
为了提高涂层对微生物腐蚀的防护效果,可以采用在涂层中添加杀菌剂的方法,将涂层保护与生物灭杀技术联合使用。氧化亚铜(Cu2O)作为一种经典的杀菌材料,具有高效、廉价、广谱的优点[5]。然而,Cu2O作为涂层杀菌剂时容易出现团聚、沉淀等问题,导致其抑菌能力减弱,防污作用失效。为了克服这些问题,可以采用氧化石墨烯(GO)作为载体与Cu2O结合,以提高Cu2O的分散性和稳定性,从而更好地发挥出Cu2O的抗菌性能和防污效果[6]。
本研究采用异丁基三乙氧基硅烷(IBTS)作为疏水涂层,分别以纳米Cu2O和氧化石墨烯/氧化亚铜复合物(GO/Cu2O)作为抑菌剂,研制出复合型硅烷防污涂层。通过芽孢杆菌菌液浸渍试验模拟微生物对砂浆的附着,研究复合涂层的防污效果和砂浆表面生物膜的生长规律,以期为我国混凝土微生物腐蚀防护工作提供参考与帮助。
1 试验部分
1.1 材料准备
1.1.1 Cu2O、GO/Cu2O的制备
以硫酸铜作为铜源,聚乙二醇2000(PEG 2000)作为表面活性剂,抗坏血酸作为还原剂,采用化学沉淀法制备Cu2O和GO/Cu2O。在制备Cu2O时,首先将PEG 2000加入硫酸铜溶液中,充分搅拌,然后加入氢氧化钠和抗坏血酸,在50 ℃水浴条件下磁力搅拌2 h。反应完成后,通过过滤、洗涤、干燥,得到淡黄色的Cu2O微粒。在制备GO/Cu2O时,先将GO分散液与硫酸铜溶液混合,超声30 min,后续步骤与Cu2O的制备步骤相同,最后得到黑褐色的GO/Cu2O微粒。
1.1.2 乳液的制备
以IBTS作为硅烷单体,司盘80(Span 80)和平平加O(PPG O)作为乳化剂,PEG 2000作为分散剂,采用溶胶-凝胶法制备硅烷乳液。本试验共制备3种乳液,包括IBTS硅烷乳液(S)、Cu2O/IBTS硅烷乳液(CS)、GO/Cu2O/IBTS硅烷乳液(CGS)。乳液的合成过程如图1所示,首先用均质机分别制备出水相(去离子水、PPG O)和油相(IBTS、Span 80、PEG 2000)。然后,在三口烧瓶中将水相逐滴加入的油相中,恒温恒速搅拌5 h后得到S。在制备CS和CGS时,分别以Cu2O和GO/Cu2O作为外加剂加入水相中,其余步骤与S的制备过程相同。
1.1.3 试块的制备
制备砂浆试块所用水泥为P·O 42.5硅酸盐水泥,细集料为ISO标准砂,配比为m(水泥)∶m(砂)∶m(水)=1∶3∶0.5,模具尺寸为40 mm×40 mm×160 mm。试块制备成型后,置于标准养护室中养护28 d(温度为21 ℃、相对湿度大于95 %)。养护完成后将试块切割为40 mm×40 mm×5 mm的薄片,并将表面打磨平整,最后涂覆涂层。
1.1.4 细菌的培养
微生物菌种为大洋芽孢杆菌、类芽孢杆菌混合菌种。采用LB培养基(胰蛋白胨10.0 g/L、酵母浸粉5.0 g/L、氯化钠10.0 g/L),pH为7.2±0.2。将菌种放入恒温摇床培养箱中培养(温度30 ℃,摇晃速度150 r/min)。
1.2 测试方法
1.2.1 Cu2O、GO/Cu2O、硅烷复合乳液的表征
Cu2O、GO/Cu2O的结构和组成使用D8 Advance型X射线衍射仪(XRD)测定;微粒的形貌使用JEM-1200EX型透射电子显微镜(TEM)测定;GO/Cu2O的热重分析(TGA)使用TG209F3型热重分析仪测定;硅烷乳液的官能团种类(FTIR)使用TENSOR型红外光谱仪测定;涂层的接触角使用SL150型静态接触角测量仪测定,选择试块的不同位置测量3次,测试结果取平均值。
1.2.2 生物膜的扫描电镜(SEM)和激光共聚焦扫描显微镜(CLSM)分析
首先将分别涂覆S、CS、CGS、Cu2O分散液(CW)的试块及空白对照组分别放入250 mL的芽孢杆菌菌液中。将浸渍14 d后的试块取出,切割成5 mm×5 mm×5 mm的正方体。然后,将试块进行固化、洗涤、晾干、喷金处理,使用SU8010型扫描电镜观察试块表面微观形貌。接着,对样品进行荧光染色,使用FV1200型激光共聚焦扫描显微镜对试块表面的细胞进行成像。在CLSM图像中,活细胞呈现绿色斑点,死细胞呈现红色斑点。
1.2.3 试块表面细菌附着数量
将涂覆S、CS、CGS、CW的试块及空白对照组分别放入250 mL的芽孢杆菌菌液中,进行为期1 d、3 d、7 d、14 d、21 d、28 d的菌液浸渍试验。试块从菌液中取出后,用磷酸盐(PBS)缓冲液冲洗3次,然后浸泡在10 mL的PBS缓冲液中,超声清洗20 min,超声清洗会使试块表面附着的细菌脱落到PBS缓冲液中。最后,将PBS缓冲液稀释,用平板菌落计数法统计稀释液中的菌落数量。
2 结果与讨论
2.1 Cu2O、GO/Cu2O、硅烷乳液的表征分析
2.1.1 Cu2O、GO/Cu2O表征分析
图2为GO、Cu2O、GO/Cu2O的XRD谱图。

图2 GO、Cu2O、GO/Cu2O的XRD分析Figure 2 XRD analysis of GO,Cu2O and GO/Cu2O
由图2可见,Cu2O的衍射峰与标准Cu2O谱图(JCPDS No.05-0667)很好地吻合,并未出现属于铜或氢氧化铜的峰值,这表明Cu2O纯度很高,产物中杂质较少。GO/Cu2O与Cu2O的峰值基本相同,这表明Cu2O与GO结合后晶体结构基本保持原样。GO在11°处有一个明显的特征衍射峰,但在GO/Cu2O中,这个特征峰消失了。这是因为在制备GO/Cu2O时,超声处理会使GO分散和剥离。在剥离过程中GO可能会发生晶格常数、晶格结构的变化,剥离后的GO层叠状态破坏、层数减少,这都会导致GO的XRD信号变弱或消失[7]。并且,在Cu2O与GO的结合过程中,Cu2O微粒会向GO薄片之间的层间迁移,阻止了GO薄片的再堆积,使其处于剥离状态。处于剥离状态的GO具有更大的比表面积,能够承载更多的Cu2O。
图3为GO/Cu2O的TGA图谱。
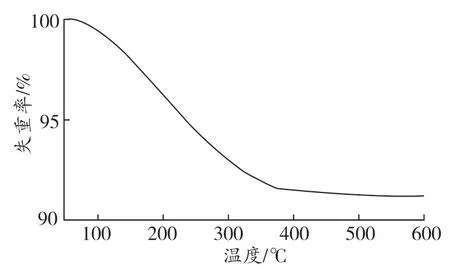
图3 GO/Cu2O的TGA分析Figure 3 TGA analysis of GO/Cu2O
由图3可见,GO/Cu2O的失重率为9.133 %,其在150~300 ℃内的质量下降速度最快。GO/Cu2O的失重主要是含氧官能团(如羟基、羧基)加热裂解导致,而这些含氧官能团主要来自其中的GO。这表明在GO/Cu2O的合成过程中,仅有部分GO被抗坏血酸还原,仍能保留大量的含氧官能团。
图4为Cu2O、GO/Cu2O的TEM图。

图4 TEM图Figure 4 TEM images
由图4a可见,Cu2O颗粒呈多面体结构,粒径为30~50 nm。由图4b可见,Cu2O颗粒紧密地附着在GO表面,基本没有出现团聚。GO薄片呈独立的单层结构,这表明GO已被很好地剥离,这与XRD的分析得出的结果相一致。
2.1.2 硅烷乳液的表征分析
图5为硅烷乳液的FTIR分析。
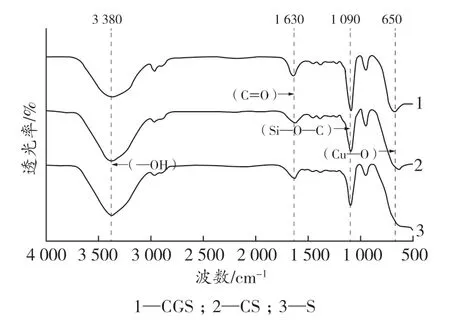
图5 硅烷乳液的FTIR分析Figure 5 FTIR analysis of silane emulsion
由图5可见,650 cm-1属于Cu(I)—O的伸缩振动峰,1 090 cm-1属于Si—O—C的伸缩振动峰,1 630 cm-1属于C=O的伸缩振动峰,3 380 cm-1属于—OH的伸缩振动峰[8-9]。CGS在1 090 cm-1和1 630 cm-1处的峰值强度均高于S和CS,而在3 380 cm-1处的峰值均低于S和CS。这表明,CGS中Si—O—C和C=O的含量最多,而—OH含量最少。根据GO与硅烷的结合机理可知,两者主要是通过GO携带的含氧官能团与硅烷分子中的—OH脱水缩合形成共价键连接[8]。因此,在CGS中除了硅烷分子自身的Si—O—C外,GO也以Si—O—C的形式与硅烷分子连接,这会导致Si—O—C的数量增加。同时,CGS中的GO含有大量的含氧官能团,这会导致C=O的数量增多。乳液中的—OH主要来自于硅烷分子,而在CGS中,GO与硅烷分子进行脱水缩合,会消耗大量的—OH,这会导致—OH的数量减少。
在CS和CGS的红外光谱图中都有属于Cu(I)—O的峰,这表明了两种复合乳液中都存在Cu2O。在CS的合成过程中,硅烷分子可以与Cu2O中的—OH反应形成Si—O—Cu,这会导致乳液中Si—O—C含量降低[10]。然而,CS与S的Si—O—C峰值相似,这说明Cu2O中的—OH含量有限,Cu2O与硅烷分子以Si—O—Cu结合的形式相对较少,主要通过静电相互作用力和范德华力结合。相比之下,在CGS中的Cu2O负载在GO表面,通过GO与硅烷分子间接结合。
2.2 涂层对砂浆表面生物膜的影响
生物膜是微生物生存的主要场所。在水泥基材料表面,微生物通过形成生物膜来适应环境变化,维持生长和繁殖[11]。通过观察砂浆表面生物膜的状态,可以判断微生物的污损情况,同时有助于研究涂层的防护效果。图6为在菌液中浸泡14 d后试块表面的形貌。

图6 在菌液中浸泡14 d后试块表面的形貌Figure 6 Surface morphology images of sample blocks after soaking in bacteria solution for 14 days
由图6a可见,可以观察到对照组试块表面布满了白色的絮状物质,这是由芽孢杆菌附着形成的生物膜。而在图6b和图6c中,也能够观察到在试块表面有薄薄的一层生物膜,但是在图6d和图6e中,试块表面上的生物膜并不明显。这表明,涂覆涂层均能抑制生物膜的生长,从而保护试块免受微生物污染。在涂层中,具有疏水性能和抑菌性能的CS和CGS保护效果最好。
图7为试块表面生物膜的SEM图,放大倍数为10K倍。在图7a对照组中,试块表面已经形成了较为成熟的生物膜,生物膜的表面结构并不是均匀、平整的,而是呈现出层叠状态,生物膜上还存在有明显的孔洞,这些孔洞被认为是底物和营养物进入生物膜的通道[12]。在图7b和图7c中,试块表面的生物膜处于生长期,生物膜以丝状菌为骨架,通过絮状的胞外聚合物交联在一起。在图7c中,还可以观察到有菌体裂解的现象,根据Cu2O的抑菌原理可以得知,这是由于Cu2O引起了生物膜的脂质过氧化反应,从而破坏生物膜的完整性,导致细胞内容物的泄露和细胞死亡[13]。而在图7d和图7e中,没有明显的生物膜结构存在,只能看到一些散落分布的细菌。同时,依然能观察到IBTS与砂浆构建的疏水涂层,这种涂层呈连续多孔的网络结构。
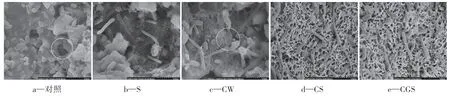
图7 试块表面生物膜的SEM图Figure 7 SEM images of biofilms on the surface of sample blocks
图8为接触角示意图。

图8 接触角示意图Figure 8 Schematic diagrams of contact angles
由图8b、图8d和图8e可见,S、CS和CGS的接触角分别为104.76°、101.22°、112.76°,这能说明3种硅烷涂层均具有良好的疏水性能。硅烷涂层对细菌附着的影响有以下几方面:第一,硅烷会与砂浆中的羟基反应,形成一个由硅氧烷链构成的疏水层。这种疏水层限制了菌液在砂浆表面的接触和浸入,从而抑制细菌的定植;第二,根据巴克斯特模型(Cassie-Baxter模型),涂层中粗糙的网状结构会在内部形成许多微小的孔隙,这些孔隙可以形成“气穴”[14]。当涂层表面浸入液体中时,液体会填充这些气穴,并在液体和涂层表面之间形成一个微小的空气层。这种空气层会减少菌液和涂层的接触面,从而降低微生物的粘附;第三,硅烷涂层的Si—O—Si骨架的表面能较低,这使得与其接触的生物分子(如蛋白质、细胞膜等)难以发生相互作用。同时,微生物在这种低表面能的表面上的粘附能力也会降低,这意味着微生物不容易在表面上形成聚集体,也不容易沿表面扩散生长[15];第四,硅氧化物表面的化学性质也具有一定的惰性,不容易与生物分子发生反应,这也降低了微生物在表面附着的可能性[16]。
图9为试块表面生物膜的CLSM图。由图9可见,具有疏水性质的S、CS、CGS表面细菌较为分散,而亲水性质的对照组和CW表面细菌较为聚集,并且CW的细菌聚集状态较对照组更为明显。这是因为在Cu2O的影响下,细菌更倾向于生成群落抵御杀菌物质的侵害[17]。然而,在CS和CGS中没有出现明显的细菌群落,这说明硅烷涂层可以有效限制细菌的聚集,从而增强Cu2O的杀菌效果。
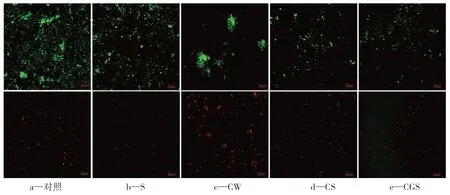
图9 试块表面生物膜的CLSM图Figure 9 CLSM images of biofilms on the surface of sample blocks
图10为CLSM图中活细胞和死细胞的粘附面积占比。由图10可见,在CW中活细胞的数量是死细胞的1.35倍,而在CS和CGS中,活细胞的数量分别是死细胞的2.16倍和2.18倍。这表明,在CS和CGS中,涂层不仅杀死了细胞,还使死亡细胞从表面脱离,从而导致活细胞和死细胞的比值升高。在生物膜中,死亡的细胞可以作为生长基质为周围细胞提供养分,从而促进生物膜的生长[18]。然而,死亡后的细胞会失去其原有的生命活力和细胞膜完整性,通常表现出较低的表面张力和粘附能力[19]。在疏水涂层中,这些失去了粘附能力的死亡细胞很容易从表面分离或剥落,因此疏水涂层具有一定的自清洁能力,可以有效减缓生物膜的生成。

图10 表面活细胞和死细胞的粘附面积占比Figure 10 Percentage of adhesion area between live cells and dead cells on the surface
2.3 涂层对砂浆表面细菌附着的影响
图11为砂浆表面细菌生长曲线。

图11 砂浆表面细菌生长曲线Figure 11 Growth cruves of bacteria on the surface of mortar
由图11可见,对照组中的细菌数量在1~14 d内呈指数增长,随后在14~21 d内细菌数量增长速度放缓,呈对数增长。到21 d左右时,细菌数量逐渐趋于稳定,砂浆表面细菌达到了动态平衡状态。与对照组相比,涂覆涂层的各组细菌数量都有不同程度的减少,这表明涂层对细菌附着均具有抑制作用。S和CW对细菌的抑制作用在早期较为显著,但随着浸泡时间的增加,抑制作用逐渐减弱。S和CW的防护效果衰减的原因是不同的。对于S而言,随着表面生物膜的生成,硅烷涂层的疏水性能降低,涂层抑制微生物附着的能力也不再显著。对于CW而言,涂层中Cu2O的流失导致抑菌性能的减弱。
CS和CGS对微生物附着都具有较好的抑制作用,其中CGS的效果更好。产生这种差异的原因有几个方面:第一,CGS中的Cu2O负载在GO表面后具有更好的分散性,这限制了Cu2O的团聚,使得Cu2O杀菌效果提高;第二,根据复合乳液的FTIR分析可知,CS中的Cu2O主要以范德华力和静电作用与硅烷分子结合,而CGS中的Cu2O是在GO表面原位生成,通过电子偶合作用吸附,并以GO为载体与硅烷分子成键结合[20-21]。因此,CGS中Cu2O的稳定性更高,表现出更为持久的抑菌效果。另外,CGS比CS的接触角更大,这是因为添加了GO的硅烷涂层具有更好的疏水性[8]。
2.4 复合涂层的作用机理
图12为CS、CGS抑菌疏水涂层的作用机理。

图12 复合涂层防污机理Figure 12 Antifouling mechanism of the composite coating
由图12可见,首先,IBTS的疏水效果可以阻止外界中细菌与有机物的附着,从而抑制生物膜的生长。其次,当细菌附着在涂层表面时,涂层中的Cu2O能够灭杀这些细菌。同时,死亡的细菌在疏水表面上很容易被水流冲走,从而减缓细菌在涂层表面的沉积,使得涂层具备自清洁能力。此外,疏水涂层还可以产生分散效应,防止细菌的聚集,这可以进一步提升Cu2O的杀菌效果。总的来说,IBTS的疏水效果和Cu2O的杀菌效果相互协作,能够更加有效地抑制细菌在涂层表面的附着和生长。
3 结语
(1) Cu2O与GO结合后,不仅可以阻止Cu2O的团聚,而且还可以阻止GO薄片的层叠堆积,这会使两者的比表面积增大,性能提高。
(2) 在CS中,Cu2O主要以静电相互作用力和范德华力与硅烷分子结合。在CGS中,Cu2O是通过负载在GO表面,由GO与硅烷分子形成共价键,从而间接与硅烷分子结合,这种结合形式更为稳定。
(3) CS和CGS中的抑菌性和疏水性在微生物防护方面具有协同效果,两种复合涂层的防护效果要好于单一属性的S和CW。
(4) CGS比CS防护效果更好,这得益于GO提高了CGS的疏水性能,以及GO/Cu2O带来的更为高效和持久的抑菌性能。
