含氮芳烃类化合物对蛋白核小球藻生长和代谢的影响
2023-02-02郭宝文朱俊英荣峻峰宗保宁
郭宝文, 朱俊英, 李 煦, 荣峻峰, 宗保宁
(中石化石油化工科学研究院有限公司,北京 100083)
含氮芳烃类化合物是一类重要的工业原料,广泛应用于炸药、农药、染料和医药等行业[1]。这类化学物质往往具有致癌性、致突变性和致畸性,一旦通过工业废水或直接施用于土壤释放到环境中,将对水生生物群产生不利影响,并对人类健康构成严重威胁[2-3]。王洪斌等[4]研究了硝基苯和间苯二酚对海洋微藻的毒理效应,发现硝基苯和间苯二酚对塔玛藻和巴夫藻的生长具有一定的抑制作用。邱海源等[5]研究发现苯胺对盐藻、三角褐指藻有明显的毒性作用。苯胺、硝基苯作为典型的含氮芳烃类化合物,由于具有高度的生态生物毒性己经被列入“中国环境优先控制污染物黑名单”中[6],在工业排水中要求严格控制其含量。此外,美国环境保护局(1994年)和欧共体联合研究中心(2004年)也将其归为“优先控制的有毒、有机污染物”,进行了严格的立法管制[7]。
藻类是水生生态系统的基础,对环境变化十分敏感,因此被用作生态风险评估的指标,以评估水中污染物的影响。利用废水培养微藻可以将废水中的氮、磷等物质转化为可用于生物能源、动物饲料和高价值产品的生物质,因而被认为是一种有前途的废水处理方式[8]。利用废水养殖藻类可以达到双重目的:一方面可以将废水中的氮、磷去除并作为自身的营养物质;另一方面,生产的高价值生物质可以降低废水处理的成本[9]。
蛋白核小球藻(Chlorellapyrenoidosa)是一种典型的淡水藻类,在生态毒理学研究中经常用作水生生物模型[10]。蛋白核小球藻蛋白质含量丰富、生长速度快,是理想的蛋白质来源。通过评估苯胺和硝基苯对蛋白核小球藻的毒性作用,根据污染物浓度、藻类生长以及氧化应激和脂质过氧化指标的变化,探索污染物对蛋白核小球藻的潜在毒性机制,并评估蛋白核小球藻对硝基苯和苯胺降解的影响。
1 实验部分
1.1 藻种和试剂
蛋白核小球藻,中国石化石油化工科学研究院藻种库提供。苯胺(C6H7N,纯度> 99%)、硝基苯(C6H5NO2,纯度>99%)、丙酮(C3H6O)分析纯,购自北京伊诺凯科技有限公司。植物蛋白裂解液购自生工生物工程(上海)股份有限公司,BCA蛋白浓度测定试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒、过氧化物酶(POD)活性检测试剂盒、丙二醛(MDA)含量检测试剂盒,购自北京索莱宝科技有限公司。
1.2 藻种预培养
配制Basal培养基[11],高温、高压灭菌后备用。无菌条件下,在250 mL三角瓶中加入150 mL培养基,接入藻种,置于光照培养箱中进行培养。条件为:光照强度55 μmol/(m2·s),光周期(光照时间/黑暗时间的比值)14 h/10 h,温度(28±1) ℃,转速150 r/min,初始pH值6.1。
1.3 生长抑制实验
通过离心收获处于指数生长期的蛋白核小球藻,并重新悬浮在无菌的新鲜Basal培养基中,葡萄糖质量浓度为10 g/L。分别加入苯胺(终质量浓度分别为10、50、100、300、500 mg/L)或硝基苯(终质量浓度分别为10、30、50、100 mg/L)进行实验作为处理组,未加入苯胺或硝基苯作为空白组。每个梯度设置3个平行样品,摇匀,置于光照培养箱与预培养相同的条件下培养48 h。
1.4 测定方法
1.4.1 藻生长测定
采用吸光度法对蛋白核小球藻生长进行测定,以接种时刻为初始时间,每12 h取适量藻液经适当稀释后使用上海菁华科技仪器有限公司生产的754紫外-可见分光光度计在波长680 nm下测定吸光值。蛋白核小球藻生物质质量浓度(C,g/L)通过单位体积藻液干重进行计算,具体取5 mL藻液于预先称重的0.22 μm的纤维素滤膜上抽滤,去离子水冲洗3次后,置于105 ℃烘箱中烘3 h至恒重,减去空滤膜质量后即为5 mL藻液生物质质量浓度。
为了评价硝基苯和苯胺对蛋白核小球藻生长的抑制作用,根据Zhang等[12]提供的公式计算生长抑制率(Id,%)。抑制率计算公式如式(1)所示。
(1)
式中:C0和Ci分别为空白组和处理组培养48 h的微藻生物质质量浓度,g/L。使用AAT BioQuest提供的EC50在线计算器(https://www.aatbio.com/tools/ec50-calculator/)计算蛋白核小球藻对苯胺和硝基苯的半最大效应浓度(EC50)[13]。
1.4.2 光合色素含量测定
取适量藻液经离心去掉上清液,加入2 mL质量分数80%丙酮于4 ℃暗处理24 h。再次离心后,将微藻提取液适当稀释后使用分光光度计在663、645和470 nm波长处测量提取液的吸光值。使用式(2)~式(4)计算光合色素叶绿素a(Chl a)、叶绿素b(Chl b)和类胡萝卜素(Car)的质量分数[14]。
(2)
(3)
(4)
式中:w(Chl a)、w(Chl b)、w(Car)分别为叶绿素a、叶绿素b和类胡萝卜素的质量分数,mg/g;A663、A645、A470分别为光合色素提取液在波长663、645、470 nm下的吸光度;F为稀释倍数;V为所取藻液体积,mL;m为所取藻液干重,g。
1.4.3 叶绿素荧光参数测定
为进一步研究苯胺、硝基苯对蛋白核小球藻光合活性影响,取5 mL藻液暗适应5 min后,使用德国Walz公司生产的DUAL-PAM叶绿素荧光仪对Fv、Fm、F0和Fs测量,并通过计算获得Fv/Fm和YⅡ。计算如式(5)~式(6)所示。
Fv/Fm=(Fm-F0)/Fm
(5)
YⅡ=(Fm-Fs)/Fm
(6)
式中:Fv/Fm为光合作用系统Ⅱ(PSⅡ)最大光化学量子产量;YII为光化学有效量子产量;F0为暗适应状态下的最小荧光产量(也称为初始荧光);Fm为暗适应状态下的最大荧光产量;Fv为可变荧光,是F0与Fm的差值。Fs为稳态荧光产量。
1.4.4 抗氧化酶活性检测
微藻培养物在4 ℃下离心收获细胞。收集的细胞在PBS缓冲液中进行清洗和复苏。复苏的藻细胞置于宁波新芝生物科技有限公司生产的JY-ⅡN超声波细胞粉碎仪中200 W下破碎10 min。破碎处理后,将细胞匀浆于4 ℃下10000 r/min离心5 min,上清液用于总蛋白、抗氧化酶和丙二醛(MDA)的测定。采用试剂盒测定总蛋白含量、超氧化物歧化酶(SOD)、过氧化物酶(POD)和丙二醛(MDA)含量。SOD、POD和MDA的测定结果均按照总蛋白含量进行归一化处理,以消除测定结果的偏差。
1.4.5 蛋白质提取和分析
在实验结束时从空白组和处理组中取5 mL藻液,经5000 r/min离心5 min,去上清液后加5 mL植物蛋白的裂解液,于超声波细胞破碎仪中200 W下破碎10 min,5000 r/min离心5 min后取上清液待测。采用BCA蛋白浓度测定试剂盒测定微藻中蛋白质含量。
1.4.6 苯胺和硝基苯含量测定
为探究微藻对苯胺、硝基苯降解的影响,分别在含质量浓度100 mg/L苯胺和30 mg/L硝基苯的培养基中接种蛋白核小球藻,以不接种微藻作为对照组,在1.3节中所述条件下培养。在培养期间每12 h收集培养液,离心后,上清液用于苯胺和硝基苯含量检测。采用安捷伦公司生产的1260 Infinity Ⅱ HPLC高效液相色谱进行分析,检测波长为254 nm,进样量为10 μL,所使用的色谱柱为反向C-18柱(250 mm×5 mm),柱温30 ℃。流动相为甲醇和水的混合物,体积比为40∶60,流速为1 mL/min。
1.5 数据分析
数据图使用软件Origin 2021绘制,实验数据均为3个平行样的平均值±标准偏差。实验数据使用软件SPSS 24进行显著性差异分析,显著性水平p<0.05。
2 结果与讨论
2.1 苯胺和硝基苯对蛋白核小球藻生长的影响
图1为不同质量浓度的苯胺和硝基苯下蛋白核小球藻的生长曲线。由图1可以看出:与不添加苯胺、硝基苯的样品相比,添加质量浓度低于100 mg/L的苯胺或低于10 mg/L的硝基苯对蛋白核小球藻的生长没有明显的抑制作用;与此相反,质量浓度高于100 mg/L的苯胺和高于30 mg/L的硝基苯的加入显著抑制了蛋白核小球藻的生长,并且抑制作用随苯胺、硝基苯质量浓度的增加而增强,表现出明显的剂量-效应关系。许多研究表明含氮芳烃类污染物对微藻毒性表现出剂量-效应关系,如Krishna等[15]研究了纺织染料亚甲基蓝对普通小球藻和钝顶螺旋藻的毒性,结果表明,随着染料浓度的增加,生长抑制率成比例增加;Du等[16]研究发现,低浓度的硝基苯(10 mg/L)处理对汉氏裸藻的生长没有明显的抑制作用,硝基苯质量浓度50 mg/L下在2 d内对藻细胞生长表现出轻度的抑制,2 d后抑制逐渐消失;质量浓度100 mg/L硝基苯胁迫显著抑制了汉氏裸藻的生长。研究中,蛋白核小球藻暴露于质量浓度100 mg/L的苯胺24 h和48 h后生长抑制率分别为25.5%和2.4%,暴露于质量浓度10 mg/L的硝基苯24 h和48 h后生长抑制率分别为11.4%和3%。生长抑制作用主要表现在对数生长期,蛋白核小球藻对苯胺和硝基苯的48 h半最大效应浓度(EC50)分别为648.6和47.1 mg/L,表明蛋白核小球藻对苯胺的耐受剂量要显著高于硝基苯。

OD680—Algal cell density图1 暴露于不同质量浓度苯胺和硝基苯下蛋白核小球藻的生长曲线Fig.1 Growth curve of Chlorella pyrenoidosa exposed to different concentrations of aniline and nitrobenzene(a) Aniline; (b) NitrobenzeneCulture conditions: Light intensity 55 μmol/(m2·s); Light/Dark cycle time 14 h/10 h; T=(28±1) ℃
2.2 苯胺和硝基苯对蛋白核小球藻光合色素含量的影响
光合色素(叶绿素a、b和类胡萝卜素)在光能的吸收和转化中起着重要作用。当藻类暴露在有毒物质中时,会对藻类中叶绿素a、b和类胡萝卜素的合成产生负面影响[15]。因而,在这种环境胁迫条件下,微藻的色素含量通常被用作敏感参数[17-18]。笔者评估了蛋白核小球藻暴露于不同质量浓度苯胺和硝基苯的光合色素含量变化情况,结果如图2和图3所示。由图2和图3可知:光合色素含量随培养时间的延长而呈下降趋势;高质量浓度苯胺(大于100 mg/L)和硝基苯(大于30 mg/L)抑制了蛋白核小球藻光合色素含量的合成,处理48 h后叶绿素a、b和类胡萝卜素含量明显下降。光合色素含量的减少是植物和藻类中的一种常见的胁迫反应,这可能是由类囊体脂过氧化和PSⅡ复合体的降解引起的[19]。
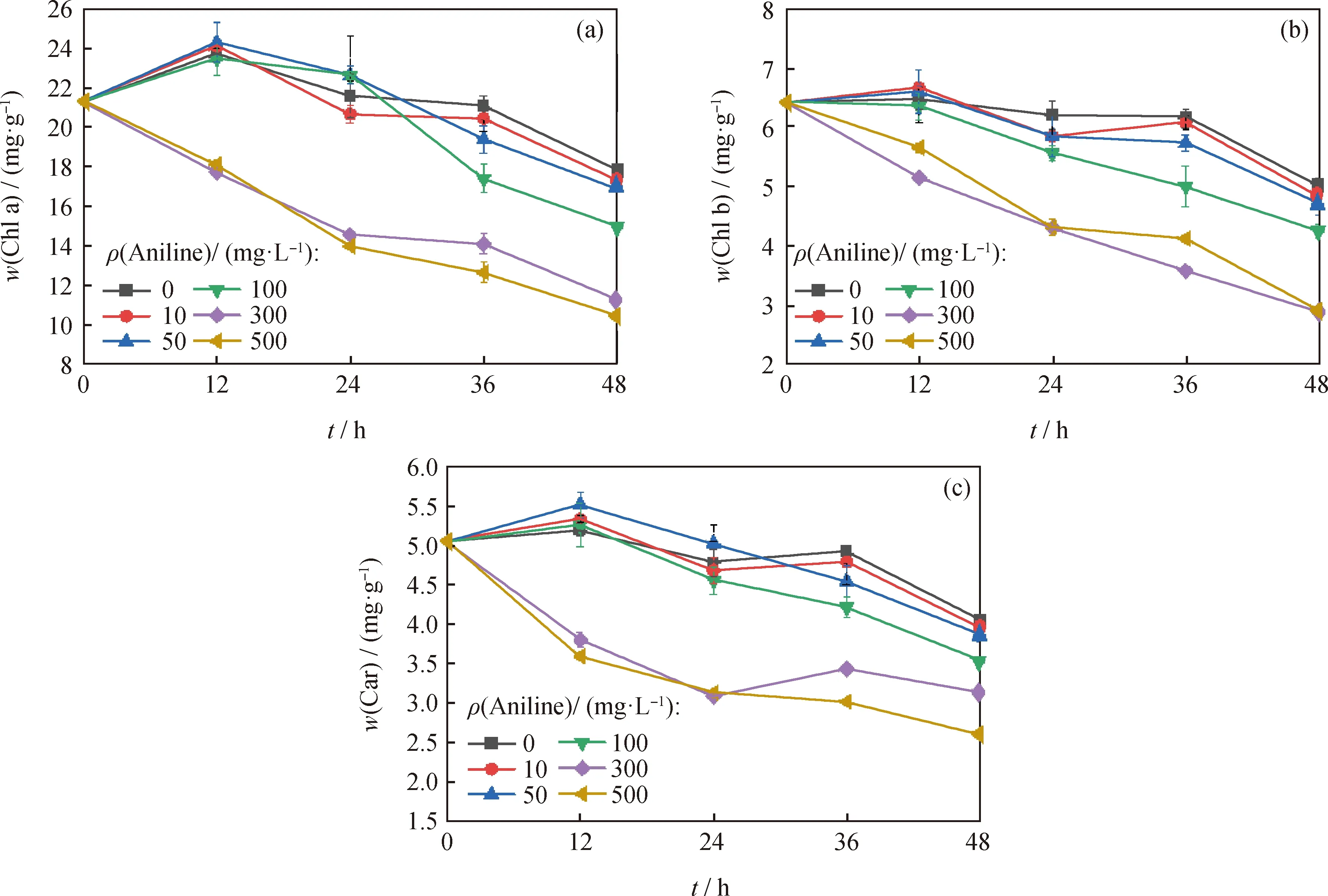
图2 暴露于不同质量浓度苯胺下蛋白核小球藻中光合色素含量的变化Fig.2 Changes of photosynthetic pigment content in Chlorella pyrenoidosa exposed to different concentrations of aniline(a) Chlorophyll a (Chl a); (b) Chlorophyll b (Chl b); (c) Carotenoids (Car)Conditions: Dark adaptation time 24 h; T=4 ℃

图3 暴露于不同质量浓度硝基苯下蛋白核小球藻中光合色素含量的变化Fig.3 Changes of photosynthetic pigment content of Chlorella pyrenoidosa exposed to different concentrations of nitrobenzene(a) Chlorophyll a (Chl a); (b) Chlorophyll b (Chl b); (c) Carotenoids (Car)Conditions: Dark adaptation time 24 h; T=4 ℃
2.3 苯胺和硝基苯对蛋白核小球藻叶绿素荧光参数的影响
叶绿素荧光参数是评价微藻细胞光合作用活性的重要指标,在正常生理条件下非常稳定[20-21]。通过测定PSⅡ的叶绿素荧光参数(Fv/Fm和YⅡ),研究了蛋白核小球藻对苯胺、硝基苯的光生理响应,结果见图4。由图4可知:质量浓度低于100 mg/L的苯胺处理后Fv/Fm变化较平稳;YⅡ呈先升后降的趋势,总体保持在0.2以上;然而,质量浓度高于100 mg/L苯胺处理后,Fv/Fm和YⅡ在培养期间呈下降趋势,且苯胺浓度越高,对蛋白核小球藻影响越大。硝基苯处理组与之类似,蛋白核小球藻在质量浓度高于50 mg/L硝基苯处理后Fv/Fm和YⅡ均明显降低,且随硝基苯含量升高,其荧光活性越低。与空白组相比,质量浓度为100 mg/L苯胺和30 mg/L硝基苯处理48 h后Fv/Fm分别下降了4.02%和57.47%,YⅡ分别下降了8.80%和53.42%。Fv/Fm的降低表明高浓度苯胺、硝基苯可能对蛋白核小球藻PSⅡ的电子传递能力有抑制作用。由于YⅡ值与类囊体膜中的电子传递相对应,可以将苯胺、硝基苯诱导的YⅡ降低归因于类囊体膜中与电子传递链相关的光合作用光化学过程的抑制[22]。
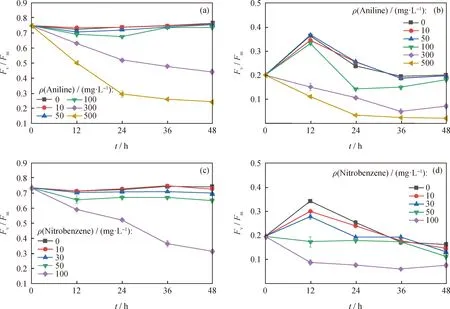
Fv/Fm—The maximum optical quantum yield; YⅡ—The actual light quantum yield图4 暴露于不同质量浓度苯胺和硝基苯下蛋白核小球藻的荧光活性Fig.4 Fluorescence activity of Chlorella pyrenoidosa exposed to different concentrations of aniline and nitrobenzene(a) Aniline Fv/Fm; (b) Aniline YⅡ; (c) Nitrobenzene Fv/Fm; (d) Nitrobenzene YⅡConditions: Dark adaptation time 5 min; T=25 ℃
2.4 苯胺和硝基苯对蛋白核小球藻抗氧化能力的影响
苯胺、硝基苯可能会导致光合作用电子传递受阻,从而导致电子积累。过多的电子可以与分子氧反应形成活性氧(ROS),随后产生氧化应激[23]。为了减少氧化损伤,植物体内有一个防御系统,主要负责清除过量的自由基来抵抗氧化损伤,以此来维持体内环境的稳定[24]。暴露于不同质量浓度苯胺下蛋白核小球藻的抗氧化酶活性和丙二醛含量变化如图5所示。由图5可知:抗氧化酶活性随着苯胺质量浓度的增加而提高;其中经质量浓度500 mg/L苯胺处理48 h后,SOD和POD活性分别是空白组的4.45和6.93倍。SOD和POD的活性同时升高表明,蛋白核小球藻抗氧化酶参与消除氧化应激过程中产生的过量ROS[25]。MDA水平可以指示脂质氧化的水平,随着苯胺质量浓度的增加,MDA含量增加(见图5(c)),苯胺处理48 h后与空白组结果相比增加47.82~432.30百分点。综上,抗氧化酶仍不足以完全清除过量的ROS,从而导致氧化损伤,过量的ROS可以与大分子作用并促使膜脂质过氧化[26-27]。

SOD—Superoxide dismutase; POD—Peroxidase; MDA—Malondialdehyde图5 苯胺质量浓度对蛋白核小球藻48 h抗氧化系统的影响Fig.5 Effect of aniline mass concentration on antioxidant system of Chlorella pyrenoidosa in 48 h(a) SOD activity; (b) POD activity; (c) MDA contentConditions: Ultrasonic crushing 200 W; Crushing time 10 min; T=4 ℃
暴露于不同质量浓度硝基苯下蛋白核小球藻的抗氧化酶活性和丙二醛含量变化如图6所示。由图6可知,与空白组相比,不同质量浓度硝基苯处理48 h后,蛋白核小球藻SOD和POD活性及MDA含量均明显升高。然而,质量浓度100 mg/L硝基苯处理后SOD、POD活性较50 mg/L硝基苯处理后有所降低。表明相对较高的硝基苯浓度可能抑制细胞的SOD和POD活性。

SOD—Superoxide dismutase; POD—Peroxidase; MDA—Malondialdehyde图6 硝基苯质量浓度对蛋白核小球藻48 h抗氧化系统影响Fig.6 Effect of nitrobenzene mass concentration on antioxidant system of Chlorella pyrenoidosa in 48 h(a) SOD activity; (b) POD activity; (c) MDA contentConditions: Ultrasonic crushing 200 W; Crushing time 10 min; T=4 ℃
2.5 苯胺和硝基苯对蛋白核小球藻蛋白质含量的影响
图7显示了采用不同质量浓度苯胺和硝基苯处理蛋白核小球藻48 h后蛋白质含量。由图7可知,处理组与空白组间蛋白质含量存在显著差异(p<0.05),且随着苯胺和硝基苯浓度的增加,蛋白质含量显著下降。其中,500 mg/L苯胺和100 mg/L硝基苯处理后蛋白质含量较空白组减少60.04%和70.20%。微藻在胁迫作用下可能会导致蛋白质含量发生变化。Gita等[28]发现,普通小球藻暴露于不同浓度的纺织染料时,蛋白质水平会显著降低。Hu等[29]还报道,在较高浓度的偶氮染料RP2B下,鱼腥藻的蛋白质合成受到抑制。研究中,蛋白核小球藻也表现出相同的变化。

a, b, c, d indicate significant differences (p<0.05).图7 不同质量浓度苯胺、硝基苯对蛋白核小球藻处理48 h后的蛋白质含量Fig.7 Protein content of Chlorella pyrenoidosa exposed to different concentrations ofaniline and nitrobenzene after 48 h of treatment(a) Aniline; (b) NitrobenzeneConditions: Ultrasonic crushing 200 W; Crushing time 10 min; T=4 ℃
2.6 蛋白核小球藻对苯胺和硝基苯去除影响
目前,关于含氮芳烃的生物降解研究主要集中在一些细菌上,一些研究表明,某些含氮芳烃降解菌可以通过氧化或还原途径降解这些化合物[30]。此外,也有一些报道表明,单细胞藻类对酚类、DDT、六六六、偶氮、石油等有机物都具有明显的富集与降解能力[31]。对培养液中苯胺和硝基苯含量进行检测,结果见图8。苯胺、硝基苯通常状态下是非常稳定的,由图8可以看出:在不加入微藻的对照组中培养48 h,苯胺质量浓度下降5.63%,硝基苯质量浓度下降9.01%;而加入蛋白核小球藻培养48 h后,苯胺质量浓度下降了40%,与对照组相比显著降低;硝基苯质量浓度下降了12.9%,与对照组相比变化不明显。结果表明,蛋白核小球藻有助于苯胺的去除。藻类吸收水体中有毒化学物质已有报道,其过程包括生物转化、富集和降解作用。有研究表明,在漆酶和NR酶作用下狐尾藻可以将TNT分解为无毒无害的物质[32]。在蛋白核小球藻存在下培养48 h,苯胺含量显著降低,但蛋白核小球藻对苯胺的去除机理还需进一步研究。

图8 不同处理时间(t)下蛋白核小球藻对苯胺、硝基苯质量浓度(ρ)的影响Fig.8 Effect of chlorella pyrenoidosa on the mass concentration (ρ) of aniline and nitrobenzene under different treatment time (t)(a) Aniline; (b) NitrobenzeneConditions: V(Methanol)∶V(Water)=40∶60; Flow rate 1 mL/min; T=30 ℃
3 结 论
(1)不同质量浓度苯胺和硝基苯会对蛋白核小球藻产生不同程度的毒害作用。蛋白核小球藻对苯胺的48 h半最大效应浓度(EC50)是硝基苯的13.8倍,蛋白核小球藻对苯胺的耐受性高于硝基苯。质量浓度高于100 mg/L的苯胺和高于30 mg/L的硝基苯处理对蛋白核小球藻的生长、光合活性、色素和蛋白质含量均有显著抑制作用。
(2)高浓度的苯胺、硝基苯会抑制光合活性,阻遏光合电子传递,造成氧化胁迫。通过检测抗氧化酶活性及MDA含量,发现一定剂量的苯胺和硝基苯会提高蛋白核小球藻抗氧化酶活性,这对清除ROS起一定作用,但高浓度苯胺和硝基苯仍会导致细胞膜脂过氧化,造成氧化损伤。
(3)含氮芳烃类化合物作为有毒污染物,难以被生物降解。通过对培养液中苯胺、硝基苯含量的检测,发现蛋白核小球藻存在下会促进苯胺的去除。这为含氮芳烃类废水治理提供了一条新的思路。
