吉林省玉米穗腐病致病镰孢菌的鉴定与部分菌株对杀菌剂的敏感性
2023-02-01柴海燕贾娇白雪孟玲敏张伟金嵘吴宏斌苏前富
柴海燕,贾娇,白雪,孟玲敏,张伟,金嵘,吴宏斌,苏前富
吉林省玉米穗腐病致病镰孢菌的鉴定与部分菌株对杀菌剂的敏感性
柴海燕1,2,贾娇2,白雪2,孟玲敏2,张伟2,金嵘1,2,吴宏斌2,苏前富2
1吉林农业大学植物保护学院,长春 130022;2吉林省农业科学院植物保护研究所/农业农村部东北作物有害生物综合治理重点实验室,长春 130033
【】明确吉林省玉米穗腐病主要致病镰孢种群分布及杀菌剂对镰孢菌菌丝生长的抑制效果,为针对性地开展玉米镰孢穗腐病的防治提供依据。【】通过组织分离法和分子生物学方法对2020年采自吉林省36个市(县)的149份玉米穗腐病样品进行病原菌分离鉴定,利用禾谷镰孢复合种(species complexFGSC)毒素合成相关基因特异性引物检测其产生毒素的化学型,对部分禾谷镰孢复合种进行致病力测定;采用菌丝生长速率法测定7种杀菌剂对禾谷镰孢复合种的抑制效果。【】分离获得233株镰孢菌,隶属4个镰孢复合种,含9种镰孢菌,包括拟轮枝镰孢()、布氏镰孢()、禾谷镰孢()、层出镰孢()、亚洲镰孢()、厚垣镰孢()、藤仓镰孢()、木贼镰孢()和亚黏团镰孢(),分离频率依次为33.05%、26.18%、25.32%、12.45%、0.86%、0.86%、0.43%、0.43%和0.43%,其中禾谷镰孢复合种分离频率最高,为52.36%,是吉林省玉米穗腐病的优势致病镰孢菌。布氏镰孢、禾谷镰孢和亚洲镰孢在禾谷镰孢复合种中的占比分别为50.00%、48.36%和1.46%。系统发育树结果表明禾谷镰孢复合种种间、种内遗传多样性均较为丰富。致病力测定结果表明52.73%的禾谷镰孢复合种为中致病型菌株,东部玉米主产区分离的禾谷镰孢致病力最强。毒素化学型检测表明,亚洲镰孢为雪腐镰刀烯醇(NIV)化学型,禾谷镰孢与布氏镰孢为15-乙酰基-脱氧雪腐镰刀烯醇(15-AcDON)化学型。7种杀菌剂抑制禾谷镰孢复合种菌丝生长的EC50介于0.02—19.45 μg·mL-1,其中咯菌腈(FS)、抑霉唑(FS)、氟硅唑(EC)、戊唑醇(TC)和腈菌唑(EW)对禾谷镰孢复合种抑制效果较好且差异不大,EC50小于1.20 μg·mL-1,EC90小于100 μg·mL-1;30%吡唑醚菌酯抑制禾谷镰孢和布氏镰孢生长的EC50差异明显,抑制禾谷镰孢的EC50是布氏镰孢的10.24倍。【】吉林省不同玉米产区的玉米穗腐病的优势致病镰孢不同,东部和西部为禾谷镰孢和布氏镰孢,中部为拟轮枝镰孢。禾谷镰孢复合种种间、种内遗传多样性均较丰富。咯菌腈、抑霉唑、氟硅唑、戊唑醇和腈菌唑对禾谷镰孢复合种的抑菌效果较好且在禾谷镰孢复合种间的药剂敏感性差别不明显。
玉米;穗腐病;镰孢菌;禾谷镰孢复合种;杀菌剂
0 引言
【研究意义】玉米()是世界上最重要的农作物之一,2021年国家统计年鉴发布我国玉米种植面积已达4 332万公顷(索引号:410A04-0402- 202202-0006)。玉米镰孢穗腐病是世界玉米种植区普遍发生的一类真菌性病害,近年来在吉林省发生程度呈加重趋势。研究报道禾谷镰孢复合种(species complex,FGSC)、拟轮枝镰孢()等是造成玉米镰孢穗腐病发生的主要病原菌,且病原菌产生的呕吐毒素、伏马毒素、玉米赤霉烯酮等真菌毒素严重危害人、畜安全[1-4]。因此,明确吉林省玉米镰孢穗腐病致病镰孢种群及杀菌剂对镰孢菌的抑制效果,可为监测吉林省乃至东北地区玉米镰孢穗腐病的发生流行和有针对性地开展该病害的防治提供科学依据。【前人研究进展】国内外研究鉴定出70余种引起玉米穗腐病的病原真菌[5],这些真菌通过单独或复合侵染玉米果穗导致穗腐病发生,且不同地区的病原菌组成差异极大。国外研究结果表明,在加拿大、德国、巴西、阿根廷和尼泊尔地区禾谷镰孢复合种和拟轮枝镰孢是玉米镰孢穗腐病的优势病原菌,在波兰、意大利、南非、伊朗拟轮枝镰孢为优势致病菌,分离频率达 32%—58%;美国、奥地利等地区引起玉米镰孢穗腐病的主要致病菌是禾谷镰孢复合种[6-16]。国内研究学者对甘肃、广西、黑龙江等21省(自治区)的玉米穗腐病致病镰孢进行分离鉴定[17-28],发现引起我国玉米镰孢穗腐病的病原菌呈现出一定的区域性分布,总体上拟轮枝镰孢和禾谷镰孢复合种在我国各玉米主产省份均占有一定优势,在黑龙江、吉林、辽宁等北方地区优势更加明显;尖镰孢()和层出镰孢()在全国的分布相对局限,层出镰孢主要分布于我国中部省份,尖镰孢主要分布于重庆市和云南省,由此可见,在我国中部和南方地区致病镰孢种群多样性更高,尖镰孢、层出镰孢等集中分布[29]。禾谷镰孢复合种至少由禾谷镰孢()、蒲苇镰孢()、南方镰孢()、布氏镰孢()和亚洲镰孢()等16个种构成[30-31],禾谷镰孢复合种在形态上极为相似,但其产毒类型及其分布区域存在巨大差异[32]。2014年,秦子惠等[32]采用延伸因子基因序列对分离到的禾谷镰孢复合种进行亚种鉴定,结果表明我国禾谷镰孢复合种由禾谷镰孢、南方镰孢和布氏镰孢构成,其中南方镰孢主要分布于南方生态区,布氏镰孢主要分布于北方生态区。2018年,孙华等[33]鉴定结果表明春玉米区禾谷镰孢复合种为禾谷镰孢与布氏镰孢,以布氏镰孢为主。与此同时,科研人员探索出一系列关于玉米穗腐病的防治措施,但喷施杀菌剂仍不失为最快、最有效的防治措施,卢宝慧等[34]测定了13种杀菌剂对禾谷镰孢菌丝生长的抑制活性,EC50介于0.11—2 202.32 μg·mL-1;郭聪聪等[35]测定了多菌灵、百菌清、吡唑醚菌酯和氰烯菌酯对禾谷镰孢菌丝生长的抑制效果,EC50分别为0.25、2.79、5.71和0.46 μg·mL-1。【本研究切入点】吉林省地处世界三大黄金玉米带之一,有“天下粮仓”的美誉,玉米播种面积高达4.27×106hm2,但受“厄尔尼诺”气候影响,近几年夏秋多雨现象普遍,易导致玉米镰孢穗腐病发生,若种植感病品种则严重影响玉米产量和质量,生产上国内尚无相关防治玉米穗腐病的药剂产品登记,因此及时监测吉林省玉米穗腐病的病原菌种群分布情况、致病力变化及防治药剂的筛选至关重要。【拟解决的关键问题】对采自吉林省36个市(县)的149份玉米穗腐病样品进行分离鉴定,对部分菌株进行致病力、毒素化学型测定和遗传多样性分析,明确吉林省镰孢菌穗腐病的致病菌组成及分布情况;采用菌丝生长速率法测定氟硅唑、腈菌唑、福美双、吡唑醚菌酯、咯菌腈、戊唑醇和抑霉唑7种杀菌剂对布氏镰孢、禾谷镰孢和亚洲镰孢等主要镰孢菌的抑制效果,为有针对性地开展玉米镰孢穗腐病的防治提供科学依据。
1 材料与方法
1.1 材料
样品:2020年在吉林省玉米主产区[36]采集149份玉米穗腐病样品,中部玉米主产区97份:长春市区2份、公主岭市33份、德惠市7份、九台市7份、榆树市2份、农安县7份、松原市区2份、扶余县8份、舒兰市2份、永吉县3份、双辽市2份、辽源市3份、东辽县3份、东丰县10份、梅河口市1份、前郭尔罗蒙古族自治县3份、伊通满族自治县2份;东部玉米主产区33份:白山市区1份、抚松市2份、靖宇县3份、延吉市1份、敦化市1份、汪清县3份、安图县2份、通化市区1份、集安市1份、通化县2份、辉南县2份、柳河口县3份、磐石市4份、蛟河市4份、桦甸市3份;西部玉米主产区19份:大安市7份、洮南市2份、长岭县8份、乾安县2份。
药剂:400 g·L-1氟硅唑EC(江门市大光明农化新会有限公司),12.5%腈菌唑EW(山东省青岛瀚生生物科技股份有限公司),80%福美双WG(比利时特胺有限公司),30%吡唑醚菌酯SC(江西禾益化工股份有限公司),1%咯菌腈FS、97%戊唑醇TC(吉林金秋农药有限公司),10%抑霉唑FS(吉林省八达农药有限公司)。
培养基:马铃薯葡萄糖琼脂培养基(PDA):马铃薯 200 g,葡萄糖 20 g,琼脂 15 g,蒸馏水 1 L;合成低营养琼脂(SNA)培养基:KH2PO42.0 g,KNO32.0 g,KCl 1.0 g,MgSO41.0 g,FeSO40.002 g,FeCl30.002 g,MnSO40.002 g,ZnSO40.002 g,葡萄糖1.0 g,蒸馏水1 L。
试剂及常用仪器:新型植物DNA提取试剂盒、2×TaqPCR Master Mix(康为世纪生物科技股份有限公司,江苏);光学显微镜(CXC41RF,日本OLYMPUS公司);高压蒸汽灭菌锅(HE-50,日本HIRAYAMA公司);电泳仪(Power Pac HC)、PCR扩增仪(C1000TMThermal Cycler)和凝胶成像系统(Universal Hood II)(美国BIO-RAD公司);蓝光切胶仪(生工生物工程(上海)股份有限公司);恒温培养箱(BPH-9162,恒科学仪器有限公司,上海);恒温摇床(HS-2112B,上海和呈仪器制造有限公司);超净工作台;血球计数板;无菌注射器。
1.2 方法
1.2.1 病原菌分离及形态学鉴定 参照秦子惠等[32]种子健康检测法分离玉米穗腐病病原菌,在超净台中将玉米籽粒置于75%酒精溶液中消毒 30 s,无菌水冲洗3次,每次30 s,灭菌滤纸吸除多余水分后将籽粒放置在含链霉素的PDA平板上,每个直径 9 cm培养皿中摆放10粒,每个处理3次重复。25℃黑暗条件下培养 2—3 d,待籽粒内部真菌长出并形成菌落后,挑取菌丝移入 PDA 或SNA平板上进行纯化培养;参照张昊等[37]方法进行单孢分离,挑取PDA或SNA培养基培养的镰孢菌菌丝置于装有1.0 mL无菌水的离心管中,10倍梯度稀释,血球计数板检查,计算分生孢子浓度为10个/mL时吸取50 μL均匀涂布于PDA培养基上,25℃培养至分生孢子萌发,挑取单孢菌落获得纯化的菌株,培养4—7 d后观察菌落形态,进行形态学鉴定[38-39]。
1.2.2 病原菌的分子生物学鉴定 参照王宝宝等[19]分子生物学鉴定方法,刮取纯化菌株菌丝,采用新型植物 DNA提取试剂盒提取总DNA,并以提取的DNA为模板进行PCR扩增,不同镰孢菌检测的特异性引物(表1)均委托生工生物工程(上海)股份有限公司合成。25 μL PCR反应体系:2×EsMasterMix(Dye)12 μL、引物R/F各1 μL、DNA模板8 μL、ddH2O 3 μL;扩增产物经1.5%琼脂凝胶电泳,根据特异目的条带进行镰孢菌鉴定,没有特异引物的镰孢菌通过测定延伸因子(TEF-F:ATGGTAA GGARGACAAGAC/TEF-R:GGARGTACCAGTSATC ATGTT,退火温度:53℃,扩增片段:703 bp)基因序列进行鉴定,并统计镰孢菌比例。镰孢菌分离频率(%)=(不同镰孢菌株数/镰孢菌总数)×100。
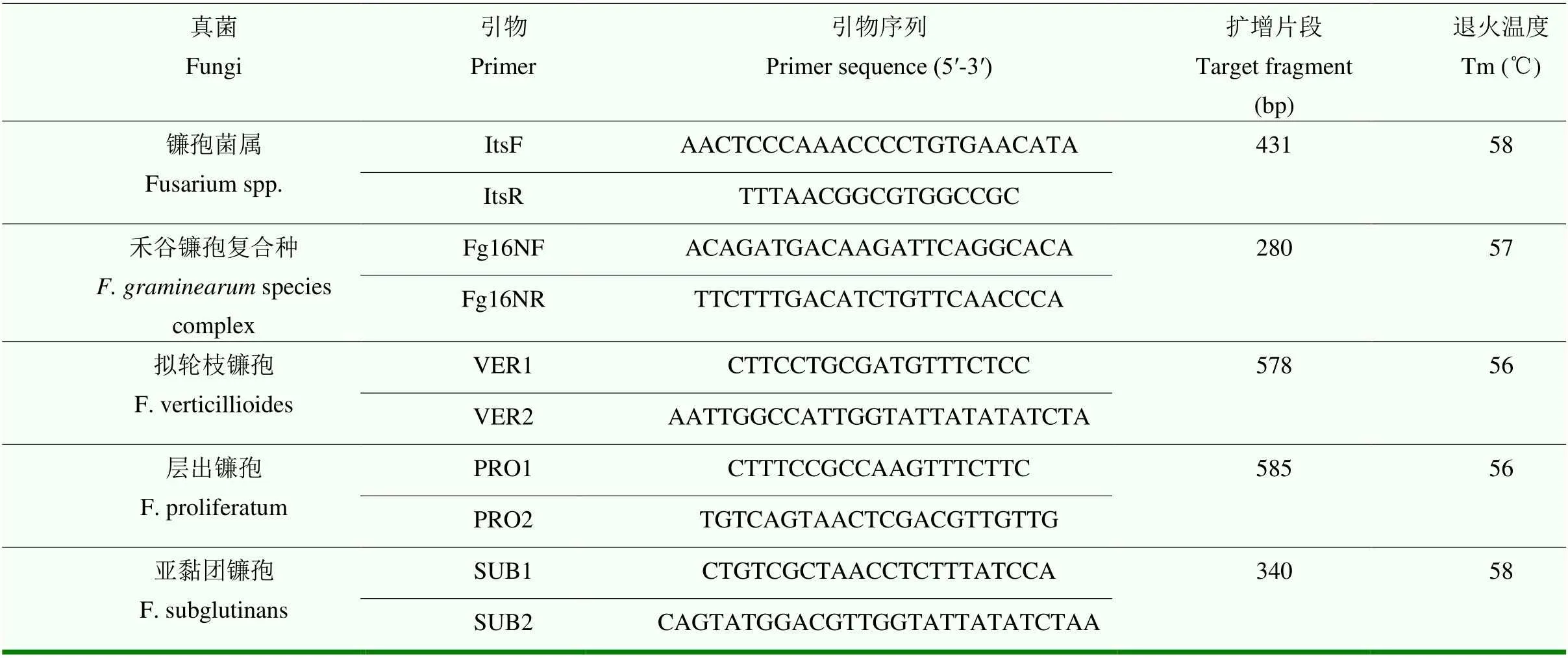
表1 镰孢菌的特异性鉴定引物
1.2.3 禾谷镰孢复合种不同种的分子鉴定及系统发育树的构建 通过引物延伸因子基因测序分析方法,对禾谷镰孢复合种的单孢分离物(编号:采集地+序号)进行序列分析,从GenBank中下载标准参照菌株南方镰孢(MG55258、MT237810、M237808)、亚洲镰孢(AF212452、KY284937、LC546964、MW62007)、布氏镰孢(MK896870、AF212445、HQ889141、MF133355、MT237770、MT237749)、禾谷镰孢(MW928838、LT548510、MH572253)和拟轮枝镰孢(MN696006)序列,利用ClustalX软件进行多序列比对(multiple alignment),并用MEGA7.0软件的neighbor-joining(NJ)方法进行1 000次自检构建系统发育树。
1.2.4 禾谷镰孢复合种致病力测定 挑取禾谷镰孢复合种菌丝置于装有300 mLSNA培养基的锥形瓶中,黑暗条件下120 r/min振荡培养5 d,双层纱布过滤培养物获得2.5×105个/mL分生孢子悬浮液,备用。选用玉米品种为KX3564,于2021年在玉米灌浆期采用针刺法从玉米果穗的中部接种2 mL 2.5×105个/mL分生孢子悬浮液,每份菌株接种50穗进行禾谷镰孢复合种的致病力测定。调查方法参照王晓鸣《玉米田间抗性鉴定手册》的玉米穗腐病发生调查方法,在乳熟期调查玉米穗腐病发生情况,并计算平均病情级别。平均病情级别=Σ(病级株数×该级代表数值)/调查总株数。
1.2.5 禾谷镰孢复合种毒素化学型检测 选用引物Tri13P1/2:5′-CTCSACCGCATCGAAGASTCTC-3′和5′-FGAASGTCGCARGACCTTGTTTC-3′,退火温度为58℃检测禾谷镰孢复合种的毒素化学型。产生15-AcDON化学型的菌株扩增片段为583 bp,3-AcDON化学型的菌株扩增片段为644 bp,NIV化学型的菌株扩增片段为859 bp[19],对禾谷镰孢复合种毒素化学型进行分子检测。
1.2.6 不同杀菌剂对禾谷镰孢复合种的室内毒力测定 采用菌丝生长速率法[40]测定7种杀菌剂对禾谷镰孢复合种禾谷镰孢、布氏镰孢、亚洲镰孢的抑制作用。在菌落边缘挑取直径为4 mm的菌饼接种到含有不同浓度杀菌剂的PDA平板上,25℃黑暗培养至空白对照菌株长满培养皿,每个处理3次重复,采用十字交叉法测量菌落直径,计算公式:抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-0.4)×100。
通过DPS数据分析处理软件,利用数量反应生测机率值分析法进行数据处理,建立毒力回归方程,计算各杀菌剂EC50、EC90和相关系数等。
2 结果
2.1 吉林省玉米穗腐病致病镰孢菌的种类及分离频率
对2020年采集的玉米穗腐病样品病原菌进行分离鉴定,结果发现造成吉林省玉米穗腐病的病原菌主要包括镰孢菌(spp.)、黑孢霉()、螺旋聚孢霉()、突脐蠕孢()、青霉()等。单孢分离获得233株镰孢菌,包括拟轮枝镰孢77株、布氏镰孢61株、禾谷镰孢59株、层出镰孢29株、亚洲镰孢2株、厚垣镰孢()2株、藤仓镰孢()1株、木贼镰孢()1株和亚黏团镰孢()1株(分生孢子形态特征,图1),分离频率依次为33.05%、26.18%、25.32%、12.45%、0.86%、0.86%、0.43%、0.43%和0.43%。分离获得的9种镰孢菌隶属禾谷镰孢复合种、藤仓镰孢复合种(species complex,FFSC)、厚垣镰孢复合种(species complex,FCSC)、species complex(FIESC)4个镰孢菌复合种,占比分别为52.36%、46.35%、0.86%、0.43%,禾谷镰孢复合种为吉林省玉米主产区玉米穗腐优势致病镰孢菌。
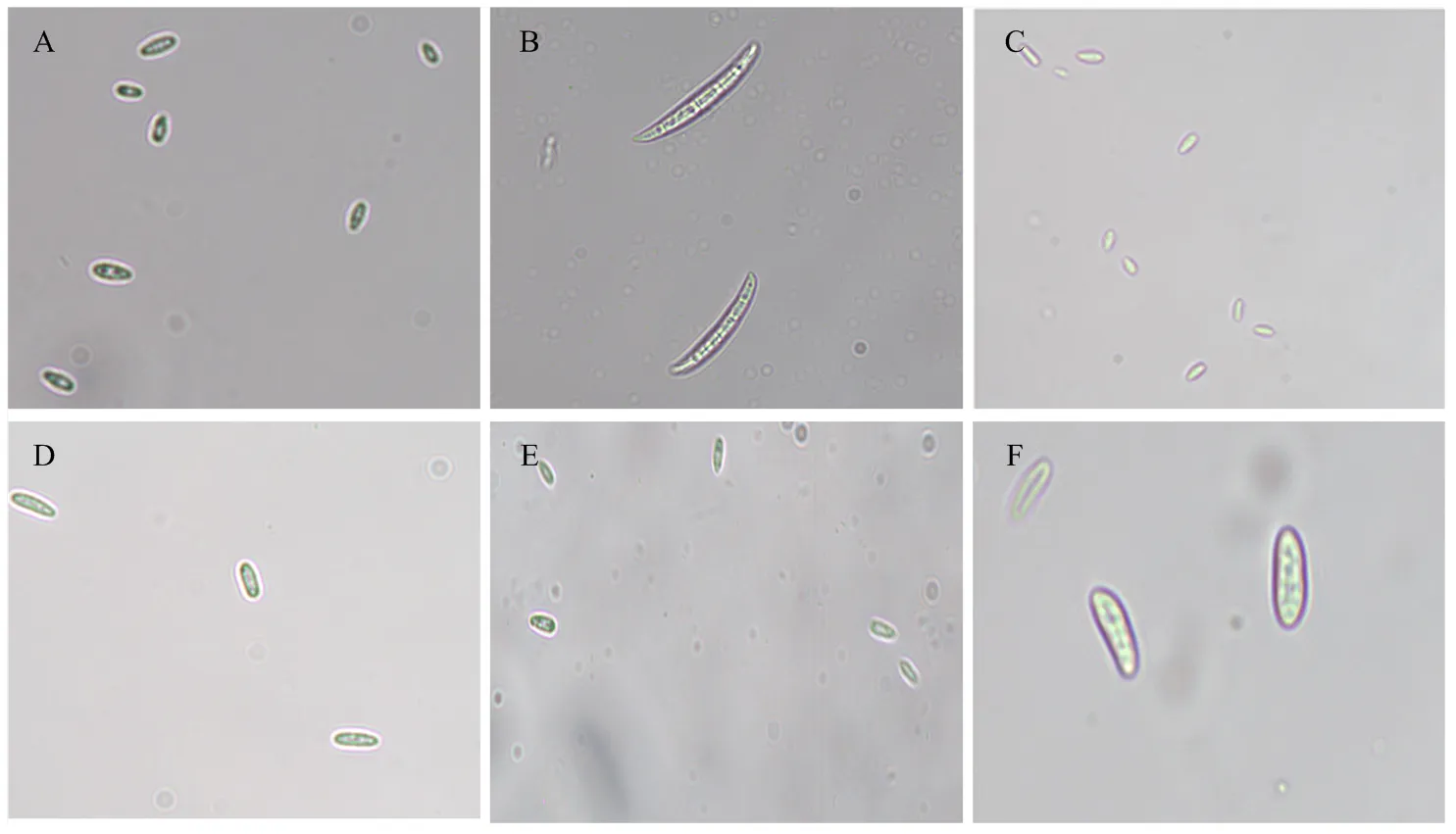
A:拟轮枝镰孢F. verticillioides;B:禾谷镰孢F. graminearum;C:厚垣镰孢F. chlamydosporum;D:木贼镰孢F. equiseti;E:层出镰孢F. proliferatum;F:亚黏团镰孢F. subglutinans
2.2 吉林省玉米穗腐病致病镰孢菌的分布
吉林省东部玉米主产区分离获得的致病镰孢菌为禾谷镰孢、布氏镰孢、拟轮枝镰孢、层出镰孢和厚垣镰孢,频率分别为33.85%、30.77%、27.69%、6.15%和1.54%;西部玉米主产区分离获得布氏镰孢、禾谷镰孢、厚垣镰孢和亚黏团镰孢4种致病镰孢,布氏镰孢的分离频率最高,为54.55%;其次是禾谷镰孢,分离频率为36.36%,厚垣镰孢和亚黏团镰孢的分布频率相对较低,均为4.55%;除藤仓镰孢和亚黏团镰孢外,其他分离获得的镰孢菌均在吉林省中部玉米主产区发现,其中拟轮枝镰孢的分离频率最高,为40.41%(表2、图2)。从主要致病镰孢菌种类区域性分布来看,在公主岭、东丰、农安、辽源市区、抚松和柳河均分离获得禾谷镰孢、布氏镰孢和拟轮枝镰孢,在磐石和榆树分离到布氏镰孢、拟轮枝镰孢和层出镰孢;在东辽和通化县分离到禾谷镰孢、拟轮枝镰孢和层出镰孢。从不同地区病原菌的种类来看,公主岭分离得到的镰孢菌种类最多,分离得到7种镰孢菌,东丰、磐石和长岭3个市(县),分离到4种镰孢菌,农安、辽源市区、抚松、柳河、德惠、榆树、东辽和通化县8个市(县)分离到3种镰孢菌,其他地区分离病原菌的种类较少。结果表明,吉林省东部和西部玉米主产区玉米穗腐病的优势病原菌为禾谷镰孢复合种中的禾谷镰孢和布氏镰孢,中部地区为拟轮枝镰孢;吉林省3个区域玉米产区的镰孢菌种类均较复杂。
M:DNA Marker,DL2000;1—8:禾谷镰孢复合种F. graminearum species complex;9—11:层出镰孢 F. proliferatum;12—14:拟轮枝镰孢 F. verticillioides;15:木贼镰孢F. equiseti;16:亚黏团镰孢F. subglutinans
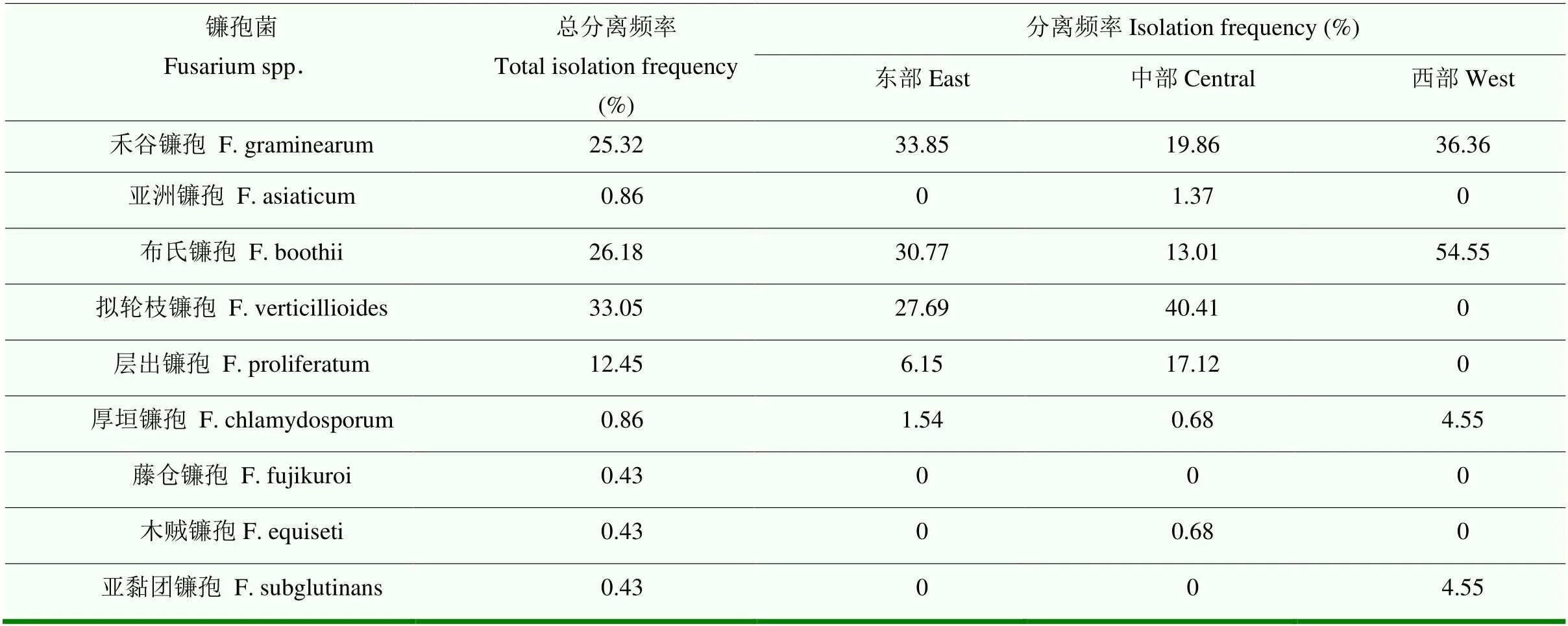
表2 吉林省不同玉米主产区镰孢菌的分离频率
2.3 禾谷镰孢复合种独立种的分子鉴定及系统发育树的构建
根据禾谷镰孢复合种延伸因子的测序结果构建系统发育树。结果表明,吉林省禾谷镰孢复合种可分为3大类群,其中布氏镰孢和禾谷镰孢在吉林省东、中、西玉米产区均有分布,占比分别为50.00%和48.36%;仅在吉林省中部玉米产区分离获得亚洲镰孢,占比为1.46%。吉林省东、中、西部玉米产区禾谷镰孢与布氏镰孢的比例存在明显差异,东部与西部地区的比例接近1﹕1,而西部地区比例为3﹕5。从树形图来看,镰孢菌种内部存在小的分支,其中布氏镰孢种内的自展值介于18—73、禾谷镰孢种内的自展值介于2—83、亚洲镰孢种内自展值为67。同一地区的菌株大部分聚在相邻的分支上,但农安县分离的禾谷镰孢菌株NAXKJ-1与NAXKJ-2在不同分支,部分采自不同地区的菌株聚在相邻的分支上,表明禾谷镰孢复合种种间、种内遗传多样性均较丰富,不同地区间的菌株存在频繁的基因交流(图3)。
2.4 禾谷镰孢复合种致病力测定与毒素化学型检测
参照王晓鸣《玉米田间抗性鉴定手册》将55株禾谷镰孢复合种的致病力测定结果分为5种致病类型,分别为强致病型(HV)、次强致病型(SH)、中致病型(MV)、次弱致病型(SL)和弱致病型(LV)。禾谷镰孢造成玉米穗腐病的平均病情级别从东至西逐渐降低,平均病情级别分别为5.23、4.47和3.73;中部玉米主产区分离的布氏镰孢在吉林省分离的布氏镰孢中致病力最强,平均病情级别为4.48,东部和西部玉米产区的相近,分别为3.42和3.29;中部玉米主产区分离的亚洲镰孢造成玉米穗腐病的平均病情级别为3.47。东部玉米主产区分离的禾谷镰孢在吉林省禾谷镰孢复合种中致病力最强;中部和西部玉米主产区分离的禾谷镰孢和布氏镰孢造成玉米穗腐病的平均病情级别相近。禾谷镰孢复合种中强致病型、次强致病型、中致病型、次弱致病型和弱致病型占比分别为1.82%、20.00%、52.73%、25.45%和1.82%。通过禾谷镰孢复合种产毒关键基因特异性引物检测122株禾谷镰孢复合种的毒素化学型,发现61株布氏镰孢和59株禾谷镰孢产生15-AcDON毒素;2株亚洲镰孢产生 NIV毒素。产15-AcDON和NIV菌株的平均病情级别分别为4.34和3.47。结果表明,禾谷镰孢复合种中禾谷镰孢造成玉米穗腐病的致病力最强,且东部玉米主产区的禾谷镰孢致病力在3个玉米主产区中最强,吉林省造成玉米穗腐病的禾谷镰孢复合种的致病强度呈正态分布。吉林省禾谷镰孢复合种中禾谷镰孢与布氏镰孢仅产15-AcDON,亚洲镰孢仅产NIV,产15-AcDON的菌株平均病情级别高于产NIV的菌株(表3、表4、图4)。
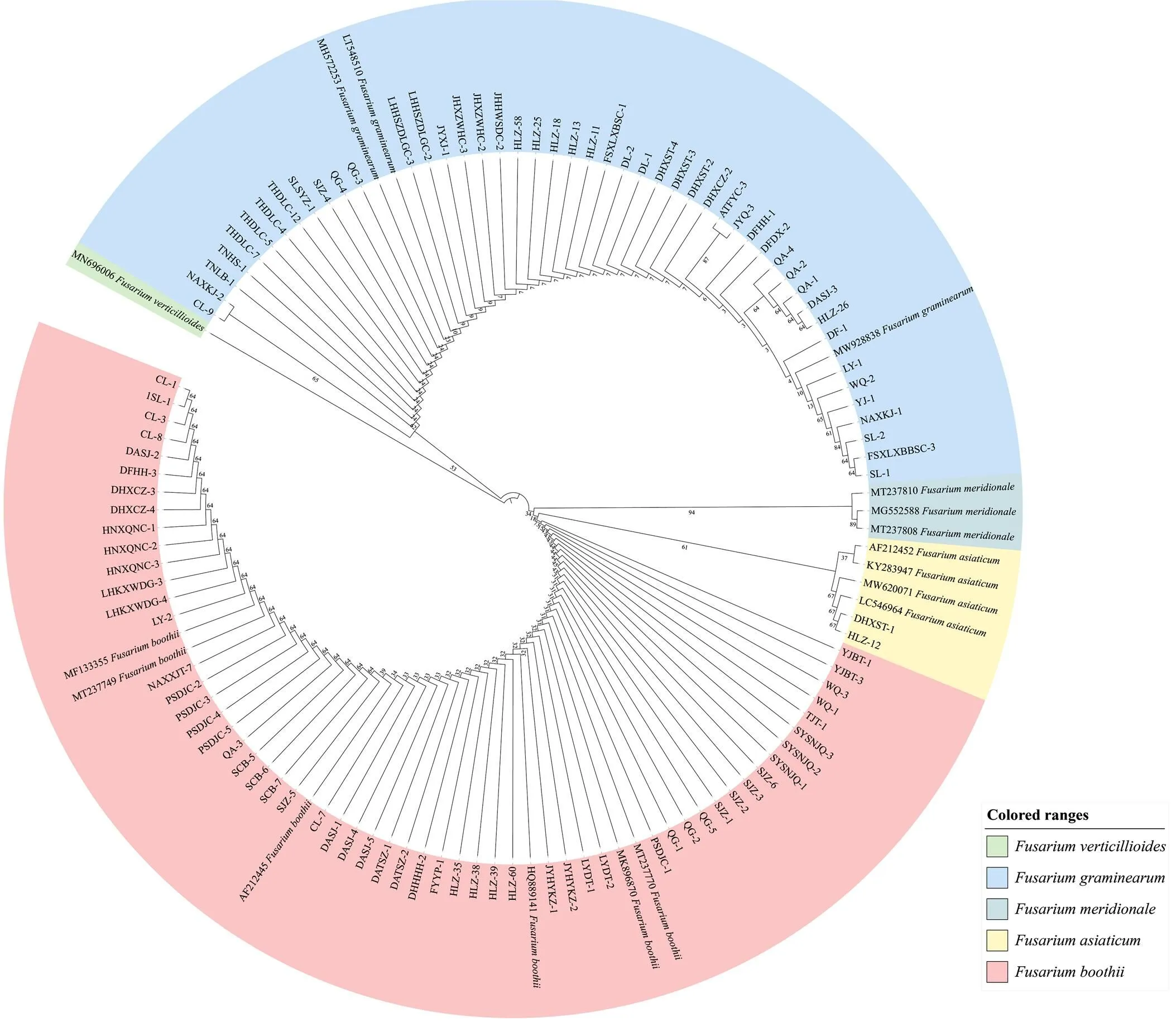
图3 基于TEF-1α基因序列构建部分禾谷镰孢复合种菌株的系统发育树
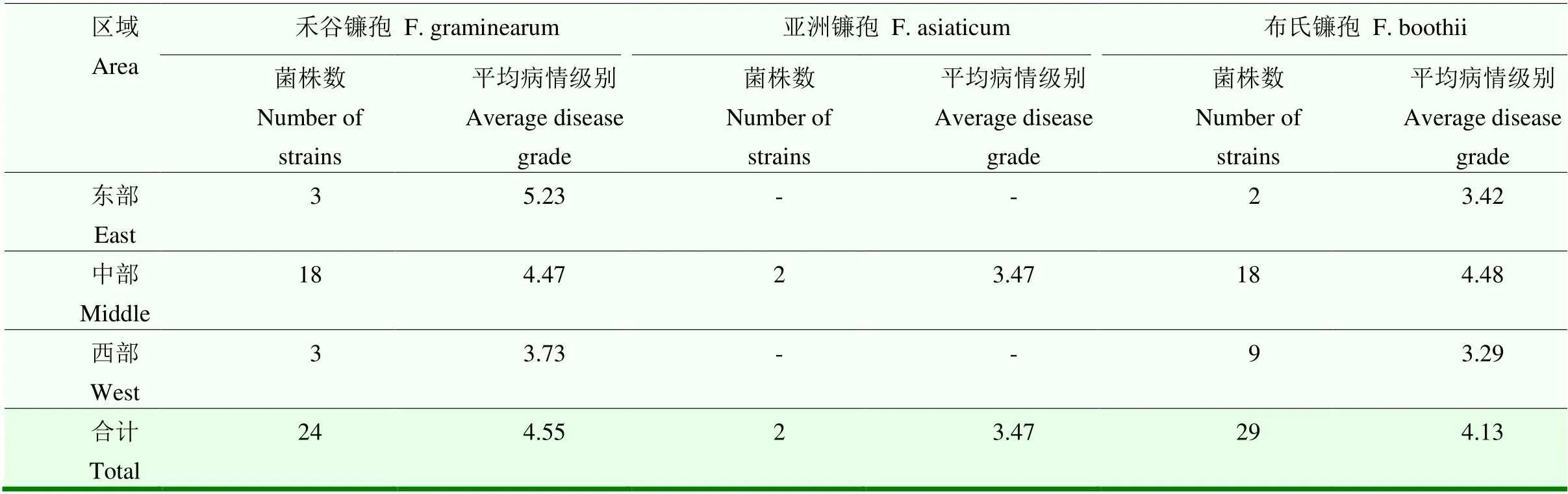
表3 禾谷镰孢复合种引起的穗腐病平均病情级别
M:DNA Marker,DL2000;1、3—5、9—11、13—16:禾谷镰孢F. graminearum;2、6—8:布氏镰孢F. boothii;12:亚洲镰孢F. asiaticum
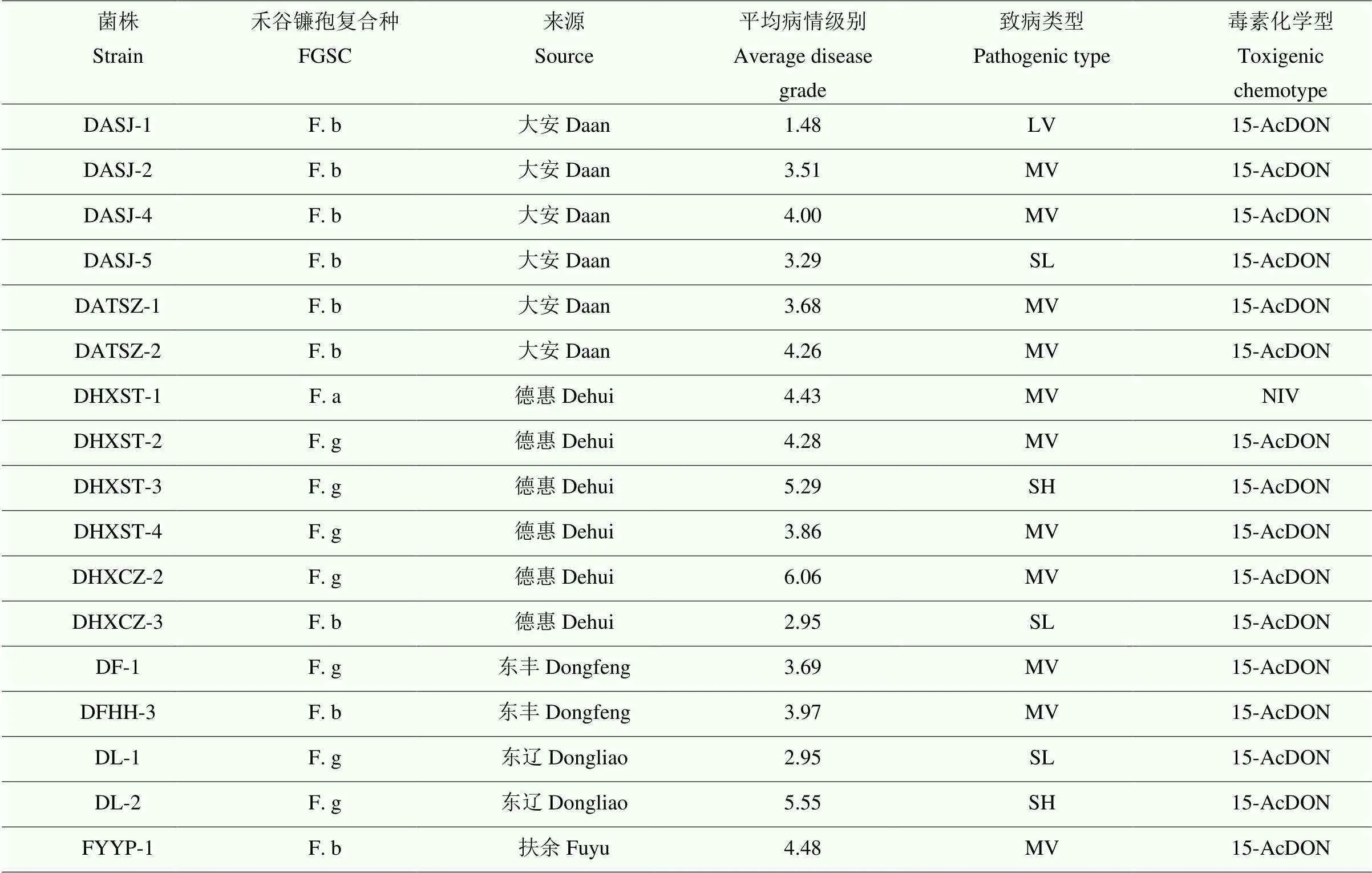
表4 禾谷镰孢复合种致病力与毒素化学型分析

续表4 Continued table 4
F. g=F. graminearum, F. b=F. boothii, F. a=F. asiaticum
2.5 7种杀菌剂对禾谷镰孢复合种的室内毒力
7种杀菌剂对禾谷镰孢、亚洲镰孢、布氏镰孢均有不同程度的抑制效果,EC50介于0.02—19.45 μg·mL-1,EC90介于0.27—3 434 875.02 μg·mL-1。1%咯菌腈、10%抑霉唑、400 g·l-1氟硅唑、97%戊唑醇和12.5%腈菌唑对禾谷镰孢、亚洲镰孢和布氏镰孢菌抑制效果较好且差别不大,EC50均<1.20 μg·mL-1,三者相差倍数介于1—2.78;EC90<100 μg·mL-1,相差倍数介于1.06—2.41。80%福美双和30%吡唑醚菌酯对禾谷镰孢、亚洲镰孢和布氏镰孢的抑制效果相对较差,30%吡唑醚菌抑制禾谷镰孢复合种生长的EC50、EC90差异比较明显,禾谷镰孢的EC50是亚洲镰孢的1.65倍;禾谷镰孢和亚洲镰孢EC50分别为与布氏镰孢的10.24和6.22倍;EC90相差倍数介于1.44—7.29;80%福美双抑制禾谷镰孢复合种生长的EC50差别不大,相差倍数介于1.23— 1.77;EC90差别较大,相差倍数介于2.96—12.01(表5)。

表5 7种杀菌剂对禾谷镰孢复合种的室内毒力测定
F. g=F. graminearum, F. b=F. boothii, F. a=F. asiaticum
3 讨论
3.1 吉林省玉米穗腐病的镰孢菌种类及优势致病镰孢
目前报道造成吉林省玉米穗腐病的致病镰孢菌主要有禾谷镰孢、拟轮枝镰孢、层出镰孢、半裸镰孢()、尖镰孢、克鲁克威尔镰孢()、弯角镰孢()、温和镰孢()等[33,41]。本研究在2020年的玉米穗腐病样品中检测到禾谷镰孢、布氏镰孢、亚洲镰孢、拟轮枝镰孢、层出镰孢、厚垣镰孢、藤仓镰孢、木贼镰孢、亚黏团镰孢,与前人研究结果略有不同,推测不同年份间造成玉米穗腐病的致病镰孢菌种类存在差异。不同学者报道吉林省玉米穗腐病的优势致病镰孢不一致,禾谷镰孢复合种的种类也存在差异。秦子惠等研究发现造成吉林省玉米穗腐病的优势致病镰孢为拟轮枝镰孢[32,42],禾谷镰孢复合种为布氏镰孢;张婷等[41]研究发现造成吉林省玉米穗腐病的优势致病镰孢为半裸镰孢;孙华等[33]研究发现吉林省玉米穗腐病主要致病菌为禾谷镰孢复合种,由禾谷镰孢和布氏镰孢组成,且以布氏镰孢为主。本研究发现禾谷镰孢复合种是吉林省玉米穗腐病的优势病原菌,分离频率为52.36%,以拟轮枝镰孢为代表的藤仓镰孢复合种分离频率仅次于禾谷镰孢复合种,为46.35%;禾谷镰孢复合种由禾谷镰孢、亚洲镰孢和布氏镰孢组成,布氏镰孢分离频率最高,优势致病菌与孙华等研究结果一致。通过病原菌的区域分布分析,本研究发现吉林省东部、中部和西部造成玉米穗腐病的优势致病镰孢菌存在差异,东部玉米主产区优势致病镰孢为禾谷镰孢复合种中的禾谷镰孢,中部为拟轮枝镰孢,西部主要为布氏镰孢。不同玉米主产区镰孢菌的分离频率及镰孢菌种类存在一定的差异性,SHANG等[43]研究发现贵州省玉米穗腐病优势致病镰孢菌为南方镰孢,禾谷镰孢复合种由禾谷镰孢、布氏镰孢、亚洲镰孢和南方镰孢组成,南方镰孢的分离频率最高;杜青等[18]研究表明广西地区玉米穗腐病的优势镰孢菌为拟轮枝镰孢,禾谷镰孢复合种主要为南方镰孢;王宝宝等[19]研究发现黑龙江地区导致玉米穗腐病的镰孢菌主要为禾谷镰孢复合种与拟轮枝镰孢,禾谷镰孢复合种主要由禾谷镰孢、布氏镰孢、亚洲镰孢组成,本研究结果与其研究结论一致,进一步验证了南方镰孢主要分布在南方较温暖的地区。
3.2 吉林省禾谷镰孢复合种种间、种内遗传多样性均较丰富
镰孢菌在其管家基因上存在一些差异,基于这些基因的分子鉴定已被广泛用于进一步鉴定镰孢菌的种类。DNA序列,如翻译延伸因子()、-微管蛋白()、钙调素(CAM)、线粒体小亚单位rDNA(mtSSU)、28S rDNA和内部转录间隔区(ITS)区域,广泛用于系统发育分析,以评估镰孢菌物种的遗传关系[43-44]。其中基因序列可以较好地体现镰孢菌种之间的关系,并已成为镰孢菌种鉴定的重要工具[25,45]。马红霞等[46]利用基因序列对禾谷镰孢复合种进行系统发育分析发现,禾谷镰孢菌种间、种内遗传多样性均较丰富。相同地理来源的菌株有较近的亲缘关系,不同地理来源的菌株存在较频繁的基因交流与交换,本研究通过序列构建的系统发育树获得的结果与前人研究结论相吻合,为验证随着人们农业生产活动多元化致病菌间的基因交流会愈加频繁,遗传多样性水平也会因此上升提供了佐证[47]。
3.3 吉林省禾谷镰孢复合种的致病强度呈正态分布,毒素化学型主要为15-AcDON
李晓鸯[48]研究表明禾谷镰孢复合种的致病力差异与其地理来源无相关性。本研究对禾谷镰孢复合种进行致病力测定,结果发现不同致病力类型菌株在吉林省3个玉米主产区均有分布。王宝宝等[47]研究表明禾谷镰孢复合种致病力在中国由北向南逐渐减弱,种间致病力存在一定差异,禾谷镰孢致病力最强。本研究发现吉林省禾谷镰孢复合种中致病型占比最高,且东部玉米产区分离的禾谷镰孢致病力最强。吉林省禾谷镰孢复合种毒素化学型研究结果与近年前人的研究结论存在一定差异性。王宝宝等研究发现禾谷镰孢与布氏镰孢含15-AcDON、3-AcDON、NIV 3种毒素类型,大部分菌株产生3种毒素化学型中的其中一种,少部分菌株同时产2种或3种;亚洲镰孢产NIV和3-AcDON,总体上以产15-AcDON和3-AcDON为主导,15-AcDON最多[19,49]。本研究发现,吉林省禾谷镰孢复合种毒素化学型存在种的特异性,禾谷镰孢和布氏镰孢仅产15-AcDON,亚洲镰孢产NIV,与王宝宝等研究结论相吻合[47,49]。
3.4 禾谷镰孢复合种对不同杀菌剂的敏感性差异不显著
由于不同禾谷镰孢复合种致病力存在明显差异,推测药剂敏感性可能也存在差异,因此选用杀菌剂研究其对不同禾谷镰孢复合种的抑制效果,结果发现咯菌腈、抑霉唑、氟硅唑、戊唑醇和腈菌唑抑制禾谷镰孢复合种菌丝生长的EC50在0.02—1.16 μg·mL-1,不同禾谷镰孢复合种之间的药剂敏感性差异较小。卢宝慧等[34]研究报道吡唑醚菌酯对禾谷镰孢有一定的抑制效果,EC50为17.09 μg·mL-1,本研究发现吡唑醚菌酯抑制禾谷镰孢菌丝生长的EC50为19.45 μg·mL-1,与卢宝慧报道的结果相近。郭聪聪等[35]和汪锟[50]研究发现吡唑醚菌酯抑制禾谷镰孢菌丝生长的EC50分别为0.989和2.186 μg·mL-1,而本研究发现30%吡唑醚菌酯对禾谷镰孢和亚洲镰孢抑制效果相对较差,EC50分别为19.45和11.81 μg·mL-1,抑制布氏镰孢的EC50为1.90 μg·mL-1,推测不同地区分离的禾谷镰孢对吡唑醚菌酯的敏感性存在明显差异,同一药剂对不同的禾谷镰孢复合种的毒力也存在明显差异。本试验仅在室内测定了不同禾谷镰孢复合种对化学杀菌剂的敏感性,尚需进一步的田间药效验证,筛选出防治玉米镰孢穗腐病的最佳杀菌剂。
4 结论
吉林省玉米穗腐病优势致病镰孢菌为禾谷镰孢复合种和拟轮枝镰孢,禾谷镰孢复合种由禾谷镰孢、布氏镰孢和亚洲镰孢构成,以禾谷镰孢和布氏镰孢为主。东部玉米主产区分离得到的禾谷镰孢致病力最强。禾谷镰孢复合种以产15-AcDON毒素类型为主,且其对同一种杀菌剂的敏感性差异不大。
[1] 段灿星, 王晓鸣, 宋凤景, 孙素丽, 周丹妮, 朱振东. 玉米抗穗腐病研究进展. 中国农业科学, 2015, 48(11): 2152-2164.
DUAN C X, WANG X M, SONG F J, SUN S L, ZHOU D N, ZHU Z D. Advances in research on maize resistance to ear rot. Scientia Agricultura Sinica, 2015, 48(11): 2152-2164. (in Chinese)
[2] TORRES A M, PALACIOS S A, YERKOVICH N, PALAZZINI J M, BATTILANI P, LESLIE J F, LOGRIECO A F, CHULZE S N.head blight and mycotoxins in wheat: prevention and control strategies across the food chain. World Mycotoxin Journal, 2019, 12(4): 333-355.
[3] LEE H J, RYU D. Worldwide occurrence of mycotoxins in cereals and cereal-derived food products: public health perspectives of their co-occurrence. Journal of Agricultural and Food Chemistry, 2017, 65(33): 7034-7051.
[4] SUN X D, SU P, SHAN H. Mycotoxin contamination of rice in China. Journal of Food Science, 2017, 82(3): 573-584.
[5] 段灿星, 崔丽娜, 夏玉生, 董怀玉, 杨知还, 胡清玉, 孙素丽, 李晓, 朱振东, 王晓鸣. 玉米种质资源对拟轮枝镰孢与禾谷镰孢穗腐病的抗性精准鉴定与分析. 作物学报, 2022, 48(9): 2155-2167.
DUAN C X, CUI L N, XIA Y S, DONG H Y, YANG Z H, HU Q Y, SUN S L, LI X, ZHU Z D, WANG X M. Precise characterization and analysis of maize germplasm resources for resistance toear rot andear rot. Acta Agronomica Sinica, 2022, 48(9): 2155-2167. (in Chinese)
[6] SCHAAFSMA A W, LIMAY-RIOS V, TAMBUR-ILLINCI L. Mycotoxins andspecies associated with maize ear rot in Ontario, Canada. Cereal Research Communications, 2008, 36(Suppl. B): 525-527.
[7] PFORDT A, ROMERO L R, SCHIWEK S, KARLOVSK P, VON TIEDENANN A. Impact of environmental conditions and agronomic practices on the prevalence ofspecies associated with ear and stalk rot in maize. Pathogens, 2020, 9(3): 236.
[8] STUMPF R, SANTOS J, GOMES L B, SILVA C N, TESSMANN D J, FERRERIA F D, MACHINSKI M, DEL PONTE E M.species and fumonisins associated with maize kernels produced in Rio Grande do Sul State for the 2008/09 and 2009/10 growing seasons. Brazilian Journal of Microbiology, 2013, 44(1): 89-95.
[9] SAMPIETRO D A, DIAZ C G, GONZALEZ V, VATTUNE M A, PLOPE L D, CATALAN C A, WARD T J. Species diversity and toxigenic potential ofcomplex isolates from maize fields in northwest Argentina. International Journal of Food Microbiology, 2011, 145(1): 359-364.
[10] DESJARDINS A E, PROCTOR R H. Genetic diversity and trichothecene chemotypes of theclade isolated from maize in Nepal and identification of a putative new lineage. Fungal Biology, 2011, 115(1): 38-48.
[11] STEPIEN Ł, GROMADZK K, CHELKOWSKI J,. BASINSKA- BARCZAK A, LALAK-KANCZUGOWSKA J. Diversity and mycotoxin production byandas causal agents of pre-harvestmaize ear rot in Poland. Journal of Applied Genetics, 2019, 60: 113-121.
[12] COVARELLI L, STIFANO S, BECCAR G, RAGGI L, LATTANZIO V M T, ALBERTINI E. Characterization ofstrains isolated from maize in Italy: fumonisin production, pathogenicity and genetic variability. Food Microbiology, 2012, 31(1): 17-24.
[13] SMALL I M, FLETT B C, MARASAS W F O, MCLEOD A, STADER M A, VILJOEN A. Resistance in maize inbred lines toand fumonisin accumulation in South Africa. Plant Disease, 2012, 96(6): 881-888.
[14] ALIAKBARI F, MIRABILFATHY M, EMAMI M, MAZHAR S F, KARAMI-OSBOO R. Natural occurrence ofspecies in maize kernels at Gholestan Province in Northern Iran. Asian Journal of Plant Sciences, 2007, 6(8): 1276-1281.
[15] DESJARDINS A E, MUNKVOLD G P, PLANTTNER R D, PROCTOR R H.—a gene required for fumonisin biosynthesis but not for maize ear rot and ear infection byin field tests. Molecular Plant-Microbe Interactions, 2002, 15(11): 1157-1164.
[16] SCHAAFSMA A W, NICOL R W, REID L M. Evaluating commercial maize hybrids for resistance toear rot. European Journal of Plant Pathology, 1997, 103: 737-746.
[17] 郭成, 魏宏玉, 郭满库, 何苏琴, 金社林, 陈红梅, 王晓鸣, 郭建国. 甘肃玉米穗腐病样品中轮枝镰孢菌的分离鉴定及生物学特性. 植物病理学报, 2014, 44(1): 17-25.
GUO C, WEI H Y, GUO M K, HE S Q, JIN S L, CHEN H M, WANG X M, GUO J G. Isolation, identification and biological characteristics offrom maize ear rot samples in Gansu Province. Acta Phytopathologica Sinica, 2014, 44(1): 17-25. (in Chinese)
[18] 杜青, 唐照磊, 李石初, 上官玲玲, 李华娇, 段灿星. 广西玉米穗腐病致病镰孢种群构成与毒素化学型分析. 中国农业科学, 2019, 52(11): 1895-1907.
DU Q, TANG Z L, LI S C, SHANGGUAN L L, LI H J, DUAN C X. Composition ofspecies causing maize ear rot and analysis of toxigenic chemotype in Guangxi. Scientia Agricultura Sinica, 2019, 52(11): 1895-1907. (in Chinese)
[19] 王宝宝, 毕四刚, 肖明纲, 张冬英, 闫强, 张彦彦, 杨树龙, 朱振东, 段灿星. 黑龙江省玉米穗腐病致病镰孢菌分离鉴定及产毒基因型分析. 草业学报, 2020, 29(1): 163-174.
WANG B B, BI S G, XIAO M G, ZHANG D Y, YAN Q, ZHANG Y Y, YANG S L, ZHU Z D, DUAN C X. Isolation and identification of pathogenicspp. causing maize ear rot and analysis of their toxin-producing genotype in Heilongjiang Province. Acta Prataculturae Sinica, 2020, 29(1): 163-174. (in Chinese)
[20] 魏琪, 廖露露, 陈莉, 齐永霞. 安徽省玉米穗腐病主要致病镰孢菌的分离与鉴定. 植物保护, 2019, 45(5): 221-225.
WEI Q, LIAO L L, CHEN L, QI Y X. Isolation and identification of mainspecies causing maize ear rot in Anhui province. plant protection, 2019, 45(5): 221-225. (in Chinese)
[21] 丁梦军, 杨扬, 孙华, 马红霞, 刘树森, 石洁. 山东省玉米穗腐病病原菌的分离鉴定及优势种的系统发育分析. 华北农学报, 2019, 34(5): 216-223.
DING M J, YANG Y, SUN H, MA H X, LIU S S, SHI J. Isolation and identification of maize ear rot pathogens and phylogenetic analysis of dominant species in Shandong province. Acta Agriculturae Boreali- Sinica, 2019, 34(5): 216-223. (in Chinese)
[22] ZHOU D N, WANG X M, CHEN G K, SUN S L, YANG Y, ZHU Z D, DUNG C X. The majorspecies causing maize ear and kernel rot and their toxigenicity in Chongqing, China. Toxins, 2018, 10(2): 90.
[23] 孙华, 郭宁, 石洁, 张海剑, 马红霞, 刘树森. 海南玉米穗腐病病原菌分离鉴定及优势种的遗传多样性分析. 植物病理学报, 2017, 47(5): 577-583.
SUN H, GUO N, SHI J, ZHANG H J, MA H X, LIU S S. Characterization of the maize ear rot pathogens and genetic diversity analysis of dominant species in Hainan. Acta Phytopathologica Sinica, 2017, 47(5): 577-583. (in Chinese)
[24] 陈晓娟, 文成敬. 四川省玉米穗腐病研究初报. 西南农业大学学报, 2002, 24(1): 21-23, 25.
CHEN X J, WEN C J. Preliminary study of maize ear rot in Sichuan. Journal of Southwest Agricultural University, 2002, 24(1): 21-23, 25. (in Chinese)
[25] 孙华, 丁梦军, 张家齐, 石洁, 郭宁, 李坡. 河北省玉米穗腐病病原菌鉴定及潜在产伏马毒素镰孢菌系统发育分析. 植物病理学报, 2019, 49(2): 151-159.
SUN H, DING M J, ZHANG J Q, SHI J, GUO N, LI P. Identification of pathogens causing maize ear rot and the phylogenetic analysis of fumonisins-producingspecies in Hebei province. Acta Phytopathologica Sinica, 2019, 49(2): 151-159. (in Chinese)
[26] 李新凤, 王建明, 张作刚, 高俊明, 郝晓娟, 贺运春. 山西省玉米穗腐病病原镰孢菌的分离与鉴定. 山西农业大学学报(自然科学版), 2012, 32(3): 218-223.
LI X F, WANG J M, ZHANG Z G, GAO J M, HAO X J, HE Y C. Isolation and identification of the pathogencausing maize ear rot in Shanxi province. Journal of Shanxi Agricultural University (Natural Science Edition), 2012, 32(3): 218-223. (in Chinese)
[27] 马秉元, 龙书生, 李多川, 李亚玲. 陕西省玉米穗粒腐病的病原菌鉴定及各分离菌分布频率. 西北农林科技大学学报(自然科学版), 1995, 23(增刊): 98-103.
MA B Y, LONG S S, LI D C, LI Y L. Identification of pathogenic bacteria of maize ear rot and distribution frequency of each isolate in Shaanxi Province. Journal of Northwest A&F University (Natural Science Edition), 1995, 23(Suppl.): 98-103. (in Chinese)
[28] 肖淑芹, 许佳宁, 闫丽斌, 隋韵涵, 薛春生, 陈捷. 辽宁省玉米镰孢穗腐病病原菌的鉴定与分布. 植物保护学报, 2017, 44(5): 803-808.
XIAO S Q, XU J N, YAN L B, SUI Y H, XUE C S, CHEN J. Identification and distribution ofspecies causing maize ear rot in Liaoning Province. Journal of Plant Protection, 2017, 44(5): 803-808. (in Chinese)
[29] 吴畏, 田宇昂, 白宇汐, 梁琳悦, 余洋, 梁鹏宽, 蒋中华, 石海春, 柯永培, 孙群. 云南玉米穗腐病致病菌鉴定与共生群落分析. 中国测试, 2022, 48(2): 56-65.
WU W, TIAN Y A, BAI Y X, LIANG L Y, YU Y, LIANG P k, JIANG Z H, SHI H C, KE Y P, SUN Q. Pathogen identification and symbiotic community analysis of maize ear rot in Yunnan Province. China Measurement and Test, 2022, 48(2): 56-65. (in Chinese)
[30] CHIOTTA M L, ALANIZ ZANON M S, PALAZZINI J M, SCANDIANI M M, FORMENTO A N, BARROS G G, CHULZE S N. Pathogenicity ofandon soybean pod blight and trichothecene accumulation. Plant Pathology, 2016, 65(9): 1492-1497.
[31] HAO J J, XIE S N, SUN J, YANG G Q, LIU J Z, XU F, RU Y Y, SONG Y L. Analysis ofspecies complex from wheat-maize rotation regions in Henan (China). Plant Disease, 2017, 101(5): 720-725.
[32] 秦子惠, 任旭, 江凯, 武小菲, 杨知还, 王晓鸣. 我国玉米穗腐病致病镰孢种群及禾谷镰孢复合种的鉴定. 植物保护学报, 2014, 41(5): 589-596.
QIN Z H, REN X, JIANG K, WU X F, YANG Z H, WANG X M. Identification ofspecies andspecies complex causing maize ear rot in China. Journal of Plant Protection, 2014, 41(5): 589-596. (in Chinese)
[33] 孙华, 张海剑, 马红霞, 石洁, 郭宁, 陈丹, 李坡. 春玉米区穗腐病病原菌组成、分布及禾谷镰孢复合种的鉴定. 植物病理学报, 2018, 48(1): 8-15.
SUN H, ZHANG H J, MA H X, SHI J, GUO N, CHEN D, LI P. Composition and distribution of pathogens causing ear rot in spring maize region and identification ofspecies complex. Acta Phytopathologica Sinica, 2018, 48(1): 8-15. (in Chinese)
[34] 卢宝慧, 吴庠玉, 刘燕妮, 南楠, 夏纬跃, 马贵龙, 高洁. 玉米穗腐病药剂防治研究. 吉林农业大学学报, 2014, 36(5): 519-523.
LU B H, WU X Y, LIU Y N, NAN N, XIA W Y, MA G L, GAO J. Study on chemical control of maize ear rot caused by. Journal of Jilin Agricultural University, 2014, 36(5): 519-523. (in Chinese)
[35] 郭聪聪, 付萌, 庞民好, 刘颖超, 董金皋. 杀菌剂对玉米穗腐病菌的毒力及毒素产生的影响. 植物保护学报, 2015, 42(6): 1036-1043.
GUO C C, FU M, PANG M H, LIU Y C, DONG J G. Effects of fungicides on growth and mycotoxins ofspecies causing maize ear rot. Journal of Plant Protection, 2015, 42(6): 1036-1043. (in Chinese)
[36] 晏明, 张磊, 盛国志. 吉林省农业功能区划研究. 中国农业资源与区划, 2011, 32(5): 36-41.
YAN M, ZHANG L, SHENG G Z. Studies on regional planning of agriculture function of Jilin province. Chinese Journal of Agricultural Resources and Regional Planning, 2011, 32(5): 36-41. (in Chinese)
[37] 张昊, 张争, 许景升, 徐进, 张丽勍, 潘哲超, 田茜, 冯洁. 一种简单快速的赤霉病菌单孢分离方法——平板稀释画线分离法. 植物保护, 2008, 34(6): 134-136.
ZHANG H, ZHANG Z, XU J S, XU J, ZHANG L Q, PAN Z C, TIAN Q, FENG J. A rapid and simple method for obtaining single-spore isolates ofspecies—agar dilution lineation separation. plant protection, 2008, 34(6): 134-136. (in Chinese)
[38] LESELIE J F, SUMMERELL B A. TheLaboratory Manual. Iowa: Blackwell Publishing, 2006.
[39] 陈鸿逵, 王拱辰. 浙江镰刀菌志. 杭州: 浙江科学技术出版社, 1992.
CHEN H K, WANG G C. Zhejiangspp. Hangzhou: Zhejiang Science and Technology Press, 1992. (in Chinese)
[40] 杨谦. 植物病原菌抗药性分子生物学. 2版. 北京: 科学出版社, 2011.
YANG Q. Molecular biology of drug resistance of plant pathogens. 2nd ed. Harbin: Science Press, 2011. (in Chinese)
[41] 张婷, 孙晓东, 吕国忠. 我国东北地区玉米穗腐镰孢菌的种类及其分离频率. 菌物研究, 2011, 9(1): 9-14, 36.
ZHANG T, SUN X D, Lü G Z.species and its isolation frequency from rot ears of maize in northeast China. Journal of Fungal Research, 2011, 9(1): 9-14, 36. (in Chinese)
[42] 许佳宁. 辽吉地区玉米穗腐病病原鉴定及防治基础研究[D]. 沈阳: 沈阳农业大学, 2018.
XU J N. Identification of pathogen of maize ear rot in Liaoning and Jilin provinces and control[D]. Shenyang: Shenyang Agricultural University, 2018. (in Chinese)
[43] SHANG G F, LI S Q, YU H, YANG J, LI S M, YU Y Q, WANG J M, WANG Y, ZENG Z, ZHANG J B, HU Z Q. An efficient strategy combining immunoassays and molecular identification for the investigation ofinfections in ear rot of maize in Guizhou province, China. Frontier in Microbiology, 2022, 13: 849698.
[44] WANG J H, ZHANG J B, LI H P, GONG A D, XUE S, AGBOOLA R S, LIAO Y C. Molecular identification, mycotoxin production and comparative pathogenicity ofisolated from maize in China. Journal of Phytopathology, 2014, 162: 147-157.
[45] DUAN C X, QIN Z H, YANG Z H, LI W X, SUN S L, ZHU Z D, WANG X M. Identification of pathogenicspp. causing maize ear rot and potential mycotoxin production in China. Toxins, 2016, 8(6): 186.
[46] 马红霞, 孙华, 郭宁, 张海剑, 石洁, 常佳迎. 禾谷镰孢复合种毒素化学型及遗传多样性分析. 中国农业科学, 2018, 51(1): 82-95.
MA H X, SUN H, GUO N, ZHANG H J, SHI J, CHANG J Y. Analysis of toxigenic chemotype and genetic diversity of thespecies complex. Scientia Agricultura Sinica, 2018, 51(1): 82-95. (in Chinese)
[47] 王宝宝, 郭成, 孙素丽, 夏玉生, 朱振东, 段灿星. 玉米穗腐病致病禾谷镰孢复合种的遗传多样性、致病力与毒素化学型分析. 中国农业科学, 2020, 53(23): 4777-4790.
WANG B B, GUO C, SUN S L, XIA Y S, ZHU Z D, DUAN C X. The genetic diversity, pathogenicity, and toxigenic chemotypes ofspecies complex causing maize ear rot. Scientia Agricultura Sinica, 2020, 53(23): 4777-4790. (in Chinese)
[48] 李晓鸯. 东北地区玉米穗腐病致病镰孢菌种群结构及品种抗性分析[D]. 沈阳: 沈阳农业大学, 2018.
LI X Y. Population structure ofspp. and the resistance of maize to maize ear rot in Northeast China[D]. Shenyang: Shenyang Agricultural University, 2018. (in Chinese)
[49] SAMPIETRO D A, MARIN P, IGLESIAS J, PRESELLO D A, VATTUONE M A, CATALAN C A, GONZALEZ JAEN M T. A molecular based strategy for rapid diagnosis of toxigenicspecies associated to cereal grains from Argentina. Fungal Biology, 2010, 114(1): 74-81.
[50] 汪锟. 杀菌剂对安徽凤阳玉米穗腐病菌的毒力及相关调控基因表达的研究[D]. 合肥: 合肥工业大学, 2019.
WANG K. Study on the virulence of fungicides against maize ear rot fungus in Fengyang, Anhui and the expression of related genes[D]. Hefei: Hefei University of Technology, 2019. (in Chinese)
Identification of pathogenicspp. causing maize ear rot and susceptibility of some strains to fungicides in Jilin Province

1College of Plant Protection, Jilin Agricultural University, Changchun 130022;2Institute of Plant Protection, Jilin Academy of Agricultural Sciences/Key Laboratory of Integrated Crop Pest Management in Northeast China, Ministry of Agriculture and Rural Affairs, Changchun 130033
【】The objective of this study is to clarify the population distribution ofspp. of maize ear rot in Jilin Province and the inhibitory effect of fungicides on the growth ofmycelium, and to provide a basis for the targeted control of maize ear rot.【】149 samples of maize ear rot collected from 36 cities and counties in Jilin Province in 2020 were isolated and identified by tissue isolation and molecular biology methods. The specific toxin synthesis primers of related genes were synthesized usingspecies complex (FGSC) toxin. The toxigenic chemotypes were detected, and the pathogenicity of someFGSC was determined. The inhibitory effect of 7 fungicides on FGSC was determined by the mycelial growth rate method.【】A total of 233strains were isolated, belonging to 4complex species, including 9species, which were,,,,,,,and. the isolation frequencies were 33.05%, 26.18%, 25.32%, 12.45%, 0.86%, 0.86%, 0.43%, 0.43% and 0.43%, respectively. The isolate frequency of FGSC was the highest, which was 52.36%, and it was the dominant pathogen ofmaize ear rot in Jilin Province. The proportions of,andin FGSC were 50.00%, 48.36% and 1.46%, respectively. The phylogenetic tree showed that the interspecific and intraspecific genetic diversity of FGSC was rich. The results of pathogenicity assay showed that 52.73% of FGSC were medium pathogenic strains.isolated from the main maize producing areas in the east had the strongest pathogenicity. toxigenic chemotype detection showed thatproducednivalenol (NIV) chemotype,andproduced 15-acetyl-deoxynivalenol (15-AcDON) chemotype. The EC50of the 7 fungicides for inhibiting the growth of FGSC ranged from 0.02 to 19.45 μg·mL-1. Fludioxonil (FS), imazalil (FS), flusilazole (EC), tebuconazole (TC) and myclobutanil (EW) had good inhibitory effects on FGSC and the difference was not significant. The EC50of FGSC was less than 1.20 μg·mL-1and EC90was less than 100 μg·mL-1. The difference of EC50betweenandwas significant under 30% pyraclostrobin treatment. the EC50ofwas 10.24 times higher than that of【】The dominant pathogenicof maize ear rot in different maize producing areas of Jilin Province is different.andare dominant species in the east and west, andisdominant species in the middle. The interspecific and intraspecific genetic diversity of FGSC is rich. Fludioxonil, imazalil, flusilazole, tebuconazole and myclobutanil have better antifungal effect on FGSC. there is no significant difference in the fungicides susceptibility among FGSC.
maize; ear rot;spp.;species complex (FGSC); fungicide

2022-07-21;
2022-09-06
吉林省重点研发计划(20210202121NC)、国家现代农业产业技术体系(CARS-02)
柴海燕,E-mail:3222181805@qq.com。通信作者苏前富,E-mail:qianfusu@126.com
(责任编辑 岳梅)
