小麦吸浆虫小热激蛋白基因Hsp21.9的克隆及在滞育过程与温度胁迫下的表达特性
2023-02-01古丽旦刘洋李方向成卫宁
古丽旦,刘洋,李方向,成卫宁
小麦吸浆虫小热激蛋白基因的克隆及在滞育过程与温度胁迫下的表达特性
古丽旦1,刘洋1,李方向2,成卫宁1
1西北农林科技大学植物保护学院/农业农村部西北黄土高原作物有害生物综合治理重点实验室,陕西杨凌 712100;2西安市农业技术推广中心,西安 710061
【】小麦吸浆虫()是最重要的小麦害虫之一,滞育使其度过酷暑和严寒。本研究旨在探讨小麦吸浆虫小热激蛋白(small heat shock protein,sHsp)基因在滞育中的作用。【】利用RACE和RT-PCR技术从小麦吸浆虫滞育前幼虫中克隆全长cDNA序列;利用生物信息学软件对其核苷酸和编码蛋白特性进行分析;采用RT-qPCR技术分析在滞育进程(滞育前、滞育、滞育后静息期和滞育后发育)不同阶段幼虫及夏滞育幼虫在短期(≤120 min)极端高温(35—50℃) 和越冬幼虫在短期(≤120 min)极端低温(0—-15℃)胁迫下的表达模式;通过大肠杆菌原核表达系统诱导表达及纯化其编码蛋白,采用吸光值法测定重组蛋白抑制猪心苹果酸脱氢酶(malate dehydrogenase,MDH)热聚沉的能力。【】克隆获得了cDNA全长为1 087 bp的小麦吸浆虫,命名为(GenBank登录号:KT749988),其开放阅读框长度为582 bp,编码193个氨基酸,其中谷氨酸含量最高(12.4%),半胱氨酸含量最低(0.5%);预测的蛋白分子量为21.9 kD,等电点为5.67。SmHsp21.9氨基酸序列具有小热激蛋白家族典型的-晶体结构域,该结构域由6个-折叠组成,其在空间上形成-三明治结构。蛋白序列相似性和系统进化分析表明,SmHsp21.9蛋白与长角亚目昆虫摇蚊()Hsp27的相似性最高、亲缘关系最近。RT-qPCR分析结果表明,小麦吸浆虫滞育不同时期幼虫表达量存在显著差异,进入滞育后表达量显著降低,10月后逐渐升高,滞育后静息阶段的12月和翌年1月显著高于其他季节。与未处理的对照相比,35—45℃高温、-5—-10℃低温处理可显著诱导越夏、越冬幼虫的表达,以30—60 min处理诱导效果较明显;高于50℃或低于-15℃诱导效果不明显。获得的SmHsp21.9重组蛋白可显著抑制MDH在高温(43℃)下聚集,具有显著的分子伴侣活性。【】小麦吸浆虫的表达不仅受滞育发育影响,而且受环境温度的调控,其可能参与滞育的启动和终止,且与滞育期间的耐热和耐寒性相关。
小麦吸浆虫;Hsp21.9;基因克隆;滞育;温度胁迫;基因表达
0 引言
【研究意义】小麦吸浆虫()是北半球小麦生产中的重要害虫[1-2],同时是一种典型的专性滞育昆虫。老熟幼虫脱离麦穗后钻入土中结茧进入滞育,直至12月大部分个体终止滞育后进入静息期,翌年3月小麦拔节后破茧恢复发育[3-4],即滞育不仅使小麦吸浆虫生活史与小麦物候保持一致,同时使其度过酷暑和严寒。探讨小麦吸浆虫滞育进程中热激蛋白(heat shock protein,Hsp)基因表达与滞育发育与温度耐受性之间的关系,对阐释其滞育的分子机理及滞育过程中对逆境的适应机制具有重要意义。【前人研究进展】面对各种环境胁迫,几乎所有的生物能够合成Hsp。Hsp主要通过帮助蛋白质正确折叠,促进变性蛋白降解而发挥分子伴侣的功能。根据分子量大小,Hsp可分为Hsp90、Hsp70、Hsp60和小分子热激蛋白(small heat shock protein,sHsp)4个主要家族[5-6]。sHsp分子量一般在12—43 kD,是Hsp超家族中分子量变化最大、种类和功能最多样化的家族[7]。目前从人类和家蚕()基因组中分别鉴定了10个和16个[8-9]。近年来的研究表明,sHsp不仅参与生物对热/冷[10-11]、干旱[12]和重金属[13]等的胁迫,而且与昆虫发育[14-15]和滞育密切相关,其在滞育中的作用因昆虫种类和同家族成员的不同有较大差异。例如红尾肉蝇()滞育期表达水平显著高于滞育前和滞育后,与滞育维持及滞育期间的抗寒性有关[16];其他昆虫如葱蝇()[17]、棉铃虫()和梨小食心虫()、也发现了相似结果。然而与之不同,棉铃虫和梨小食心虫进入滞育后下调表达[18-19],丝光绿蝇()和叔白颜果蝇()的表达与滞育无关[20-21]。【本研究切入点】前期研究了小麦吸浆虫和在滞育进程及极端高、低温胁迫下的表达特点[22]。由于不同成员在昆虫滞育[18-19]或抵抗温度胁迫[10]时的作用机制不同,有关小麦吸浆虫其他成员在滞育发育或极端温度胁迫中的作用还有待探究。【拟解决的关键问题】克隆小麦吸浆虫,分析其在滞育进程与极端高、低温胁迫下的mRNA表达模式;通过原核表达系统和苹果酸脱氢酶(malate dehydrogenase,MDH)热聚沉试验研究Hsp21.9重组蛋白的分子伴侣活性,为探明Hsp21.9在小麦吸浆虫滞育中的作用及适应温度响应的机制提供理论依据。
1 材料与方法
1.1 试虫来源
供试虫源为小麦吸浆虫滞育前、滞育、滞育后静息和滞育后发育幼虫,均采自田间,参考Cheng等[23]的方法获得。2020年5月,在陕西省兴平市大量采集被小麦吸浆虫严重危害的麦穗,剥穗获得3龄幼虫作为滞育前样本,其余麦穗放入在陕西杨凌构建的养虫圃(34°16′N,108°4′E),为使虫体快速脱离麦穗和钻入土中结茧进入滞育,适度浇水。前期研究发现,12月以后从田间采集的结茧幼虫转入25℃后,几乎全部羽化,说明此后它们已终止滞育进入滞育后静息期[4]。从6月下旬大部分幼虫进入滞育至翌年2月,每月定期淘土采集滞育(6—11月)和滞育后静息(12月至翌年2月)幼虫,3月幼虫离开茧后采集发育幼虫。收集的幼虫每20头放入2 mL冻存管中液氮速冻,-80℃保存。
1.2 极端高、低温处理
自然条件下,小麦吸浆虫幼虫主要在地下3—10 cm滞育[24],陕西杨凌此范围夏季最高和冬季最低温度分别为30℃和0℃左右,而夏季地表极端温度常超过50℃,冬季达-15℃。为明确小麦吸浆虫对极端高、低温胁迫的响应,将8月采集的滞育幼虫放入2 mL离心管,分别置于不同温度(35、40、45和50℃)水浴中处理 1 h和40、45℃水浴中处理不同时间(0、15、30、60和120 min);12月采集的幼虫在低温培养箱中进行不同低温(0、-5、-10和-15℃)处理1 h和-5、-10℃处理不同时间(0、15、30、60和120 min)。处理结束后样本液氮速冻,-80℃保存。每处理20头试虫,重复3次。
1.3 小麦吸浆虫Hsp21.9全长序列的克隆
1.3.1 总RNA提取和cDNA合成 以采集的麦穗幼虫为样本,参照RNA simple Total RNA Kit说明书(TIANGEN,北京)提取总RNA,用核酸蛋白浓度测定仪检测其浓度(OD260/OD280),1.0%琼脂糖凝胶电泳检测其完整性。取1 μg总RNA,按照PrimeScriptTMRT Reagent Kit with gDNA Eraser(Perfect Real Time)(Takara,大连)反转录试剂盒说明书除去基因组DNA后反转录合成cDNA第1链,-20℃保存备用。
1.3.2 RACE扩增 基于本实验室获得的小麦吸浆虫幼虫转录组中Unigene序列分别设计5′和3′ RACE特异引物(表1),按照3′-Full RACE Core Set with PrimeScriptTMRTase和5′-Full RACE Kit with TAP(Takara,大连)说明进行5′和3′ RACE扩增。Outer PCR反应程序为94℃预变性3 min;94℃ 30 s,55℃ 30 s,72℃60 s,25个循环;最后72℃延伸10 min。Inner PCR反应程序除循环数为35外,其余同Outer PCR。PCR产物用1%琼脂糖凝胶电泳检测,将符合预期大小的条带用DNA纯化回收试剂盒(TIANGEN,北京)回收后连接到克隆pMDTM-19T载体,然后转化DH5感受态细胞,蓝白斑筛选后随机挑选3个阳性克隆在LB培养基中37℃振荡培养,菌液PCR鉴定后送英潍捷基()贸易有限公司测序。
1.3.3 全长序列验证 将获得的5′和3′末端序列与转录组中的序列用DNAMAN 6.0软件进行拼接,根据拼接获得的序列设计特异引物(表1)进行PCR扩增,扩增程序为94℃ 2 min;94℃ 30 s,56℃ 30 s,72℃ 30 s,35个循环;最后72℃延伸5 min。PCR产物克隆测序步骤同上。
1.4 序列分析和系统进化树构建
应用在线软件Expasy(http://www.expasy.org)将克隆获得的小麦吸浆虫核苷酸序列翻译成氨基酸序列并进行分子量和等电点预测,在线程序ORF finder(http://www.ncbi.nlm.nih.gov/gorf/gorf. html)预测开放阅读框,在线工具Conserved Domains(http:// www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)进行蛋白功能域预测,SWISS-MODEL服务器(https://www. swissmodel.expasy.org/)进行蛋白三维结构预测。应用Blastp(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行蛋白序列相似性分析,用MEGA6.0软件中的邻接法(neighbor-joining,NJ)构建系统进化树(Bootstrap:1 000 次)。
1.5 小麦吸浆虫Hsp21.9在滞育和极端温度胁迫下的表达分析
1.5.1 RNA提取和cDNA模板的合成 取滞育进程不同阶段和高、低温处理的小麦吸浆虫幼虫各20头,按照1.3.1节的方法提取总RNA并反转录合成cDNA。每处理重复3次。
1.5.2 RT-qPCR分析 根据获得的全长cDNA序列设计定量引物(表1),以小麦吸浆虫(GenBank登录号:KR733066)为内参,合成的cDNA为模板,按照SuperReal荧光定量预混试剂增强版(SYBR Green)(TIANGEN,北京)试剂盒说明,在QuantStudio®5实时荧光定量PCR仪(Bio-Rad,Hercules,CA)上进行PCR扩增。20 μL反应体系包括2×SuperReal PreMix Plus 10 μL,上下游引物(10 μmol·L-1)各0.8 μL,模板1.0 μL,其余为ddH2O。反应程序为95℃预变性15 min;95℃变性30 s,55℃退火30 s,72℃延伸 30 s,40个循环;最后从55℃开始,以每循环增加0.5℃后停留10 s,81次循环进行熔解曲线扩增。
1.5.3 数据分析 qPCR反应结束后读取Ct值,分别以小麦吸浆虫滞育前和未处理的越夏/越冬幼虫转录水平为基准,采用2-ΔΔCt法[25]计算滞育进程不同阶段和高、低温处理下的相对表达水平,所得数据进行单因素方差分析(<0.05)和Duncan氏多重比较。

表1 本研究所用引物
酶切位点用下划线标记 Restriction sites are underlined
1.6 小麦吸浆虫Hsp21.9的原核表达与纯化
以合成的cDNA为模板,利用带R Ⅰ和dⅢ酶切位点的特异引物(表1)扩增目的基因编码区,扩增产物连接至pMD-19T载体并转化DH5感受态细胞,白色菌落振荡培养后提取质粒并测序验证。将pMD19-T/SmHsp21.9重组质粒和表达载体pET28a (+)分别进行双酶切,纯化后用T4连接酶连接,转化DH5感受态细胞,阳性克隆培养后测序。测序正确的重组表达质粒转化BL21 (DE3)感受态细胞,阳性克隆培养、测序验证后于含100 μg·mL-1卡那霉素的LB培养基中振荡培养(37℃、220 r/min);取5 μL过夜培养的菌液接种至50 mL新鲜的LB培养基中继续培养,当菌液OD600达到0.6—0.8时,加入终浓度为0.5 mmol·L-1的IPTG诱导蛋白表达,5 h后离心收集菌体;菌体用含0.5 mmol·L-1PMSF的20 mmol·L-1Tris-HCl(pH 7.4)悬浮,0.4 mg·mL-1溶菌酶裂解,液氮反复冻融后在1 200×离心30 min,收集上清和沉淀,15% SDS-PAGE检测蛋白的表达情况。重组蛋白的变性、复性、纯化和浓度测定等参照文献[26]。
1.7 重组蛋白的分子伴侣活性分析
为明确Hsp21.9重组蛋白是否具有分子伴侣活性,参照Pérez-Morales等[27]的方法分析其抑制猪心苹果酸脱氢酶(MDH,Sigma,美国)热聚沉的能力。目的蛋白、牛血清蛋白(BSA,对照)和MDH用1×PBS缓冲液(pH 7.0)分别稀释至1 μmol·L-1,设3个处理组,即100 μL MDH+100 μL Hsp21.9重组蛋白、100 μL MDH+100 μL BSA和200 μL MDH。各处理置于温度为43℃的酶标仪中,分析360 nm处70 min内吸光值的变化。重复3次。
2 结果
2.1 小麦吸浆虫Hsp21.9 cDNA特征
通过RACE-PCR技术克隆获得了cDNA全长为1 087 bp的小麦吸浆虫(,GenBank登录号:KT749988)(图1)。开放阅读框(ORF)长度为582 bp,编码193个氨基酸,预测的蛋白分子量为21.9 kD,等电点为5.67;5′和3′非编码区(UTR)长度分别为100 和405 bp,其中3′-UTR具有真核生物典型的多聚腺苷酸信号(AATAAA)和PolyA结构。氨基酸组成分析表明,该蛋白由19种氨基酸组成,其中谷氨酸(Glu,E)含量最高(24个),占12.4%;半胱氨酸(Cys,C)含量最低(1个),占0.5%。保守结构域搜索显示,SmHsp21.9具有sHsp家族典型的-晶体结构域(第59—137位氨基酸)和IXI基序(第149—151位氨基酸)。

起始密码子和终止密码子用方框标注,多聚腺苷酸位点用下划线表示,α-晶体结构域用阴影表示,IXI基序用椭圆标注
二级结构预测显示,SmHsp21.9-晶体结构域由6个-折叠和2个-螺旋组成,它们分别包含46和6个氨基酸,各占58.2%和7.6%。利用SWISS-MODEL同源建模服务器,以斑马鱼()-晶体蛋白(PDB ID: 3n3e.1A)为模板对其三维结构进行预测,发现该蛋白以二聚体形式存在,每个单体中6个反向平行的-折叠构成-三明治结构(图2)。
2.2 SmHsp21.9氨基酸序列相似性和进化分析
将SmHsp21.9与来自于双翅目、鳞翅目和膜翅目昆虫的其他20种sHsp氨基酸序列进行Blastp比对,发现SmHsp21.9与同目长角亚目摇蚊()Hsp27(AGJ98435.1)一致性最高,为59.0%,与地中海实蝇()Hsp23(XP_ 004523813.1)橘小实蝇()Hsp23(XP_011198111.1)铜绿蝇()Hsp23(KNC34287.1)、黑腹果蝇()Hsp26(XP_017121953.1)和葱蝇Hsp23(ADX36150.1)的一致性为50.9%—53.9%,与其他昆虫同源蛋白(包括同亚目的冈比亚按蚊()Hsp20.9)的一致性为36.2%—49.6%。基于邻接法构建SmHsp21.9与20种同源蛋白的进化关系,结果(图3)显示系统树分为4支,即双翅目、鳞翅目、膜翅目和包含不同目昆虫(包括冈比亚按蚊家蝇()家蚕和大蜜蜂())sHsp的直系同源族,双翅目中,SmHsp21.9与摇蚊亲缘关系最近,与氨基酸序列比对和昆虫传统分类结果一致;同时发现同目中,同物种sHsp间的亲缘关系比与其他物种间的近。

N和C分别表示N端和C端,蓝色和绿色片层表示两个单体的β-折叠结构,箭头表示氨基酸序列由N端到C端,红色部分为α-螺旋

图3 SmHsp21.9与其他昆虫sHsp系统进化关系
2.3 小麦吸浆虫滞育进程中SmHsp21.9表达量变化
对小麦吸浆虫滞育前(5月)、滞育(6—11月)、滞育后静息(12月至翌年2月)和滞育后发育(翌年3月)幼虫的表达量分析结果(图4)表明,滞育进程中表达量存在显著差异。滞育前较高,入土进入滞育后(6月)显著降低,仅为滞育前的12%;9月之前维持在较低水平,但是10月后逐渐升高,大部分幼虫终止进入滞育后静息期的12月和1月达到最高(滞育前的2.89—3.27倍),显著高于其他阶段;2月后表达量显著降低,恢复发育后降到滞育前的水平。
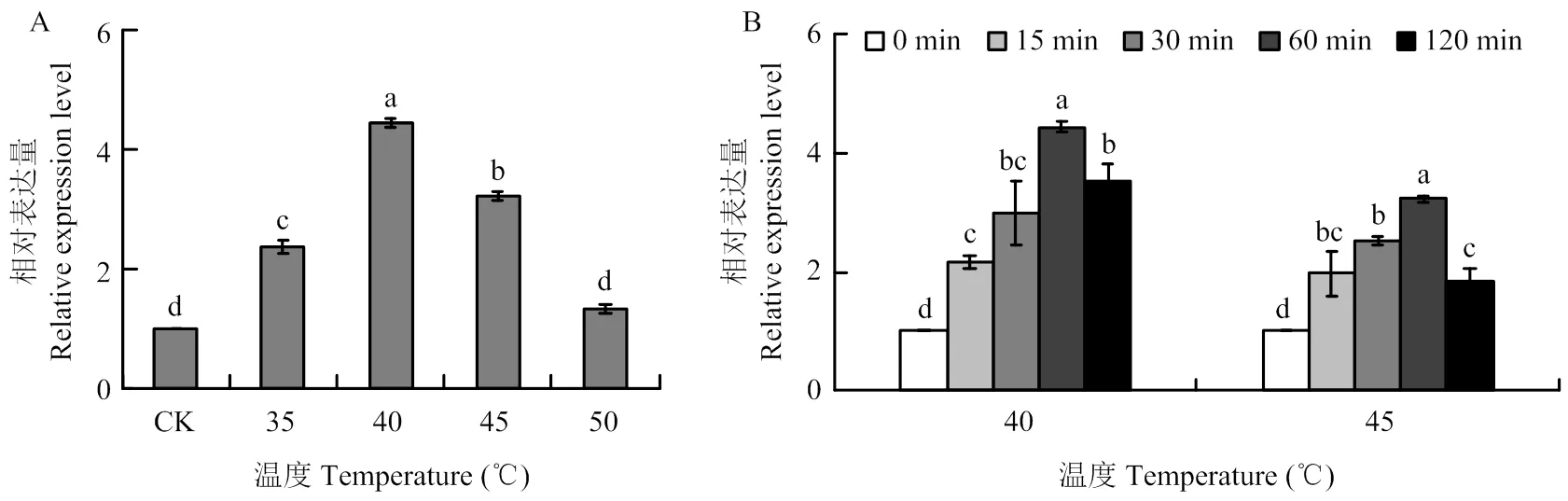
2.4 短期极端高温对越夏幼虫SmHsp21.9表达的影响
由图5-A可知,35—45℃高温处理1 h可显著诱导越夏幼虫的表达,以40℃处理的诱导效果最明显,表达量为对照(未处理幼虫)的4.43倍,其次为45℃处理,表达量为对照的3.22倍;然而50℃处理的表达量与对照差异不显著。同时分析了40℃和45℃处理不同时间对表达的影响,结果(图5-B)表明,15—120 min处理均显著诱导的表达,但不同处理时间之间表达量差异显著。60 min处理范围内,随着时间的延长,表达量逐渐升高,60 min处理的表达量显著高于其他处理。
2.5 短期极端低温对越冬幼虫SmHsp21.9表达的影响
由图6-A可知,不同低温处理1 h的越冬幼虫表达量差异显著,其中-5℃处理的表达量最高,为对照(未处理幼虫)的5.85倍,显著高于其他处理;其次为-10℃,表达量为对照的3.41倍;0℃和-15℃处理与对照差异不显著。同时分析了-5℃和-10℃处理不同时间对表达的影响,结果(图6-B)表明,-5℃下,30和60 min 处理的表达量显著高于其他处理,其次为15 min处理,90 min处理的表达量与对照差异不显著;-10℃下,60 min处理的表达量显著高于对照和15 min处理,其他处理间差异不显著。

图中数据为平均值±标准误,柱上不同小写字母表示经Duncan氏多重比较后差异显著(P<0.05)。图5、图6同
CK:未处理的对照The untreated control。图6同The same as Fig. 6
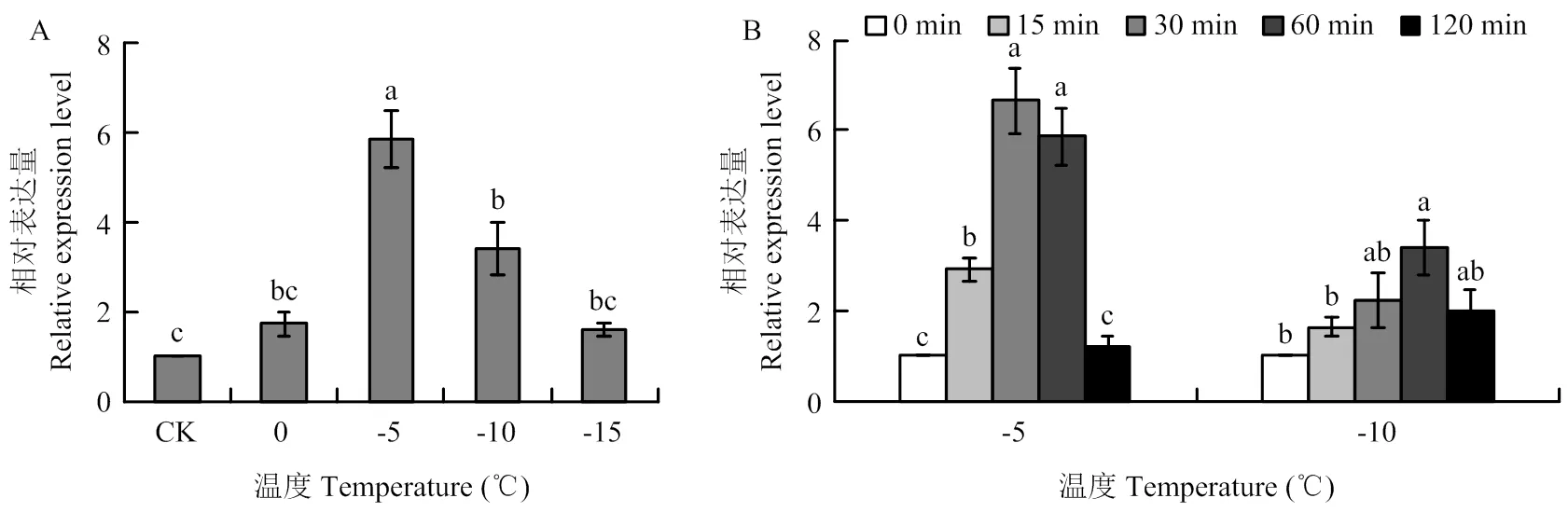
图6 不同低温处理1 h(A)和-5、-10℃处理不同时间(B)的小麦吸浆虫越冬幼虫SmHsp21.9相对表达量
2.6 SmHsp21.9的原核表达与分子伴侣活性分析
将成功构建的原核表达重组质粒pET28a(+)/ SmHsp21.9转入BL21感受态细胞,经IPTG诱导表达后用15% SDS-PAGE检测(图7),发现重组蛋白以包涵体形式存在(泳道3);重组蛋白经变性、复性和纯化后在约25 kD(包括His标签)处出现单一条带(泳道4),表明获得了较高纯度的融合蛋白。
为明确SmHsp21.9蛋白是否具有保护细胞免遭高温胁迫的分子伴侣功能,应用吸光值法测定了其抑制猪心苹果酸脱氢酶(MDH)热聚沉的能力(图8)。MDH在43℃孵育时,360 nm处吸光值不断升高,表明发生明显的热聚沉反应[26],当与无分子伴侣活性的牛血清蛋白(BSA)等摩尔浓度混合时吸光值快速上升,热聚沉速度更快。但当混入等摩尔浓度的SmHsp21.9时,吸光值非常低,说明其显著抑制MDH热聚沉,具有显著的分子伴侣功能。

M:蛋白分子量标准molecular weight marker;1:未诱导的蛋白复合物un-induced pET28a (+) /SmHsp21.9;2:IPTG诱导的蛋白上清supernatant of pET28a (+) /SmHsp21.9 after induction by IPTG;3:IPTG诱导的蛋白包涵体inclusion body of pET28a(+) /SmHsp21.9 after induction by IPTG;4:纯化后的融合蛋白purified pET28a (+)/SmHsp21.9

图8 苹果酸脱氢酶热聚沉分析中SmHsp21.9的分子伴侣活性
3 讨论
3.1 SmHsp21.9具有sHsp家族典型的结构特点
本研究成功克隆了小麦吸浆虫全长序列,其编码蛋白仅含有1个半胱氨酸,但富含谷氨酸,这与已报道的多数伴侣蛋白半胱氨酸含量较少的结论相一致[28];研究表明谷氨酸能够提供额外的静电引力维持蛋白质在高温下的稳定性[29]。SmHsp21.9蛋白不仅与同目长角亚目昆虫sHsp序列相似性最高,亲缘关系最近,而且与已报道的多数昆虫sHsp一样,包含-晶体结构域[30],且其富含-折叠,在空间上形成-三明治结构。-结构对sHsp的分子伴侣及对底物蛋白的特异性结合是十分重要的,-三明治结构对于低聚物的形成十分必要[31],说明该基因属于-晶体/sHsp家族,在进化中结构高度保守,即具备在高温下发挥分子伴侣作用的条件。
3.2 SmHsp21.9的表达与小麦吸浆虫滞育启动、终止和20E滴度相关
小麦吸浆虫的表达与滞育进程相关。滞育启动后表达量显著下调,9月前的滞育维持期表达量一直很低,10月后随着田间温度的降低,滞育终止率的提高表达量逐渐升高,所有个体终止滞育进入滞育后静息(低温静息)阶段的初期(12月至翌年1月)[4]表达量达到最高,即该基因表达量变化与滞育的启动和终止紧密相关。该结论与蛀茎夜蛾()在滞育期表达量较低,滞育终止后表达量显著升高[32]的结论相一致。小麦吸浆虫滞育和滞育后静息幼虫均以结茧形式存在[4],二者在形态上无法区分,故可以表达量变化作为判断滞育终止、区分两种状态的分子指标。
昆虫发育和滞育受激素调控,而20E是调控昆虫发育和滞育最重要的激素之一。有研究表明,在昆虫发育中发挥作用,其在发育中的表达受20E的调控,如地中海实蝇[33]、中华蜜蜂()[34]和甜菜夜蛾()、[35]。本实验室前期研究发现,小麦吸浆虫进入滞育后20E滴度显著降低,12月和翌年1月的低温静息阶段显著高于滞育前、后和滞育期其他阶段[36],即与该虫滞育进程表达变化趋势相一致,故此认为在小麦吸浆虫滞育中的表达可能受20E调控。
3.3 SmHsp21.9在小麦吸浆虫抵御温度胁迫中发挥作用
大量研究表明,昆虫受到极端环境尤其热、冷胁迫后表达量会迅速提高,在昆虫抵抗热、冷胁迫中发挥着重要作用。如40℃以上高温处理(≤2 h)可迅速提高中华稻蝗()/[37]和赤拟谷盗()[38]的表达量,说明在中华稻蝗和赤拟谷盗抵抗高温胁迫中起到一定作用。-10℃低温处理1 h可诱导白蜡虫()的表达[39];红尾肉蝇在低温下的上调表达提高了越冬蛹的存活率[16]。本研究发现,短期(≤ 2 h)极端高温(≥35℃)、低温(≤-5℃)胁迫可显著诱导小麦吸浆虫越夏、越冬幼虫的表达,但随着温度的进一步升高、降低或者暴露时间的延长,诱导效果不明显或者下降,说明夏季、冬季通过农事操作(如翻地)将吸浆虫幼虫从地下翻到地表时,可能在机体抵御一定程度的短期极端地面温度胁迫中发挥作用,SmHsp21.9抑制MDH热聚沉的能力说明其具有保护细胞免遭高温胁迫的分子伴侣功能。
4 结论
小麦吸浆虫的表达不仅受滞育发育影响,而且受环境温度的调控,其在滞育中的表达与滞育启动和终止相关;极端高、低温胁迫可诱导越夏、越冬幼虫的表达,可显著抑制MDH热聚沉,说明该基因与滞育期的耐热和耐寒性相关。
[1] Shrestha G, Reddy G V P. Field efficacy of insect pathogen, botanical, and jasmonic acid for the management of wheat midgeand the impact on adult parasitoidpopulations in spring wheat. Insect Science, 2019, 26(3): 523-535.
[2] Wang Q, Liu X B, Liu H, Fu Y, Cheng Y M, Zhang L J, Shi W P, Zhang Y, Chen J L. Transcriptomic and metabolomic analysis of wheat kernels in response to the feeding of orange wheat blossom midges () in the field. Journal of Agricultural and Food Chemistry, 2022, 70(5): 1477-1493.
[3] 王越, 龙治任, 冯安荣, 成卫宁. 虫口基数、小麦品种和降水对麦红吸浆虫危害程度的影响. 西北农业学报, 2015, 24(10): 165-171.
Wang Y, Long Z R, Feng A R, Cheng W N. Effects of initial population number, wheat varieties and precipitation on infestation of(Diptera: Cecidomyiidae). Acta Agriculture Boreali-occidentalis Sinica, 2015, 24(10): 165-171. (in Chinese)
[4] Cheng W N, Long Z R, Zhang Y D, Liang T T, Zhu- Salzman K Y. Effects of temperature, soil moisture and photoperiod on diapause termination and post-diapause development of the wheat blossom midge,(Géhin) (Diptera: Cecidomyiidae). Journal of Insect Physiology, 2017, 103: 78-85.
[5] Gu J, Huang L X, Shen Y, Huang L H, Feng Q L. Hsp70 and small hsps are the major heat shock protein members involved in midgut metamorphosis in the common cutworm,. Insect Molecular Biology, 2012, 21(5): 535-543.
[6] Shen Q D, Zhao L N, Xie G Q, Wei P, Yang M M, Wang S G, Zhang F, Tang B. Cloning three(Coleoptera: Coccinellidae) heat shock protein 70 family genes: regulatory function related to heat and starvation stress. Journal of Entomological Science, 2015, 50(3): 168-185.
[7] Franck E, Madsen O, van Rheede T, Ricard G, Huynen M A, de Jong W W. Evolutionary diversity of vertebrate small heat shock proteins. Journal of Molecular Evolution, 2004, 59(6): 792-805.
[8] Kappé G, Franck E, Verschuure P, Boelens W C, Leunissen J A, de Jong W W. The human genome encodes 10 alpha-crystallin-related small heat shock proteins: HspB1-10. Cell Stress & Chaperones, 2003, 8(1): 53-61.
[9] Li Z, Li X, Yu Q Y, Xiang Z H, Kishino H, Zhang Z. The small heat shock protein (sHSP) genes in the silkworm,, and comparative analysis with other insect sHSP genes. BMC Evolutionary Biology,2009, 9: 215.
[10] 汪慧娟, 赵静, 施佐堃, 邱玲玉, 王甦, 张帆, 王世贵, 唐斌. 异色瓢虫3个小分子热激蛋白序列及低温诱导表达分析. 中国农业科学, 2017, 50(16): 3145-3154.
WANG H J, ZHAO J, SHI Z K, QIU L Y, WANG S, ZHANG F, WANG S G, TANG B. Sequence analysis and induced expression of three novel small heat shock proteins mediating cold-hardiness in. Scientia Agricultura Sinica, 2017, 50(16): 3145-3154. (in Chinese)
[11] Zhang Y Y, Liu Y L, Guo X L, Li Y L, Gao H R, Guo X Q, Xu B H., an intronless small heat shock protein gene, is involved in stress defence and development in. Insect Biochemistry and Molecular Biology, 2014, 53: 1-12.
[12] Zahur M, Maqbool A, Irfan M, Barozai M Y K, Qaiser U, Rashid B, Husnain T, Riazuddin S. Functional analysis of cotton small heat shock protein promoter region in response to abiotic stresses in tobacco using-mediated transient assay. Molecular Biology Reports, 2009, 36(7): 1915-1921.
[13] Zhang A G, Lu Y L, Li C H, Zhang P, Su X R, Li Y, Wang C L, Li T W. A small heat shock protein (sHSP) fromagainst heavy metals stresses. Fish & Shellfish Immunology, 2013, 34(6): 1605-1610.
[14] Huang L H, Wang C Z, Kang L. Cloning and expression of five heat shock protein genes in relation to cold hardening and development in the leafminer,. Journal of Insect Physiology, 2009, 55(3): 279-285.
[15] Xie J, Hu X X, Zhai M F, Yu X J, Song X W, Gao S S, Wu W, Li B. Characterization and functional analysis ofgene in the red flour beetle,. Insect Science, 2019, 26(2): 263-273.
[16] Rinehart JP, LiAQ, YocumGD,Robich RM, HaywardSAL, Denlinger DL.Up-regulation of heat shock proteins is essential for cold survival during insect diapause.Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(27): 11130-11137.
[17] Si FL, He ZB, ChenB.Cloning and expression profiling of heat shock protein DaHSP23 gene in the winter and summer diapause pupae of the onion maggot,(Diptera: Anthomyiidae). Acta Entomologica Sinica, 2016, 59(4): 402-410.
[18] Lu Y X, Xu W H. Proteomic and phosphoproteomic analysis at diapause initiation in the cotton bollworm,. Journal of Proteome Research, 2010, 9(10): 5053-5064.
[19] Zhang B, Zheng JC, Peng Y, Liu XX, Hoffmann AA, Ma CS.Stress responses of small heat shock protein genes in lepidoptera point to limited conservation of function across phylogeny. PLoS ONE, 2015,10(7): e0132700.
[20] Tachibana S I, Numata H, Goto S G. Gene expression of heat-shock proteins (,and) during and after larval diapause in the blow flyJournal of Insect Physiology, 2005, 51(6): 641-647.
[21] GOTO SG, KIMURA MT.Heat-shock-responsive genes are not involved in the adult diapause of. Gene, 2004,326(1): 117-122.
[22] Zhao J J, Huang Q T, Zhang G J, Zhu-Salzman K Y, Cheng W N. Characterization of two small heat shock protein genes (and) from, and their expression regulation during diapause. Insects, 2021, 12: 119.
[23] Cheng W N, Li D, Wang Y, Liu Y, Zhu-Salzman K Y. Cloning of heat shock protein genes (,and) and their expression in response to larval diapause and thermal stress in the wheat blossom midge,. Journal of Insect Physiology, 2016, 95: 66-77.
[24] Doane J F, Olfert O. Seasonal development of wheat midge,(Géhin) (Diptera: Cecidomyiidae), in Saskatchewan, Canada. Crop Protection, 2008, 27(6): 951-958.
[25] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod. Methods, 2001, 25(4): 402-408.
[26] Cheng W N, Zhang Y D, Liu W, Li G W, Zhu-Salzman K Y. Molecular and functional characterization of three odorant-binding proteins from the wheat blossom midge,. Insect Science, 2020, 27(4): 721-734.
[27] Pérez-Morales D, Ostoa-Saloma P, Espinoza B.SHSP16: Characterization of an-crystallin small heat shock protein. Experimental Parasitology, 2009, 123: 182-189.
[28] Fu X, Li W, Mao Q, Chang Z. Disulfide bonds convert small heat shock protein Hsp16.3 from a chaperone to a non-chaperone: implications for the evolution of cysteine in molecular chaperones. Biochemical and Biophysical Research Communications, 2003, 308(3): 627-635.
[29] Jacobsen J V, Shaw D C. Heat-stable proteins and abscisic acid action in barley aleurone cells.Plant Physiology, 1989, 91(4): 1520-1526.
[30] Bagneris C, Bateman O A, Naylor C E, Cronin N, Boelens W C, Keep N H, Slingsby C. Crystal structures of-crystallin domain dimers ofB-crystallin and Hsp20. Journal of Molecular Biology, 2009, 392: 1242-1252.
[31] Sun Y, Macrae T H. Small heat shock proteins: molecular structure and chaperone function. Cellular and Molecular Life Sciences, 2005, 62(21): 2460-2476.
[32] Gkouvitsas T, Kontogiannatos D, Kourti A. Differential expression of two small Hsps during diapause in the corn stalk borer(Lef.).Journal of Insect Physiology, 2008, 54(12): 1503-1510.
[33] Kokolakis G, Tatari M, Zacharopoulou A, Mintzas AC.Thegene of the Mediterranean fruit fly,: structural characterization, regulation and developmental expression. Insect Molecular Biology, 2008, 17(6): 699-710.
[34] Liu Z H, Yao P B, Guo X Q, Xu B H. Two small heat shock protein genes in: characterization, regulation, and developmental expression. Gene, 2014, 545(2): 205-214.
[35] Shen Y, Gu J, Huang L H, Zheng S C, Liu L, Xu W H, Feng Q L, Kang L. Cloning and expression analysis of six small heat shock protein genes in the common cutworm,. Journal of Insect Physiology, 2011, 57(7): 908-914.
[36] 成卫宁, 李建军, 李怡萍, 李修炼, 仵均祥, 王洪亮. 小麦吸浆虫成虫和幼虫滞育过程中蜕皮激素的定量分析. 植物保护学报, 2009, 36(2): 163-167.
Cheng W N, Li J J, Li Y P, Li X L, Wu J X, Wang H L. Quantitative analysis of ecdysteroid in adults and the pre-diapause, diapause and post-diapause larvae of wheat blossom midge,Gehin. Acta Phytophylacica Sinica, 2009, 36(2): 163-167. (in Chinese)
[37] 史学凯, 寇利花, 张育平, 马恩波, 张建珍, 吴海花. 温度对中华稻蝗小分子热休克蛋白基因表达的影响. 应用昆虫学报, 2016, 53(6): 1267-1273.
SHI X K, KOU L H, ZHANG Y P, MA E B, ZHANG J Z, WU H H. Effects of temperature on the expression patterns ofgenes in. Chinese Journal of Applied Entomology, 2016, 53(6): 1267-1273. (in Chinese)
[38] Garcia-Reina A, Rodriguez-Garcia M J, Ramis G, Galian J. Real-time cell analysis and heat shock protein gene expression in the TcAcell line in response to environmental stress conditions. Insect Science, 2017, 24(3): 358-370.
[39] 刘魏魏, 杨璞, 陈晓鸣. 白蜡虫热激蛋白基因在低温胁迫下的表达分析. 林业科学研究, 2013, 26(6): 681-685.
LIU W W, YANG P, CHEN X M. Expression analysis of heat shock protein genes inunder cold stress. Forest Research, 2013, 26(6): 681-685. (in Chinese)
Cloning of Small Heat Shock Protein Geneand its Expression Characteristics during Diapause and Under Temperature Stresses
GU LiDan1, Liu Yang1, Li FangXiang2, CHENG WeiNing1
1College of Plant Protection,Northwest A&F University/Key Laboratory of Integrated Pest Management on Crops in Northwestern Loess Plateau, Ministry of Agriculture and Rural Affairs, Yangling712100, Shaanxi;2Xi’an Agricultural Technology Extension Centre, Xi’an 710061
【】The wheat blossom midge(Diptera: Cecidomyiidae), one of the most important wheat pests, undergoes obligatory larval diapause to survive adverse temperature extremes during hot summers and cold winters. This study aims to explore the potential roles of small heat shock protein (sHsp) gene.【】 RACE and RT-PCR technologies were used to clone the full-length cDNA offrompre-diapause larvae. Bioinformatics programs were used to characterize the nucleotide and amino acid sequence of cloned. Real-time quantitative PCR (RT-qPCR) was used to determine the mRNA expression level of, as well as over-summering larvae exposed to short-term (≤120 min) heat stress (35-50℃) and over-wintering larvae exposed to short-term (≤120 min) cold stress (0 to -15℃). The recombinant Hsp21.9 proteinwas expressed byprokaryotic expression technology, and then purified. The activity of bacterially expressed recombinant proteins to suppress thermal aggregation of pig heart mitochondrial malate dehydrogenase (MDH) was determined by colorimetry.【】The full-length cDNA of() obtained was 1 087 bp (GenBank accession number: KT749988), which contained a 582 bp open reading frame (ORF). The predicted ORF encoded a protein of 193 amino acids of which the content of glutamic acid (12.4%) was the most, and the content of cysteine (0.5%) was the least. The estimated molecular weight and isoelectric point were 21.9 kD and 5.67, respectively. The amino acid sequence of SmHsp21.9 contains typical-crystallin domain of the sHsp family. The domain consists of six-sheets, which forms a-sandwich structure. Sequence alignment and phylogenetic analysis suggested that SmHsp21.9 displayed the highest amino acid identity and the closest relationship to Hsp27 from the Nematocera. RT-qPCR indicated thatexpression differed significantly among different diapause stages. The expression level was decreased after the initiation of diapause, gradually increased in October, and peaked in early-to-mid phase of post-diapause (December and January). Compared with the untreated control, the expression level ofwas significantly induced in over-summering larvae exposed to heat stress (35-45℃) or over-wintering larvae exposed to cold stressed (-5 to -10℃), but temperature extremes i.e. as high as 50℃ or as low as -15℃ failed to do so. The treatment duration also affected transcript levels of, with the maximum value at 30-60 min. Recombinant SmHsp21.9 proteins obtained significantly prevented heat-induced (43℃) aggregation of MDH, suggesting its significant molecular chaperone functionality.【】The expressionofis regulated not only by diapause development, but also by environmental temperature.might be involved in initiation and termination of diapause, and heat/cold tolerance during diapause in.
; Hsp21.9; gene cloning; diapause; temperature stress; gene expression

2022-07-25;
2022-09-08
国家自然科学基金(31371933)、陕西省重点研发计划(2020NY-059)
古丽旦,E-mail:826185856@qq.com。通信作者成卫宁,E-mail:cwning@126.com
(责任编辑 岳梅)
