人巨细胞病毒UL133基因型导致儿童肝功能损伤的机制研究
2023-01-31顾盼盼张慧桑旭罗厚江
顾盼盼,张慧,桑旭,罗厚江
人巨细胞病毒(human cytomegalovirus, HCMV)感染是新生儿期及婴幼儿期常见的病毒感染性疾病之一。作为HCMV唯一宿主的人类,巨细胞病毒可以潜伏在唾液、乳汁、肾脏以及造血系统等不同类型的体液和各个脏器中,其传播方式亦多种多样,例如呼吸道、输血、哺乳、分娩及不洁性交等。30%~40%婴幼儿肝炎综合征的病原体是HCMV[1],而且其临床表现轻重不一,从无症状感染到胆汁淤积肝炎甚至胆道闭锁,均可出现。具体表现为皮肤颜色黄染、尿色变深、粪便颜色变浅呈白陶土样、胆红素及转氨酶异常升高,甚至发生肝硬化、肝功能衰竭致死,尤其多见于亚裔患者[2-4]。HCMV病毒中有几百个基因型,其中与HCMV的毒力关系最为密切的是UL133基因型,是诱发婴幼儿出现肝功能损害的重要危险因素,但其具体发生机制尚不明朗。温正旺等[5]报道显示,婴幼儿HCMV肝损伤与Caspase家族蛋白介导的细胞凋亡通路关系密切。本课题先通过建立幼鼠UL133肝损伤模型,检测每组幼鼠肝脏细胞的凋亡情况、UL133RNA、Caspase-3、Caspase-6及Toll 样受体4(TLR4)的蛋白含量,随后进行临床验证,监测2组患儿尿液UL133阳性率及血液Caspase-3、Caspase-6表达水平,探索HCMV-UL133基因型导致婴幼儿肝损伤的内在分子机制。现报告如下。
1 对象、材料与方法
1.1 实验动物和分组 购买领航生物科技有限公司(中国上海)的3~4周龄健康雌性SD幼鼠共30只,初始体质量100±10 g,动物合格证号SCXK20180003。蚌埠医学院动物保护委员会批准了所有动物研究(批准文号:AM-SU-AP#:JP-2018-1)。将上述幼鼠依据随机数字表法分为3组,即空白组、对照组和实验组,每组10只。空白组经尾静脉注射生理盐水;对照组经尾静脉注入100μl空载的腺病毒;实验组在PubMed中搜索萤光素酶(luciferase)基因的CDS区域,合成并构建到PLVX-EF1a-puro载体中,在pLKO.1-puro慢病毒载体(IGE BIOTECHNOLOGY LTD,广州,中国)中构建靶向U133-PLVX-EF1a-puro。6 h后,将培养基完全更换为新鲜培养基,转染48 h后收集病毒上清液,用0.22 μm滤器过滤。取携带UL133基因型的慢病毒500 μL的原液加入0.9%生理盐水1 mL稀释为1.5 mL,随后向每只幼鼠的尾静脉中注入100 mL,浓度滴度:2.0×1012,饲养7日使药物稳定。
1.2 选择患儿对象 选取2019年5月—2022年5月蚌埠医学院第二附属医院儿科收住的HCMV伴有肝功能损害患儿66例为肝损害组,64例无肝功能异常为无肝损害组。纳入标准:所有患儿诊断标准符号2012年中华医学会儿科学分会制定的《巨细胞病毒感染诊断方案》[6],经荧光定量PCR定量检测尿液确诊为HCMV病毒感染,均为初发未经抗病毒及免疫抑制剂治疗病例。排除标准;所有患儿均排除先天性胆道闭锁、消化道畸形、其他类型病毒性肝炎(如甲、乙、丙肝炎病毒、EB、风疹病毒、单纯疱疹病毒等感染所致的肝炎)、遗传代谢性疾病及药物性肝炎等。本研究均详细告知患儿监护人,取得其同意后签署知情同意书,蚌埠医学院第二附属医院医学伦理委员会报备后通过。2组患儿初始临床资料比较,见表1。

表1 2组患儿初始临床资料比较
1.3 方法
1.3.1 标本制备 实验开始7日后将鲁米诺(Luminol)(武汉德晟生化科技有限公司,CAS521-31-3),注射到每只小鼠的腹腔内,并立即用异氟醚气体麻醉。使用NightOWL体内成像系统(BERTHOLD,德国)对每组幼鼠进行成像,确认其形成肝损伤模型。实验开始后第10天将SD幼鼠拉断脊椎处死,立即取出幼鼠的肝脏,使用双蒸水冲洗肝脏表面血液至洁净,每组均取部分组织标本固定于4%多聚甲醛24 h后,再施行石蜡包埋、切片,HE染色;剩余组织标本放置于液氮罐中保存,采用RT-PCR方法检测UL133 RNA,ELISA 检测Caspase-3、Caspase-6及TLR4表达水平。
1.3.2 幼鼠肝脏细胞HE染色及凋亡监测 观察幼鼠肝脏的病理改变,对肝脏标本进行HE染色;使用原位缺口末端标记(TUNEL)试剂盒(购自罗氏公司),根据试剂盒里提供的操作流程进行细胞核荧光染色。凋亡细胞的细胞核呈绿色荧光,随机挑选出3个高倍视野(x400),并对凋亡细胞进行计数。凋亡指数=凋亡细胞/100个细胞×100%。
1.3.3 幼鼠肝脏UL133RNA测定 Trizol试剂购自北京普利莱基因有限公司,按照说明书的指示抽提RNA,并测定RNA浓度。RT-PCR剂盒(购自Fermentas公司),根据说明书要求向96孔板中加入引物(引物由上海基康生物工程有限公司负责合成,并检验合格)、SYBR Green I、模板,液体的总体积是20μl,混匀后进行RT-PCR过程,使用Lightcycler48015.0软件处理实验数据。
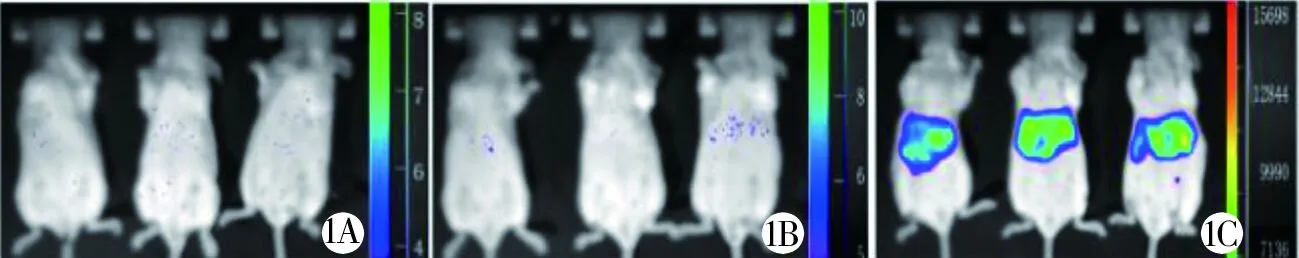
1A 空白组 1B 对照组 1C 实验组图1 3组小鼠肝脏的荧光信号强度图

2A 空白组 2B 对照组 2C 实验组图2 3组幼鼠肝脏的HE染色图(HE染色X100)
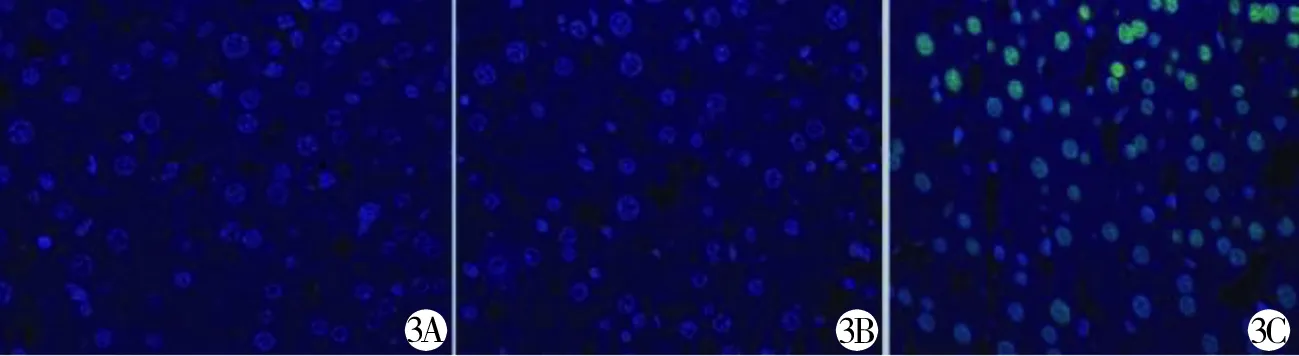
3A 空白组 3B 对照组 3C 实验组图3 3组小鼠肝细胞凋亡情况
1.3.4 幼鼠肝脏Caspase-3、Caspase-6、TLR4水平测定 应用ELISA试剂盒(购自美国PeproTech公司)检测幼鼠肝脏中Caspase-3、Caspase-6及TLR4的水平;抗Caspase-3(220509-74-0)、Caspase-6(ab39707)及TLR4(76B357.1)抗体均购自Abcom公司。ELISA试剂盒从冰箱中取出后放置在室温环境下30 min,随后向每个孔中加入50 uL的匀浆/标准样品,用薄膜覆盖微孔板,室温下孵育2 h,随后进行4次洗板,轻轻甩干后;每个孔加入50 μL抗Caspase-3、Caspase-6和TLR4抗体并及时封板,再次室温孵育2h,完成4次洗板并彻底甩干后,每个孔先后显色剂A液和B液(A液和B液按照1:1配比),避光常温静置30 min;加入终止液100 μL,450 nm处测定吸光度值(OD);横坐标是标准品浓度,纵坐标是OD值,作出标准曲线图,计算Caspase-3、aspase-6及TLR4的表达水平。
1.3.5 患儿尿液UL133基因型及血液Caspase-3、Caspase-6的测定 留取患儿的尿液10 mL,应用RT-PCR技术明确尿液中的HCMV是否含有UL133基因型。抽取患儿静脉血液3 mL,采用ELISA试剂盒(美国PeproTech公司)检测,酶标孔中提前包被Caspase-3、Caspase-6的单克隆抗体温育;随后加入使用生物素标记的相关抗体,与链霉亲和素相互结合形成免疫复合物后温育、洗涤和甩干后,显色剂A液和B液(A液和B液按照1∶1配比),避光常温静置30 min;加入终止液100 μL,依据标准品浓度和相应的OD值作出标准曲线图,计算Caspase-3、Caspase-6表达水平。

2 结果
2.1 3组幼鼠肝脏的荧光信号强度比较 实验组的荧光信号强度为(12 423.68±3 334.19)CPS,高于空白组[(6.31±2.13)CPS]和对照组[(7.52±2.58)CPS],差异有统计学意义((P<0.05)),而空白组和对照组比较差异无统计学意义P>0.05)。见图1。
2.2 3组幼鼠肝脏HE染色情况 光学显微镜下显示:空白组和对照组肝脏细胞形态基本正常,而实验组的肝脏细胞变性,细胞核固缩。见图2。
2.3 3组幼鼠肝细胞凋亡情况 实验组肝细胞的凋亡指数为(10.96±0.52),高于空白组(2.39±0.27)及对照组(2.32±0.21)(P<0.05)),空白组和对照组比较差异无统计学意义(P>0.05)。见图3。
2.4 3组幼鼠肝脏组织UL133RNA、Caspase-3、Caspase-6及TLR4的表达量比较 实验组的UL133RNA、Caspase-3、Caspase-6及TLR4表达量高于空白组及对照组(P<0.05),而空白组和对照组比较差异无统计学意义(P>0.05)。见表1。
2.5 2组患儿尿液UL133阳性率及血液Caspase-3、Caspase-6表达水平比较 肝损害组尿液中UL133阳性率、血液中Caspase-3、Caspase-6表达水平均高于无肝损害组,差异有统计学意义(P<0.05)。见表2。

表1 3组幼鼠肝脏组织UL133、Caspase-3、Caspase-6及TLR4的表达量比较

表2 2组患儿尿液UL133阳性率及血液Caspase-3、Caspase-6表达水平比较
3 讨论
巨细胞病毒感染是一种常见的病毒性传染病,在发展中国家发病率较高。相关文献[7-8]显示,孕产妇巨细胞病毒抗体检测的阳性率最高可达95%。妊娠期间携带有巨细胞病毒后可诱发胎儿的宫内感染,进而导致不良产科事件,如死胎、宫内生长发育迟缓等,使新生儿出现血液系统、肝脏及神经系统等脏器的损伤[9],危及孕产妇、胎儿和新生儿的健康。新生儿和婴幼儿的巨细胞病毒检测阳性率2%左右[10-11],而且巨细胞病毒感染临床表现缺乏特异性,所以现有的诊断手段已不能满足临床需求,运用分子诊断和基因诊断势在必行。
研究[12-13]表明,巨细胞病毒的毒性和感染性强弱主要受到UL基因家族的β区的调控,其中以UL133、UL144及UL146调控作用最强。目前,调控的详细机制仍不清楚,本研究向幼鼠的尾静脉注射UL133后会出现不同程度的变性甚至坏死,TUNEL法提示细胞凋亡,表明UL133的基因片段会致使幼鼠肝细胞变性、坏死和凋亡。有研究[14-16]显示,巨细胞病毒感染引起的肝功能损伤与Caspase家族蛋白关系密切,但Caspase家族蛋白成员众多,功能复杂,每一个Caspase蛋白所形成的机制不尽相同。比如,Caspase-3主要参与的是细胞外信号凋亡路径,Caspase-6参与内质网分子伴侣诱发的应激反应导致细胞凋亡途径,Caspase-9却是介导的线粒体诱导的细胞凋亡路径。研究[17-19]表明,HCMV感染可激活内质网分子伴侣所致应激反应,最终引起了肝脏受损。本研究发现,UL133进入SD幼鼠体内导致肝细胞的损伤乃至凋亡,可以推测UL133与内质网分子伴侣诱发的应激反应之间存在相关性。实验组Caspase-3水平高于其他2组,差异具有统计学意义,而Caspase-3可以直接参与细胞凋亡。所以我们认为,UL133可能通过激活Caspase-3介导的信号通路引发肝细胞的程序性死亡。另外,有研究[20]显示,HCMV导致的细胞凋亡过程中,TLR家族蛋白发挥了炎症诱发剂的作用,其中尤以TLR4的作用最为明显,许永杰等[21]研究发现TLR4主要通过Caspase系列蛋白酶的激活起作用。本研究实验组TLR4的表达水平高于其他2组,提示感染病毒后,TLR4介导的信号通路可能被激活,进一步诱发Caspase-3、Caspase-6等凋亡蛋白激活,从而导致肝细胞凋亡。
肝脏在全身各个系统中是最易受到HCMV攻击的器官之一。研究[12-13]显示HCMV是婴儿肝炎综合征最常见的病原体之一,其检测阳性率甚至可高达60%以上。HCMV大多数情况下聚集在肝胆管上皮及内皮细胞中,在白细胞吸附、吞噬作用和抗原呈递等复杂过程之后,各种细胞因子和免疫介质共同作用,最终导致免疫炎症反应损害肝脏。本研究发现肝损害组患儿UL133基因型阳性率、Caspase-3及Caspase-6蛋白水平高于无肝损害组,这与以上研究相符合,即Caspase系列蛋白表达升高可直接导致肝炎病人的肝脏细胞凋亡,出现黄疸、转氨酶升高等一系列临床表现。
综上所述,携带有UL133基因型的HCMV感染婴幼儿后,可能激活TLR4路径并介导Caspase-3和Caspase-6参与HCMV诱发肝损伤的病理生理过程,从内部揭示HCMV UL133基因型引起肝功能损伤的病理生理机制,但本研究虽然发现在给小鼠注射UL133后,体内与细胞凋亡因子相关的细胞因子表达发生了比较明显的变化,但仍需进一步研究TLR4与Caspase-3和Caspase-6的相关性,从而为HCMV基因型与体内肝功能损伤的内在相关性提供分子理论依据。
