基于UPLC-Q-TOF-MS/MS技术分析前胡化学物质组及体内成分
2023-01-31吉春亮苏艳张金戈盛先杰张健榕单晨啸
吉春亮,苏艳,张金戈,盛先杰,张健榕,单晨啸
(1.句容市第四人民医院药剂科,江苏 镇江 212008;2.南京中医药大学药学院,江苏 南京 210023)
前胡Peucedaniradix为伞形科植物白花前胡PeucedanumpraeruptorumDunn的干燥根。其性微寒,味苦、辛[1]。作为疏风清热,止咳祛痰的常用中药之一,近年来关于前胡化学成分分析的文献报道提示,前胡中的多种香豆素类化合物,可能是其解热祛痰,治疗感冒、咳嗽、支气管炎及疖肿等病症的物质基础[2-3]。前胡中的香豆素主要包括简单香豆素、角型吡喃香豆素和呋喃香豆素3种,通常可以通过测定香豆素类的含量来评价前胡的质量[4-5]。《中国药典》以白花前胡甲素及白花前胡乙素为其含量测定项下的指标性成分,规定前胡含白花前胡甲素(C21H22O7)不得少于0.90%,含白花前胡乙素(C24H26O7)不得少于0.24%[6]。另外有研究表明,白花前胡甲素及白花前胡乙素具有较好的抗炎作用,可通过抑制NF-κB、STAT3等信号通路控制炎症反应的发生[7-9]。
虽然目前关于前胡的化学活性成分研究较多,但未见全面分析其进入体内的原型成分及代谢物,特别是被吸收进入肺组织中的活性成分及代谢物的研究报道较少[10-11]。因此,有必要对前胡的化学成分及体内活性成分进行全面研究,进而阐明其药效物质基础。本研究拟采用UPLC-Q-TOF-MS/MS技术分析表征前胡的化学成分,通过与混合对照品的质谱信息及文献对比化合物的质荷比、相对保留时间、二级质谱图及裂解方式,推测其中的化学成分。再根据动物实验给药后入血及入肺的原型及代谢情况,推测前胡的体内代谢过程,为阐明其药效物质基础甚至治病机制等研究提供依据[12-13]。
1 材料
1.1 仪器
AB SCIEX Triple TOFTM5600质谱仪(美国AB Sciex公司),LC-20A快速液相仪(日本Shimadzu公司),Milli-Q超纯水机(美国Millipore公司),MS3.Digital旋涡振荡器(IKA公司),Speed Vac离心浓缩仪(美国Thermo Scientific公司),Neofuhe23R台式高速冷冻离心机(上海力申科学仪器有限公司),ER-2000A旋转蒸发仪(上海亚荣生化仪器厂),SK8200H数控超声波清洗仪(上海科导超声仪器有限公司),BS214D型万分之一电子天平(北京赛多利斯仪器系统有限公司)。
1.2 试剂
乙腈、甲醇(色谱纯,德国默克公司),甲酸(色谱纯,阿拉丁试剂有限公司),75%乙醇(分析纯,南京化学试剂股份有限公司)。
1.3 药材
前胡(批号:20220511)购自亳州市紫锐药业有限公司,经南京中医药大学刘圣金教授鉴定为伞形科白花前胡PeucedanumpraeruptorumDunn的干燥根。白花前胡甲素(批号:JOT-10487)、白花前胡乙素(批号:JOT-10486)购自成都普菲德生物科技有限公司,白花前胡素 E(批号:B-044-181216)购自成都瑞芬思生物科技有限公司,以上对照品质量分数均大于98.0%。
2 方法
2.1 样品制备
供试品溶液的制备:取前胡(打粉后过3号筛)约100 g,精密称定,加入1 L 75%乙醇回流提取3次,每次2 h,合并提取液,减压浓缩至100 mL(浓缩液所含生药量为1 g·mL-1),放冷,取200 μL前胡提取液于1.5 mL离心管中,置于冷冻离心机中4 ℃ 12 000 r·min-1离心10 min后,小心吸出所有上清液于1.5 mL离心管中,溶剂完全挥干后,加入200 μL甲醇于超声波清洗仪中超声30 min至完全溶解,随后再12 000 r·min-1离心10 min,取部分上清液进样(进样液中含生药量为1 g·mL-1)。
对照品溶液的制备:取白花前胡甲素对照品、白花前胡乙素和白花前胡素E对照品适量,精密称定,加甲醇溶解,定容。进一步稀释制成每1 mL含10 μg的混合对照品溶液,即得。
2.2 动物实验
2.2.1 给药方案 雄性SD大鼠6只,体质量180~220 g,由杭州医学院提供。实验动物许可证号:SCXK(浙)2019-0002。所有动物饲养均按照美国国家卫生研究院《实验动物护理和使用指南》进行。饲养于SPF级动物房内,按照饲养要求先自由饮食和饮水,并且自动开关灯以模拟正常昼夜交替。适应性饲养7 d后将6只大鼠随机分为2组(空白组和前胡给药组,n=3),给药组给予前胡提取液,按26 g·kg-1的剂量给药,每日1次,每次2 mL,空白组灌胃等体积的生理盐水,连续给药7 d后取材。
2.2.2 生物样品收集与处理 血浆样品收集与处理:在最后1次给药后的3个时间点(1、2、4 h),通过各组大鼠眼眶取血的方式来收集血样,取出后置于装有抗凝血剂的离心管中并轻摇混匀,于4 ℃、5 000 r·min-1冷冻离心10 min,吸取血浆用于后续成分分析。吸取500 μL血浆样品,加入3倍体积的乙腈沉淀样品,取上清完全挥干后,加入200 μL甲醇超声复溶,随后12 000 r·min-1,离心10 min后取上清进样。
肺组织样品收集与处理:分别于最后1次给药后1、2、4 h 3个时间点处死大鼠,取肺组织。分别取对应时间点的大鼠0.2 g肺组织加入2 mL EP管中,加入0.8 mL超纯水后匀浆,将匀浆液全部转移至5 mL EP管后,加入3倍体积的乙腈,充分振荡,于5 000 r·min-1离心10 min后取出上清至1.5 mL离心管中,完全挥干溶剂后,加入200 μL甲醇超声复溶,12 000 r·min-1,离心10 min后取上清液留待进样。
2.3 色谱条件
色谱柱:Thermo AcclaimTMRSLC 120 C18(3.0 mm×100 mm, 2.2 μm)色谱柱,柱温:35 ℃,流动相为0.1%甲酸水-乙腈。流速为0.3 mL·min-1,进样体积5 μL。梯度洗脱程序:0~3 min,10%B;3~20 min,25%B;20~30 min,40%B;30~41 min,60%B;41~55 min,85%B;55~57 min,95%B;57~58.1 min,10%B;58.1~63 min,10%B。
2.4 质谱条件
电喷雾离子源(ESI),离子源温度(TEM)550 ℃,气帘气(CUR)40 psi,雾化气(GS1)55 psi,辅助加热气(GS2)55 psi,离子源喷雾电压(IS)5 500 V,碰撞电压(CE)10 V,去簇电压(DP)100 V,正离子模式下为全扫模式,扫描范围为m/z50~1 500。
2.5 数据处理
通过查阅国内外关于前胡的文献及相关数据库建立包含化合物名称、分子量、分子式、结构、质谱和紫外信息的前胡化学成分标准数据库,将采集到的质谱数据导入PeakView SoftwareTM(ABSciex)进行分析,从原始质谱数据中筛选目标化合物,获取各化合物的保留时间、精确分子量等信息。按偏差小于10 ppm、根据化合物的二级碎片信息和检索的化合物裂解过程中产生的碎片信息,分析总结主要类型化合物的质谱裂解规律。
3 结果
正离子模式下相关样品显示出更为丰富的质谱信息,因此本研究选择正离子模式所得的质谱数据进行解析[14]。解析出前胡中所含化合物的质谱信息如表1所示,结果共鉴定出54个化合物,包括52个香豆素类、1个萜烯类和1个酚类化合物。其中,白花前胡甲素、白花前胡素E和白花前胡乙素3个化合物通过与对照品分别对比分子量、保留时间和二级碎片等质谱信息得到进一步确认。图1为正离子模式下的前胡提取液及混合对照品总离子流图。

表1 前胡体外化学成分鉴定

(续表一)
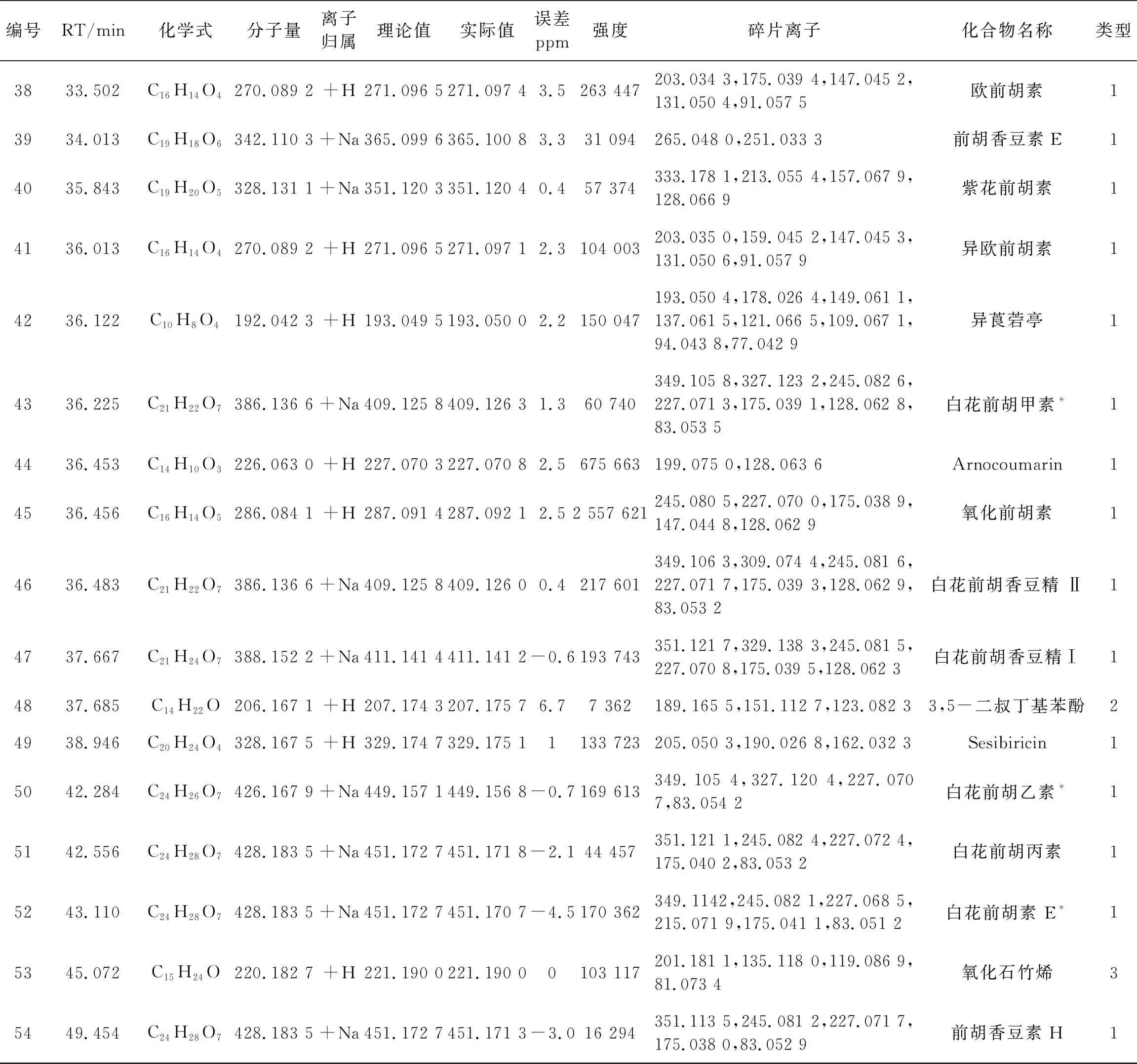
(续表二)

图1 正离子模式下的前胡提取液(A)及混合对照品(B)的总离子流图
3.1 前胡体外成分鉴定
在前胡提取物中共推测出52个香豆素类成分[15]。香豆素类化合物的基本母核是苯骈α-吡喃酮,该母核的一般特征是芳环上连接有多个氧原子和羟基,所以在碱性条件下可以开环。其分子量较小,在正离子模式下具有较强的分子离子峰,其质谱主要发生中性小分子碎片丢失,出现一系列连续失去一分子羰基、羟基或水、甲基或甲氧基以及烷基链的碎片离子峰,其中环上的羰基比酯键中的更易失去[16]。图2为前胡中典型成分的提取离子流图及裂解规律图。
例如,正离子模式下化合物3(RT=2.432 min,C15H16O8)(图2A)的母离子在m/z325.091 8 [M+H]+,其产物离子分别为m/z163.039 8 [M+H-Glc]+、m/z119.051 5 [M+H-CO2]+,分别为依次脱糖基、掉落1分子CO2形成。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道,推测化合物3为茵芋苷[17-18]。化合物12(RT=9.211 min,C20H26O10)(图2B)母离子在m/z427.158 8 [M+H]+,二级碎片离子分别为m/z247.097 5 [M+H-Glc]+、m/z229.086 9 [M+H-Glc-H2O]+、m/z175.040 3 [M+H-Glc-H2O-C4H6]+,分别为依次脱糖基、掉落1分子H2O以及小分子C4H6形成。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道,推测化合物12为Praeroside Ⅵ[19]。
正离子模式下,化合物14(RT=11.019 min,C20H24O9)(图2C)母离子在m/z409.150 1 [M+H]+,产物离子分别为m/z247.096 6 [M+H-Glc]+、m/z229.086 2 [M+H-Glc-H2O]+、m/z187.039 2 [M+H-Glc-H2O-C3H6]+、m/z175.039 4 [M+H-Glc-H2O-C4H6]+。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道,推测化合物14为紫花前胡苷[20]。化合物32(RT=29.532 min,C18H18O7)(图2D)母离子为m/z369.094 5 [M+Na]+,产物离子为m/z287.092 5 [M+H-C2H3O2]+、m/z245.081 6 [M+H-C2H3O2-C2H2O]+、m/z227.070 1 [M+H-C2H3O2-C2H2O-H2O]+和m/z175.040 3 [M+H-C2H3O2-C2H2O-H2O-C4H4]+。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道,推测化合物32为前胡香豆素D。

图2 前胡中典型成分的提取离子流图及裂解规律图
另外,正离子模式下化合物47(RT=37.677 min,C21H24O7)母离子为m/z411.141 2 [M+Na]+,产物离子分别为m/z351.121 7 [M+Na-CH3COOH]+、m/z329.138 3 [M-CH3COOH]+、m/z245.081 5 [M-CH3COOH-CH3CH2CH(CH3)CO]+、m/z227.070 8 [M-CH3COOH-CH3CH2CH(CH3)COOH]+。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道,推测化合物47为白花前胡香豆精Ⅰ。化合物50(RT=42.284 min,C24H26O7)母离子为m/z449.156 8 [M+Na]+,产物离子分别为m/z349.105 4 [M+Na-CH3CH=C(CH3)COOH]+、m/z327.120 4 [M-CH3CH=C(CH3)COOH]+、m/z227.070 7 [M-2CH3CH=C(CH3)COOH]+和m/z227.070 8 [M-CH3COOH-CH3CH2CH(CH3)COOH]+。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道以及标准品的质谱信息,表明化合物50为白花前胡乙素。
3.2 前胡体内成分鉴定
大鼠连续给药前胡提取物7 d后的血浆和肺部组织样品中共检测到22个原型成分,包括1个酚类化合物和21个香豆素类化合物等。入血的原型成分有21个,分别为4-甲氧基香豆素(P8)、(+)-白花前胡醇(P11)、(-)-白花前胡醇(P13)、前胡香豆素G(P15)、芸香霉素(P17)、紫花前胡苷元(P19)、5-甲氧基香豆素(P22)、九里香内酯(P25)、蛇床子素(P28)、异氧化前胡素(P29)、异补骨脂素(P33)、前胡香豆素A(P34)、前胡香豆素E(P39)、白花前胡甲素(P43)、氧化前胡素(P45)、白花前胡香豆精 Ⅱ(P46)、白花前胡香豆精Ⅰ(P47)、3,5-二叔丁基苯酚(P48)、白花前胡乙素(P50)、白花前胡丙素(P51)、白花前胡素E(P52),具体的信息见表2。前胡给药后典型入血原型成分的提取离子流图及裂解规律如图3所示。
3.2.1 原型成分的鉴定 正离子模式下,P28(RT=25.025 min)(图3A)母离子为m/z245.117 3 [M+H]+,产物离子分别为m/z227.070 7 [M+H-H2O]+、m/z189.021 7 [M+H-C4H8]+、m/z175.039 6 [M+H-C5H10]+、m/z147.044 7 [M+H-C5H10-CO]+和m/z131.050 7 [M+H-C4H8-CH2O-CO]+。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道,推测该化合物为蛇床子素[21]。P52(RT=43.110 min)(图3B)母离子为m/z451.173 0 [M+Na]+,产物离子分别为m/z245.080 8 [M+H-C10H15O3]+、m/z227.071 1 [M+H-C10H15O3-H2O]+、m/z175.039 8 [M+H-C10H15O3-H2O-C5H10]+,分别为依次3',4'双水解、脱水、开环掉落C5H10形成。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道和对照品对比,推测该化合物为白花前胡素E。

图3 典型入血原型成分的提取离子流图及裂解规律
3.2.2 代谢物的鉴定 本实验在前胡中共推测出26个代谢成分。其中在血中找到26个代谢物,肺部组织中找到9个代谢物。前胡提取物给药后典型入血及肺组织中的代谢成分的裂解情况如图4所示。结果提示前胡中的香豆素类成分在体内主要以氧化、葡萄糖醛酸化、脱异戊烯基化以及水解等方式代谢[22]。
例如,正离子模式下M3(RT=7.040 min,C20H22O11)(图4A)母离子为m/z439.123 7 [M+H]+,产物离子分别为m/z263.091 9 [M+H-Glu]+、m/z245.082 0 [M+H-Glu-H2O]+、m/z191.034 0 [M+H-C5H10]+、m/z147.044 7 [M+H-C5H10-CO]+和m/z163.037 9 [M+H-C4H8-CH2O-CO]+。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道,推测该化合物为芸香霉素葡萄糖醛酸化产物。
正离子模式下,化合物38(RT=33.502 min,C16H14O4)母离子为m/z271.097 4 [M+H]+,在m/z203.034 3 [M+H-C5H8]+、m/z175.039 4 [M+H-C5H8-CO]+、m/z147.045 2 [M+H-C5H8-2CO]+、m/z131.050 4 [M+H-C5H8-CO2-CO]+产生的二级碎片离子。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道,推测该化合物为欧前胡素。M13(RT=19.542 min,C11H6O4)母离子为m/z203.032 8 [M+H]+,其准分子离子峰比欧前胡素(C38)的小68 Da,推断其为可能为C38脱异戊烯基化后的产物。M13分别为m/z175.033 0 [M+H-CO]+和m/z147.045 8 [M+H-2CO]+产生二级碎片离子。根据其连续丢失 CO 特征的碎片裂解方式及相对分子质量,结合文献报道中碎片信息,推测该化合物为欧前胡素的脱异戊烯基产物花椒毒酚。M16(RT=25.960 min,C16H14O6)在正离子模式下准分子离子为m/z303.087 4 [M+H]+,其准分子离子峰比欧前胡素(C38)的大32 Da,推测其为C38的双氧化产物。二级碎片离子分别为m/z203.033 1 [M+H-CO2-C4H8]+、m/z147.043 5 [M+H-CO2-C4H8-2CO]+、m/z119.088 9 [M+H-CO2-C4H8-3CO]+。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道,推测该化合物为欧前胡素双氧化产物[23-24]。
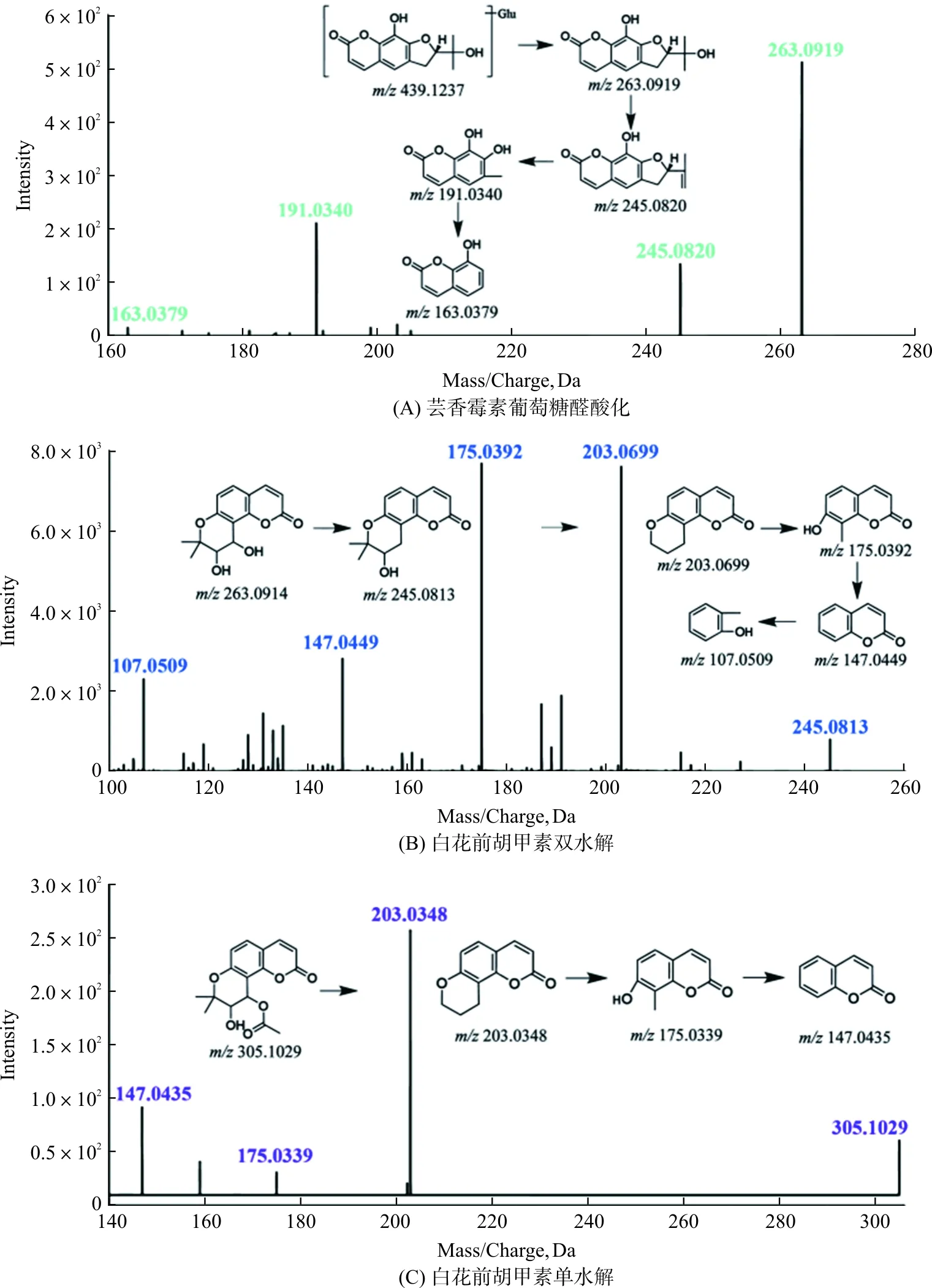
图4 大鼠给药前胡提取物后血浆中代谢成分的裂解规律图
另外,正离子模式下P43(RT=35.225 min,C21H22O7)母离子为m/z409.125 7 [M+Na]+,产物离子分别为m/z245.082 6 [M+H-C7H10O3]+、m/z227.071 3 [M+H-C7H10O3-H2O]+、m/z175.039 1 [M+H-C7H10O3-H2O-C4H4]+。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道,推测该化合物为白花前胡甲素[22]。M6(RT=13.740 min,C14H14O5)(图4B)母离子为m/z263.091 4 [M+H]+,其分子量比P43小124 Da,二级碎片离子分别为m/z245.080 8 [M+H-H2O]+、m/z203.069 9 [M+H-C2H4O2]+、m/z175.039 2 [M+H-C4H8O2]+,分别为依次脱水、3',4'双水解、开环掉落C2H4形成。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道,推测该化合物为白花前胡甲素双水解产物。M12(RT=17.690 min,C16H16O6)(图4C)母离子为m/z305.102 9 [M+H]+,二级碎片离子分别为m/z203.034 8 [M+H-C4H6O3]+、m/z175.033 9 [M+H-C5H6O3]+、m/z147.043 5 [M+H-C5H6O3-CO]+。根据此裂解方式及其产生的碎片离子信息,再结合已有的文献报道,推测该化合物为白花前胡甲素单水解产物[25-26],见表2。

表2 大鼠灌胃前胡提取物后的体内原型及代谢物信息
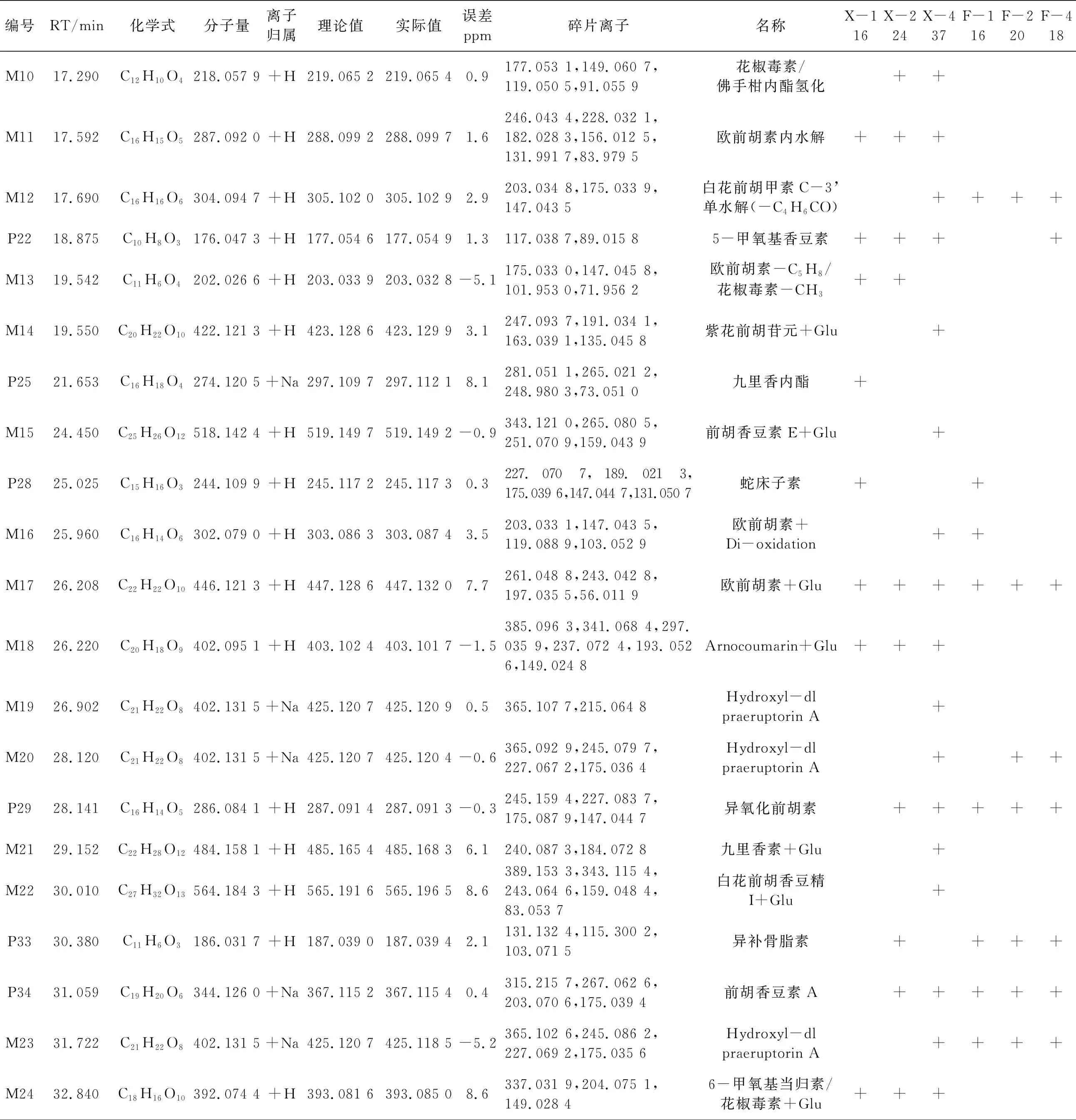
(续表一)

(续表二)
4 讨论
祛痰止咳是前胡最具特色的传统功效之一[27]。既往的植物化学研究表明,前胡中的香豆素类化合物具有多种药理活性,这也导致其化学成分的研究主要集中在香豆素类化合物上。前胡中香豆素类化合物的酯键易水解形成凯琳内酯,具有较好的镇咳祛痰和抗炎活性。例如,白花前胡丙素和紫花前胡苷具有祛痰作用;白花前胡甲素、白花前胡素E、白花前胡丁素以及白花前胡丙素等为NF-κB以及STAT-3的双通路抑制剂,可显著降低TNF-α和IL-6 mRNA的表达,在体内外均显示出一定的抗炎效果[7-9]。本实验通过UPLC-Q-TOF-MS技术对前胡提取液中的化学成分进行快速、准确、全面的定性分析,根据化合物的二级碎片信息和检索的化合物裂解过程中产生的碎片信息,分析总结典型化合物的质谱裂解规律。从前胡中鉴定出54个化学成分,其中香豆素类成分种类最多,占比最大。大鼠连续给药前胡提取物7 d后的血浆和肺部组织样品中共检测到22个原型成分,其中有21个为香豆素类化合物。从前胡中鉴定出的化学成分可能为相关药理作用的活性成分,但是如何将化学成分与药效相关联以确定前胡药效物质是今后的一个研究方向。
本文的实验结果为进一步深入阐明前胡药效物质基础、建立更为科学的质量评价体系用于前胡的质量和安全评价,规范药材市场,保证临床合理和精准用药提供了重要参考。
