黄芪注射液对大鼠急性脊髓损伤的神经保护作用及机制研究
2023-01-31冯韬吕烨华王盛黄维糜大国
冯韬,吕烨华,王盛,黄维,糜大国
(南通大学附属南通市中医院,江苏 南通 226001)
脊髓损伤(Spinal cord injury,SCI)是一种破坏性的神经系统损伤疾病,在病理生理学上包含2个阶段,即原发性损伤和继发性损伤[1]。这2个阶段尤其是继发性损伤阶段中凋亡信号传导、炎症反应、氧化应激、自由基形成等级联反应能够导致机体严重的神经功能障碍[2]。SCI以其高发病率、高致残率以及治疗护理的昂贵成本等特性,给患者家庭及社会造成了沉重的负担[3-5]。神经元细胞凋亡是继发性SCI持续存在所导致的病理表征,在中枢神经系统的扩大损伤过程中扮演重要角色。在大鼠SCI中,细胞凋亡最早在损伤后4 h发生,并在第7天达到高峰;在损伤部位,大部分少突胶质细胞在SCI后7 d内凋亡[6]。如何抑制神经元细胞凋亡、恢复急性SCI后的神经功能成为目前科学研究的热点。
黄芪注射液(Astragalus injection,AS)是由中药黄芪提取而来,主要成分包含黄芪皂苷和黄酮两大类[7-8]。黄芪具有免疫调节、抗氧化、抗炎等良好功效,在肝损伤、糖尿病、癌症等疾病治疗中蕴藏着巨大应用价值[7,9-11]。黄芪对神经系统也具有较好的保护功能[12]。黄芪注射液可通过抑制死亡受体通路和线粒体通路中关键因子的激活抑制神经元细胞凋亡,降低神经毒性,发挥神经保护作用,进而缓解脑缺血性损伤[13-16]。黄芪注射液在急性SCI中发挥神经保护作用,但其机制尚不明确。本研究构建了大鼠急性SCI模型,探究黄芪注射液对大鼠急性SCI的神经保护作用及其机制,为预防和治疗SCI提供新的思路和数据支持。
1 材料
1.1 动物
40只SPF级雄性SD大鼠,购自南京青龙山繁殖场,许可证号:SCXK(苏)2017-0001,体质量180~200 g。大鼠饲养于恒温(21~23 ℃)、恒湿(45%~65%)的环境中,保持12 h明暗循环,自由进食饮水。所有实验均遵循南通大学动物护理和使用指南,本实验方案获南通大学实验动物伦理委员会批准,批号:S20201201-399。
1.2 试剂
黄芪注射液(上海禾丰制药有限公司,每支10 mL(相当于原药材20 g);尼氏染色液(北京百奥莱博科技有限公司,货号:YT167);TUNEL检测试剂盒:DAB(SA-HRP) TUNEL Cell Apoptosis Detection Kit(Servicebio,货号:G1507);TRIzol(Sigma,货号:T9424);UeIris Ⅱ RT-PCR System for First-Strand cDNA Synthesis(with dsDNase)(苏州宇恒生物科技有限公司,货号:R2028);2×SYBR Green qPCR Master Mix(苏州宇恒生物科技有限公司,货号:S2014);FAIM抗体(Affinity,货号:DF6119);FAS抗体(Affinity,货号:AF5342);Anti-TRAIL抗体(Abcam,货号:ab231063);Cleaved Caspase-8(Asp387)抗体(CST,货号:#9429);Anti-Bcl-2抗体(Abcam,货号:ab196495);Anti-Bax抗体(EPR18283)(Abcam,货号:ab182733);Cleaved Caspase-3(Asp175)(5A1E)Rabbit mAb(CST,货号:#9664);重组Anti-Caspase-9抗体(EPR18868)(Abcam,货号:ab184786);β-Tubulin抗体(CST,货号:#2146);山羊抗兔IgG(H+L)HRP二抗(Affinity,货号:S0001);ECL Plus检测试剂盒(Affinity,货号:K002)。
1.3 仪器
石蜡切片机(Leica,型号:RM2235);凝胶成像系统(上海天能科技有限公司,型号:Tanon-4600);高通量组织匀浆机(宁波新芝生物科技股份有限公司,型号:Scientz-48);微量分光光度计(杭州奥盛仪器有限公司,型号:Nano-500);倒置荧光显微镜(Olympus,型号:IX3-SVR);PCR热循环仪(Applied biosystems,型号:VeritiPro);qPCR仪(Applied biosystems,型号:QuantStudio 3)。
2 方法
2.1 大鼠SCI模型制备
参考姚年伟等[17]的方法。所有SD大鼠腹腔注射3%戊巴比妥钠(40 mg·kg-1)麻醉,背部切开以暴露椎旁肌肉,在T9~T11进行椎板切除术,在不损伤硬膜的情况下暴露脊髓。将10 g的金属棒从25 mm的高度自由落下,使大鼠后背暴露的脊椎承受重量坠落冲击。随后,将手术切口的肌肉和皮肤分别缝合。给每只大鼠皮下注射1 mL生理盐水溶液以补充手术过程中损失的血容量。手术后,将无菌纱布包裹在大鼠的伤口周围。每日向大鼠提供标准饮食和水。实验设计假手术(Sham)组,组内大鼠进行相同手术过程,但不进行脊椎重量坠落冲击。
2.2 实验分组及给药方法
40只健康的雄性SD大鼠随机分为假手术组,模型组,黄芪注射液低、中、高剂量组,每组8只。黄芪注射液低、中、高剂量组大鼠在造模后3 d内每日腹腔注射相应剂量的黄芪注射液(1、2、4 mL·kg-1)。黄芪注射液剂量设定参照Zhou等的研究[14]。假手术组和模型组腹腔注射同等剂量的生理盐水。
2.3 神经功能评分
对造模给药后1、2、3 d的大鼠进行神经功能评分。按BBB评分法评价大鼠双后肢神经功能恢复情况[18]。评分由非本组实验人员且熟悉BBB评分标准的观察者独立进行。
2.4 Rivlin斜板实验
在造模给药后1、2、3 d的各组大鼠中随机抽取6只,将大鼠竖直放于木板上,将木板从水平位置起逐渐增大该木板与水平面之间的角度,每次以5°为界值成梯度升高,以大鼠能够在木板上停留5 s而不下落的最大角度作为其最终的神经功能值。
2.5 骨髓组织病理切片的制备与观察
将大鼠俯卧位,取腰背部后正中切口,依次切开皮肤、筋膜至棘上韧带、棘突,由棘突两旁分离竖脊肌,咬骨钳咬除T9-L4棘突和椎板,锋利刀片切断神经根、脊髓和马尾神经,细心分离后完整取出T9段骨髓组织,一部分置-80 ℃冰箱备用,另一部分用4%多聚甲醛溶液固定,将标本进行脱水、透明、浸蜡、包埋、修片切片后,进行苏木素-伊红(HE)染色及尼氏染色,使用光学显微镜观察、拍照与分析。
2.6 转录组学测序
将各组大鼠骨髓取材,按照TRIzol试剂使用方法进行总RNA提取,通过微量分光光度计测定RNA浓度及纯度。使用VAHTS®mRNA-Seq V3 Library Prep Kit for Illumina(Vazyme,NR611)构建RNA文库后,再进行转录组测序。
2.7 qPCR检测
反应混合物包含2 μL模板cDNA,正向和反向引物各0.3 mmol·L-1,TB Green Premix Ex Taq Ⅱ(2×)试剂(TaKaRa)10 μL。将GAPDH用作内部参照。FAIM正向引物:5′-CACGTCAGGCAAACGAGTTG-3′,反向引物:5′-GGTGGCTTTGGTCTTTGCAG-3′;TRAIL正向引物:5′-CCCAGAGGTAGAAGACCCCA-3′,反向引物:5′-TGGCCCAAGGTCTTTCCATC-3′;GAPDH正向引物:5′-CAAGGTCATCCATGACAACTTTG-3′,反向引物:5′-GTCCACCACCCTGTTGCTGTAG-3′。所有反应重复3次。使用2-ΔΔCt方法分析基因相对表达量[19]。
2.8 Western blot检测
参考前人的方法[14]。将提取的大鼠脊髓蛋白进行10%SDS-聚丙烯酰胺凝胶电泳,随后转移到PVDF膜中。分别与一抗[FAIM抗体、FAS抗体、Anti-TRAIL抗体、Cleaved Caspase-8(Asp387)抗体、Anti-Bcl-2抗体、Anti-Bax抗体、Cleaved Caspase-3(Asp175)(5A1E)抗体、Anti-Caspase-9抗体均1∶1 000稀释,β-Tubulin抗体1∶5 000稀释]和二抗(1∶5 000稀释)孵育并洗涤后,利用ECL显色。凝胶分析系统扫描每个条带蛋白,通过图像分析软件(Image J)测量条带的灰度值。
2.9 TUNEL检测
TUNEL检测按照试剂盒说明书进行:将大鼠脊髓组织石蜡切片脱蜡,利用Proteinase K对其修复、破膜,随后再进行内源性过氧化物酶灭活。经室温平衡后继续标记反应、DAB显色以及苏木素染核,最后封片镜检。
2.10 数据统计分析
3 结果
3.1 行为学评价AS对急性SCI大鼠的运动功能影响
BBB评分结果如图1,假手术组在1、2、3 d时的评分分别为19.83±1.72、19.17±1.72、21.17±0.75,表明后肢神经功能正常。模型组以及黄芪注射液组在给药1 d时表现出严重的后肢神经功能障碍。黄芪注射液各剂量组在给药后第3天的BBB评分均高于模型组(P<0.01),表明黄芪注射液有助于急性SCI大鼠的运动功能加速恢复。大鼠斜板实验表现出类似趋势(图1),与模型组比较,黄芪注射液各剂量组术后第3天的大鼠斜板实验临界角度显著增加,且差异具有统计学意义(P<0.05,P<0.01)。BBB行为评分和Rivlin斜板实验结果提示黄芪注射液加速恢复急性SCI大鼠的运动功能。

注:与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与黄芪注射液低剂量组比较,
3.2 组织病理学观察
脊髓组织HE染色观察结果如图2所示,假手术组脊髓组织结构完整清晰,无病变。而模型组视野中脊髓组织有明显出血、神经细胞水肿。给予黄芪注射液后,脊髓组织病变程度得到缓解。与模型组和黄芪注射液低剂量组比较,黄芪注射液中剂量组和高剂量组的组织结构较完整。与黄芪注射液低剂量组和中剂量组比较,高剂量组无明显组织出血。尼氏染色结果发现(图2),与假手术组比较,模型组尼氏小体溶解消失,神经元细胞损坏严重。黄芪注射液各剂量组尼氏小体数目较模型组多,其中中剂量组和高剂量组具有统计学差异(P<0.05,P<0.01)。由此可见,黄芪注射液对急性SCI后的神经保护具有显著作用。
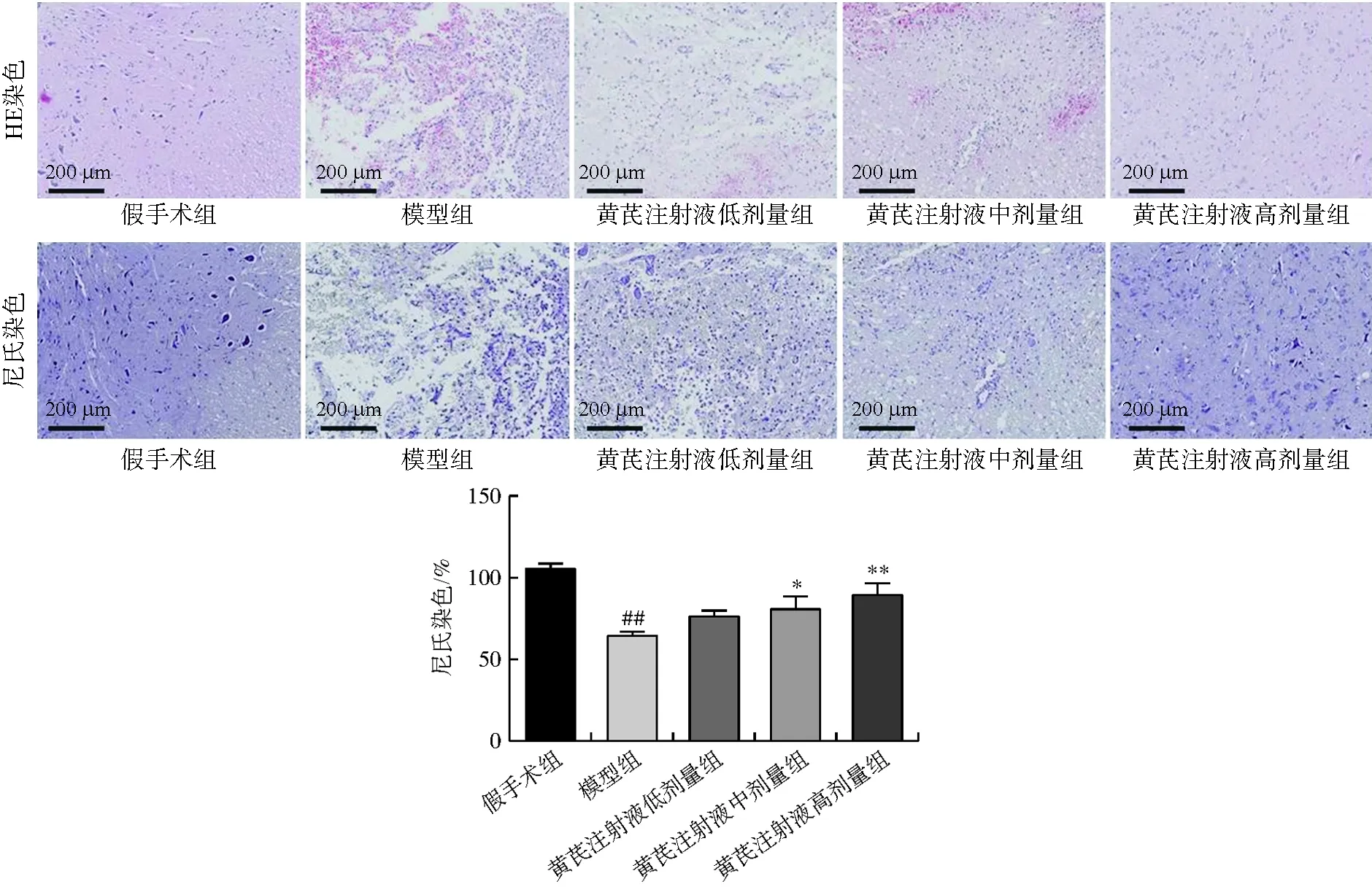
注:与假手术组比较,##P<0.01;与模型组比较,
3.3 差异表达基因分析
为探究黄芪注射液对SCI神经保护的机制,对假手术组、模型组、黄芪注射液高剂量组骨髓组织进行了转录组测序。测序数据经过层次聚类分析发现,假手术组和模型组被聚为2大类(图3A),符合SCI后基因差异表达预期。而模型组和黄芪注射液高剂量组未被聚类。与假手术组比较,模型组显著上调基因数为2 393个,下调基因数为2 204个(图3B)。模型组与黄芪注射液高剂量组比较,有54个基因差异表达显著(图3C~D)。韦恩图分析数据显示,假手术组与模型组显著差异表达的基因中有21个基因在模型组与黄芪注射液高剂量组比较中同时存在显著差异表达(图3E),这暗示了黄芪注射液可能通过对这21个基因进行靶向调控,进而发挥对SCI的治疗作用。对这21个基因人工分析后,发现了2个参与细胞凋亡调控的基因:FAIM和TRAIL。
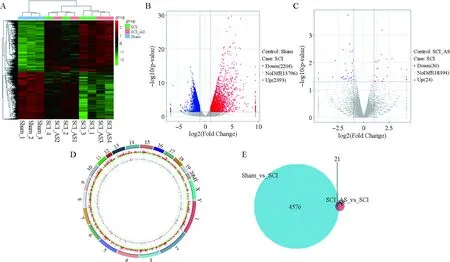
注:A.转录组数据的层次聚类分析;B.模型组与假手术组比较差异表达基因火山图;C.模型组与黄芪注射液高剂量组比较差异表达基因火山图; D.描绘全基因组RNA-Seq数据的Circos图;E.B和C中差异表达基因的韦恩图;Sham.假手术组;SCI.模型组;SCI_AS.黄芪注射液高剂量组
3.4 差异表达基因定量验证
通过qPCR技术对转录组数据筛选出来的2个基因FAIM和TRAIL在不同组的大鼠脊髓中的mRNA水平进行验证。结果如图4所示,与假手术组比较,模型组的FAIMmRNA表达量显著下降(P<0.01),中、高剂量黄芪注射液能上调损伤脊髓中的FAIM的表达(P<0.01)。相反,模型组中的TRAILmRNA表达水平较假手术组显著升高(P<0.01),而黄芪注射液能够下调损伤脊髓中的TRAIL转录水平(P<0.05,P<0.01),并且剂量越高,下调程度越大。这与前述转录组数据分析结果相一致。FAIM和TRAIL是死亡受体介导细胞凋亡过程中的2个重要基因,黄芪注射液对其表达量的影响表明细胞凋亡信号途径可能参与了黄芪注射液对神经细胞的保护作用过程。
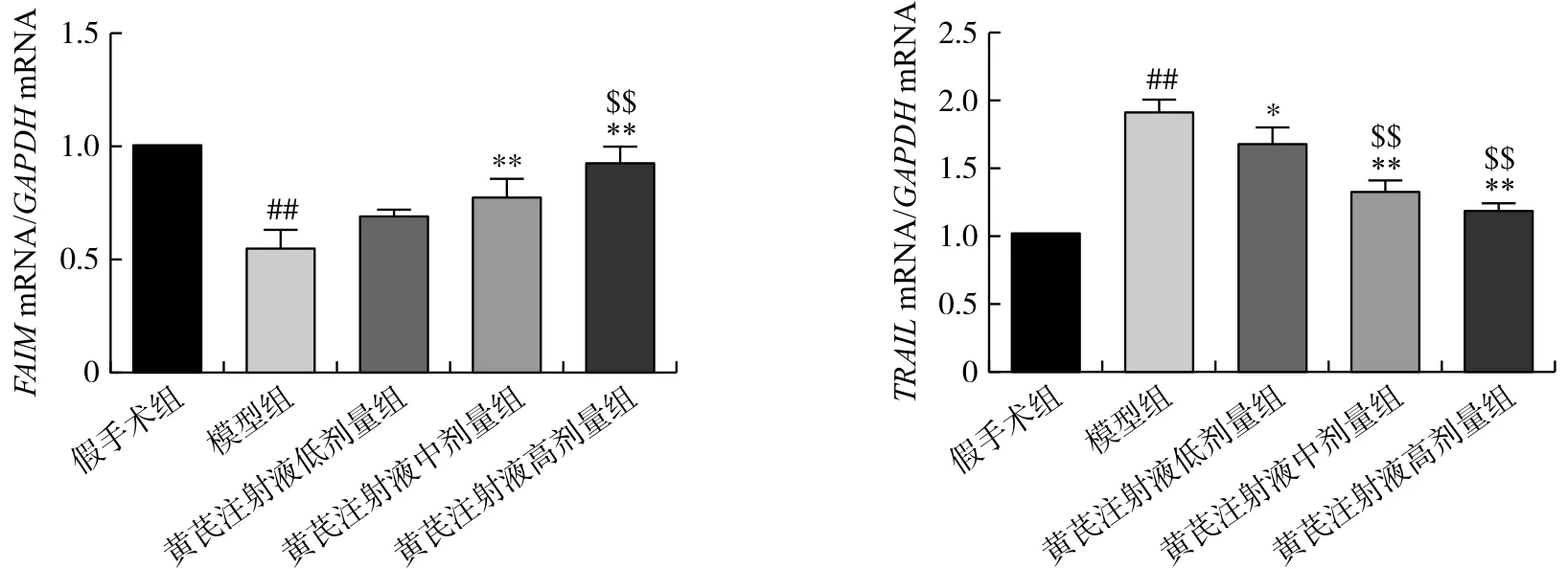
注:与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与黄芪注射液低剂量组比较,
3.5 细胞凋亡情况检测
图5显示,与假手术组比较,模型组脊髓组织神经细胞凋亡严重(P<0.01)。黄芪注射液各剂量组的大鼠脊髓组织细胞凋亡率有所下降(P<0.05,P<0.01),随着黄芪注射液剂量的提高,神经细胞凋亡率降低。
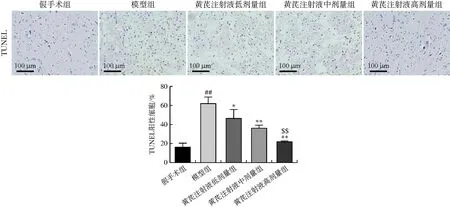
注:与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与黄芪注射液低剂量组比较,
3.6 Western blot检测细胞凋亡相关蛋白
结果如图6所示,与假手术组比较,模型组的死亡途径受体Fas、TNF相关的凋亡诱导配体TRAIL以及促凋亡因子Bax蛋白表达量显著上调(P<0.01),凋亡信号通路下游关键蛋白Cleaved-Caspase-3、Cleaved-Caspase-8和Cleaved-Caspase-9被激活(P<0.01),Fas凋亡抑制分子FAIM蛋白和抗凋亡因子Bcl-2的表达量显著降低(P<0.01),可见SCI后大量神经元细胞启动凋亡程序。与模型组比较,黄芪注射液高剂量组的Fas、TRAIL、Bax蛋白表达量被显著下调(P<0.05,P<0.01),Cleaved-Caspase-3、Cleaved-Caspase-8和Cleaved-Caspase-9活性被抑制(P<0.01),FAIM和Bcl-2的表达呈剂量依赖性上调(P<0.01)。表明黄芪注射液能够通过影响细胞凋亡的死亡受体途径关键蛋白来保护损伤脊髓组织的神经细胞。
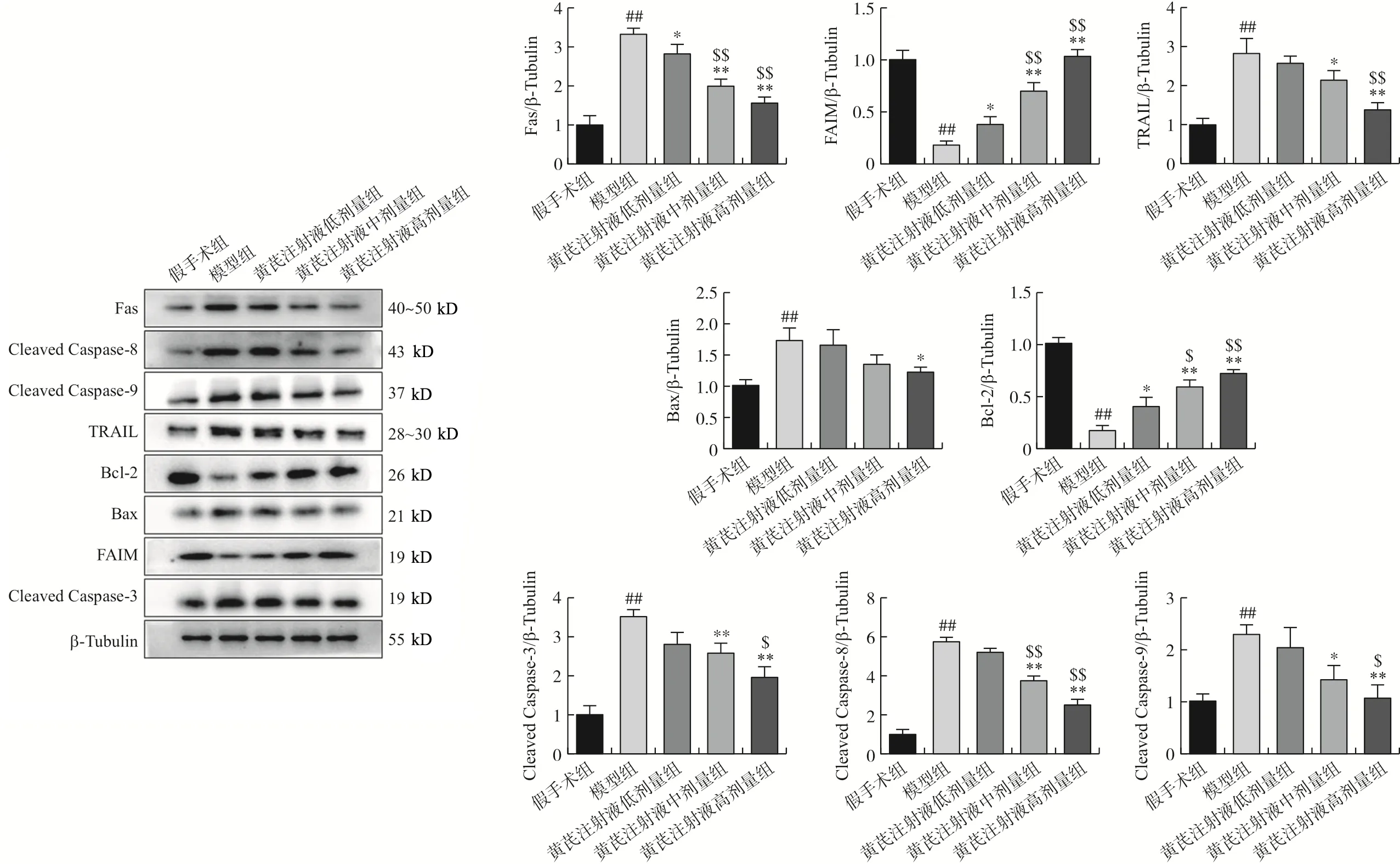
注:与假手术组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01;与黄芪注射液低剂量组比较,
4 讨论
SCI是一种破坏性的神经系统损伤疾病。近年来,科学研究在SCI的病理生理方面取得了实质性进展。虽然各类针对SCI的治疗干预措施表现出较好的效果,但对于控制继发性SCI阶段相关事件的级联反应以及对损伤脊髓组织的再生和神经功能恢复仍具有挑战性[20]。黄芪是一种常用的低毒、副作用小的中草药,其提取物黄芪甲苷Ⅳ可以逆转或缓解多种中枢神经系统疾病,如帕金森病和脑缺血[21-22]。有研究报道,黄芪注射液对脊髓缺血再灌注的大鼠具有神经保护作用[14,23]。本研究通过组织病理学观察发现,高剂量黄芪注射液有效改善损伤脊髓的组织病变,对SCI大鼠的神经元细胞具有保护作用。行为学研究表明,黄芪注射液能够加速SCI大鼠后期神经运动功能的恢复(P<0.05,P<0.01)。由此可见,黄芪注射液对急性SCI疾病具有潜在的高效治疗效果。
SCI中的继发性SCI病症涉及复杂的分子生化机制,包括自由基形成、脂质过氧化、炎症反应和神经细胞凋亡信号传递等[24-25]。细胞凋亡在SCI的急性期以及继发损伤病变中发挥关键作用,抑制SCI脊髓组织中细胞凋亡是促进神经功能恢复的有效思路。黄芪甲苷可通过各类途径抑制脑缺血/再灌注损伤大鼠的细胞凋亡从而发挥神经保护作用[13,26]。相关报道表明SCI 4 h后即开始出现神经元细胞凋亡[27]。本研究在给予黄芪注射液干预3 d后通过对急性损伤的脊髓组织细胞凋亡进行检测,结果发现,模型组神经细胞凋亡严重(P<0.01),而黄芪注射液干预后,细胞凋亡率呈剂量依赖性下降(P<0.05,P<0.01),这表明黄芪注射液对急性SCI中细胞凋亡信号通路具有调控作用。
细胞凋亡通路主要包含外源性和内源性2个途径,半胱天冬酶是这两个途径中的重要组成部分[28-29]。外源性途径也称为死亡受体途径,由TNFR(肿瘤坏死因子受体)、Fas-FasL和肿瘤坏死因子(TNF)相关的凋亡诱导配体(TRAIL)介导[30]。死亡受体的激活导致Caspase-8和Caspase-10被募集和激活,继而触发Pro-Caspase-3向Caspase-3的转化。另外,Fas信号途径介导的细胞凋亡可被Fas凋亡抑制分子FAIM所抑制[31]。在内源性途径中,组织损伤后刺激细胞色素C的释放和促凋亡蛋白的上调,招募凋亡蛋白酶激活因子-1(Apaf-1),激活Caspase-9活性,进而促进凋亡体的形成[32]。外源和内源途径虽然启动阶段不同,但下游有多种相同蛋白质的活性调控过程,如糖原合酶激酶3(GSK3)、Bcl-2家族成员(Bcl-2、Bax)等[33]。本研究为深入探究黄芪注射液的神经保护作用机制,对各组大鼠进行转录组测序。测序数据经过层次聚类分析发现,假手术组和模型组被聚为2大类,符合SCI后基因差异表达预期。模型组和黄芪注射液高剂量组未被聚类,一方面,这可能由于黄芪注射液引起的显著差异表达基因数相对于全基因数较少所导致;另一方面,可能因黄芪注射液干预时间不够,机体还未产生足量的差异表达基因。数据分析发现SCI后诸多细胞凋亡通路相关基因差异表达,黄芪注射液的干预导致FAIM、Fas基因的表达变化。qPCR验证表明,大鼠脊髓损伤后,黄芪注射液可上调FAIMmRNA的表达(P<0.01),抑制FasmRNA的表达(P<0.01)。进一步对细胞凋亡通路关键蛋白的表达量进行Western blot检测,大鼠脊髓损伤后,促凋亡蛋白Bax表达上调(P<0.01),抗凋亡蛋白Bcl-2表达下降(P<0.01);Caspase-3、Caspase-8、Caspase-9被激活(P<0.01),损伤组织的细胞凋亡被启动。黄芪注射液干预治疗后,细胞凋亡有所抑制(P<0.05,P<0.01),死亡途径启动阶段的Fas、TRAIL蛋白表达被抑制(P<0.05,P<0.01),相反,Fas凋亡抑制分子FAIM表达被上调(P<0.05,P<0.01),这表明黄芪注射液调控了死亡途径介导的细胞凋亡过程。转录组数据显示,模型组相比于黄芪注射液干预组的差异表达基因,与模型组相比于假手术组的差异表达基因有21个共有基因,暗示可能存在其他多种信号通路介导黄芪注射液对SCI的神经保护,有待深入探索。
综上所述,大鼠急性SCI后,启动神经元细胞凋亡。黄芪注射液的干预治疗,可通过对死亡受体途径Fas和TRAIL蛋白的抑制,进而调控神经元细胞的程序性凋亡,发挥对SCI的神经保护作用,改善脊髓组织损伤病变程度,加速后期神经运动功能障碍的恢复。
