猪NLRP3单克隆抗体制备及其抗原表位的鉴定
2023-01-31徐晴晴刘海隆蔡青云谷英华王文秀
刘 博,霍 芳,徐晴晴,2,刘海隆,张 莹,蔡青云,谷英华,张 艳*,王文秀,2*
(1.山东省滨州畜牧兽医研究院,山东 滨州 256600;2.山东省院士工作站,山东 滨州 256600; 3.山东绿都生物科技有限公司,山东 滨州 256600; 4.海南省家畜家禽工程技术研究中心,海南 海口 571100;5.滨州市人民医院,山东 滨州 256600)
炎症反应是一种机体对感染和组织损伤的急性反应。炎症反应可以抑制感染和组织损伤对机体造成的伤害。然而当发生调节异常和慢性炎症时,炎症反应也可能导致继发性损伤和宿主免疫病。炎症小体是细胞免疫应答过程中产生的一种复合物,是天然免疫系统重要的组成部分[1-3]。它由胞浆内的模式识别受体(pattern recognition receptors,PRRs)参与并招募其他蛋白组装而成的。在炎症小体的组装过程中,首先作为传感器的炎症小体蛋白寡聚化并招募包含 CARD结构域的蛋白凋亡相关斑点样蛋白 (ASC)形成复合物,该复合物与半胱氨酸蛋白酶 Caspase-1的酶原分子连接组装形成炎症小体复合物。组装后,炎症小体介导 Caspase-1的激活,进而介导促炎细胞因子 IL-1和 IL-18的加工和释放,同时还可诱导炎症反应相关的细胞凋亡。
迄今为止发现的炎症小体中,NLRP3炎症小体可以被多种病原体如细菌、病毒、真菌、原虫感染所激活,也能够被各种不同结构的病原相关分子模式(pathogen-associated molecular patterns,PAM-Ps)、宿主内源危险信号 (danger associated molecular patterns,DAMPs) DAMPs 和环境因素所刺激,因此被广泛研究。已知的流感病毒 (influenza A virus,IAV)、腺病毒 (adenovirus)、仙台病毒 (sendai virus,Sev)以及猪繁殖与呼吸障碍综合征病毒 (porcine reproductive and respiratory syndrome virus,PRRSV)等都可以激活 NLRP3炎症小体[4-10],肺炎链球菌可诱导 NLRP3依赖性 IL-1β的产生,其与促炎细胞因子级联相关[11-12]。另外,NLRP3炎症小体与各种疾病的发病和进展相关,包括代谢紊乱、多发性硬化、炎性肠病等相关的周期性发热,以及其他免疫和自发性炎症性疾病。
畜牧业生产过程中,猪的各种炎症性疾病频发,造成了重大的经济损失。快速、准确诊断猪体炎症可以为正确治疗和防控病毒和细菌等引起的炎性疾病提供时间参考。本研究以 NLRP3重组蛋白为抗原制备了3株特异性单克隆抗体,并对其特性和结合的抗原位点进行鉴定,为研究和开发可准确检测 NLRP3炎症小体的试剂盒提供了重要条件。
1 材料与方法
1.1 菌株、细胞与实验动物E.coliDH5α与 BL21 (DE3)、小鼠骨髓瘤细胞系 SP2/0均由山东省滨州畜牧兽医研究院保存; 6~8周龄的健康雌性 BALB/c小鼠,购自北京维通利华实验动物技术有限公司。
1.2 主要试剂截短的 NLRP3重组蛋白由本实验室构建并保存; HRP(horseradish peroxidase) Goat Anti Mouse IgG、FITC(fluoresceine isothiocyanate) Goat Anti Mouse IgG、DAB(diaminobenzidine)显色试剂盒购自济南和拓生物技术有限公司;胎牛血清购自浙江天杭生物科技股份有限公司;小鼠外周血淋巴细胞分离液购自天津灏洋生物制品科技有限公司; ECL(Enhanced Chemiluminescence)超敏发光液购自碧云天生物技术有限公司。
1.3 小鼠免疫将镍柱纯化的 NLRP3重组蛋白与等体积佐剂混合乳化后,背部皮下多点注射 6周龄 BALB/c小鼠 5只,0.1 mg/只。首次免疫使用弗氏完全佐剂,后续2次免疫使用弗氏不完全佐剂。三免后第 7 天进行断尾采血,用间接 ELISA方法检测血清抗体效价。融合前 3 d腹腔注射纯化重组蛋白 0.2 mg进行加强免疫。
1.4 间接 ELISA方法的建立采用方阵滴定法确定抗原(重组 NLRP3蛋白)最佳包被浓度和阳性血清的最佳稀释度,HRP标记山羊抗鼠 IgG作为酶标二抗,免疫小鼠的血清为一抗,按照常规 ELISA程序进行包备、封闭和洗涤等步骤,以此确定抗原最佳包被浓度和血清最适稀释度。
1.5 细胞融合及杂交瘤细胞的筛选常规方法制备免疫鼠脾脏细胞并与 SP2/0胞进行融合,分散于 96孔培养板经 HAT、HT选择培养基培养获得融合细胞株。用优化后间接 ELISA方法筛选阳性杂交瘤细胞株,放大培养并保种,同时收获培养上清测定效价。
1.6 腹水制备及亚类鉴定腹水制备前 7 d,取 8周龄的阴性雌性小鼠,腹腔注射灭菌液体石蜡,每只 500 μL,致敏小鼠。 然后选取高效价的杂交瘤细胞株腹腔注射已致敏小鼠,10 d后采集腹水,并将其保存于 -70℃冰箱中。按照 Mouse Monoclonal Antibody Isotyping Kit说明书的步骤,检测所制备的单克隆抗体的类别和亚类。
1.7 单克隆抗体的Western blot鉴定将表达纯化的 NLRP3蛋白作为抗原转移到硝酸纤维素膜 (NC膜)上,用 5%脱脂奶粉于 37℃封闭 2 h,PBST洗涤 3次后,加入 1∶2 000稀释的单克隆抗体作为一抗于 4℃孵育 12 h,PBST洗涤 3次后,加入 1∶3 000 稀释的HRP标记山羊抗鼠IgG,37℃孵育 1 h,PBST洗涤 3次后,ECL显色剂显色观察试验结果。
1.8 单克隆抗体的间接免疫荧光(IFA)检测腹水经 NH4SO2沉淀后,按 Protein G Focurose 4FF说明书进行纯化。 1×107PK细胞经 0.25%胰酶消化,接种到 96孔板,37℃培养至细胞单层铺满 70%~80%时,接种 1×1010CCU/L猪肺炎支原体 (mycoplasma hyopneumoniae,Mhp),2%的 DMEM维持液继续培养以刺激猪炎症小体 NLRP3蛋白的表达,同时设未感染的细胞做对照。细胞接种猪肺炎支原体 48 h后,弃掉细胞上清液,用冰冻的无水乙醇固定 20 min,PBS洗涤 3次;用 0.1% TritonX-100于室温通透细胞膜 10 min,PBS洗涤 3次;使用含 10%胎牛血清的 PBS于室温封闭 1 h,加入单克隆抗体于 4℃孵育 12 h,PBS洗涤 3次后,加入 1∶1 000稀释的 FITC标记山羊抗小鼠 IgG,37℃孵育 1 h,PBS洗涤 3次,加入少量 PBS置于荧光显微镜下观察。
1.9 抗原表位筛选与鉴定为筛选出单克隆抗体所识别的抗原表位,将表达的 NLRP3蛋白分为 5段,引物序列见表 1。以 p32a-NLRP3-864质粒为模板分别进行 PCR扩增,并与表达载体 pGEX-6P-1进行连接,构建分段表达载体。将构建好的质粒分别转入 BL21中表达及纯化,方法参照文献[19]。将分段表达的蛋白进行 SDS-PAGE凝胶电泳,得到的条带转到 NC膜上,用纯化的单抗作为一抗,HRP标记的山羊抗小鼠 IgG作为二抗,对单抗进行 Western blot鉴定,ECL显色来初步确定每个单克隆抗体所识别的抗原表位区域。

表1 猪NLRP3基因分段扩增引物
2 结果
2.1 杂交瘤细胞株的筛选及效价测定成功筛选出 3株稳定分泌抗 NLRP3蛋白的杂交瘤细胞株,命名为 9H5、13E1和 15E2。间接 ELISA方法测定 3株单克隆抗体的效价均为 1∶12 800。
2.2 抗体亚类鉴定经鉴定 3株单克隆抗体的重链亚类均为 IgG 2b;轻链 15E2为 κ 链,其余均为 λ 链。
2.3 Western blot如图 1所示,3株单抗 9H5、13E1和 15E2均能与 NLRP3重组蛋白发生特异性结合,而与 pET-32a诱导表达蛋白未发生反应,表明制备的3株单抗与 NLRP3重组蛋白具有良好的反应活性。

M.蛋白Marker;1.NLRP3重组蛋白;2. pET-32a空载体蛋白
2.4 单克隆抗体的 IFA检测将已纯化的质量浓度为 1 mg/L单克隆抗体 1∶50稀释作为一抗分别进行 IFA检测。IFA 结果显示,与未感染组相比,3株单克隆抗体 9H5、13E1、15E2均能在 Mhp感染的 PK细胞的细胞质中观察到荧光,且荧光强度强,表明 3株 MAb都与 PK细胞中的NLRP3炎症小体发生了特异性反应(图 2)。
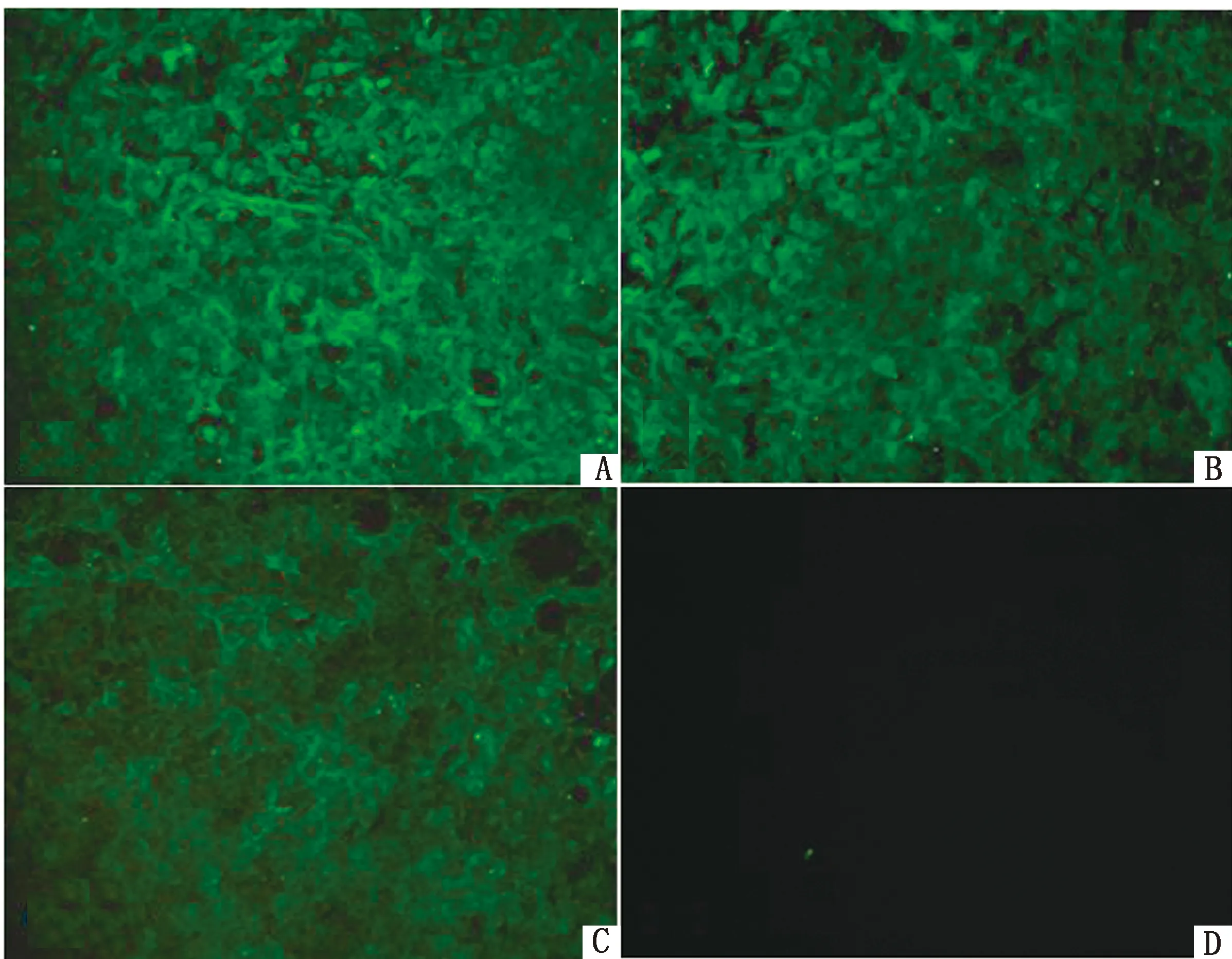
A.9H5;B.13E1;C.15E2;D.阴性对照
2.5 单克隆抗体抗原结合位点的鉴定将一系列分段表达的 NLRP3重组蛋白作为抗原,进行 Western blot 鉴定,结果显示单克隆抗体 9H5和 15E2仅可识别 NLRP3分段表达的重组蛋白 NLRP3-1而不能识别其他分段表达的重组蛋白,表明 9H5和 13E1的抗原结合位点在 1~50 aa之间;单克隆抗体 13E1仅可识别 NLRP3分段表达的重组蛋白NLRP3-3而不能识别其他分段表达的重组蛋白,表明 13E1的抗原结合位点在 118~183 aa之间(图3)。
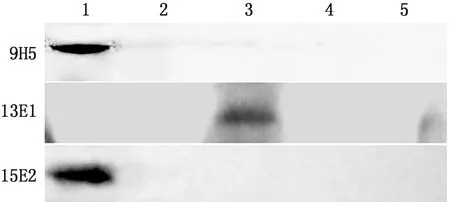
1.分段表达蛋白 1(NLRP3-1); 2.分段表达蛋白 2(NLRP3-2); 3.分段表达蛋白3 (NLRP3-3); 4.分段表达蛋白 4(NLRP3-4); 5.分段表达蛋白 5(NLRP3-5)
3 讨论
NLRP3属于 NOD样受体 (nod-like receptors,NLRs)家族成员,目前发现的炎症小体还有 NLR家族成员 NLRP1和 NLRC4以及 HIN 域的家族成员 AIM2和 Pyrin 4种[4,6]。 NLRP3炎症小体的激活是一个两步过程,在 PRRs感应到 PAMPs和 DAMPs后启动:首先这些 PRRs识别病原体会激活各种下游信号级联反应,包括导致 pro-IL-1 和 NLRP3 转录诱导的 NF-κB通路;在 NLRP3直接或间接感知其活化剂的存在后,即发生第二步炎症小体的组装[13-15]。
近些年猪 NLRP3炎症小体蛋白及其激活的炎症反应也在各种病原感染中被研究。 2014年刘园园等[16]研究证明 PRRSV 感染 PAM能够激活 NLRP3炎症小体,并初步判断 DDX19A参与了炎症小体的激活,该研究对促进 PRRSV的基础研究和临床研究都具有重要意义。 2015年胡亮等[17]从分子水平揭示了 HP-PRRSV感染 PAMs诱导 NLRP3炎症小体激活的机理,证明宿主蛋白 DDX19A可以识别 PRRSV基因组 RNA,招募 NLRP3,激活 NLRP3 炎症小体,诱导 IL-1β分泌。 2019年林岚等[11]以小鼠为模型证实了猪链球菌 2型分泌的溶血素能激活 NLRP3炎性小体,诱导炎性“风暴”,促进了链球菌中毒样休克综合征(streptococcal toxic-shock-like syndrome,STSLS) 的发生。 2018年范双旗等[18]发现 NLRP3炎症小体在对 CSFV感染的先天免疫反应中起重要作用,该研究将经典猪瘟病毒感染猪外周血单核细胞,通过检测 NLRP3、Caspase-1和 IL-1β的表达情况发现 CSFV感染抑制了 NLRP3的表达,同时敲除 NLRP3基因可增强了 CSFV的复制。
本实验室为进一步研究猪 NLRP3炎症小体在不同病原体感染后被激活的炎症反应机制,首先制备了用于 NLRP3炎症小体检测的抗体工具。通过 NCBI检索及相关抗原表位在线预测网站选取了表位丰富的结构域构建原核达载体,表达纯化后的重组蛋白制备了 NLRP3的兔源多抗[19]。与多克隆抗体相比,单克隆抗体具有特异性强、定向性结合、交叉反应少等特点[20]。为提高检测效率降低反应背景值,本研究以实验室保存的重组蛋白做为抗原制备了3株单克隆抗体并对其生物学特性进行鉴定,Western blot结果显示所制备的3株 MAb均可与 NLRP3蛋白特异性结合。近些年Mhp等病原体引起的炎症反应对猪的养殖产生了重大影响,造成了具大的经济损失。 IFA研究表明 3株 MAb均可与 PK细胞质中的 NLRP3炎症小体发生特异性结合,同时初步证明了猪肺炎支原体感染可激活 PK细胞中的 NLRP3炎症小体的表达。 NLRP3分段表达蛋白 Western blot检测中发现 9H5和 13E1可识别 NLRP3上不同的抗原表位,为建立 NLRP3炎症小体双抗体夹心 ELISA检测方法提供了重要技术支持。
