蚓激酶对哮喘小鼠免疫相关转录因子T-bet、GATA-3、RORγt、Foxp3的影响①
2023-01-28韩兆鹏薛征杨艳胡逸中周欢刘亚尊山西中医药大学太原030024
韩兆鹏 薛征 杨艳 胡逸中 周欢 刘亚尊(山西中医药大学,太原 030024)
支气管哮喘(简称哮喘)作为一种气道慢性炎症性疾病,免疫细胞失衡导致的炎症反应失控是其关键机制之一。Th1/Th2与Th17/Treg失衡在气道炎症中发挥重要作用[1-2]。IL-6、TGF-β、IL-1β、TNF-α可诱发T细胞免疫失衡,而T-bet、GATA-3、RORγt和Foxp3分别作为免疫细胞Th1、Th2、Th17和Treg的特异性转录因子调控初始CD4+T细胞向Th1、Th2、Th17和Treg分化[3-4]。炎症因子与转录因子一定程度上可反映Th1/Th2、Th17/Treg免疫平衡情况,判断气道炎症程度。通过改善Th1/Th2与Th17/Treg平衡缓解过敏性症状是哮喘治疗的重要策略。蚓激酶作为中药地龙中提取的一组丝氨酸蛋白水解酶,具有抗凝纤溶、抗纤维化、抗肿瘤、抗炎、抗氧化等药理作用。研究显示,蚓激酶可抑制白细胞介素-1受体相关激酶-4(interleukin-1 receptor-associated kinase-4,IRAK4)活化及NF-κB、MAPKs表达缓解炎症反应[5],但蚓激酶在哮喘气道炎症方面的研究较少。本研究拟观察蚓激酶对哮喘小鼠炎症因子IL-6、TGF-β、IL-1β、TNF-α和细胞转录因子T-bet、GATA-3、RORγt及Foxp3的影响,探讨蚓激酶对哮喘小鼠Th1/Th2和Th17/Treg平衡的调节作用。
1 材料与方法
1.1材料
1.1.1 实验动物4~6周龄健康SPF级BALB/c雄性小鼠40只,体质量18~22 g,购于上海斯莱克实验动物有限公司,合格证号:20170005019743,许可证号:SCXK(沪)2017-0005,经上海市中医医院动物伦理委员会批准(dw2020003),饲养于上海市中医医院SPF级动物房,20~24℃、50%~70%湿度、IVC-Ⅱ型独立送风笼具中饲养,自由饮水与进食,适应性喂养1周。
1.1.2 药物与试剂醋酸地塞米松片(0.75 mg/片,上海上药信谊药厂有限公司,批号:HB102079);蚓激酶(≥12 000 U/mg,上海国源生物技术有限公司,批号:20190105);OVA(Sigma,货号:A5503);Al(OH)3(Thermo,货号:77161);苏木素、伊红溶液(BASO,货号:714094、BA4099);甲醛、二甲苯、异丙醇、无水乙醇、氯仿(国药集团,货号:10010018、10023418、80109218、100092680、10023419);IL-6、IL-1β、TGF-β、TNF-αELISA试 剂 盒(X-Y Biotechnology,货 号:XY-E20012、XY-E20533、XY-E20217、XY-E20220);Trizol(Invitrogen,货号:1596-026);BCA蛋白定量试剂盒、SYBR Green PCR试剂盒(Thermo,货号:PIC⁃PI23223、#K0223);逆转录试剂盒(Fermentas,货号:#K1622);蛋 白 预 染Marker(Fermentas,货 号:SM1811);DEPC处理水、RIPA组织细胞快速裂解液、4×蛋白上样缓冲液、TEMED(上海基尔顿生物,货 号:R1600、BYL40825、BYL40828、BYL40728);Tween20(Amresco,货号:BYL40713);发光液(Milli⁃pore,货号:WBKLS0100);RORγt(Bioss,货号:Bs-6217R);Foxp3(Abcam,货 号:Ab23683);T-bet、GATA-3(Proteintech,货号:13700-1-AP、66400-1-Ig);GAPDH抗体(CST,货号:#5174);羊抗兔HRP标记的二抗(碧云天,货号:A0208)。
1.1.3 仪器正置显微镜(Nikon公司,ECLIPSE Ni);石蜡切片机、摊片机(徕卡公司,SQ2125、PPTHK-21B);恒温烘箱(上海恒一科学仪器有限公司,DHG-9023A);显微图像分析系统(Nikon公司,DS-Ri2);Real-time检测仪(ABI公司,ABI-7300);低温冷冻离心机(上海卢湘仪离心机仪器有限公司,TG-16M);旋涡振荡器(青浦泸西仪器厂,K30);电动匀浆机(FLUKO,PRO200);酶标仪(芬兰雷勃酶标仪,MK3);电泳仪(Bio-Rad公司,mini protean 3 cell);电转仪(大连竞迈科技有限公司,PS-9);移液器(吉尔森P型移液器,Pipetman);水浴锅(Leica,HI1210);成像系统(Tanon,Tanon-5200);超声雾化器(PARI GmbH,PARI BOY N)。
1.2方法
1.2.1 药物配制10 g OVA、1 g Al(OH)3溶于100 ml生理盐水,制成10%致敏液;蚓激酶以1.75 g/(kg·d)溶于pH=6的PBS;醋酸地塞米松片溶于生理盐水配制成0.075 mg/ml溶液。
1.2.2分组、造模及给药40只SPF级BALB/c雄性小鼠随机分为空白对照组(空白组)、哮喘模型组(模型组)、地塞米松组(地米组)、蚓激酶组,每组10只。造模第1、14天,模型组、地米组和蚓激酶组小鼠腹腔注射致敏液(0.5 ml/只),第21~27天将小鼠置于5 L密闭容器,雾化吸入5%OVA激发,40 min/次,1 d/次。空白组腹腔注射及超声雾化均以等量生理盐水代替。4组小鼠每次雾化激发1 h后,蚓激酶组灌胃给予蚓激酶[20 ml/(kg·d)],地米组灌胃给予等量地塞米松,空白组和模型组灌胃给予等量生理盐水。
1.2.3 标本留取各组小鼠末次灌胃24 h后脱颈处死,结扎右侧支气管,左侧主支气管以1.5 ml生理盐水灌洗,收集支气管肺泡灌洗液(bronchoalveo⁃lar lavage fluid,BALF),离心取上清;右侧肺上叶用10%甲醛固定,HE染色,制备肺组织切片;右侧肺下叶剪碎制成匀浆,进行RT-PCR和Western blot检测。1.2.4 HE染色观察肺组织病理变化右侧肺上叶以10%甲醛固定48 h,流水冲洗,梯度乙醇脱水,置于无水乙醇和二甲苯混合液2 h,二甲苯脱水透明,浸蜡、包埋、切片,烤片、水化,HE染色,透明,封片,显微镜拍照,采集分析样本相关部位。
1.2.5 ELISA测定BALF上清IL-6、TGF-β、IL-1β、TNF-α水平取BALF上清分装,按ELISA试剂盒说明书操作,测定450 nm处吸光度,通过标准品吸光度(A)绘制标准曲线,计算标本中IL-6、TGF-β、IL-1β、TNF-α实际浓度。
1.2.6 RT-PCR检测肺组织T-bet、GATA-3、RORγt、Foxp3 mRNA表达取适量右肺组织匀浆,按试剂盒说明书操作。Trizol法提取总RNA,消除总RNA中的DNA后反转录合成cDNA第一条链,反应体系(25μl):RNA-Primer Mix 12μl、5×RT Reaction Buffer 5μl、25 mmol/L dNTPs 1μl、25 U/μl RNase Inhibitor 1μl、200 U/μl M-MLV Rtase 1μl、RT引物1μl、ddH2O 4μl,反 应 程 序:37℃60 min、85℃5 min、4℃5 min,-20℃保存。对cDNA进行PCR扩增,反应体系(25μl):SYBR Green Mix 12.5μl、正向 引 物0.5μl、反 向 引 物0.5μl、ddH2O 9.5μl、cDNA模板2μl,95℃10 min(95℃15 s;60℃45 s)40个循环、95℃15 s、60℃1 min、95℃15 s、60℃15 s。数据分析采用仪器自带分析软件ABI Prism 7300 SDS Software,以GAPDH为 内 参,2-ΔCt计 算mRNA相对表达。引物序列见表1。

表1 RT-PCR引物序列Tab.1 RT-PCR primer sequences
1.2.7 Western blot检测肺组织T-bet、GATA-3、RORγt、Foxp3蛋白水平取适量右肺组织匀浆,按试剂盒说明书操作,组织匀浆完全裂解后离心取上清,蛋白定量,根据标准曲线求出相应样品蛋白实际浓度,制胶、上样、电泳,在25 V的半干式电转缓冲液(48 mmol/L Tris、39 mmol/L glycine、0.04%SDS、20%甲醇)中转膜30 min,室温下置于丽春红染色工作液中摇动染色5 min,封闭,孵育抗原,根据说明书将抗体稀释后4℃孵育过夜,加入HRP标记的二抗(1∶1 000稀释)37℃孵育1 h,TBST洗涤3次,与配制的ECL发光液混合显色,成像系统扫描,Image J软件分析,Western blot结果表示为目标蛋白条带灰度值/内参GAPDH灰度值。
1.3 统计学处理采用SPSS22.0软件进行统计学分析,数据采用±s表示。各组数据进行方差齐性检验,若方差齐则直接进行单因素方差分析,并用LSD进行两两比较;若方差不齐则先对数据进行变量转换,再进行单因素方差分析,并用LSD进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 4组小鼠一般状态空白组小鼠进食、饮水、活动度、毛色、体质量均正常;模型组小鼠进食、饮水减少,烦躁搔鼻,毛发蓬立且光泽度差,体质量减轻;地米组及蚓激酶组小鼠进食、饮水、毛色、搔鼻均较模型组改善,体质量较模型组增加。
2.2 4组小鼠肺组织病理学改变高倍镜下显示,空白组管腔平滑,未见明显炎症细胞浸润;模型组造模后,小鼠管腔及周围炎症细胞浸润明显,黏膜水肿增厚;地米组和蚓激酶组上述病理变化较模型组改善(图1)。

图1 4组小鼠肺组织病理变化(HE,×200)Fig.1 Pathological changes of lung tissue of mice in four groups(HE,×200)
2.3 4组小鼠BALF上清IL-6、TGF-β、IL-1β、TNF-α水平与空白组比较,模型组小鼠IL-6、TGF-β、IL-1β、TNF-α水平升高(P<0.01),地米组、蚓激酶组IL-6、TGF-β水平差异有统计学意义(P<0.01),地米组、蚓激酶组IL-1β、TNF-α水平差异无统计学意义(P>0.05)。与模型组比较,地米组和蚓激酶组IL-6、TGF-β、IL-1β、TNF-α水平显著降低(P<0.05,P<0.01),地米组与蚓激酶组差异无统计学意义(P>0.05,表2)。
表2 4组小鼠BALF上清IL-6、TGF-β、IL-1β、TNF-α水平(±s,n=10,pg/ml)Tab.2 Levels of IL-6,TGF-β,IL-1βand TNF-αin BALF supernatant of mice in four groups(±s,n=10,pg/ml)
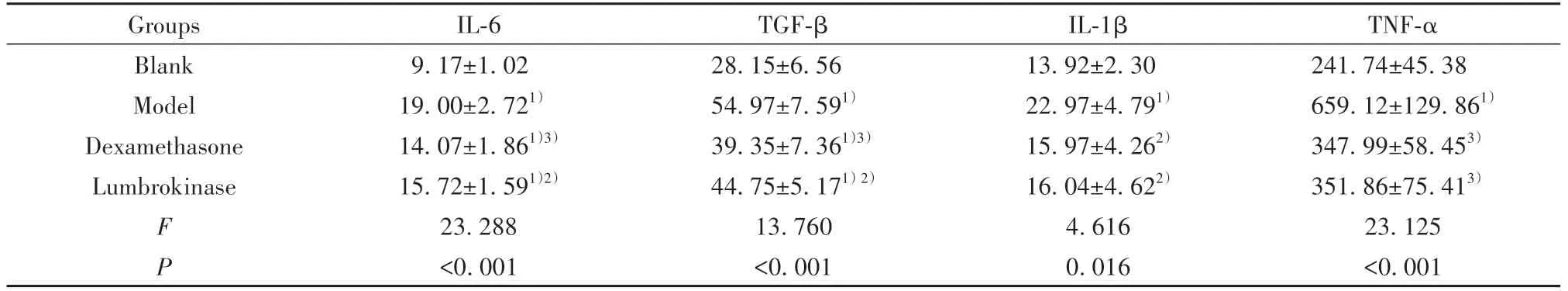
表2 4组小鼠BALF上清IL-6、TGF-β、IL-1β、TNF-α水平(±s,n=10,pg/ml)Tab.2 Levels of IL-6,TGF-β,IL-1βand TNF-αin BALF supernatant of mice in four groups(±s,n=10,pg/ml)
Note:Compared with blank group,1)P<0.01;compared with model group,2)P<0.05,3)P<0.01.
Groups Blank Model Dexamethasone Lumbrokinase F P IL-6 9.17±1.02 19.00±2.721)14.07±1.861)3)15.72±1.591)2)23.288<0.001 TGF-β 28.15±6.56 54.97±7.591)39.35±7.361)3)44.75±5.171)2)13.760<0.001 IL-1β 13.92±2.30 22.97±4.791)15.97±4.262)16.04±4.622)4.616 0.016 TNF-α 241.74±45.38 659.12±129.861)347.99±58.453)351.86±75.413)23.125<0.001
2.4 4组小鼠肺组织T-bet、GATA-3 mRNA水平与空白组比较,模型组小鼠T-bet mRNA水平降低,GATA-3 mRNA水平升高(P<0.01),与模型组相比,地米组与蚓激酶组T-bet mRNA表达增加(P<0.01),GATA-3 mRNA表达减少(P<0.01),地米组与蚓激酶T-bet、GATA-3 mRNA水平差异无统计学意义(P>0.05,表3)。
表3 4组小鼠肺组织T-bet、GATA-3 mRNA水平比较(±s,n=10)Tab.3 Comparison of T-bet,GATA-3 mRNA levels in lung tissues of mice in four groups(±s,n=10)

表3 4组小鼠肺组织T-bet、GATA-3 mRNA水平比较(±s,n=10)Tab.3 Comparison of T-bet,GATA-3 mRNA levels in lung tissues of mice in four groups(±s,n=10)
Note:Compared with blank group,1)P<0.01;compared with model group,2)P<0.01.
Groups Blank Model Dexamethasone Lumbrokinase F P T-bet 0.017 9±0.003 8 0.005 8±0.001 31)0.014 8±0.004 62)0.013 5±0.005 22)8.384 0.001 GATA-3 0.007 5±0.002 0 0.022 7±0.003 41)0.012 3±0.002 81)2)0.014 9±0.003 71)2)21.744<0.001
2.5 4组小鼠肺组织RORγt、Foxp3 mRNA水平
与空白组比较,模型组小鼠Foxp3 mRNA水平降低,RORγt mRNA水平升高(P<0.01),与模型组相比,地米组与蚓激酶组Foxp3 mRNA表达增加(P<0.01),RORγt mRNA表达减少(P<0.01),地米组与蚓激酶的RORγt、Foxp3 mRNA水平差异无统计学意义(P>0.05,表4)。
表4 4组小鼠肺组织RORγt、Foxp3 mRNA水平比较(±s,n=10)Tab.4 Comparison of lung tissues RORγt,Foxp3 mRNA levels of mice in four groups(±s,n=10)

表4 4组小鼠肺组织RORγt、Foxp3 mRNA水平比较(±s,n=10)Tab.4 Comparison of lung tissues RORγt,Foxp3 mRNA levels of mice in four groups(±s,n=10)
Note:Compared with blank group,1)P<0.01;compared with model group,2)P<0.01.
Groups Blank Model Dexamethasone Lumbrokinase F P RORγt 0.009 7±0.001 0 0.030 6±0.005 81)0.015 7±0.003 11)2)0.017 9±0.004 21)2)24.996<0.001 Foxp3 0.016 0±0.003 8 0.005 4±0.001 71)0.012 4±0.003 51)2)0.011 5±0.002 51)2)10.908<0.001
2.6 4组小鼠肺组织T-bet、GATA-3蛋白水平与空白组比较,模型组小鼠T-bet蛋白水平降低,GATA-3蛋白水平升高(P<0.01),与模型组相比,地米组与蚓激酶组T-bet蛋白表达增加(P<0.01),GATA-3蛋白表达减少(P<0.05),地米组与蚓激酶T-bet、GATA-3蛋白水平差异无统计学意义(P>0.05,表5、图2)。

图2 4组小鼠肺组织T-bet、GATA-3蛋白表达电泳图Fig.2 Electrophoresis of T-bet and GATA-3 protein expressions in lung tissues of mice in four groups
表5 4组小鼠肺组织T-bet、GATA-3蛋白水平比较(±s,n=10)Tab.5 Comparison of T-bet and GATA-3 protein levels in lung tissues of mice in four groups(±s,n=10)

表5 4组小鼠肺组织T-bet、GATA-3蛋白水平比较(±s,n=10)Tab.5 Comparison of T-bet and GATA-3 protein levels in lung tissues of mice in four groups(±s,n=10)
Note:Compared with blank group,1)P<0.01;compared with model group,2)P<0.05,3)P<0.01.
Groups Blank Model Dexamethasone Lumbrokinase F P T-bet 0.395 9±0.088 1 0.054 0±0.007 71)0.269 0±0.032 31)3)0.201 0±0.014 91)3)26.791<0.001 GATA-3 0.198 4±0.109 7 0.794 7±0.019 81)0.426 2±0.274 72)0.412 8±0.181 72)6.080 0.018
2.7 4组小鼠肺组织RORγt、Foxp3蛋白水平与空白组比较,模型组小鼠Foxp3蛋白水平降低,RORγt蛋白水平升高(P<0.01),与模型组相比,地米组与蚓激酶组Foxp3蛋白表达增加(P<0.01),RORγt蛋白表达减少(P<0.01),地米组与蚓激酶的RORγt、Foxp3蛋白水平差异无统计学意义(P>0.05,表6、图3)。
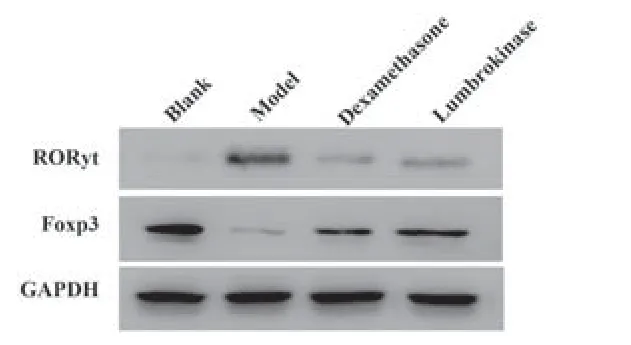
图3 4组小鼠肺组织RORγt、Foxp3蛋白表达电泳图Fig.3 Electrophoresis of RORγt and Foxp3 protein expressions in lung tissues of mice in four groups
表6 4组小鼠肺组织RORγt,Foxp3蛋白水平比较(±s,n=10)Tab.6 Comparison of RORγt,Foxp3 protein levels of lung tissues of mice in four groups(±s,n=10)
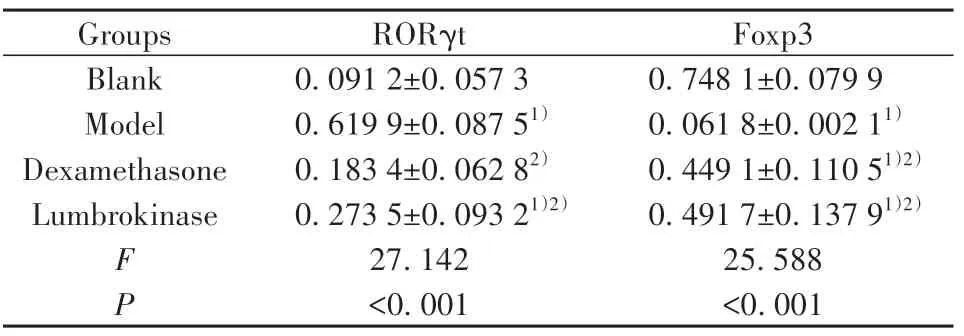
表6 4组小鼠肺组织RORγt,Foxp3蛋白水平比较(±s,n=10)Tab.6 Comparison of RORγt,Foxp3 protein levels of lung tissues of mice in four groups(±s,n=10)
Note:Compared with blank group,1)P<0.01;compared with model group,2)P<0.01.
Groups Blank Model Dexamethasone Lumbrokinase F P RORγt 0.091 2±0.057 3 0.619 9±0.087 51)0.183 4±0.062 82)0.273 5±0.093 21)2)27.142<0.001 Foxp3 0.748 1±0.079 9 0.061 8±0.002 11)0.449 1±0.110 51)2)0.491 7±0.137 91)2)25.588<0.001
3 讨论
世界范围内哮喘患者超过3.39亿,仅2016年全球就有417 918人死于哮喘[6-7]。哮喘是儿童最常见的慢性疾病,遗传易感性与环境接触是哮喘发病的主要原因,气道慢性炎症是其最重要的发病机制之一。
哮喘发病过程中存在Th1/Th2和Th17/Treg失衡,TNF-α、IL-1β可促使免疫细胞向Th2/Th17偏移。促炎因子IL-6、TGF-β过分泌在哮喘中可诱导免疫相关转录因子T-bet、GATA-3、RORγt、Foxp3水平向Th2/Th17倾斜;而转录因子T-bet、GATA-3、RORγt、Foxp3分别作为Th1、Th2、Th17和Treg最具有特征性的分子标志物,调控这些免疫细胞分化。
TGF-β在Th17/Treg分化中不可或缺,IL-6则决定了二者分化比例,且介导Th1/Th2分化。IL-6是引起炎症反应和组织损伤的重要因子,可增加哮喘患病风险,并可作为评估哮喘的重要标志物[8]。IL-6对T细胞增殖与分化具有重要调控作用[9]。正常情况下,IL-6在IL-12作用下可刺激T-bet基因表达,从而激发Th1分化。IL-6可在IL-4作用下增加GATA-3基因表达,促进初始CD4+T细胞向Th2分化,且可诱导Th2和Th17优势分化,并通过巨噬细胞抑制Th1和Treg分化。过敏原刺激机体后,哮喘活动期和持续状态的气道中均发现不同程度IL-6水平升高[10-11]。IL-6基因敲除后,模型小鼠气道高反应性降低,气道炎症细胞募集与Th2、Th17细胞因子表达也 明 显 减 少[12]。TGF-β在IL-6缺 失 情 况 下增 加Foxp3 mRNA及蛋白表达,扩充Treg分化含量。而TGF-β在IL-6刺激下会诱导RORγt表达,增加Th17表达,而Th17也会分泌部分IL-6形成Th17分化的正反馈循环。
TNF-α、IL-1β同样作为前炎症细胞因子参与气道炎症反应,二者均可诱导ICAM-1、VCAM-1、E-selectin表达和趋化因子分泌,还可直接作用于平滑肌细胞和细胞间质放大炎症反应[13]。过敏原激活NLRP3后产生IL-1β,从而参与以Th2/Th17为优势的哮喘[14-15]。IL-1β可加强Th2型细胞因子IL-6、IL-13表达,也会诱导Treg向Th17分化加强炎症反应。炎症中TNF-α往往出现在IL-1β之后[16]。致敏阶段,TNF-α可通过促进CD11c+细胞分泌参与Th2/Th17介导的细胞炎症[17]。TNF-α可招募、激活嗜酸性粒细胞与中性粒细胞过表达,促进Th17向分化,通过刺激巨噬细胞活化增加细胞因子IL-6、IL-1β分泌。
药物干预是哮喘防治过程中的重要环节,从中药中提取的天然化合物对疾病研究及治疗得到了广泛认可。中药地龙具有清热定惊、通络平喘功效,治疗哮喘疗效确切,但具体机制尚不明确[18]。蚓激酶作为从地龙中提取的一组蛋白水解酶,具有良好的抗凝溶纤作用,临床被广泛用于心脑血管溶栓治疗。研究表明,蚓激酶还可通过发挥溶纤作用,改善大鼠肺纤维化症状,可能是地龙治疗哮喘的有效组分[19]。
本研究通过腹腔致敏与OVA雾化激发建立急性发作期哮喘小鼠模型,并在激发1 h后给予蚓激酶治疗,发现在哮喘急性期存在炎症因子IL-6、TGF-β、IL-1β、TNF-α水平升 高,细胞转 录因子GATA-3、RORγt mRNA及蛋白表达增加,而T-bet、Foxp3 mRNA及蛋白水平显著降低。药物治疗后,哮喘小鼠肺组织炎症因子IL-6、TGF-β、IL-1β、TNF-α水平降低,其中IL-1β与TNF-α降至正常水平,与空白组差异无统计学意义(P>0.05)。本研究还发现,蚓激酶可有效抑制Th2/Th17的特异性转录因子GATA-3、RORγt基因表达,减少其蛋白翻译;同时诱导Th1/Treg转录因子T-bet、Foxp3 mRNA及蛋白表达,因此,蚓激酶可降低IL-6、TGF-β、TNF-α、IL-1β水平,调节转录因子T-bet、GATA-3、RORγt、Foxp3基因及蛋白表达。机体Th1/Th2和Th17/Treg分化离不开炎症因子和免疫细胞特异性转录因子参与,因此推测蚓激酶可能通过调节炎症因子IL-6、TGF-β、IL-1β、TNF-α水 平 及 转 录 因 子T-bet、GATA-3、RORγt、Foxp3基因及蛋白表达改善哮喘小鼠Th1/Th2和Th17/Treg免疫失衡。本研究仅探讨了蚓激酶对免疫转录因子的影响,拟进一步探究其对细胞免疫失衡的作用机制。
总之,本研究表明,哮喘急性发作期存在炎症因子及免疫细胞特异性转录因子水平异常。蚓激酶可通过降低IL-6、TGF-β、IL-1β、TNF-α水平减少GATA-3、RORγt mRNA及蛋白转录和翻译,诱导T-bet、Foxp3 mRNA及蛋白表达,即通过降低相关前炎症因子水平调节免疫细胞转录因子表达,达到治疗哮喘的目的。