重楼皂苷Ⅰ对脂多糖诱导的小鼠急性肺损伤的保护作用研究
2023-01-28曹银利孙亚洲崔清洋何晓敬唐成和新乡医学院第一附属医院新生儿科新乡453000
曹银利 孙亚洲 崔清洋 何晓敬 唐成和(新乡医学院第一附属医院新生儿科,新乡 453000)
急性肺损伤(acute lung injury,ALI)及其并发症急性呼吸窘迫综合征是临床常见的急危重症,具有高发病率和病死率[1-2]。目前除了保护性机械通气外暂无更好的药物治疗,因此研发安全有效的治疗药物具有重要意义[3]。越来越多的证据表明,氧化应激是影响ALI严重程度的关键途径[4]。此外,气道炎症也在ALI的发病机制中起重要作用[5]。因此,抑制炎症和/或氧化应激可能是预防和治疗ALI的潜在策略。重楼皂苷Ⅰ(polyphyllinⅠ,PPⅠ)是重楼中的重要活性和抗肿瘤成分。之前的报道显示,PPⅠ通过抑制肿瘤的增殖和生长,在多种癌症中具有抗癌作用[6-8]。最近研究表明,PPⅠ还可以防止心肌缺血再灌注损伤,显著抑制炎症细胞因子的分泌并抑制P65的易位[9-10]。但PPⅠ对脂多糖(lipo⁃polysaccharide,LPS)诱导的ALI的影响尚未见报道。本研究主要观察PPⅠ对LPS诱导的ALI小鼠肺组织病理损伤、炎症反应和氧化应激的调节作用,并探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物与试剂48只SPF级C57BL/6雄性小鼠,6~8周龄,体质量20~25 g,购自河南省实验动物中心,动物生产许可证号:SCXK(豫)2017-0001。PPⅠ(B21668,HPLC≥98%,上海源叶生物科技有限公司);地塞米松(DEX,D1756)、LPS(货号:L2630)(美国Sigma公司);苏木素伊红(HE)染色试剂盒(货号:C0105)、比辛酸(BCA)蛋白浓度测定试剂盒(货号:P0012)、ECL发光液(货号:P0018S)和RIPA裂解缓冲液(货号:P0013B)(碧云天生物公司);p38(#8690)、p-p38(#4511)、NLRP3(#15101)、caspase-1(#24232)、AMPK(#5831)、p-AMPK(#2535)、Nrf2(#12721)、KEAP1(#8047)、GAPDH(#5174)和辣根过氧化物酶(HRP)标记的山羊抗兔IgG(#7074)(美国CST公司);一氧化氮(nitric oxide,NO)测定试剂盒(货号A013-2-1)、超氧化物歧化酶(super oxide dismutase,SOD)试剂盒(货号:A001-3-2)、丙二醛(malondialdehyde,MDA)试剂盒(货号:A003-1-2)、髓过氧化物酶(myeloperoxidase,MPO)试剂盒(货号:A044-1-1)、TNF-α(H052-1)、IL-1β(H002)和IL-6(H007)ELISA试剂盒(南京建成生物工程研究所)。
1.1.2 仪器 凝胶成像系统(型号Gel Doc XR+,美国Bio-Rad公司);光学显微镜(型号RX51,日本奥林巴斯公司);多功能紫外酶标仪(型号EPOCH2,上海玉博生物科技有限公司);高速离心机(型号5424R,德国Eppendorf公司)。
1.2 方法
1.2.1 动物分组、建模及给药C57BL/6小鼠在25℃、50%湿度,光照12 h/12 h光/暗环境下适应性喂养1周。将小鼠随机分为6组(n=8):对照组、LPS组、PPⅠ5 mg/kg组、PPⅠ10 mg/kg组、PPⅠ20 mg/kg组和地塞米松(DEX)组。PPⅠ治疗组小鼠造模前7 d每天灌胃相应剂量的PPⅠ,对照组和LPS组给予同体积的生理盐水,DEX组灌胃2 mg/kg DEX。末次给药1 h后LPS组和PPⅠ组鼻腔滴入LPS(5 mg/kg),对照组腹腔注射等量生理盐水。
1.2.2 样品采集与处理滴鼻建模24 h后,用无菌磷酸盐缓冲液(PBS)灌洗肺收集支气管肺泡灌洗液(BALF),4℃、3 000 r/min离心10 min,收集上清液,用BCA法定量测定其中总蛋白浓度。用100μl PBS重悬沉淀,滴于载玻片上,并用瑞氏-姬姆萨复合染色液染色5 min,使用血细胞计数仪确定总白细胞计数和巨噬细胞数。然后处死小鼠,取肺部组织进行检测。将小鼠肺右上叶浸入4%多聚甲醛中,固定24 h,石蜡包埋,脱水,切成5μm切片;手术切取小鼠右下叶,保存于液氮中。
1.2.3 肺湿/干重(W/D)值测定分离小鼠左肺,称重得肺湿重(W),将左肺置于80℃的烘箱中,干燥48 h后,称重得肺干重(D),计算肺W/D值。
1.2.4 HE染色观察肺组织病理变化将石蜡切片用二甲苯脱蜡,梯度乙醇脱水,然后用苏木精染色5 min,伊红染色2 min,封片并在光学显微镜下观察肺组织病理学变化。基于严重程度(正常=0分,微小变化=1分,轻度变化=2分,中度变化=3分,重度变化=4分)记录肺损伤评分。评估依据包括中性粒细胞浸润、肺部间质水肿和肺泡出血[11]。
1.2.5 Western blot检测蛋白表达RIPA裂解液提取保存于液氮中的大鼠肺组织总蛋白,BCA测定总蛋白浓度。每孔上样量40μg,用SDS-PAGE分离并电转至PVDF膜,室温下用5%脱脂奶粉液封闭膜2 h,加入一抗GAPDH(1∶1 000)、p38(1∶1 000)、p-p38(1∶1 000)、NLRP3(1∶1 000)、caspase-1(1∶1 000)、AMPK(1∶1 000)、p-AMPK(1∶1 000)、Nrf2(1∶1 000)和KEAP1(1∶1 000)抗体,4℃孵育过夜,加HRP标记的山羊抗兔IgG(1∶3 000),室温孵育2 h,洗膜,ECL发光显色,拍照。采用Image J软件分析蛋白条带灰度值。
1.2.6检测肺组织BALF中炎症因子水平按照试剂盒的说明使用ELISA法测定BALF样品上清液中TNF-α、IL-1β和IL-6的水平。
1.2.7 检测肺组织BALF中SOD和MDA含量根据试剂盒说明,使用NO、MPO、SOD、MDA测定试剂盒分别在酶标仪550 nm、460 nm、450 nm、532 nm处测量吸光度值,以计算NO、MPO、SOD和MDA含量。
1.3 统计学分析采用SPSS19.0软件进行统计学分析,数据以±s表示。采用单因素方差分析(ANOVA)对多组间结果进行比较,用t检验确定实验组间差异的意义。P<0.05为差异有统计学意义。
2 结果
2.1 PPⅠ对LPS诱导肺组织病理学变化的影响对照组小鼠肺组织结构正常,LPS组肺组织出现显著的病理变化,如炎症细胞浸润、肺间质出现水肿,PPⅠ(10 mg/kg和20 mg/kg)或DEX处理明显改善了LPS诱导的病理损伤,炎症细胞浸润减少,见图1A。与对照组比较,LPS组小鼠肺损伤评分提高(P<0.01),与LPS组比较,PPⅠ(10 mg/kg和20 mg/kg)组和DEX组肺损伤评分降低(P<0.05,P<0.01),见图1B。

图1 PP Ⅰ对LPS诱导的肺组织病理学变化的影响Fig.1 Effect of PP Ⅰon LPS-induced lung histopathologi⁃cal changes
2.2 PPⅠ对LPS诱导的肺水肿和BALF中蛋白含量的影响与对照组比较,LPS刺激后小鼠肺W/D值升高(P<0.01),PPⅠ(10 mg/kg和20 mg/kg)或DEX治疗显著降 低LPS诱导的 肺W/D值(P<0.05),见图2A。如图2B~D所示,与对照组相比,LPS组总蛋白含量、白细胞和巨噬细胞数量均显著增加(P<0.01),PPⅠ(10 mg/kg和20 mg/kg)或DEX治疗显著减少总蛋白含量、白细胞和巨噬细胞数量(P<0.05,P<0.01)。
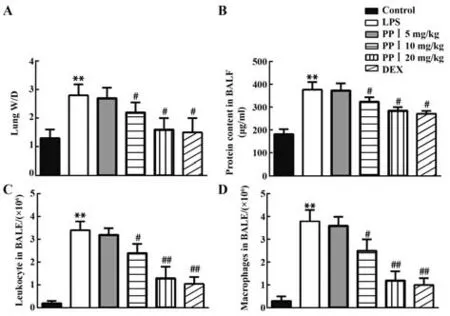
图2 PP Ⅰ对LPS诱导的肺损伤的影响Fig.2 Effect of PP Ⅰon LPS-induced lung injury
2.3 PPⅠ对LPS诱导的肺部氧化损伤的影响与对照组相比,LPS显著诱导BALF中的NO、MPO和MDA产生,降低SOD的含量(P<0.01)。与LPS组比较,PPⅠ(10 mg/kg和20 mg/kg)或DEX处理显著减少NO、MPO和MDA的含量,并增加SOD的产生(P<0.05,P<0.01),见图3。
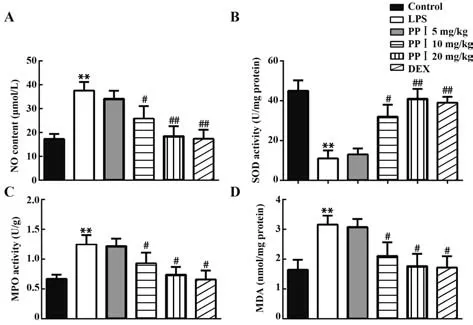
图3 PP Ⅰ对LPS诱导的肺部氧化损伤的影响Fig.3 Effect of PP Ⅰon LPS-induced lung oxidative injury
2.4 PPⅠ抑制LPS诱导的BALF中促炎症因子的分泌与对照组比较,LPS诱导后小鼠BALF中TNF-α、IL-1β和IL-6水平升高(P<0.01),与LPS组比较,PPⅠ(10 mg/kg和20 mg/kg)组和DEX组TNF-α、IL-1β和IL-6水平降低(P<0.05,P<0.01),见图4。
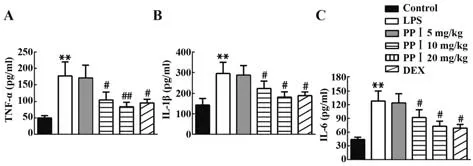
图4 PP Ⅰ对LPS诱导的BALF中促炎因子分泌的影响Fig.4 Effect of PP Ⅰon LPS-induced secretion of proinflammatory cytokines in BALF
2.5 PPⅠ抑制p38-NLRP3/caspase-1信号通路的激活与对照组相比,p38磷酸化水平和NLRP3、cas⁃pase-1的表达在LPS刺激后显著增加(P<0.01)。总p38的表达水平在LPS刺激后未改变。相反,PPⅠ(10 mg/kg和20 mg/kg)或DEX处理后可以显著抑制LPS诱导的p38-NLRP3/caspase-1信号传导途径的磷酸化(P<0.05,P<0.01),见图5。
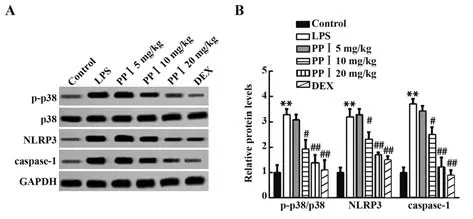
图5 PP Ⅰ对p38-NLRP3/caspase-1信号通路的影响Fig.5 Effect of PP Ⅰon p38-NLRP3/caspase-1 signaling pathway
2.6 PPⅠ对AMPK-Nrf2/KEAP1信号通路的影响与对照组相比,LPS刺激后p-AMPK和Nrf2的表达显著下调(P<0.01),KEAP1的表达显著上调(P<0.01)。PPⅠ(10 mg/kg和20 mg/kg)或DEX的治疗显著增加了AMPK的磷酸化和Nrf2的表达,并减少了KEAP1的表达(P<0.05,P<0.01),见图6。

图6 PP Ⅰ对AMPK-Nrf2/KEAP1信号通路的影响Fig.6 Effect of PP Ⅰon AMPK-Nrf2/KEAP1 signaling pathway
3 讨论
ALI是肺泡上皮细胞和由各种直接或间接损伤因子引起的血管内皮细胞损伤,其特征在于肺部间质和肺泡水肿及炎症细胞浸润[12]。LPS是革兰氏阴性菌的主要成分,会导致脓毒症综合征,并伴有ALI的重要特征,包括过度的炎症反应[13]。因此,LPS常用作诱导ALI损伤模型。在本研究中,LPS诱导肺W/D值和总蛋白含量的增加,这是肺水肿的基本标志,PPⅠ可显著降低肺W/D值和BALF中的蛋白含量[14]。LPS刺激产生的促炎细胞因子可以激活内皮细胞产生更多的黏附分子。因此,肺泡嗜中性粒细胞、白细胞和巨噬细胞被募集到肺部,导致急性肺炎的发生[15]。本研究中,PPⅠ显著减轻LPS诱导的肺泡结构破坏、肺泡腔出血和炎症细胞浸润,降低BALF中的白细胞和巨噬细胞数。因此,PPⅠ能够治疗LPS诱导的ALI。
SOD可有效清除有害自由基,防止氧化应激。相反,中性粒细胞和脂质过氧化的过度积累分别产生MPO和MDA,导致氧化应激反应[16]。同时,NO的过量产生可能导致过氧亚硝酸盐形成,进而引起肺微血管通透性增加,产生细胞毒性作用。因此,抑制NO的产生可以减弱LPS刺激的ALI[17]。LPS诱导的ALI的关键特征是炎症介质的释放,例如TNF-α和IL-β,其可以激活初始炎症级联并增强肺损伤[18]。HUANG等[19]研究表明PPⅠ通过增加SOD、GSH和IL-10的水平,降低ROS、MDA、TNF-α和IL-6水平缓解心肌缺血再灌注损伤。本研究结果表明,PPⅠ治疗可以显著抑制BALF中NO、MPO和MDA、TNF-α、IL-1β和IL-6的产生,促进SOD的产生。因此,PPⅠ能够抑制LPS诱导的小鼠肺组织炎症反应和氧化应激损伤。
p38途径参与了LPS的内毒性作用,介导TNF-α和IL-1β等细胞因子的产生,抑制p38的磷酸化对肺泡毛细血管屏障渗透具有保护作用[20]。NLRP3炎症小体是一种主要的细胞内炎症途径,并且当它被激活时,IL-1β的分泌和caspase-1的表达增加[21]。本研究结果表明,p38-NLRP3/caspase-1信号传导途径在LPS诱导的ALI中被激活。然而,PPⅠ可显著下调p-p38、NLRP3和caspase-1的表达。AMPK可通过磷酸化导致Nrf2核转录的积累,减轻LPS诱导的ALI[22]。在无压力条件下,Nrf2与KEAP1结合;在暴露于应激源时,Nrf2从KEAP1中释放并易位到细胞核中,诱导抗氧化酶的表达[23-24]。本研究结果显示PPⅠ明显下调KEAP1的表达,上调p-AMPK和Nrf2的表达。因此PPⅠ可能通过抑制p38-NLRP3/caspase-1途径抑制炎症因子的分泌,通过激活AMPK/Nrf2途径诱导抗氧化酶的表达,从而减轻氧化应激反应。
综上所述,本研究结果证明了PPⅠ可有效地保护LPS诱导的ALI,抗氧化应激和炎症损伤,这主要取决于p38-NLRP3/caspase-1信号通路的抑制和AMPK/Nrf2途径的激活。本研究数据证明了PPⅠ作为治疗LPS诱导的ALI潜在的可能性。