细菌感染激活炎症小体介导细胞焦亡的机制研究进展
2023-01-28李世青袁媛王景林
李世青 袁媛 王景林
(军事医学研究院微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071)
炎症小体作为一种胞质大分子信号平台,自2002年提出以来逐渐走入研究者视野,作为机体免疫系统的重要组成备受关注。宿主细胞受到细菌感染后,细菌不同组件可通过不同机制激活宿主体内多种炎症小体组装,引发炎症反应。炎症反应是把双刃剑,在感染早期,炎症反应有利于机体抵御细菌感染,但持续性的过度炎症反应则有害于机体,导致多器官衰竭。本文综述了不同细菌组件激活炎症小体的种类并同时阐述了各炎症小体的激活机制。
1 炎症小体介导细胞焦亡的概述
机体受到外来刺激时,宿主细胞可识别特定刺激物,引发体内炎症小体组装及其介导的炎症反应。炎症小体介导的炎症反应主要表现为两方面:一方面组装好的炎症小体能够调节caspase-1活化,在天然免疫防御过程中促进细胞因子前体pro-IL-1β和pro-IL-18成熟和分泌。另一方面,炎症小体组装复合物能够调节caspase-1依赖的炎症形式编程性细胞死亡——细胞焦亡(pyroptosis),诱导细胞在炎症和应激病理条件下死亡。炎症小体介导的两方面炎症反应既有区别,也存在联系。本文将分别介绍炎症小体及细胞焦亡,并进一步阐述两者的联系。
1.1 炎症小体炎症小体于2002年由TSCHOPP实验组提出,从结构来说,其是由传感器、适配器ASC(apoptosis-associated speck-like protein containing a CARD)和酶原pro-caspase-1组成的多聚蛋白复合物[1]。传感器包括三类蛋白,分别为NLR[nucleo⁃tide-binding oligomerization domain(NOD)-like recep⁃tor]家族成员、AIM2(absent in melanoma 2)蛋白和Pyrin蛋白。以传感器为分类依据,目前研究最为广泛的炎症小体主要包括NLRP1、NLRP3、NLRC4、AIM2、Pyrin。NLRs由三部分组成:C末端、中央高度保守的可结合核苷酸的寡聚结构域(nucleotidebinding domain,NACHT)及可结合下游蛋白的可变N端。C末端为LRR(leucine rich repeat)结构域,能够识别细胞溶质配体并将NLRs保留在非激活状态。依据不同N末端结构域,NLR家族蛋白可进行亚分类,如带有PYD(Pyrin domain)的NLRP、带有BIR结构域(baculovirus inhibitory repeat domain)的NLRB和带有CARD(caspase activation and recruit⁃ment domain)的NLRC。AIM2属于ALR(AIM2-like receptor)模式识别受体家族蛋白成员,其N端含有PYD结构域,C端含有负责结合多聚核苷酸的HIN200结构域。Pyrin蛋白主要由3个结构域组成:N端Pyrin域(PYD)、2个中心锌指域(B-boxes)、1个螺旋线圈域(coiled-coil,CC)。适配器ASC蛋白由PYD-CARD组成,在炎症小体组装过程中起中间桥梁作用。识别特定刺激后,传感器与ASC结合,在细胞核周围形成1个ASC斑点结构,随后促进procaspase-1聚集,进而引发体内炎症小体组装及其介导的炎症反应。
1.2 细胞焦亡细胞焦亡是近年发现的一种不同于凋亡、坏死的细胞死亡方式,主要表现为细胞不断肿胀直至细胞膜破裂,导致细胞内容物释放进而激发强烈炎症反应。目前认为细胞焦亡存在两种途径,一类是caspase-1参与组成的炎症小体引发的经典细胞焦亡途径,另一类是小鼠caspase-11和人caspase-4/5单独作为胞质传感器响应胞质脂多糖(LPS)引起的非经典细胞焦亡途径。最初发现cas⁃pase-1/4/5/11可裂解GSDMD,释放其N端结构域,在细胞膜上寡聚成孔,诱发细胞焦亡[2]。与上述不同的是,近年也有研究表明耶尔森氏菌(Yersinia)感染巨噬细胞后,caspase-8可水解活化Gasdermin引发细胞焦亡[3]。也有研究表明caspase-3可通过酶切GSDME激活细胞焦亡[4]。因此,目前细胞死亡命名委员会建议细胞焦亡定义为一种依赖于Gasdermin家族蛋白形成质膜膜孔的可调控细胞死亡,通常(但并不总是)是炎症性caspase活化的结果[5]。
1.3 炎症小体与细胞焦亡的联系机体受到细菌感染后可识别细菌刺激物激活体内炎症小体组装引发细胞焦亡,介导炎症反应发生。炎症小体与细胞焦亡既存在联系也存在差别。两者联系主要表现为两方面:一是炎症小体可作为经典细胞焦亡途径的上游通路引发细胞焦亡;二是两者分别对细胞因子IL-1β和IL-18的成熟和分泌发挥作用。刺激物激活炎症小体可引起pro-IL-1β和pro-IL-18成熟,而其进一步释放依赖于细胞焦亡引发的膜孔形成。两者相互依存,共同促发体内炎症反应。本综述从细菌组件出发,介绍不同细菌组件可激活经典炎症小体(NLRP1、NLRC4、NLRP3、AIM2、Pyrin)的种类,同时探讨这些炎症小体激活介导经典细胞焦亡的发生机制。
2 不同细菌组件可激活炎症小体的种类
不同细菌感染可激活不同炎症小体,同一细菌感染也可激活不同炎症小体,体现细菌感染激活炎症小体的多样性与网络性。宿主细胞感应不同细菌组件,激活不同炎症小体,引发细胞焦亡和细胞因子释放,具体细菌组件激活炎症小体介导细胞焦亡的汇总见表1、表2。以下将以细菌菌体表面结构、附件、内部物质、分泌系统效应蛋白及外毒素为分类依据,汇总这些组件可激活炎症小体的种类。
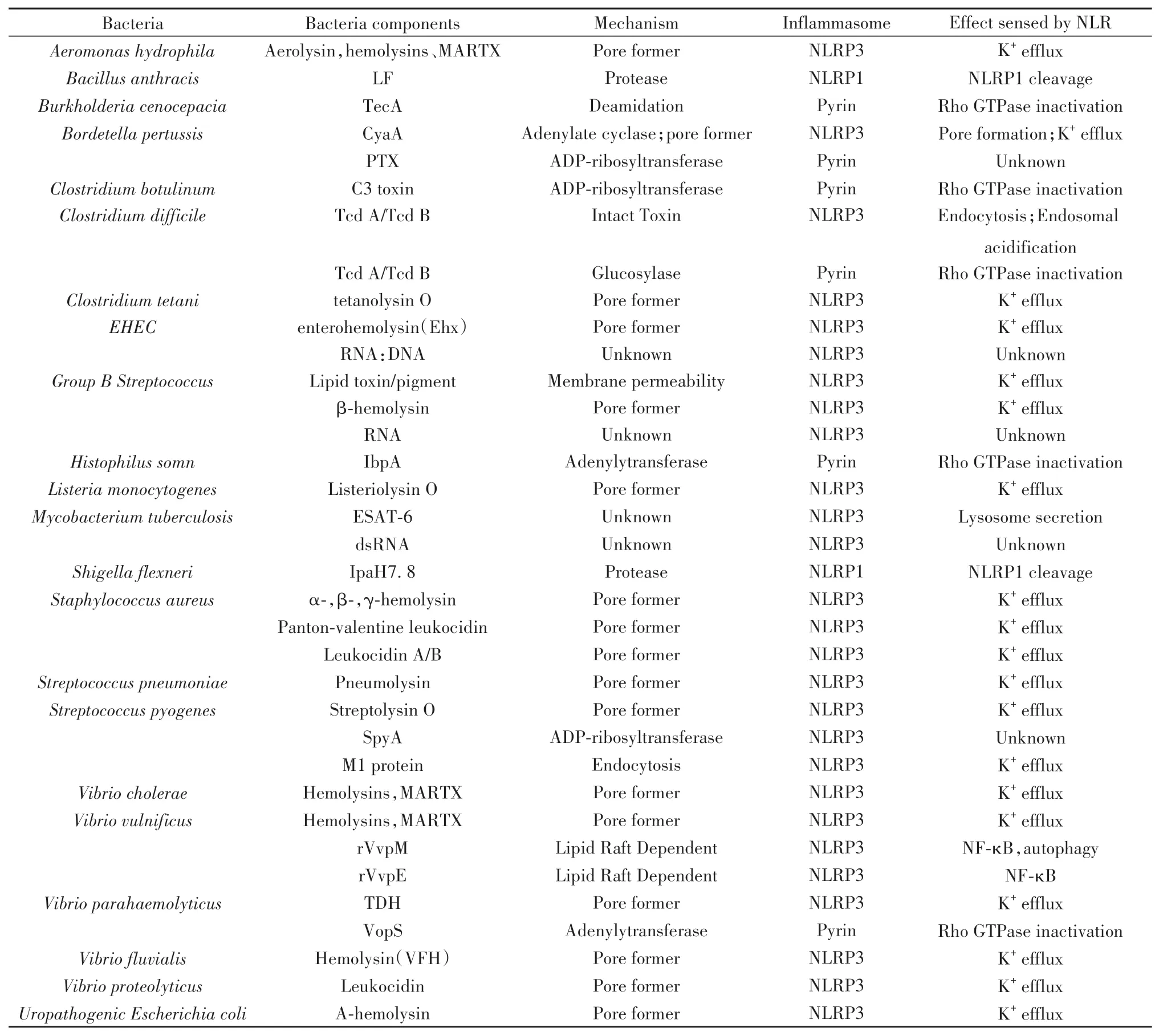
表1 细菌感染间接激活炎症小体[6-7]Tab.1 Bacterial infection indirectly activates inflammasome[6-7]
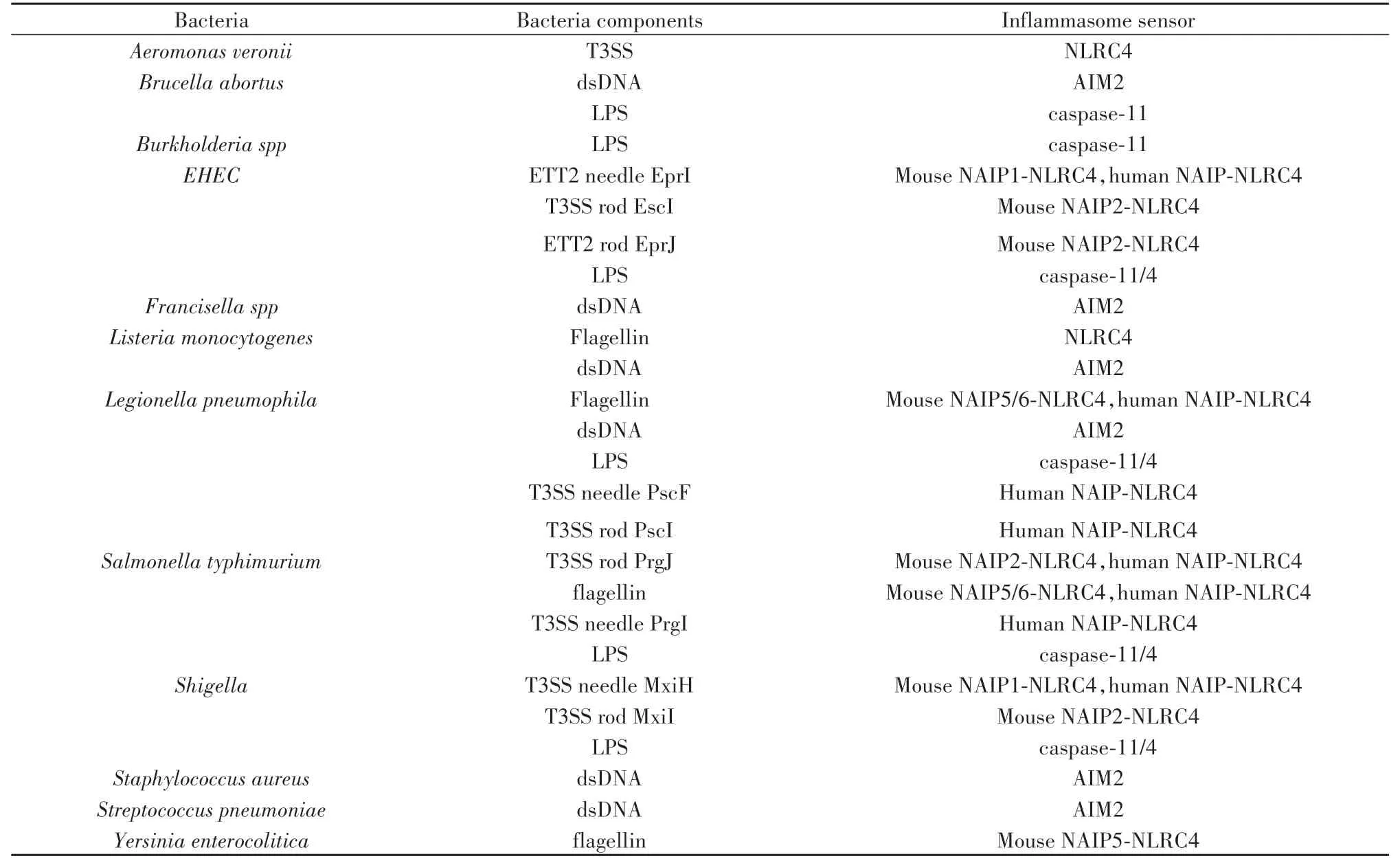
表2 细菌感染直接激活炎症小体[7-8]Tab.2 Bacterial infection directly activates inflammasome[7-8]
2.1 菌体表面结构(细胞壁、表面蛋白)可激活炎症小体的细菌表面结构主要包括细胞壁成分、表面蛋白。如干酪乳杆菌(Lactobacillus casei)细胞壁片段、化脓链球菌(Streptococcus pyogenes)细胞表面蛋白M1可激活NLRP3炎症小体引发经典细胞焦亡途径[9-10]。此外,革兰氏阴性菌细胞壁成分LPS中的脂质A可直接与caspase4/5/11结合引发非经典细胞焦亡途径[11]。
2.2 菌体附件(鞭毛)可激活炎症小体的细菌附件是细菌的鞭毛结构,如军团菌(Legionella)、沙门氏菌(Salmonella)、假单胞菌(Pseudomonas)等多种细菌感染时可通过鞭毛蛋白激活NLRC4炎症小体组装[12]。
2.3 菌体的内部物质(核酸、质粒)细菌内部物质中的核酸(dsDNA、RNA)、质粒可激活AIM2、NLRP3、NLRP1炎症小体。AIM2蛋白可识别单核细胞增生李斯特菌(Listeria monocytogenes)、弗朗西斯氏菌(Francisella)、肺炎链球菌(Streptococcus pneu⁃moniae)和牛布鲁氏菌(Brucella abortus)细菌胞质dsDNA激活AIM2炎症小体组装[13]。此外细菌RNA可激活NLRP3炎症小体组装,如B族链球菌提取的纯化总RNA、大肠杆菌的mRNA和RNA-DNA杂交体、结核分枝杆菌中的dsRNA均可激活NLRP3炎症小体[14-17]。进一步研究表明,细菌mRNA、tRNA和
rRNA也能激活人巨噬细胞的NLRP3炎症小体[18]。除细菌核酸外,最新研究发现细菌质粒也可激活NLRP1炎症小体,福氏志贺菌分泌的侵袭性质粒抗原H7.8(IpaH7.8)是一种可诱导NLRP1B降解和激活的蛋白酶,可激活NLRP1炎症小体引发经典细胞焦亡途径[19-20]。
近年来,黑社会性质组织向政治领域渗透的现象又出现了新的趋势:一是通过暴力、威胁、贿赂等手段,操纵选举,直接控制农村基层政权;二是通过收买有权势的上级领导,控制下属组织谋取暴利。[15]
2.4 细菌分泌系统效应蛋白细菌通用的Ⅰ~Ⅵ型细菌分泌系统中,可激活炎症小体组装的分泌系统包括Ⅲ型、Ⅵ型分泌系统(T3SS、T6SS)。研究发现,大肠杆菌、志贺氏菌(Shigella)、耶尔森菌(Yersinia)等多种细菌感染可通过T3SS杆状蛋白和针状蛋白激活NLRC4炎症小体[12]。此外来自副溶血弧菌(Vibrio parahaemolyticus)的T3SS效应蛋白VopS及新洋葱伯克霍尔德菌(Burkholderia cenocepacia)的T6SS效应蛋白TecA可激活Pyrin炎症小体[21-22]。除通用的Ⅰ~Ⅵ型分泌系统,分枝杆菌属中存在特有的Ⅶ型分泌系统(ESX-1型分泌系统),可激活NLRP3炎症小体,如结核分枝杆菌(Mycobacterium tuberculosis)Ⅶ型分泌系统中早期分泌抗原靶蛋白ESAT-6(6 kD early secretory antigenic target protein)[11]。同时海洋分枝杆菌(Mycobacterium marinum)的ESX-1型分泌系统也可激活NLRP3炎症小体,但并未找到具体诱导蛋白[23]。
2.5 细菌的分泌外毒素根据作用于靶细胞的方式不同,外毒素主要分为三类:作用于细胞膜毒的素、损伤细胞膜的毒素和细胞内作用毒素。这些细胞毒素中,可激活炎症小体毒素主要包括损伤细胞膜的毒素和细胞内作用毒素。
2.5.1 损伤细胞膜毒素损伤细胞膜毒素在体外具有溶血素或溶细胞素活性,主要包括孔形成毒素和磷脂酶类毒素,两者均可激活NLRP3炎症小体。如孔形成毒素中金黄色葡萄球菌分泌的α-、γ-溶血素、杀白细胞素、杀白细胞素A/B[24];也包括弧菌属中霍乱弧菌(Vibrio cholerae)和创伤弧菌(Vibrio vul⁃nificus)分泌的溶血素和MARTX毒素、副溶血性弧菌(Vibrio parahaemolyticus)分泌的耐热直接溶血素、河流弧菌(Vibrio fluvialis)分泌的溶血素、蛋白水解弧菌(Vibrio proteolyticus)分泌的杀白细胞素[25-26]。磷脂酶类毒素包括金黄色葡萄球菌β溶血素等。
2.5.2 细胞内作用毒素细胞内作用毒素主要具有酶活性,通过酶活性影响细胞内生物机制或抑制蛋白合成,包括多种腺苷酸环化酶、ADP-核糖转移酶、葡(萄)糖基转移酶、神经毒素等毒素,主要激活NLRP3和Pyrin炎症小体。如百日咳鲍特菌分泌的百日咳腺苷酸环化酶毒素(adenylate cyclase toxin,CyaA)可激活NLRP3炎症小体,同时其分泌的百日咳毒素(pertussis toxin,PTX)依赖其ADP核糖基转移酶可激活Pyrin炎症小体诱导小鼠腹腔细胞IL-1β分泌[27-28]。同时化脓链球菌分泌的SpyA和铜绿假单胞菌分泌的PEA两种ADP-核糖基转移酶毒素(ADP-ribosyltransferase toxin)也可激活体内细胞NLRP3炎症小体[29]。此外艰难梭菌(Clostridium difficile)分泌的艰难梭菌毒素A(Tcd A)和艰难梭菌毒素B(Tcd B)两种葡糖基转移酶毒素既可激活NLRP3炎症小体也可激活Pyrin炎症小体[30]。
综上,细菌感染时可通过其自身不同组件激活体内多种炎症小体介导炎症反应。具体来说,细菌鞭毛和T3SS效应蛋白可激活NLRC4炎症小体,细菌分泌的成孔毒素、酶类毒素、某些效应蛋白、RNA可激活NLRP3炎症小体,细菌dsDNA可激活AIM2炎症小体,细菌分泌的某些毒素可激活Pyrin炎症小体,同时细菌的LPS可激活非经典炎症小体途径,引发细胞焦亡和细胞因子IL-1β、IL-18成熟与分泌。
3 细菌感染激活炎症小体介导细胞焦亡的机制研究
细菌通过不同组件激活不同炎症小体诱导细胞焦亡,各炎症小体激活过程中涉及机制也不同,主要分为直接激活与间接激活。直接激活中,主要激活机制为不同蛋白结构的直接切割与结合。如细菌的效应物质可切割NLRP1蛋白激活炎症小体组装,细菌的鞭毛蛋白和III型分泌系统效应蛋白结合NAIP、dsDNA结合AIM2分别激活NLRC4、AIM2炎症小体介导经典细胞焦亡途径,LPS结合caspase-4/5/11直接介导非经典细胞焦亡途径。间接激活中,细菌组件扰动细胞内信号进而激活Pyrin和NLRP3炎症小体。以下将针对每一炎症小体介绍其蛋白结构进而阐述其激活机制。
3.1 直接激活
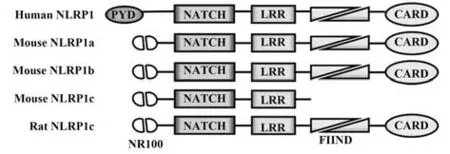
图1 人、小鼠、大鼠NLRP1蛋白结构[31]Fig.1 NLRP1 protein structure of human,mouse and rat[31]
目前研究确定的可激活NLRP1炎症小体的细菌效应物质包括炭疽杆菌分泌的炭疽致死毒素(lethal toxin,LT)的致死因子(lethal factor,LF)及福氏志贺菌分泌的IpaH7.8,其激活机制均在于可直接切割或酶解NLRP1蛋白的N末端,释放其C端片段进而激活caspase-1[19-20]。综上,NLRP1激活的先决条件为FIIND的自蛋白分解、对刺激的响应和N-末端蛋白分解,进而指出细菌感染主要通过其组件切割NLRP1蛋白激活NLRP1炎症小体介导细胞焦亡。
3.1.2 细菌感染结合NAIP激活NLRC4炎症小体引发细胞焦亡NLRC4炎症小体是目前已知较为清楚的炎症小体之一,其蛋白由3部分组成,N端CARD结构域、中间NACTH结构域和C端LRR结构域。NLRC4通过直接的NLRC4CARD-caspase-1CARD相互作用激活caspase-1。
多种细菌感染可通过鞭毛蛋白和T3SS效应蛋白激活NLRC4炎症小体。分析其激活机制发现,与其他炎症小体不同,NLRC4激活需要另一种蛋白,即神经元凋亡抑制蛋白(NAIPs),可在胞浆中识别细菌成分的存在。没有这些细菌组分存在时,NAIP和NLRC4中的LRR结构域与其自身NBD相互作用维持自抑制状态[34]。细菌配体存在的情况下,NAIP直接识别并结合特定配体,从而打破其自抑制构象,允许其NBD介导与NLRC4的共齐聚[35]。这种共齐聚反应诱导形成一个大的NAIP-NLRC4炎症小体,激活caspase-1,最终导致IL-1β/IL-18释放和细胞焦亡。NAIP蛋白是NLR家族成员之一,小鼠有4种NAIP同源基因:NAIP5/NAIP6识别鞭毛蛋白;NAIP1和NAIP2分别特异性识别T3SS针状蛋白和杆状蛋白。而人类仅编码1个NAIP基因(hNAIP),T3SS杆状/针状蛋白和鞭毛蛋白均能被识别[12]。目前研究表明,NLRC4的Ser533磷酸化激活了NLRC4,用于通过NAIP感应配体的后续激活[36]。但也有与之相矛盾的报道表明,这种磷酸化也发生在NLRC4的非活性状态。因此,需要进一步研究确定NLRC4-Ser533磷酸化的必要性。
3.1.3 细菌感染结合AIM2激活AIM2炎症小体引发细胞焦亡相对于NLRC4炎症小体激活时结合NAIP才可引发pro-caspase-1聚集,AIM2炎症小体的激活机制更为简单,可通过本身HIN200结构域直接结合细菌胞质dsDNA诱导炎症小体组装引发细胞焦亡。AIM2能与胞质细菌双链DNA(dsDNA)相互作用使ASC和pro-caspase-1结合形成功能性炎症小体。
静息细胞中,AIM2中的PYD通过静电吸引结合其HIN200结构域,使AIM2持续处于自抑制状态。当细菌感染时,细菌的dsDNA对HIN200结构具有更高的亲和力。因此,细胞内dsDNA出现后,PYD被dsDNA取代,从而使AIM2取消自抑制状态[37]。进一步,PYD暴露于ASC,通过同型PYDPYD相互作用招募ASC。随后通过ASC-CARD和procaspase-1-CARD结合组装成一个功能性AIM2炎症小体,引发炎症反应和细胞焦亡。
dsDNA-AIM2炎症小体途径是宿主细胞抵御细菌和病毒病原体的重要途径,涉及多种信号通路,包括AIM2直接识别细菌DNA,也包括胞浆双链DNA激活IFN刺激DNA[interferon(IFN)-stimulatory DNA,ISD]途径,即cGAS-STING-TBK1-IRF3途径促进AIM2感知dsDNA。ISD途径中,环GMP-AMP合酶(cGAS)独立于其序列感知DNA,激活胞质DNA传感适配器-IFN基因刺激因子(stimulator of interferon genes,STING)。STING随后激活蛋白激酶IKK和TBK1,进而激活转录因子NF-κB和干扰素调节因子3(IRF3),诱导Ⅰ型IFN产生,Ⅰ型IFN进一步通过细胞膜IFNAR1受体进入细胞参与AIM2感知dsDNA。此外,不同细菌感染涉及机制略有差别,如肺炎链球菌与单核细胞增生李斯特菌感染时肺炎链球菌溶血素(pneumolysin,PLY)、李斯特菌溶素O(listeriolysinO,LLO)均可激活AIM2炎症小体。弗朗西斯氏菌激活AIM2炎症小体时涉及多种机制,包括细菌内化、溶酶体酸化、线粒体ROS产生、K+外流、鸟苷酸结合蛋白(GBPs)和IFN诱导蛋白IRGB10参与[13]。
3.2 间接激活
3.2.1 细菌感染失活Rho-GTPases激活Pyrin炎症小体引发细胞焦亡与直接激活中蛋白间结构切割与结合不同,间接激活主要通过扰动细胞内信号进而激活炎症小体引发经典细胞焦亡途径,主要包括Pyrin、NLRP3两种炎症小体。
研究表明,在静息细胞中,Pyrin作为不活跃的蛋白存在,其B-Box结构域与PYD、CC结构域自齐聚成三聚体,维持Pyrin自抑制状态。细菌感染可通过毒素或效应蛋白翻译后修饰Rho-GTPase的开关Ⅰ区使其失活,进而被Pyrin识别,触发Pyrin炎症小体激活[38]。如艰难梭菌分泌的细胞毒素TcdA和TcdB可引起Rho-GTPase家族成员中的RhoA糖基化[39];肉毒梭菌C3毒素可引起RhoA去酰胺化[38];副溶血性弧菌T3SS效应蛋白VopS、睡眠嗜组织菌IbpA蛋白均可引发RhoA FIC-结构域腺苷酸化[38];新洋葱伯克霍尔菌T6SS效应器TecA引发RhoA去酰胺化[21]。此外,目前也发现百日咳鲍特菌分泌的PTX毒素依赖其ADP核糖基转移酶活性诱导小鼠腹腔细胞IL-1β分泌,但未研究PTX与Rho-GTPase的关系[28]。这些翻译后修饰均使Rho-GTPase失活。进一步分析翻译后修饰的Rho-GTPase与Pyrin关系发现,Pyrin似乎未直接与修饰的Rho-GTPase结合,而是引起Pyrin去磷酸化和14-3-3蛋白解离。研究发现,静息状态下,Rho-GTPases激活了丝氨酸-苏氨酸激酶PKN1和PKN2,在S208和S242结合并磷酸化Pyrin蛋白。磷酸化的Pyrin与14-3-3蛋白结合维持Pyrin炎症小体非活性状态。但当Rho-GTPase被细菌毒素或效应蛋白修饰时,Pyrin去磷酸化和14-3-3蛋白解离导致构象变化,从而使Pyrin炎症小体活化[40-41]。但Pyrin如何去磷酸化以及14-3-3蛋白如何释放尚未阐明。
3.2.2 细菌感染激活NLRP3炎症小体引发细胞焦亡NLRP3与其他NLRP家族蛋白一致,其N端具有PYD。与其他NLRs相比,NLRP3在细胞静息状态下的表达太低不足以激活炎症小体组装。目前关于NLRP3炎症小体激活的机制建立了双信号模型。第一信号指可上调NLRP3和pro-IL-1β所需的启动信号,TLR4、NOD2、TNFR和IL-1R等模式识别受体可激活启动信号,这些信号可引起NF-κB激活,从而增加pro-IL-1β和NLRP3合成。第二信号被称为感应信号,可由广泛的结构不同的激动剂触发,包括二氧化硅、石棉、铝等环境晶体污染物、成孔毒素和核酸等病原体组件及血清淀粉样蛋白A和ATP等内源性危险信号[42]。
多种细菌感染可激活人或小鼠细胞NLRP3炎症小体,活化caspase-1,引发IL-1β和IL-18炎症因子成熟与分泌或细胞焦亡。激活NLRP3炎症小体的细菌组件包括成孔毒素或具有酶活性的毒素、某些效应蛋白和细菌RNA。如此众多的激动剂如何激活细胞内NLRP3炎症小体组装,既往研究指出可能与钾离子外流、线粒体DNA释放、线粒体功能障碍、线粒体相关ROS产生、溶酶体相关组织蛋白酶B释放、胞内钙离子浓度改变、细胞膜孔道形成等相关,但尚未找出激活的统一通路。目前有几项研究从细胞内的另外一些信号通路出发尝试阐明其激活机制。一方面有研究指出NIMA相关激酶7(NIMA-related kinase 7,NEK7)可直接与巨噬细胞内NLRP3结合,是NLRP3炎症小体组装的核心驱动因子。NEK7的激酶结构域直接与NLRP3的LRR结构域结合形成复合物,与ASC和pro-caspase-1结合组装后形成NLRP3炎症小体复合物[43-45]。同时也有研究指出高尔基体反面网络结构(trans-Golgi net⁃work,TGN)是一种新的共同细胞信号,研究表明多种差异极大的激动剂均能引起细胞内TGN解体为分散的特殊结构(dispersed TGN,dTGN)。dTGN形成后,其膜上富集的带负电荷的磷脂酰肌醇-4-磷酸(phosphatidylinositol-4-phosphate,PtdIns4P)会招募原本处于细胞质基质内的NLRP3至dTGN,诱导ASC聚合,激活下游信号级联[46-48]。但NLRP3炎症小体的激活机制仍需进一步验证。
综上,细菌组件激活炎症小体时既可通过不同蛋白结构间的切割或结合直接组装炎症小体,也可扰动细胞通用信号进一步活化炎症小体组装进一步促进下游炎症反应发生。同时直接激活与间接激活间也存在联系,如AIM2炎症小体激活既可直接结合dsDNA结构直接激活也可扰动细胞信号通路间接激活。
4 总结
综上,细菌感染宿主时,可通过其本身不同组件、不同机制激活宿主细胞体内多种炎症小体,引发IL-1β、IL-18成熟与释放及细胞焦亡。细胞分泌IL-1β、IL-18和诱导细胞焦亡发挥诱发、放大和持续炎症反应的作用以及在多数情况下可帮助宿主抵御病原体感染。同时炎症小体激活后也会对机体产生一些影响,如诱发凝血级联反应及增强局部血管通透性[48-49]。
尽管目前对炎症小体激活机制和效应反应有了大量研究进展,但对炎症小体对抗微生物感染的认识还十分有限,仍存在诸多问题。如在炎症小体激活机制中,翻译后修饰起的具体作用是什么?炎症小体激活与其他细胞死亡途径(凋亡、坏死、自噬)是否存在其他联系?同时在炎症小体效应反应中,炎症反应与细胞焦亡的作用是否可帮助清除体内感染的病原体?炎症小体组装与炎症性脂质、抗菌递质产生、细胞迁移和适应性免疫等其他细胞生理过程间的联系为何?炎症小体抑制剂是否可用于脓毒症、自身免疫性疾病的临床治疗?对这些问题的理解将为宿主与病原菌的相互抗衡作用研究提供进一步见解,以便更好地理解细菌感染与宿主免疫防御间的博弈战。
