干扰MAFG-AS1靶向miR-335-3p对淋巴细胞白血病的影响
2023-01-28杨琪王波涛党惠兵河南省南阳医学高等专科学校第一附属医院血液内科南阳473000
杨琪 王波涛 党惠兵(河南省南阳医学高等专科学校第一附属医院血液内科,南阳 473000)
淋巴细胞白血病是一种血液性的恶性肿瘤,按病程缓急分为急性和慢性,急性型常见于儿童,慢性型多见于中老年患者。分子靶向治疗是淋巴细胞白血病新型的治疗方式,研究其分子发病机制,可为临床新药研发提供参考[1-3]。研究表明血液恶性肿瘤中lncRNAs的异常表达参与其进展过程[4]。研究报道沉默lncRNA MAFG-AS1通过调控miR-3196抑制胰腺癌细胞增殖和迁移,促进胰腺癌细胞凋亡[5]。敲低MAFG-AS1可通过调节miR-150-5p抑制乳腺癌细胞的增殖和迁移[6]。沉默MAFG-AS1抑制肺腺癌细胞增殖,诱导细胞凋亡[7]。然而MAFGAS1对淋巴细胞白血病的影响及机制尚不清楚。研究表明miRNA是肿瘤抑制因子和致癌基因,可作为治疗白血病的靶标[8]。研究报道miR-335-3p在急性淋巴细胞性白血病中低表达,与患者不良预后有关[9]。LncRNA CDKN2B-AS1通 过miR-335-3p/TRAF5轴促进小儿T细胞急性淋巴细胞白血病的肿瘤发生和化学耐药性[10]。本实验通过在线软件预测发现MAFG-AS1与miR-335-3p的结合位点。但MAFG-AS1是否通过靶向调控miR-335-3p影响淋巴细胞白血病还尚不清楚。因此,本实验旨在研究MAFG-AS1对淋巴细胞白血病的影响及机制是否与miR-335-3p表达有关。
1 资料与方法
1.1 资料
1.1.1 一般资料以2018年1月至2020年12月间河南省南阳医学高等专科学校第一附属医院25例急性白血病患者为研究对象,其中男16例,女9例,年龄12~68岁,平均(35.2±2.3)岁;并随机选取25例健康志愿者作为正常对照,抽取患者及健康对照的外周血标本,离心、分离血浆后置于-20℃冰箱保存待用。
1.1.2 主要试剂人T淋巴细胞白血病细胞HUT-78购自上海秋传生物科技有限公司;RPMI1640培养基购自上海玉博生物科技有限公司;Tripure分离试剂购自德国Roche公司;Trizol试剂购自上海瑞楚生物科技有限公司;荧光定量试剂盒购自上海子起生物科技有限公司;MTT试剂盒购自上海美轩生物科技有限公司;凋亡检测试剂盒购自上海机纯实业有限公司;双荧光素酶报告实验检测试剂盒购自上海英拜生物科技有限公司;蛋白提取试剂盒购自南京恩晶生物科技有限公司。
1.2 方法
1.2.1 细胞转染与分组人T淋巴细胞白血病细胞HUT-78置于RPMI1640培养基在37℃的培养箱中培养,将MAFG-AS1抑制表达载体质粒及阴性对照,miR-335-3p模拟物或抑制剂及其对应的阴性对照转染至HUT-78,分别记为si-NC组、si-MAFGAS1、miR-NC组、miR-335-3p组、anti-miR-NC组、an⁃ti-miR-335-3p组;将MAFG-AS1抑制表达载体质粒与miR-335-3p抑制剂共转染至HUT-78,记为si-MAFG-AS1+anti-miR-335-3p组。
1.2.2 实时荧光定量PCR(RT-qPCR)检测MAFGAS1和miR-335-3p的表达水平将分离后的血浆用Tripure分离试剂提取血浆总RNA;用Trizol试剂提取各组细胞的总RNA,将RNA反转录成cDNA(42℃反应1 h,95℃5 min,然后置于冰上),按照荧光定量试剂盒说明书进行PCR,扩增条件:94℃2 min;94℃30 s,58℃60 s,72℃30 s,共40个循环;后72℃延伸5 min;然后进行融解曲线;相对表达量用2-ΔΔCt法计算。MAFG-AS1正向引物:5'-GGGACG⁃GAGACAAATGACGG-3',反向引物:5'-GCAGGCTCCCTGACACGTA-3';GAPDH正向引物:5'-ACACCCACTCCTCCACCTTT-3',反向引物:5'-TTACTCCTT⁃GGAGGCCATGT-3';miR-335-3p正向引物:5'-TCAAGAGCAATAACGAAAATGT-3',反向引物:5'-TTTTTCATTATTGCTCCTGACC-3';U6正向引物:5'-CGCTTCGGCAGCACATATACTA-3',反向引物:5'-CGCTTCACGAATTTGCGTGTCA-3'。
1.2.3 MTT检测细胞活性将各组对数生长期细胞消化后接种于96孔板,每组设3个复孔,分别培养至24 h、48 h、72 h时,每孔加入20μl的MTT溶液,反应4 h后加入150μl DMSO,振荡反应10 min,用酶标仪于波长490 nm处检测吸光度(OD)值。
1.2.4 流式细胞术检测细胞凋亡收集各组细胞,PBS洗2遍后调细胞浓度2×106个/ml,用结合缓冲液重悬,取490μl细胞加入5μl FITC-Annexin V及5μl PI,混匀温育10 min,上机分析,同时以不加Annexin V-FITC及PI的细胞作为阴性对照。
1.2.5 双荧光素酶报告实验构建MAFG-AS1的野生型和突变型荧光素酶载体,待细胞密度达到70%时,将其分别与miR-NC和miR-335-3p共转染至HUT-78胞中,转染48 h后按照试剂盒说明检测荧光素酶活性。
1.2.6 Western blot法检测蛋白表达提取各组细胞的总蛋白,取30μl蛋白样品进行SDS-PAGE,通过湿转法将蛋白转至PVDF膜,加入封闭液室温反应2 h;洗膜后加入稀释好的一抗4℃过夜,倒掉一抗并洗膜后再加入稀释好的二抗,室温培养2 h,加入显色液显影,成像后用Image J软件分析蛋白条带的灰度水平,计算蛋白表达水平。
1.3 统计学分析采用SPSS20.0软件进行统计学分析,符合正态分布的计量资料用±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 MAFG-AS1、miR-335-3p在白血病患者中的表达与正常人血浆相比,白血病患者血浆中MAFGAS1表达水平升高,miR-335-3p表达水平降低(P<0.05,表1)。
表1 检测白血病患者中MAFG-AS1、miR-335-3p表达(±s,n=25)Tab.1 Detection of MAFG-AS1 and miR-335-3p expres⁃sion in leukemia patients(±s,n=25)
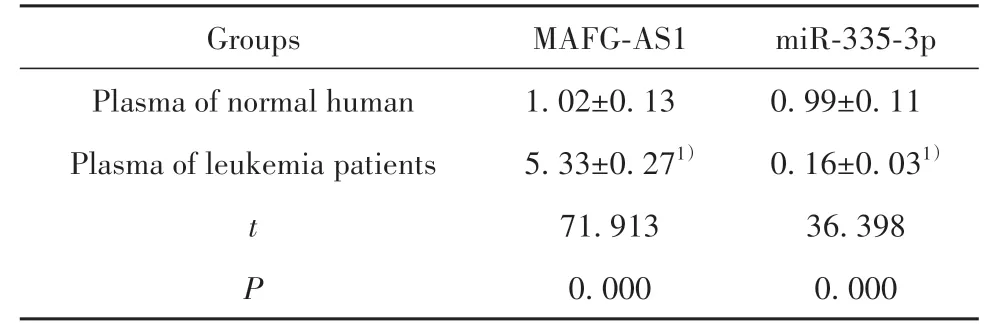
表1 检测白血病患者中MAFG-AS1、miR-335-3p表达(±s,n=25)Tab.1 Detection of MAFG-AS1 and miR-335-3p expres⁃sion in leukemia patients(±s,n=25)
Note:Compared with plasma of normal human group,1)P<0.05.
Groups Plasma of normal human Plasma of leukemia patients t P MAFG-AS1 1.02±0.13 5.33±0.271)71.913 0.000 miR-335-3p 0.99±0.11 0.16±0.031)36.398 0.000
2.2 各处理组中MAFG-AS1和miR-335-3p表达情况的检测与si-NC组相比,si-MAFG-AS1组MAFGAS1表达水平降低,miR-335-3p表达水平升高(P<0.05);与miR-NC组相比,miR-335-3p组miR-335-3p表达水平升高(P<0.05);与anti-miR-NC组相比,an⁃ti-miR-335-3p组miR-335-3p表 达 水 平 降 低(P<0.05);与si-MAFG-AS1组相比,si-MAFG-AS1+antimiR-335-3p组miR-335-3p表达水平降低(P<0.05,图1)。

图1 MAFG-AS1和miR-335-3p的表达Fig.1 Expression of MAFG-AS1 and miR-335-3p
2.3 各处理组中细胞活性的检测与si-NC组相比,si-MAFG-AS1组细胞活性降低(P<0.05);与miR-NC组相比,miR-335-3p组细胞活性降低(P<0.05);与anti-miR-NC组相比,anti-miR-335-3p组细胞活性升高(P<0.05);与si-MAFG-AS1组相比,si-MAFG-AS1+anti-miR-335-3p组细胞活性升高(P<0.05,图2)。
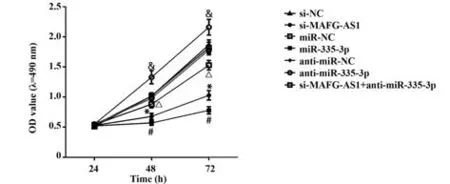
图2 各处理组细胞活性的检测Fig.2 Detection of cell viability in each treatment group
2.4 各处理组中凋亡率的检测与si-NC组相比,si-MAFG-AS1组细胞凋亡率升高(P<0.05);与miRNC组相比,miR-335-3p组细胞凋亡率升高(P<0.05);与anti-miR-NC组相比,anti-miR-335-3p组细胞凋亡率降低(P<0.05);与si-MAFG-AS1组相比,si-MAFG-AS1+anti-miR-335-3p组细胞凋亡率降低(P<0.05,图3、表2)。
表2 流式细胞仪检测各处理组细胞凋亡率(±s,n=3)Tab.2 Flow cytometry detection of apoptosis rate of each treatment group(±s,n=3)
Note:Compared with si-NC group,1)P<0.05;compared with miR-NC group,2)P<0.05;compared with anti-miR-NC group,3)P<0.05;compared with si-MAFG-AS1 group,4)P<0.05.
Groups si-NC si-MAFG-AS1 miR-NC miR-335-3p anti-miR-NC anti-miR-335-3p si-MAFG-AS1+anti-miR-335-3p F P Apoptosis rate(%)8.63±0.22 21.44±0.831)8.54±0.38 24.70±0.992)8.75±0.37 3.60±0.383)13.57±0.614)491.787 0.000

图3 细胞凋亡率的检测Fig.3 Detection of cell apoptosis rate
2.5 MAFG-AS1靶向miR-335-3p关系的验证DI⁃ANA Tools预测显示MAFG-AS1和miR-335-3p有互补序列(图4)。Wt-MAFG-AS1与miR-335-3p共转染的细胞荧光素酶活性降低,而Mut-MAFG-AS1与miR-335-3p共转染的细胞荧光素酶活性无显著变化(表3)。

图4 MAFG-AS1和miR-335-3p的互补序列Fig.4 Complementary sequence of MAFG-AS1 and miR-335-3p
表3 荧光素酶活性的检测(±s,n=3)Tab.3 Detection of luciferase activity(±s,n=3)
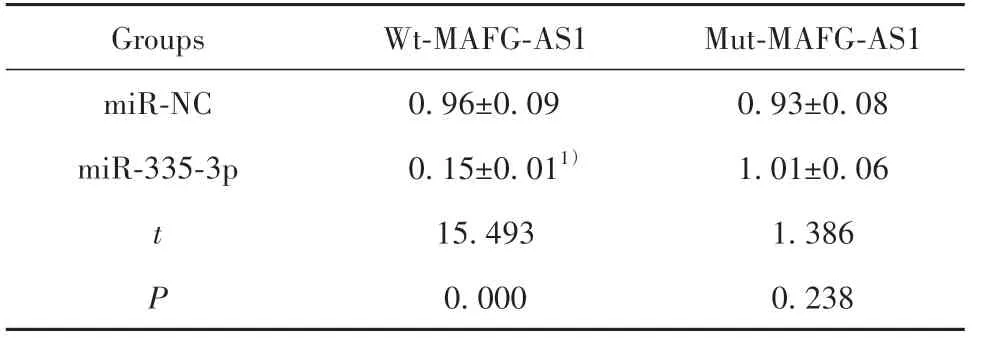
表3 荧光素酶活性的检测(±s,n=3)Tab.3 Detection of luciferase activity(±s,n=3)
Note:Compared with miR-NC group,1)P<0.05.
Groups miR-NC miR-335-3p t P Wt-MAFG-AS1 0.96±0.09 0.15±0.011)15.493 0.000 Mut-MAFG-AS1 0.93±0.08 1.01±0.06 1.386 0.238
2.6 各处理组中凋亡蛋白表达的检测与si-NC组相比,si-MAFG-AS1组Bax表达水平升高,Bcl-2表达水平降低(P<0.05);与miR-NC组相比,miR-335-3p组Bax表达水平升高,Bcl-2表达水平降低(P<0.05);与anti-miR-NC组相比,anti-miR-335-3p组Bax表达水平降低,Bcl-2表达水平升高(P<0.05);与si-MAFG-AS1组相比,si-MAFG-AS1+anti-miR-335-3p组Bax表达水平降低,Bcl-2表达水平升高(P<0.05,图5、表4)。
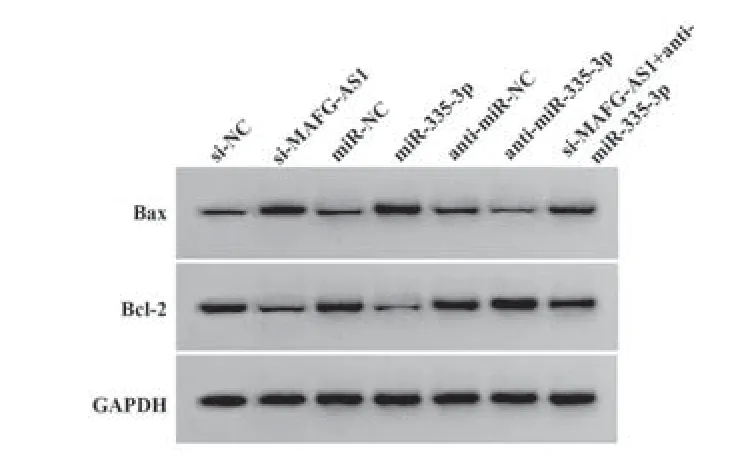
图5 Western blot检测Bax和Bcl-2蛋白表达Fig.5 Western blot detection of Bax and Bcl-2 protein expression
表4 Western blot检测各处理组细胞中Bax和Bcl-2蛋白表达(±s,n=3)Tab.4 Western blot detection of Bax and Bcl-2 protein expressions in cells of each treatment group(±s,n=3)
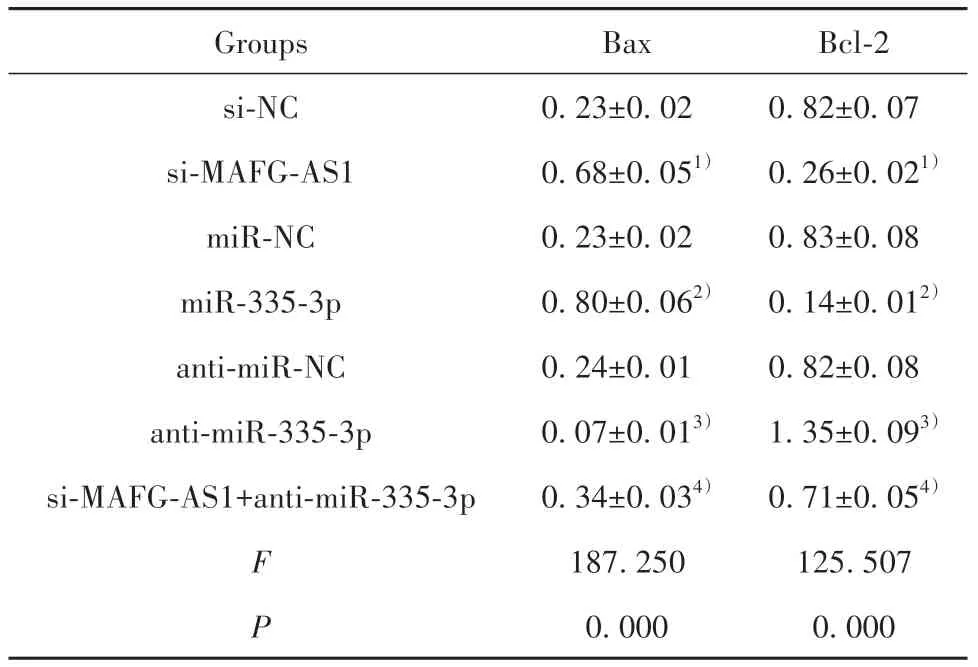
表4 Western blot检测各处理组细胞中Bax和Bcl-2蛋白表达(±s,n=3)Tab.4 Western blot detection of Bax and Bcl-2 protein expressions in cells of each treatment group(±s,n=3)
Note:Compared with si-NC group,1)P<0.05;compared with miR-NC group,2)P<0.05;compared with anti-miR-NC group,3)P<0.05;compared with si-MAFG-AS1 group,4)P<0.05.
Groups si-NC si-MAFG-AS1 miR-NC miR-335-3p anti-miR-NC anti-miR-335-3p si-MAFG-AS1+anti-miR-335-3p F P Bax 0.23±0.02 0.68±0.051)0.23±0.02 0.80±0.062)0.24±0.01 0.07±0.013)0.34±0.034)187.250 0.000 Bcl-2 0.82±0.07 0.26±0.021)0.83±0.08 0.14±0.012)0.82±0.08 1.35±0.093)0.71±0.054)125.507 0.000
3 讨论
非编码RNA在淋巴细胞白血病的发生和发展中起主要作用,作为潜在的生物标志物和治疗靶标用于淋巴细胞白血病的靶向治疗[11-12]。lncRNA作为非编码RNA的一种,参与调控淋巴细胞白血病的进展,如lncRNA-H19通过靶向miR-29a-3p促进急性髓性白血病细胞增殖,但抑制细胞凋亡[13]。lnc-RNA ANRIL可促进成人T细胞白血病细胞的增殖[14]。MAFG-AS1作为lncRNA的一种,已有研究报道MAFG-AS1可调控结直肠癌、卵巢癌及宫颈癌细胞的增殖和凋亡[15-17]。而MAFG-AS1对淋巴细胞白血病的影响尚不清楚。本实验结果显示,白血病患者血浆中MAFG-AS1表达水平升高;干扰MAFGAS1后,淋巴细胞白血病细胞的活性降低,凋亡率升高,Bax表达水平升高,Bcl-2表达水平降低,表明干扰MAFG-AS1可抑制淋巴细胞白血病细胞的增殖,促进细胞凋亡。
研究报道miR-335-3p靶向COPB2促进肺腺癌NCI-H1975细胞的凋亡,抑制细胞迁移和增殖[18]。CASC9可以通过miR-335-3p/S100A14轴促进非小细胞肺癌进展[19]。本实验结果显示,白血病患者血浆中miR-335-3p表达水平降低,过表达miR-335-3p可降低细胞活性,提高细胞凋亡率,表明过表达miR-335-3p可抑制淋巴细胞白血病细胞的增殖,促进细胞凋亡。而抑制miR-335-3p表达与过表达miR-335-3p的作用相反。且本实验还发现MAFGAS1靶向负调控miR-335-3p,抑制miR-335-3p表达减弱了干扰MAFG-AS1对淋巴细胞白血病细胞增殖和凋亡的影响。
综上所述,干扰MAFG-AS1通过靶向上调miR-335-3p抑制淋巴细胞白血病细胞的增殖,促进细胞凋亡。