基于高效液相色谱-三重四极杆质谱联用方法评价透析器对蛋白结合类尿毒症毒素的清除效果
2023-01-24牟倡骏张洁敏王禹峰江君杰
牟倡骏,许 洁,张洁敏,王 磊,王禹峰,江君杰
(山东威高血液净化制品股份有限公司,山东 威海 264200)
2020年国际肾脏病学会和国际肾脏基金联合会公布的一项数据显示,全球约有十分之一的成年人患有慢性肾脏病,预计到2040年该病将成为全世界第五大死亡原因[1]。慢性肾衰竭是其发展到后期的一种临床综合征,主要有肾小球滤过率下降、水电解质和酸碱平衡失调以及代谢产物潴留等临床表现[2]。这些代谢产物通常称为尿毒症毒素,根据生化特征及清除方式,可分为三大类:小分子物质(< 500 Da)、中分子物质(> 500 Da)和蛋白结合类毒素(PBUTs)[3]。硫酸吲哚酚(IS)、硫酸对甲酚(PCS)和马尿酸(HA)是PBUTs的主要代表物质,它们与心血管疾病和肾功能损伤具有高度相关性,容易诱发多种并发症[4-7]。提高透析器对PBUTs的清除效果,已成为血液净化领域关注的重点[4]。目前因缺乏简单有效的PBUTs检测方法,透析器的清除性能仅通过部分中小分子毒素进行评价,并未将PBUTs作为指标性物质[8-9]。因此,建立一种评价透析器对PBUTs清除效果的方法,对于开发具有高效清除性能的产品,提高透析患者的生存质量具有重要意义。
高效液相色谱-串联质谱具有样品用量少、检测灵敏度高、定量准确等优点[10-11],已逐渐成为生物样品分析的主要技术手段[12-13],被广泛应用于透析患者血液中PBUTs的定量检测[14-20]。Prokopienko等[18]建立了一种同时测定患者血清中4种肠源性尿毒症毒素的超高效液相色谱-串联质谱方法。Wang等[20]建立了一种同时测定腹膜透析患者血清中8种PBUTs的超高效液相色谱-串联三重四极杆质谱方法,医生通过患者体内PBUTs的浓度评估其发生并发症的可能性,但该方法准确度均较低,HA的准确度只有60%左右。上述文献报道只是将高效液相色谱-串联质谱法应用于患者体内PBUTs的浓度检测,在体外评价透析器对PBUTs清除效果方面的应用尚未见报道。
本研究以与透析患者体内PBUTs浓度相当的牛血清白蛋白水溶液作为模拟液代替血液,不仅降低了实验成本,而且有效解决了临床血液样品来源困难以及因患者个体差异导致样品不平行的问题,采用一步沉淀蛋白的前处理方法和高效液相色谱-三重四极杆质谱联用检测技术,建立了一种同时评价透析器对IS、P-CS和HA 3种PBUTs清除效果的分析方法。该方法应用于透析前后模拟液中PBUTs浓度的检测,3种待测物质均可在10 min内出峰,具有快速、准确、灵敏等优势,为透析器研发阶段的测试以及临床处方的选择提供了技术支持。
1 实验部分
1.1 仪器与试剂
Thermo Vanquish色谱仪、Thermo TSQ Quantis三重四极杆质谱仪(美国Thermo公司);DV215CD电子分析天平(美国OHAUS公司);Centrisart G-16C冷冻离心机(德国Sartorius公司);Milli-Q10纯水系统(美国Millipore公司);KQ-500DB超声仪(昆山市超声仪器有限公司);VORTEX1涡旋振荡器(德国IKA公司);超滤离心管(10 kDa,德国Sartorius公司)。
硫酸吲哚酚盐(97%,美国Sigma公司);马尿酸(98%,美国Sigma公司);硫酸对甲酚盐(≥ 98%,日本TCI公司);3-吲哚基硫酸盐-D4钾盐(IS-D4,> 95%,百灵威科技有限公司);乙酸铵、甲醇、乙腈(色谱纯,美国Sigma公司);牛血清白蛋白(广州蕊特生物科技有限公司);实验用水为Milli-Q10超纯水机制备的超纯水。
1.2 标准溶液的配制
混合标准工作液:精密称取IS、P-CS、HA标准品各10 mg,分别用甲醇溶解并定容至10 mL,得到质量浓度为1 mg∕mL的标准储备液。分别取上述标准储备液适量,用水配制成2.5、5.0、10、25、50、75、100 µg∕mL的混合标准工作液,于-20 ℃保存备用。
内标标准储备液:精密称取IS-D4标准品2.5 mg,用甲醇配制成质量浓度为1 mg∕mL的储备液。取上述储备液适量,用水配制成10 µg∕mL的内标工作液,于-20 ℃保存备用。
1.3 模拟液的制备
称取适量的牛血清白蛋白,用水配制成质量浓度为50 g∕L的蛋白水溶液;称取适量的IS、P-CS、HA标准品加入上述溶液,使其质量浓度分别为30、40、50 µg∕mL,37 ℃水浴,磁力搅拌4 h,即得模拟液。同法平行制备12份。
1.4 样品前处理
参照透析器的临床使用说明,按照图1连接透析器、体外循环血路和透析设备。通过滚压泵将模拟液引入整个系统,设定模拟液流量(QB)为200 mL∕min,透析液流量(QD)为500 mL∕min,脱水量(QF)为10 mL∕min,循环10 min后,分别在透析器血液入口和出口处取样作为待测样品。
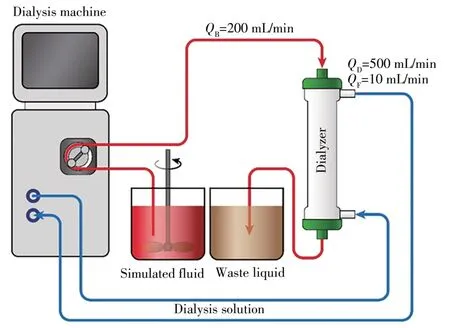
图1 模拟血液透析示意图Fig.1 Schematic diagram of simulated hemodialysis
游离蛋白结合类毒素样品配制:取200 µL样品置于超滤离心管(2 mL,10 kDa)中,4 ℃下14 000 r∕min离心10 min;弃去套管,取滤液10 µL,置于2 mL EP管中,加10 µL内标工作液和980 µL超纯水,涡旋1 min,取10 µL混合溶液上机。
总蛋白结合类毒素样品配制:取50 µL样品加入50 µL水和50 µL内标工作液,涡旋1 min,加入350 µL乙腈,涡旋2 min,4 ℃下14 000 r∕min离心10 min;取100 µL上清液,置于2 mL EP管中,加入900 µL水,涡旋1 min,取10 µL混合溶液上机。
1.5 色谱条件
色谱柱:Hypersil GOLD VANQUISH C18(100 mm × 2.1 mm,1.9 µm);流动相:A为5 mmol∕L乙酸铵溶液,B为甲醇;梯度洗脱:0 ~ 2 min,20% B;2 ~ 8 min,20% ~ 80% B;8 ~ 10 min,80% B;10 ~10.1 min,80% ~ 20% B;10.1 ~ 15 min,20% B。柱温:30 ℃;流速:0.2 mL∕min;进样量:10 µL。
1.6 质谱条件
Thermo TSQ Quantis三重四极杆质谱仪;电喷雾离子源(ESI),喷雾电压:3 000 V,鞘气流速:4.58 L∕min,辅气流速:10.08 L∕min,毛细管温度:325 ℃,负离子扫描模式,选择反应监测(SRM);各物质的质谱参数见表1。
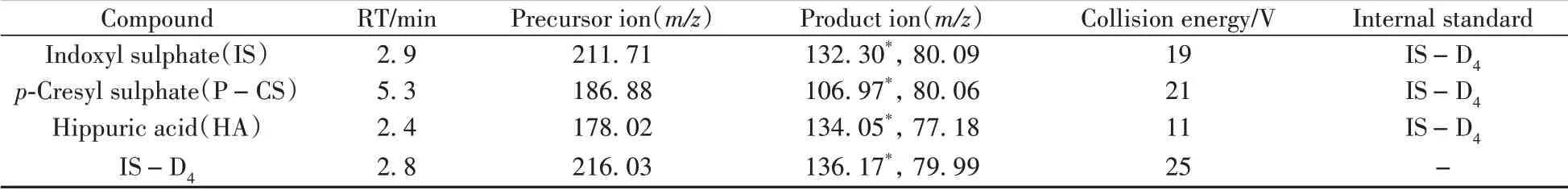
表1 3种PBUTs的保留时间(RT)与质谱参数Table 1 Retention times(RT) and mass spectrometric parameters of 3 PBUTs
2 结果与讨论
2.1 模拟液制备条件的优化
本研究选择含有适量PBUTs的牛血清白蛋白溶液模拟患者血液进行实验。参照文献[15],透析患者体内HA的含量最高,其次是P-CS和IS,且质量浓度均在30 ~ 50 µg∕mL范围内,因此本实验配制的模拟液中IS、P-CS和HA的质量浓度分别设定为30、40、50 µg∕mL。文献报道成人血液中白蛋白的质量浓度在35 ~ 50 g∕L范围内[21],为最大程度接近人体血液中PBUTs的蛋白结合率水平,因此考察了牛血清白蛋白质量浓度(40、50 g∕L)和反应时间(2、4、8 h)对IS、P-CS、HA蛋白结合率的影响。由图2可知,当牛血清白蛋白质量浓度为50 g∕L时,加入IS、P-CS、HA,37 ℃下反应4 h,其蛋白结合率最接近透析患者血液中的水平(IS、P-CS、HA的蛋白结合率分别为90%、95%、45%)[15,22]。基于上述考察,实验最终选择此条件制备模拟液。
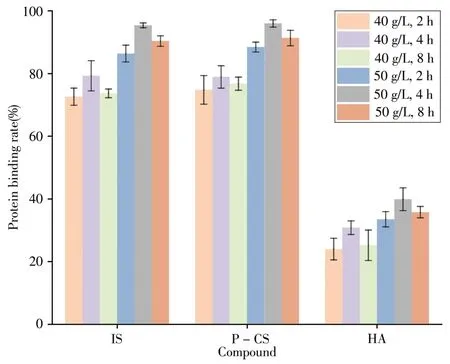
图2 牛血清白蛋白质量浓度和反应时间对IS、P-CS、HA蛋白结合率的影响Fig.2 Effects of concentrations of bovine serum albumin and reaction times on the protein binding rate of IS,P-CS and HA
2.2 前处理条件的优化
沉淀蛋白最常用的方法是盐析法和有机试剂沉淀法[23]。盐析法会将高浓度不挥发性的盐引入样品中,干扰质谱检测,因此选择乙腈进行蛋白沉淀处理。本研究进一步比较了样品稀释和沉淀的先后顺序对检测结果的影响,结果表明,先稀释样品再经乙腈沉淀蛋白后直接上机检测,干扰峰较多、峰形分叉;而先经乙腈沉淀蛋白再用水稀释后上机检测,峰形尖锐、干扰少,且IS、P-CS、HA的回收率为97.1% ~ 112%,故选择后者作为最终的样品前处理方法。
2.3 色谱条件的优化
分别考察了水-甲醇、水-乙腈、5 mmol∕L乙酸铵-甲醇和5 mmol∕L乙酸铵-乙腈4种流动相体系的分离效果。结果表明,有机相为乙腈时,其洗脱能力过强,导致待测物的保留时间过于集中,色谱峰不能完全分离。由于3种待测PBUTs是带有磺酸或羧酸官能团的化合物,在流动相中加入一定量的乙酸铵,可提高待测物的离子化效率,有利于峰形的改善。经综合比较,确定流动相为5 mmol∕L乙酸铵溶液-甲醇,通过优化梯度洗脱程序,减少了色谱峰拖尾现象,实现了待测物的快速分离和高信号响应。3种PBUTs和IS-D4的提取离子流色谱图如图3所示。
2.4 质谱条件的优化
采用注射泵方式以5 µL∕min流速将1 µg∕mL的IS、P-CS、HA和IS-D4混合标准溶液注入质谱仪。由于待测化合物含有磺酸基或羧基,因此选择负离子模式进行一级质谱Q1全扫描,以确定其母离子;然后进行二级质谱扫描,每种化合物选择2个特征碎片离子分别作为定性和定量离子。3种PBUTs的子离子扫描质谱图见图4。在SRM监测模式下,对各项质谱参数进行优化,使目标分析物的离子信号达到最佳。根据IS、P-CS、HA和IS-D4的特征碎片离子丰度确定最佳碰撞能量(CE),优化后的质谱参数见表1。
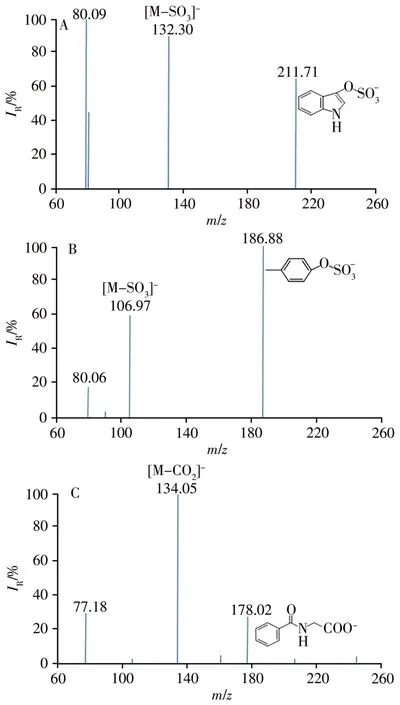
图4 3种PBUTs的子离子扫描质谱图Fig.4 Product ion mass spectra of 3 PUBTs
2.5 蛋白结合率
蛋白结合率(B%)根据下式计算:
式中,Cs和Cf分别代表模拟液中溶质的总质量浓度和游离溶质的质量浓度(µg∕mL),均由优化后的色谱质谱条件测得。经计算,根据“1.3”方法所制备的12份模拟液中,IS、P-CS和HA的蛋白结合率分别为90% ± 3%、93% ± 3%和40% ± 5%,与血液透析患者体内的蛋白结合率基本一致[15,22]。因此,本实验配制的模拟液可以代替血液进行模拟透析实验。
2.6 专属性
将空白模拟液经前处理后得到空白模拟液样品,添加IS、P-CS、HA和IS-D4的混合标准工作液上机测试。结果显示,所有目标化合物的峰形尖锐对称,分离良好;P-CS的保留时间处有干扰物质,但该杂质的响应低于定量下限20%,不影响定量[24],其余目标化合物的出峰时间附近无干扰峰,说明该方法具有良好的专属性。
2.7 线性关系与定量下限
空白模拟液经处理后得到空白基质溶液,以此溶液稀释混合标准工作液得到质量浓度分别为25、50、100、250、500、750、1 000 ng∕mL的混合标准溶液,IS-D4的质量浓度为100 ng∕mL,在优化的色谱-质谱条件下进行测定,以各待测物和内标物的峰面积比值为纵坐标(y),以对应的质量浓度为横坐标(x,ng∕mL)进行线性回归(加权系数1∕x2)。如表2所示,3种PBUTs在25 ~ 1 000 ng∕mL范围内均呈良好线性关系,相关系数(r)大于0.99。根据信噪比(S∕N)大于10,确定IS、P-CS、HA的定量下限均为25 ng∕mL。

表2 3种PBUTs的线性范围、线性方程及相关系数Table 2 Linear ranges,linear equations and correlation coefficients of 3 PBUTs
2.8 准确度与精密度
为验证前处理方法对3种PBUTs定量检测的可靠性,选择空白基质溶液进行低(75 ng∕mL)、中(250 ng∕mL)、高(750 ng∕mL)3个浓度水平的加标回收实验(n= 3)。其中,中浓度样品平行配制6份,以相对标准偏差(RSD)作为日内精密度;该浓度样品连续测定3 d,计算RSD,作为日间精密度,结果见表3。3种PBUTs的平均回收率为92.5% ~ 114%,日内、日间RSD为1.6% ~ 3.5%,本方法的准确度和精密度均满足实际样品分析要求,可用于透析前后模拟液中PBUTs的定量检测。
2.9 基质效应
当采用质谱方法检测生物样品时,常出现较严重的基质干扰,因此应考察基质效应。以超纯水配制的IS、P-CS和HA混合标准溶液作为溶剂样品;空白基质配制的IS、P-CS和HA混合标准溶液作为基质样品;将IS、P-CS和HA混合标准溶液加入空白模拟液进行处理后得到的样品溶液作为处理样品。将上述样品的响应值(A)进行比较,基质效应(ME) =A基质样品∕A溶剂样品× 100%,提取回收率 =A处理样品∕A基质样品×100%,结果如表3所示。IS、P-CS和HA的基质效应为80.6% ~ 105%,提取回收率为95.0% ~ 113%,表明基质不影响PBUTs的检测,可以满足测定要求。
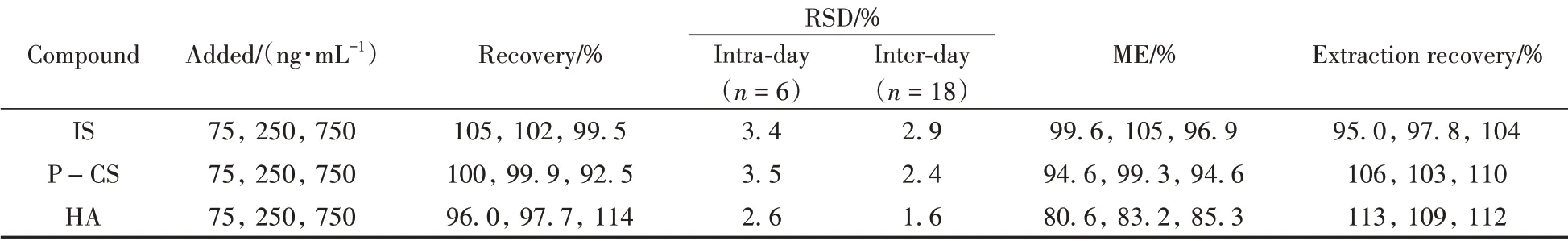
表3 3种PBUTs的回收率、相对标准偏差、基质效应和提取回收率Table 3 Recoveries,relative standard deviations,matrix effects and extraction recoveries of 3 PBUTs
2.10 实际样品分析
选取12支市售的同一规格高通量透析器进行透析模拟实验,采用本方法对透析前后模拟液中PBUTs的浓度进行测定,根据测定结果计算清除率。结果显示,3种PBUTs的清除率平行性均较好,RSD小于10%。表明该方法能够快速、准确地评估透析器对PBUTs的清除效果。
3 结 论
本文基于高效液相色谱-三重四极杆质谱联用技术,以含有适当浓度PBUTs的牛血清白蛋白水溶液作为模拟液,采用有机溶剂沉淀蛋白和超滤离心前处理方法,建立了可同时评价透析器对3种PBUTs清除效果的方法。该方法前处理简单、成本低廉、回收率高、重复性好,一次测定即可完成透析器对3种PBUTs清除效果的评价,可为血液净化行业研发具有高效清除性能的透析器提供技术支持。
