miR-203a-3p抑制人肝癌细胞系增殖
2023-01-18黄驿胜叶启文王竞枫
黄驿胜,叶启文,王竞枫
宁德市闽东医院 1.普通外科; 2.心血管内科,福建 宁德 352000
肝细胞癌(hepatocellular carcinoma, HCC)是世界上常见的癌之一,亚洲和非洲的发病率最高[1]。微小RNAs(microRNAs,miRNAs)在调节癌细胞的增殖、迁移、存活和化疗敏感性中发挥重要作用[2]。MRNAs在癌诊断及预后中的潜在应用前景仍很乐观,但其价值仍有待确定,其促进或抑制肿瘤发生的潜在机制尚不完全清楚。MiRNA是HCC发展和进展的关键参与者和调节因子,在HCC中miRNAs的关键调控过程包括增殖、凋亡、侵袭、转移、上皮细胞间充质转化(epithelial-mesenchymal transition,EMT)、血管生成、耐药和自噬[3]。既往研究证实miR-203a-3p在许多肿瘤中表达水平低,它可以调节肿瘤细胞的分化、增殖和凋亡,并通过调控靶基因参与肿瘤细胞的侵袭转移[4]。本研究采用慢病毒感染模型实现HepG2细胞中miR-203a-3p的过表达,分析miR-203a-3p对HepG2细胞增殖、凋亡、克隆和迁移的影响,以及对HCC细胞基因表达谱的影响,为miR-203a-3p在HCC中的功能研究及其在细胞癌变中的相关机制提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞及试剂:人肝癌细胞系(HepG2、Huh7、SMMC-7721、Bel-7402)和正常人肝细胞系(LO2)(中国科学院生物化学与细胞生物学研究所);DMEM高糖培养基、胎牛血清(FBS)、100 U/mL青霉素和100 mol/mL链霉素、Trizol试剂和第一链cDNA合成试剂盒(赛默飞世尔科技(中国)有限公司);FFPE RNA 纯化试剂盒(Norgen Biotek公司);RNAiso小RNA提取试剂[宝日医生物技术(北京)有限公司];SYBR select master mix试剂盒(Hoffmann-La Roche有限责任公司);转化生长因子-β1(transforming growth factor-β1, TGF-β1)ELISA试剂盒(R&D Systems公司);全蛋白提取试剂盒、BCA(2,2-Biquinoline-4,4-dicarboxylic acid二钠盐)蛋白质含量试剂盒和电化学发光 (electrochemiluminescence, ECL)检测试剂盒(江苏凯基生物技术股份有限公司);抗TGF-β1和抗GAPDH单克隆抗体(Cell Signaling Technology公司);抗TGFβR1单克隆抗体[艾博抗(上海)贸易有限公司];3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di-phenytetrazoliumromide, MTT)细胞增殖试剂盒(北京索莱宝科技有限公司);细胞凋亡检测试剂盒(上海贝博生物公司);人源TGF-β1重组蛋白(亚诺法生技股份有限公司);引物(是生工生物技术有限公司);miR-203a-3p慢病毒载体(上海汉恒生物技术有限公司)。
1.1.2 组织标本:HCC组织标本取自2017年12月至2019年6月,宁德市闽东医院病理科石蜡包埋块,HCC及邻近非肿瘤标本30例。所有标本均经免疫组织化学验证,并按原发灶(tumor,T),淋巴结(node,N),远处转移(metastasis,M)分期进行特征分析。本研究经宁德市闽东医院伦理委员会批准(批准号20170111),肝癌临床标本石蜡块的使用告知患者,并签署知情同意书。
1.2 方法
1.2.1 细胞的分组及处理:所有的细胞在37 ℃、5% CO2的DMEM高糖培养基中培养,培养基中添加10%胎牛血清(FBS)、100 U/mL青霉素和100 mg/mL链霉素,将细胞分为:HepG2细胞对照组(Ctrl)、慢病毒空质粒组(NC),慢病毒miR-203a-3p过表达组(OP),TGF-β1处理组(TGF-β1),TGF-β1联合miR-203a-3p过表达处理组(OP+TGF-β1)。
1.2.2 慢病毒感染与稳定细胞株的筛选:取出-80 ℃保存的病毒,放在冰上慢慢融化。病毒准备好之后,从培养箱中拿出已贴壁的细胞,各孔更换新鲜完全培养基后,向各组细胞中加入计算好的病毒液,HepG2细胞的感染复数(multiplicity of infection, MOI)值为30。摇动培养板,轻轻混匀,37 ℃、5% CO2培养24 h。弃去含病毒液的培养基上清,更换为完全培养基。37 ℃、5% CO2条件下继续培养。以嘌呤霉素(6 μg/mL)完成筛选,建立稳定表达miR-203a-3p的细胞株用于后续实验。
1.2.3 TGF-β1干预细胞模型:从培养箱中拿出已贴壁的细胞,更换新鲜完全培养基后,向各组细胞中加入含有TGF-β1(终浓度为10 mg/L,浓度的选择参考文献[5])的新鲜完全培养基,摇动培养板,轻轻混匀,37 ℃、5% CO2培养。每隔24 h弃去培养基,更换含TGF-β1的完全培养基,直至实验结束。
1.2.4 RT-qPCR检测miR-203a-3p及mRNA的表达:按照Norgen FFPE RNA提取试剂盒提取石蜡组织中的总RNA,按照RNAiso小RNA提取试剂说明书,提取细胞的小RNA。通过茎环引物对miR-203a-3p进行反转录,引物序列为:5′-CTCAACT GGTGTCGTGGAGTCGGCAATTCAGTTGAGCTAGTG GT-3′。以U6(内参基因)的反转录作为下游引物。使用反转录酶说明书对分离的小RNA进行反转录。miR-203a-3p检测引物上游序列为5′-ACACTCCA GCTGGCGTGAAATGTTTAGG-3′,下游序列为常规序列5′-TGGTGTCGTGGAGTCG-3′。U6检测引物上游序列为5′-CTCGCTTCGGCAGCACA-3′,下游序列为5′-AACGCTTCACGAATTTGCGT-3′。
使用Trizol试剂从细胞中提取总RNA,使用第一链cDNA合成试剂盒完成mRNA的反转录。RT-PCR使用SYBR select master mix试剂盒进行。针对目的基因的引物(表1)。RT-qPCR在平行实验中,每个样本检测3次,GAPDH作为内对照。采用相对定量2-ΔΔCt法检测mRNA表达水平。
1.2.5 Western blot 检测TGF-β1蛋白的表达:用全细胞裂解法提取总蛋白质。用BCA试剂盒测定蛋白质浓度。每个分组的总蛋白用12%的SDS-PAGE分离胶完成垂直电泳,然后转移到PVDF膜上,5%脱脂牛奶进行封闭,清洗后采用鼠抗人TGF-β1(1∶2 000)、鼠抗人GAPDH(1∶5 000)单克隆抗体进行孵育,羊抗鼠二抗(1∶5 000)单克隆抗体进行孵育,以ECL发光试剂盒进行可视化发光成像。最后,使用化学发光检测系统完成成像和吸光度值分析。
1.2.6 ELISA检测TGF-β1的分泌情况:收集细胞培养上清,2 000 r/min离心5 min,取200 μL上清,以TGF-β1 ELISA 试剂盒,按照按说明书建立标准曲线,从而定量测定TGF-β1含量水平。
1.2.7 MTT法实验检测细胞增殖:用MTT细胞增殖试剂盒,按照说明书进行。细胞的增殖率以A450 nm的数值进行相互比较。
1.2.8 平板集落实验检测细胞集落形成:各组细胞接种到6孔板中,400个细胞/孔。将平板置于细胞培养接种器中培养1周至集落形成。用迪夫快速染色液固定细胞。最后对集落数量进行统计分析。集落形成率(%)=(细胞集落数/每孔细胞数)×100%。
1.2.9 划痕实验检测细胞迁移:各组细胞在对数增殖期转移到12孔培养板。12 h后将细胞贴壁,用200 μL移液管尖在培养孔中线进行划痕处理。分别于12 h和48 h用光学显微镜进行成像。观察两侧细胞的增殖和迁移情况,以划痕宽度作为检测值,评估偏移率。
1.2.10 流式细胞测量术检测细胞凋亡:取对数期细胞接种于6孔培养板,每孔以1×106个贴壁。然后每孔加入3 mL培养液,待底部区域细胞增殖达到90%汇合时进行实验。使用凋亡检测试剂盒,按照说明书在流式细胞仪中完成实验。
1.2.11 表达谱芯片检测差异mRNA的表达: 人源表达谱芯片检测由上海康成生物技术有限公司完成,合计6份样本,包括3份HepG2细胞及和3份miR-203a-3p过表达的HepG2细胞。使用NanoDrop ND-1000对每个样本的总RNA进行定量,Arraystar Flash RNA标记协议(Arraystar)扩增每个样本的总RNA并转录成荧光cRNA。将标记的cRNA杂交到安捷伦人基因组表达谱芯片阵列(4×44K)上。洗片,用芯片扫描仪GenePix 4000B对阵列进行扫描,Agilent Feature Extraction软件(version 11.0)对获取的阵列图像进行分析。采用R软件limma软件包进行分位数归一化和后续数据处理。通过火山图过滤,筛选出两组间差异有统计学意义的mRNA。通过Fold Change filtering识别两个样本间差异表达的mRNA。

表1 引物序列Table 1 Primer sequence
1.3 统计学分析
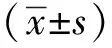
2 结果
2.1 miR-203a-3p在细胞和临床标本中的表达
miR-203a-3p在HCC中的表达水平低于癌旁组织(P<0.001)(图1A)。miR-203a-3p在TNM期HCC患者中的表达水平明显低于Ⅰ期和Ⅱ期(P<0.001)(图1B)。miR-203a-3p在HepG2细胞中表达水平最低 (图1C),选择HepG2细胞进行后续的细胞实验。HepG2细胞感染miR-203a-3p慢病毒颗粒后,miR-203a-3p的表达显著高于对照组(P<0.001)(图1D)。
2.2 miR-203a-3p对HepG2细胞增殖、凋亡和迁移的影响
相比于对照组, OP组细胞在24、48、72和96 h时增殖均降低(P<0.05)(图2A);OP组细胞的迁移能力降低(P<0.05)(图2B);OP组集落形成能力降低(P<0.001)(图2C);OP组细胞凋亡显著增加 (P<0.05)(图2D)。
2.3 miR-203a-3p过表达对HepG2细胞中TGF-β1及其TGFβR1表达的影响
相比于对照组,CD27等12个基因表达升高(P<0.05),MMP7等7个基因表达降低(P<0.05) (图3A),关注一对配体TGF-β1及其受体TGFβR1基因的表达;相比于Ctrl组,OP组TGF-β1 mRNA表达降低(P<0.05),而转化生长因子β受体1(transforming growth factor beta receptor 1,TGFβR1)mRNA表达升高(P<0.05)(图3B);OP组TGF-β1在细胞培养上清中含量明显降低(P<0.05)(图3C);OP组TGF-β1表达降低(P<0.05),而TGFβR1表达升高(P<0.05) (图3D,E)。
2.4 TGF-β1联合miR-203a-3p对HepG2细胞增殖和迁移的影响
相比于OP组, OP+TGF-β1组在48、 72和96 h时细胞增殖能力上升(P<0.05)(图4A);OP+TGF-β1组48 h细胞迁移能力上升(P<0.05)(图4B,C)。

A.expression of miR-203a-3p in 30 patients with HCC was significantly lower than that in 30 cases of adjacent tissues; B.expression of miR-203a-3p was negatively correlated with histological grade; C.expression of miR-203a-3p was in expression in HCC cells (LO2, HepG2, Huh7, SMMC-7721 and Bel-7402); D.RT-qPCR verified miR-203a-3p over-expression; *P<0.05 compared with tumor, grade and Ctrl group

A.HepG2 cell proliferation test; B.HepG2 cell scratch test; C.HepG2 cell colony formation test; D.HepG2 cell apoptosis test; *P<0.05 compared with Ctrl group
3 讨论
研究表明,miR-203在HCC中表达下调,高表达miR-203是HCC手术后预后良好的独立预测因子[6]。在本研究中,收集临床HCC的癌及癌旁的成对标本,分析miR-203a-3p在癌及癌旁肿瘤中的表达模式。结果显示miR-203a-3p在HCC中低表达,且与HCC的进展和分期呈负相关,这与报道的结果一致。然而miR-203 的表达也被描述为在几种癌中上调,例如结肠癌[7]和胰腺癌[8]。miR-203 在癌发展中的这些相互矛盾的结果可能是由于 miRNA表达的特定特征,其根据癌类型而变化。
miR-203在多个癌中发挥抑制功能。研究显示miR-203的模拟物可以抑制食道癌细胞增殖和侵袭能力[9]。miR-203可以抑制前列腺癌细胞增殖和迁移[10],其过表达促进前列腺癌细胞凋亡[11]。miR-203 还可抑制乳腺癌细胞的活力、迁移和侵袭[12]。在HCC中,已有研究表明miR-203 在体外抑制 HCC 细胞的迁移、侵袭和增殖[13]。本文以miR-203a-3p过表达HepG2细胞作为研究模型,证实miR-203a-3p降低增殖能力和迁移能力,促进凋亡效应和削弱集落形成能力,这与报道一致,充分证实 miR-203a-3p在HCC中发挥类似抑癌基因的功能。
一般来说,miR-203在转录后调控基因表达,并对信号分子发生反应,从而发挥影响癌细胞表现变化的功能。本研究通过表达谱芯片发现TGF-β信号通路相关的TGF-β1及其TGFβR1基因表达差异较大。TGF-β1是肿瘤微环境(tumor microenviron-ment,TME)内多种细胞产生的,负责调控肿瘤微环境内的细胞活性。免疫组化检测显示,TGF-β1蛋白在肝癌组织中的表达明显高于腹膜肝组织, TGF-β1mRNA表达的表达水平亦明显低于腹膜肝组织[14]。有趣的是,本文发现细胞内TGF-β1蛋白表达降低,细胞外培养上清中TGF-β1蛋白含量降低这说明miR-203a-3p可以降低HepG2细胞中TGF-β1蛋白的表达。TGFBR1是TGF-β1的受体膜基因,TGF-β1驱动细胞后,TGFBR1介导SMAD2/3复合物磷酸化,影响下游通路。TGFBR1表达的增加可能是细胞的代偿作用,因为TGF-β1蛋白在细胞外的刺激减弱,细胞的代偿作用增加了TGF-β信号通路的能力。TGF-β信号通路在肝癌中又发挥着促癌机制[15]。本研究采用TGF-β1重组蛋白进行细胞培养的外在刺激,使得miR-203a-3p过表达的HepG2细胞部分恢复了细胞增殖和迁移能力。

A.heat map, red-labeled was over-expressed, green-labeled was down-regulated; B.RT-qPCR verified the expression of TGF-β1 and TGFβR1 mRNA; C.ELISA to detect TGF-β1 protein content in cell culture supernatant; D, E.Western blot to detect TGF-β1 and TGFβR1 protein expression level in cells; *P<0.05 compared with ctrl group
综上所述,miR-203a-3p在HCC中低表达,过表达miR-203a-3p可降低HepG2细胞增殖、集落形成,促进细胞凋亡,miR-203a-3p可以降低TGF-β1基因的表达水平,但是生物信息预测显示miR-203a-3p与TGF-β1 mRNA之间无靶向相关性,说明其抑制表达是间接作用。总之,miR-203a-3p是否通过TGF-β途径发挥抑癌功能的作用机制还要进一步探索。
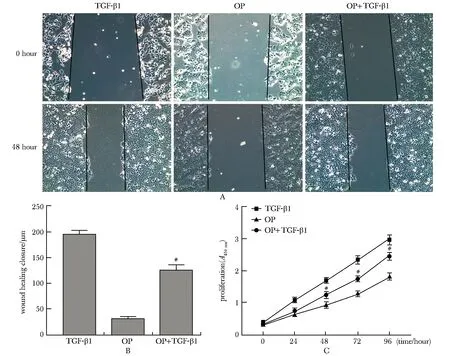
A.cell proliferation curve; B.cell migration histogram; C.cell scratch; # P<0.05 compared with OP group图4 TGF-β1联合miR-203a-3p过表达对HepG2细胞增殖和迁移的影响
