β-卡巴林类化合物的合成研究进展
2023-01-18宋鹏飞唐潇潇李伟泽
宋鹏飞,高 璐,唐潇潇,关 丽,李伟泽
(西安医学院药学院,陕西 西安 710021)
卡巴林是重要的芳香族杂环化合物,是一种吲哚类生物碱,其结构中含有三环吡啶并吲哚的母核。卡巴林化合物主要分为4类:α-卡巴林、β-卡巴林、γ-卡巴林、δ-卡巴林(图1)。自1841年从骆驼蓬中分离出第一个β-卡巴林化合物以来,β-卡巴林类化合物得到学者们的广泛关注[1-3]。以β-卡巴林结构为母核的化合物广泛存在于天然植物[4]、海洋生物[5]、菌类[6]等天然产物中。Kleks等[6]从海洋无脊椎动物文氏苔藓虫中提取纯化了2种新的β-卡巴林类化合物,发现其对恶性疟原虫3D7株具有抑制作用;Wu等[7]从骆驼蓬种子中分离得到6种新的β-卡巴林生物碱(Pegaharines A~G),其中Pegaharines D对单纯疱疹病毒2型(HSV-2)表现出很强的抗病毒活性,IC50值为(2.12±0.14) μmol·L-1。β-卡巴林类化合物对肿瘤[8-10]、精神疾病[11]等症表现出良好的药理活性。因此,β-卡巴林类化合物的合成和药理活性研究引起了人们的广泛关注。最常见的β-卡巴林类化合物合成方法是:以色胺或色氨酸为起始原料,与醛(Pictet-Spengler反应)或酸(Bischler-Napieralski反应)反应形成吡啶环,进而生成二氢或四氢-β-卡巴林,最后脱氢获得β-卡巴林类化合物[12]。近年来,随着研究的深入,也出现了一些新的合成方法。作者对β-卡巴林类化合物的合成研究进展进行综述,为探索便捷、实用、高效的β-卡巴林类化合物的合成路线提供参考。
1 β-卡巴林类化合物的药理活性
1.1 抗肿瘤活性
β-卡巴林类化合物具有良好的体内外抗肿瘤活性,可以与多种抗癌靶点相互作用[8](如插入DNA位点[13]),抑制拓扑异构酶活性[14]、抑制组蛋白和微管蛋白乙酰化[15-16]和损伤线粒体[17]等。β-卡巴林类化合物已成为合成各种抗癌活性剂的有前途的先导化合物[18]。
1.2 神经保护作用
阿尔茨海默病具有复杂的病因和多因素的病理背景,由于天然β-卡巴林显示出与神经递质结构的相似性,因此,可以利用β-卡巴林设计合成多靶点导向的衍生物,用于治疗阿尔茨海默病[19]。此外,β-卡巴林类化合物已被证实影响多种中枢神经系统靶点,如乙酰胆碱酶(AChE)[20-22]、单胺氧化酶(MAO)[23-24]、β-淀粉样蛋白[25-26]、tau蛋白[27]等,具有神经保护作用[25,28]。
1.3 其它药理活性
β-卡巴林类化合物还被证实具有抗疟疾[29-30]、抗菌[31-32]、抗病毒[33]等药理活性。此外,多种商业药物及其候选药物,如长春西汀(Vinpocetine)、溴长春胺(Brovincamine)、阿贝卡尼(Abecarnil)、西帕加明(Cipargamin)、他达拉非(Tadalafil)、利血平(Reserpine)、鲁宾联定(Lrbinectedin)和依托度(Eetodolac)等都含有β-卡巴林骨架[34-35]。
2 β-卡巴林类化合物的合成方法
由于β-卡巴林类化合物具有众多的药理活性,简单方便地合成β-卡巴林类化合物越来越受到重视,合成路线越来越多,如:Pictet-Spengler反应、Bischler-Napieralski反应、aza-Michael反应、Ullmann反应、Willgerodt-Kindler反应、金属(主要以钯为代表)催化合成反应、酶催化反应等。
2.1 以Pictet-Spengler反应为机理的合成方法
2.1.1 钌催化的串联Pictet-Spengler反应
2020年,Nalikezhathu等[36]通过吡啶基膦钌(Ⅱ)催化的串联醇胺化/Pictet-Spengler反应合成了四氢-β-卡巴林。由[RuCl(η6-异丙基){(2-吡啶基)-CH2PtBu2}]OTf(催化剂1)催化苯甲醇和色胺在回流甲苯中反应,可以选择性地完全转化为N-苄叉基色胺,并且使用In(OTf)3实现了完全转化生成四氢-β-卡巴林(Scheme 1),确定了环化N-苄叉基色胺的条件。该反应也适用于苯甲醇、杂环甲醇和脂肪醇。
2.1.2 金催化的对映选择性Pictet-Spengler反应
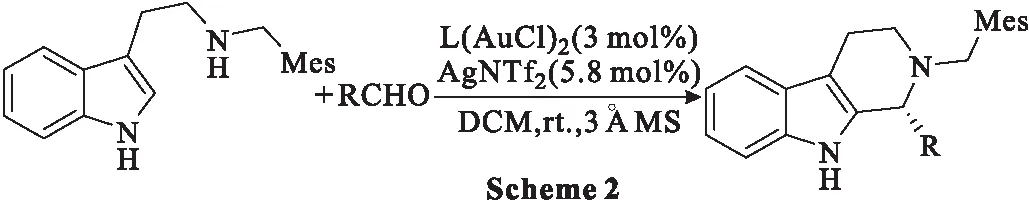
2019年,Glinsky-Olivier等[37]开发了一种使用Au(Ⅰ)催化合成具有高对映选择性的手性四氢-β-卡巴林的新途径。尽管仅限于芳香醛,但该反应可以耐受大量具有高化学选择性的反应性官能团。Au(Ⅰ)络合物通过与吲哚环结合而起到活化剂的作用,从而在吲哚环的C2处伴随金属化形成关键亚胺。实验以[3,5-(Me)2-C6H3]-SEGPHO作为最佳手性配体(L),在室温下,使用色胺(0.3 mmol)、苯甲醛(0.6 mmol)和粉末状活化3Å分子筛(300 mg)在二氯甲烷(DCM,3 mL)中反应(Scheme 2),产率为89%,ee值为83%。
2.1.3 两种氨基酸直接仿生合成β-卡巴林
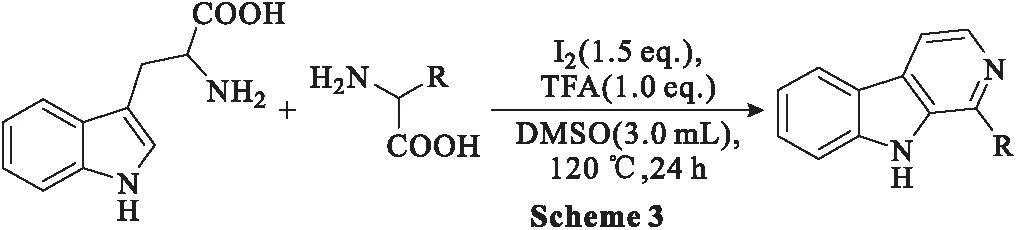
2018年,Wang等[38]设计了一种直接利用色氨酸和苯基甘氨酸合成β-卡巴林生物碱的新型仿生合成方法。在分子碘和三氟乙酸(TFA)的驱动下,脱羧、脱氨基、Pictet-Spengler反应和氧化反应依次进行,将生物氨基酸转化为具有附加值的生物碱。实验研究了色氨酸和苯基甘氨酸在绿色氧化剂I2存在下在DMSO中的反应(Scheme 3)。由于在没有其它添加剂的情况下无法获得所需的β-卡巴林衍生物,所以将布朗斯台德酸引入反应中,在TFA存在下获得了最佳结果,产率为52%。
2.1.4 异胡豆苷合成酶(strictosidine synthases,STRs)催化色胺和非天然脂肪族低分子量醛之间的Pictet-Spengler反应
2018年,Pressnitz等[39]研究色胺与低分子量脂肪醛的Pictet-Spengler反应时,发现STRs存在下意外地获得了R构型的产物(Scheme 4)。由此,开发了一种高效转化色胺与各种醛合成β-卡巴林类化合物的方法,产物的ee值>98%。
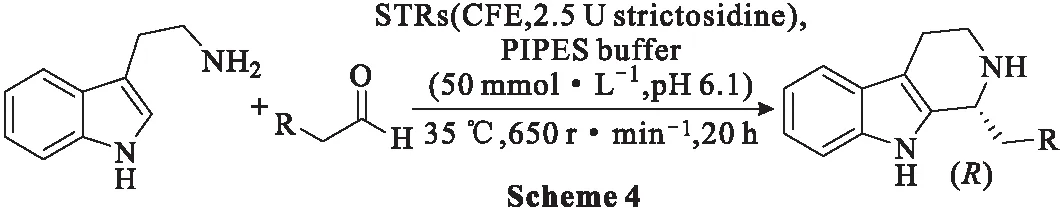
该研究主要集中在源自长春花(CrSTR)、小豆蔻(OpSTR)、萝芙木(RsSTR)及其V208A变体(RvSTR)的4种STRs,当使用冻干无细胞提取物时,4种STRs均可生物转化色胺与脂肪醛合成β-卡巴林类化合物。在优化的反应条件下,色胺(10 mmol)和异戊醛(50 mmol)反应转化为相应的1,2,3,4-四氢-β-卡巴林,使用RsSTR时20 h内的转化率为77%。反应使用了2.5 U strictosidine,这相当于每500 mL反应液含0.32~6.90 mg纯STRs(作为5~65 mg CFE) 的催化剂负载。可能是由于,酶和醛底物之间的相互作用位点较少,与天然底物相比,STRs对非天然醛的转化显示出较低的活性,RsSTR、RvSTR、OpSTR和CrSTR催化的产率分别为77%、50%、63%、12%。光学纯度分析表明,RsSTR、RvSTR和OpSTR催化的产品ee值>98%(HPLC),基本为光学纯,而CrSTR催化的ee值为88%。
2.2 以Bischler-Napieralski反应为机理的合成方法
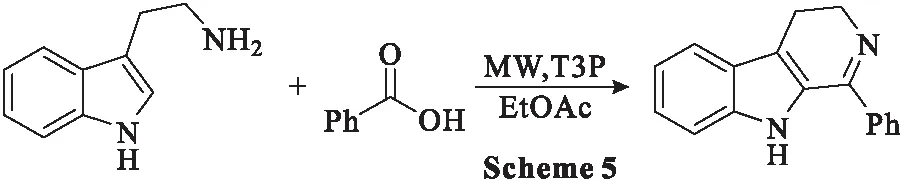
2.2.1 T3P促进色胺与羧酸一锅法反应合成二氢-β-卡巴林
2.2.2 Ugi/Bischler-Napieralski反应两步策略多组分合成β-卡巴林
2014年,Silvani等[41]报道了一种简单、有效和通用的两步策略,先进行Ugi反应,然后进行Bischler-Napieralski反应杂环化串联闭合,得到新型四氢-β-卡巴林衍生物。实验按照Ugi反应一般程序进行,在甲醇中依次加入1.1 eq.醛(a)、1.1 eq.胺(b)、1.1 eq.羧酸(c)和1.0 eq.吲哚异氰化物(d),混合物在40 ℃的甲醇溶液中搅拌24~120 h,得到中间体e;中间体e在80~110 ℃充满氮气的甲苯溶剂中进行Bischler-Napieralski反应杂环化,使用15 eq.磷酰氯作为脱水试剂,反应60~360 min,得到目标产物f(Scheme 6)。
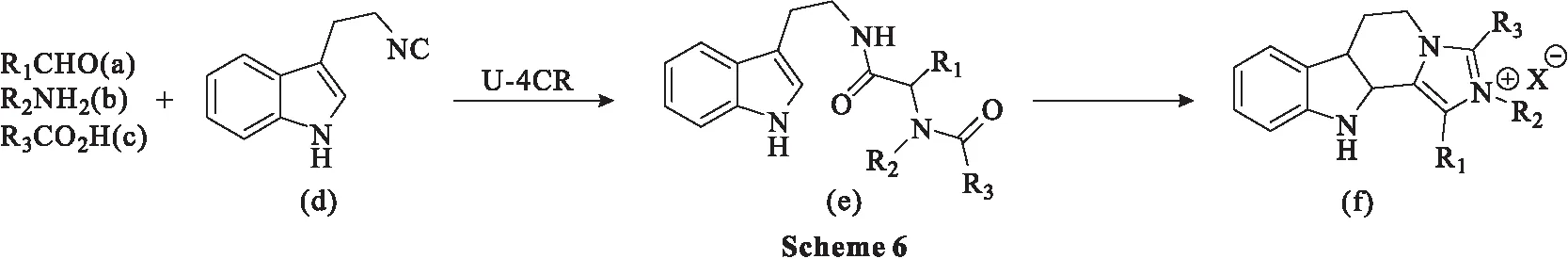
应注意的是,反应时间和产率在一定程度上取决于Ugi反应的起始组分,这决定了R1、R2、R3残基的结构。一般来说,对于Ugi反应,在相同的合成条件下,具有不同电子性质的脂肪族和芳香族残基以及带有大量取代基的残基都适用于该反应。
2.2.3 氧化酰胺化Bischler-Napieralski反应合成β-卡巴林
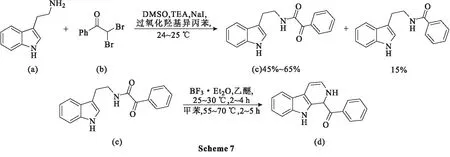
2013年,Meruva等[42]以色胺和2,2-二溴-1-苯乙酮为起始原料,采用氧化酰胺化Bischler-Napieralski反应,开发了一种合成二氢-β-卡巴林衍生物的新方法。使用该方法合成了许多二氢-β-卡巴林衍生物,产率中等至良好。研究人员试图将这些二氢-β-卡巴林衍生物转化为天然存在的优地托明生物碱,首先在NaI存在下,色胺(a)与2,2-二溴-1-苯基乙酮(b)反应转化为相应的希夫碱;希夫碱在过氧化羟基异丙苯的氧化作用下,生成α-酮酰胺(c);α-酮酰胺(c)在POCl3存在下进行Bischler-Napieralski反应环化,得到产物二氢-β-卡巴林衍生物(d)(Scheme 7)。当反应在乙醚、BF3·Et2O中25~30 ℃下进行时,获得最佳产率为55%。
2.2.4 Bischler-Napieralski反应环化氧化合成β-卡巴林
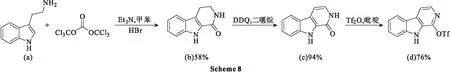
2014年,Roggero等[43]为合成优地霉素U(天然吲哚生物碱的一个亚类),以色胺(a)开始,经过Bischler-Napieralski反应环化生成内酰胺(b);通过DDQ 氧化以 94% 的产率生成了产物二氢-β-卡巴林(c),无需进一步纯化即可直接用于下一步,在碱性条件下使用三氟甲磺酸酐(Tf2O)生成β-卡巴林的三氟甲磺酸取代盐(d)(Scheme 8),产率为 76%。
2.3 以aza-Michael反应为机理的合成方法
2.3.1 通过原位生成的二酮吲哚合成高度取代β-卡巴林
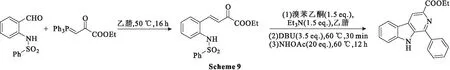
2020年,Untergehrer等[44]在aza-Michael加成级联反应基础上,开发了不同的级联反应,从易于获得的邻芳基磺酰氨基苯甲醛开始,生成高度取代的β-卡巴林类化合物。通过醛醇缩合或Wittig烯化使醛官能团烯化,得到反应性烯酮中间体,该中间体通过两步或一锅法转化进行级联反应,得到β-卡巴林类化合物(Scheme 9),一锅法产率为63%。
2.3.2N-磺酰基-1,2,3-三唑通过铑催化的C-H插入和碱介导的aza-alkylation/Michael反应一锅法合成β-卡巴林
2019年,Rajasekar等[45-46]通过一种高效的铑催化氮杂乙烯基卡宾插入吲哚的C3-H键,然后进行碱介导的分子内aza-Michael反应(Scheme 10)。通过优化反应条件可以适用于各种官能团,并以良好的产率合成各种二氢-β-卡巴林。
2.4 以Ullmann反应为机理的合成方法
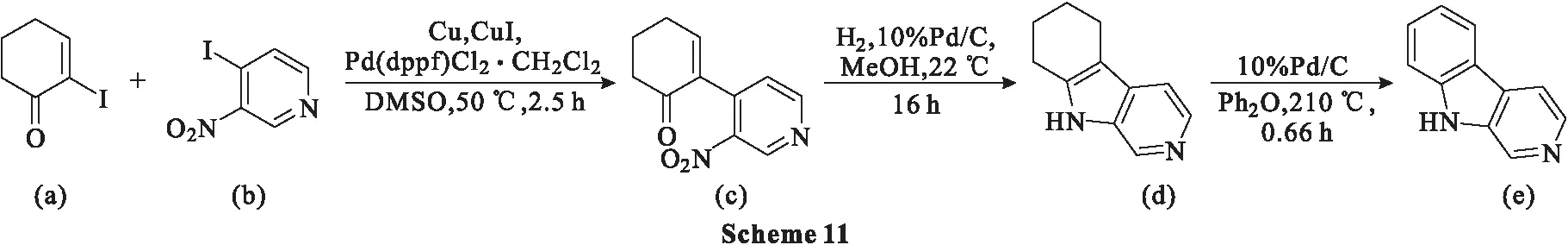
2017年,Qiao等[47]以2-硝基吡啶为原料,通过钯催化Ullmann交叉偶联反应,在常规条件下还原环化得到6,7,8,9-四氢-β-卡巴林,该化合物本身很容易芳构化生成β-卡巴林。
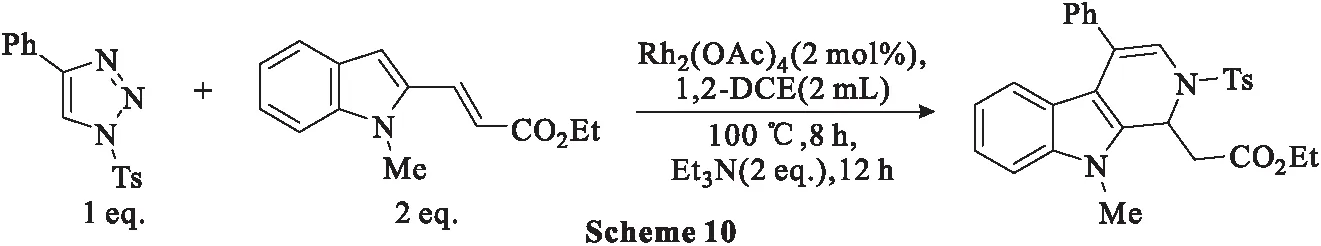
具体过程为:首先2-碘代环己酮-2-烯-1-酮(a)与4-碘-3-硝基吡啶(b)在钯催化下进行Ullmann交叉偶联反应,得到偶联产物2-吡啶基-环己酮-2-烯-1-酮(c),产率为86%。4-碘-3-硝基吡啶(b)作为反应中的偶联剂,可通过氯代类似物与碘化钠在乙腈中反应获得。为了减少该反应中吡啶的均偶联程度,在添加化合物b之前,化合物a在金属铜、碘化铜和Pd(dppf)Cl2·CH2Cl2存在下在DMSO中放置0.75 h。室温(22 ℃)下,10%Pd/C催化作用下,化合物c在甲醇中通过氢气还原环化,生成6,7,8,9-四氢-β-卡巴林(d)(Scheme 11),产率为88%。产物(d)在热二苯醚中短时间暴露于等质量的10%Pd/C后容易氧化为β-卡巴林,产率为94%。
2.5 以Willgerodt-Kindler反应为机理的合成方法
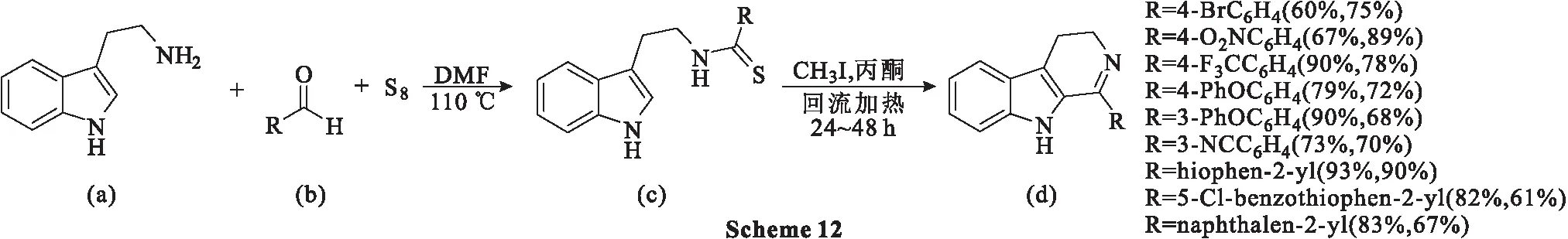
2015年,Milen等[48]通过Willgerodt-Kindler反应(涉及胺、醛和元素硫的反应)得到相应的Nb-硫代酰基色胺,进一步反应生成β-卡巴林。在110 ℃下,以二甲基甲酰胺(DMF)为溶剂,色胺(a)、醛(b)和元素硫的混合物在Willgerodt-Kindler反应的标准条件下反应生成中间体(c),随后在沸腾丙酮中使用5 eq.CH3I,以中等或良好的产率合成β-卡巴林类化合物(Scheme 12)。
2.6 由金属钯催化的合成方法(过渡金属催化)
2.6.1 以常见起始原料选择性钯催化的CeC、CeN偶联反应合成β-卡巴林
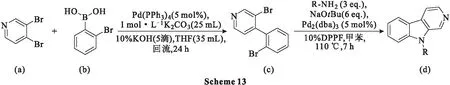
2019年,Hung等[49]报道了一种有效且实用的以常见起始原料3,4-二溴吡啶合成β-卡巴林类化合物的方法。3,4-二溴吡啶(a)与1.2 eq.邻溴苯硼酸(b)在5 mol%Pd(PPh3)4存在下发生位置选择性Suzuki-Miyaura反应生成中间体(c),产率为89%;随后化合物c与一系列胺进行Buchwald-Hartwig反应得到β-卡巴林类化合物(d)(Scheme 13),产率良好至优异。
2.6.2 钯催化的2-氨基芳基炔酮不对称串联环化反应合成β-卡巴林
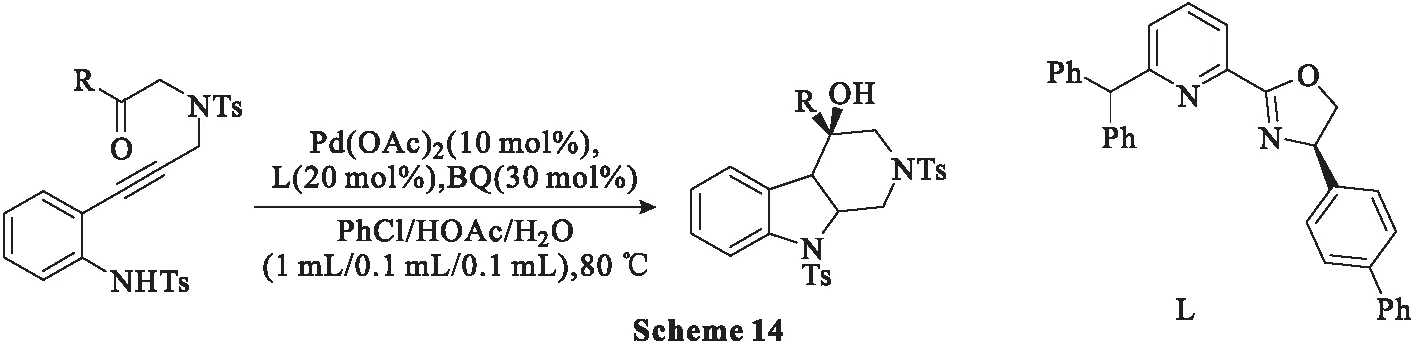
2018年,Chen等[50]开发了Pd(OAc)2催化的2-氨基芳基炔酮的不对称环化,包括炔烃的分子内反式氨基钯化和羰基串联过程的1,2-加成。通过该方法,0.1 mmol(1.0 eq.)原料在适宜的反应条件下搅拌4.0 h,可以获得高产率和优异对映选择性的手性1,2,3,4-四氢-β-卡巴林类化合物(Scheme 14)。
2.6.3 金属钯和有机羧酸联合催化合成β-卡巴林
2018年,Cera等[51]使用Pd(0)配合物与苯甲酸结合,将炔丙基色胺转化为相应的四氢-β-卡巴林类化合物。发现,含有烷基、芳基炔衍生物、联苯、萘和杂芳烃(如噻吩)的色胺衍生物以良好的产率合成1,2,3,4-四氢-β-卡巴林类化合物(Scheme 15),且得到的产物可以完全控制烯烃构型。因此,该方法可以用于β-卡巴林类化合物的合成。

2.6.4 钯催化色氨酸衍生异氰酸酯的亚氨基化环化合成β-卡巴林
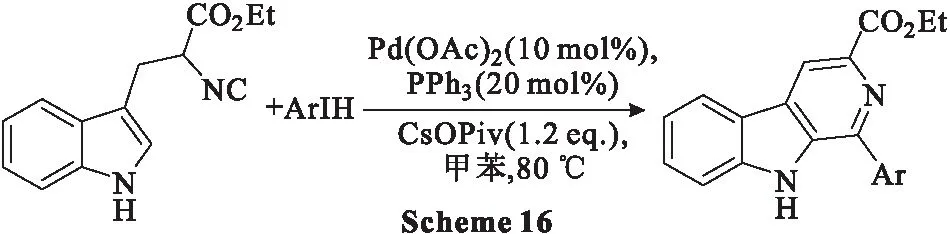
2017年,Tang等[52]开发了一种Pd(OAc)2催化的3-(1H-吲哚-3-基)-2-异氰丙二酸乙酯(色氨酸的衍生物)亚氨基化环化反应合成β-卡巴林类化合物(Scheme 16)。在温和条件下,该反应通过连续的异氰化合物插入、分子内C-H亚氨酰化和有氧脱氢芳构化顺利进行。该研究为含有β-卡巴林片段的分子提供了一种合成路线。
2.7 其它环化反应
2.7.1 以非金属化合物为催化剂的环化反应
2.7.1.1 在温和无金属条件下合成β-卡巴林类稠合氮杂芳烃
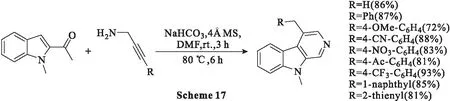
2018年,Uredi等[53]首次开发了以丙炔胺和(杂)芳香醛为起始原料,通过碱介导、一锅法和无金属条件以克级规模合成β-卡巴林、γ-卡巴林和各种稠合氮杂芳化合物。为了优化反应参数,研究人员选择1-甲基-吲哚-2-甲醛(0.6 mmol)作为模型底物与炔丙胺(0.9 mmol)组合,并且反应在温和条件下通过亚胺、6π氮杂环化策略顺利进行(Scheme 17)。研究人员对各种碱和溶剂系统的金属催化和无金属条件的研究表明,在80 ℃、NaHCO3(1.2 mmol)存在下,反应进行得很顺利。
2.7.1.2 光催化自由基化反应合成β-卡巴林
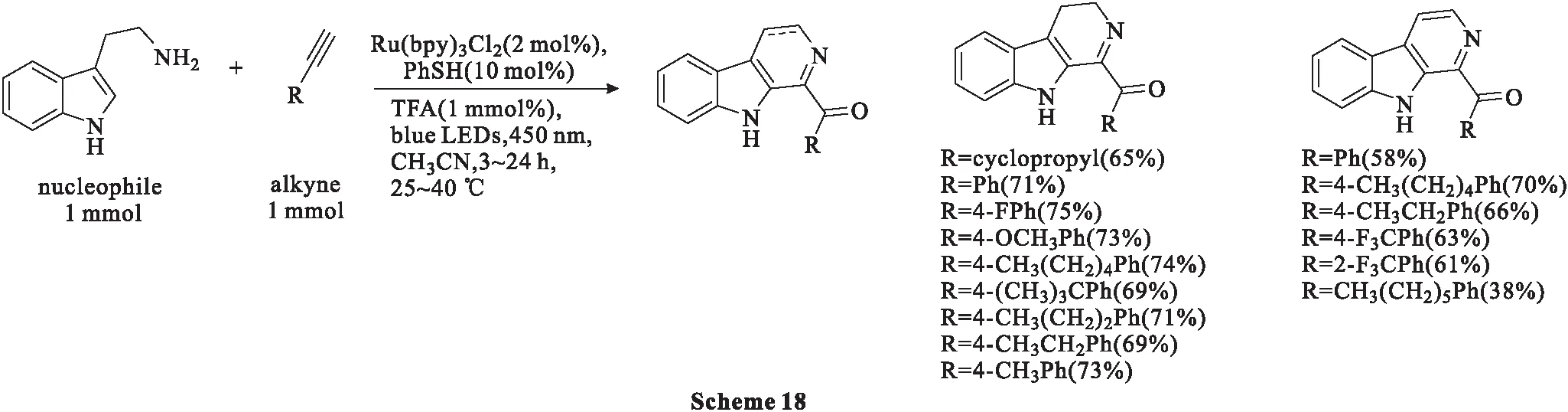
2018年,Chalotra等[54]报道了一种光催化自由基化反应合成β-卡巴林。值得注意的是,该过程中色胺与环丙基乙炔反应生成唯一产物二氢-β-卡巴林,产率为65%;此外,色胺与4-氟苯基乙炔、4-甲氧基苯基乙炔、4-戊基苯基乙炔、4-叔丁基苯基乙炔、4-丙基苯基乙炔、4-乙基苯基乙炔和4-甲基苯基乙炔均可以生成二氢-β-卡巴林类化合物(Scheme 18),产率为69%~75%。并且,将反应温度提高到40 ℃时,可以很容易地获得含有色胺的完全芳香化产物β-卡巴林类化合物。
2.7.1.3 通过级联耦合策略一锅法合成β-卡巴林
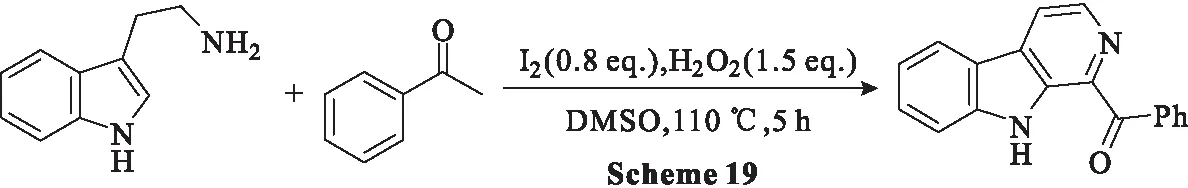
2013年,Zhu等[55]以色胺和苯乙酮作为模型底物优化了β-卡巴林合成反应条件。当1.0 eq.I2在DMSO中100 ℃下持续反应24 h,得到β-卡巴林,产率为68%。然而,当I2用量增加到1.6 eq.时,产率大幅提高到88%;将反应温度提高到110~130 ℃时,在12 h内,产率提高到86%~88%;在上述条件下,转化在(110±8) ℃下3 h内完成,产率为92%。得出最佳反应条件为:色胺(1.0 mmol)和苯乙酮(1.0 mmol)在H2O2(1.5 eq.)、I2(0.8 eq.)存在下,于DMSO中110 ℃下反应5 h(Scheme 19)。
2.7.2 以金属化合物为催化剂的环化反应
2.7.2.1 催化3-溴吲哚烯醇芳基化的反应
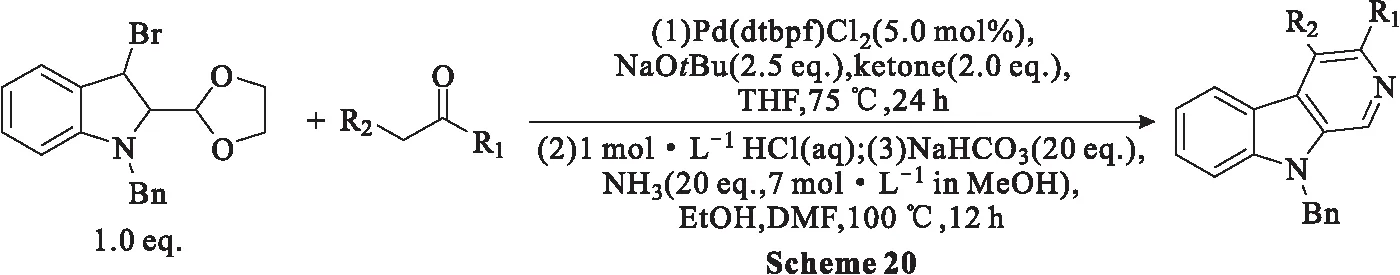
2017年,Esteves等[56]使用吲哚基溴化物作为偶联剂进行一锅法烯醇化芳基化/芳构化反应,以良好的产率提供了多个C3、C4衍生物。这种化学反应为C-3,4-二取代-β-卡巴林化合物的合成提供了一条特别方便和快捷的途径(Scheme 20),并且可以在完全控制化学区域的情况下插入所需的官能团。
2.7.2.2 金催化的叠氮化合物与炔酰胺分子间的反应
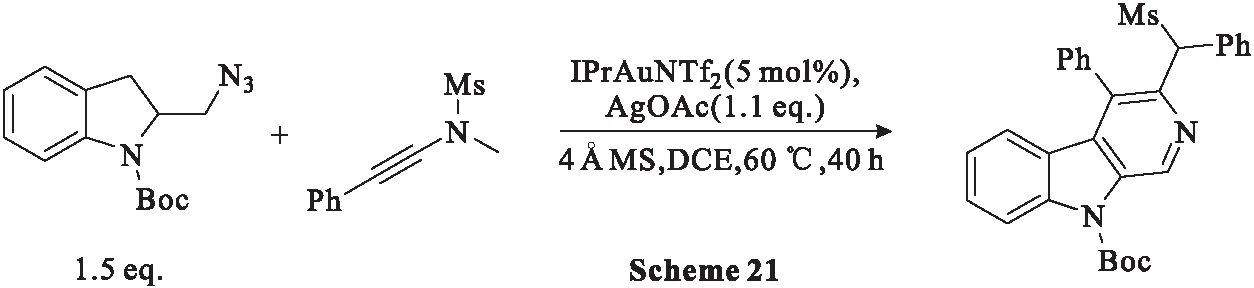
2015年,Shu等[57]在5 mol%IPrAuNTf2、1.1 eq.AgOAc存在下,使用吲哚基叠氮化物与炔酰胺通过[4+2]环加成反应合成β-卡巴林类化合物(Scheme 21),产率为99%。
2.7.2.3 铑(Ⅱ)催化芳基叠氮化合物合成β-卡巴林
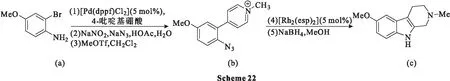
2012年,Pumphrey等[58]研究发现,铑(Ⅱ)催化的C-H键胺化条件适合从芳基叠氮化物合成β-卡巴林类化合物。以2-溴-4-甲氧基苯胺(a)和4-吡啶基硼酸为原料,分3步(Suzuki反应、叠氮反应和甲基化反应)合成了用于胺化反应的芳基叠氮化物(b)底物,产率为67%;将叠氮化物(b)暴露于胺化还原序列中生成β-卡巴林类化合物(c)(Scheme 22),产率为91%。
2.7.2.4 通过一锅法三组分的亲核、环化反应合成β-卡巴林
2009年,Ohta等[59]开发了两种通过铜催化三组分生成吲哚,然后在吲哚的C3连续环化直接合成1,2,3,4-四氢-β-卡巴林类化合物。当以氨基乙醇作为胺组分时,4-氯苯磺酰基是t-BuOK诱导的第二次环化的首选保护和活化基团。此外,N-甲基-2-乙炔基苯胺和R-氨基酯是MsOH诱导C3环化反应的良好组分,可以生成各种光学活性的4-羰基-1,2,3,4-四氢-β-卡巴林。
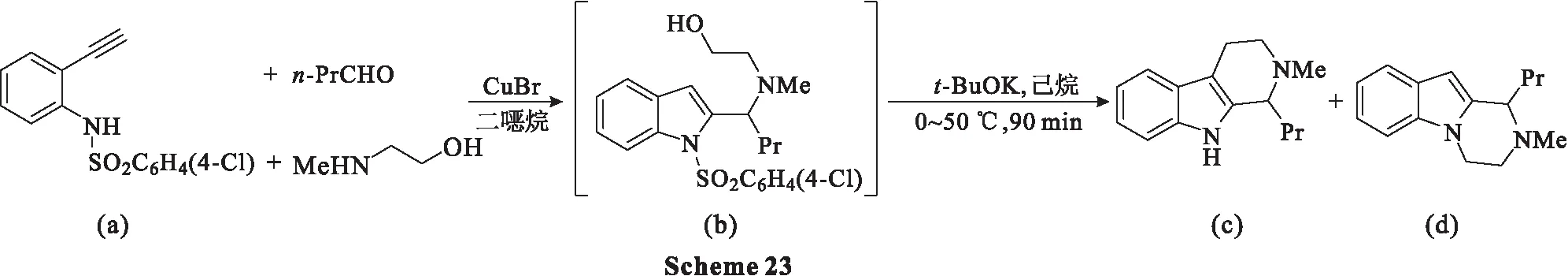
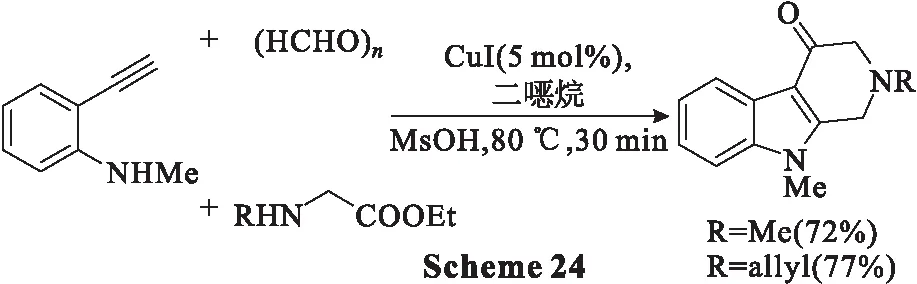
另一过程为:在微波辐射(300 W)和170 ℃的条件下,将乙炔苯胺1 g(0.19 mmol)、多聚甲醛(2 eq.)和氨基酯3(1.2 eq.)在二烷中与CuI(5 mol%)的混合物搅拌1 h;生成吲哚后(通过TLC监测),将反应混合物在80 ℃下用MsOH处理30 min;分离产物,取代基R为甲基时的产率为72%,为烯丙基时的产率为77%(Scheme 24)。
3 结语
近年来,β-卡巴林类化合物因其广泛的药理活性具有广阔的市场前景。各种含有β-卡巴林骨架的生物活性物质或新药被研发,与此同时,人们对β-卡巴林类化合物的合成方法也进行了深入研究。Pictet-Spengler反应是合成β-卡巴林类化合物最重要、最实用和最通用的策略之一,是高效合成手性四氢-β-卡巴林类化合物的主要方法。由Pd催化合成手性β-卡巴林类化合物的方法一直都很受欢迎,并且产率较高。由生物酶催化一锅法合成β-卡巴林类化合物,利用了来源丰富且易获得的起始原料,为传统方法提供了一种绿色且环境友好的替代方案。无金属、高效、便捷、反应条件温和的化学合成将成为合成β-卡巴林类化合物的主要趋势。
