响应面法优化阿里红总三萜酸提取工艺及抗氧化活性研究
2023-01-18吴欣恬阿吉尔古丽麦麦提高哈尔巴克别尔王诗瑶何文静
吴欣恬,阿吉尔古丽·麦麦提,高哈尔·巴克别尔,王诗瑶,何文静
(新疆医科大学中医学院,新疆 乌鲁木齐 830017)
阿里红(FomesofficinalisAmes,FOA),在维语中多被译为“哈日混”,又称麻西芒,来源于担子菌纲多孔菌科层孔菌属植物苦白蹄的干燥子实体,在我国新疆、云南、四川、吉林、黑龙江等地分布广泛,也是新疆维吾尔族民间常用药物[1]。据《中国医学百科全书》记载,其性味干热微辛,有祛寒止痛、燥湿平喘、利尿通经等功效,用于治疗寒性感冒、胸痛、关节痛、闭尿闭经、慢性气管炎等症[2]。研究表明,阿里红富含三萜酸类、多糖类、倍半萜类、脂肪酸类等化合物,其中三萜酸类化合物是阿里红发挥药效的重要活性成分,具有抗炎抗菌、抗肿瘤、抗氧化、祛痰止咳、镇痛、降血糖血脂等多种药理作用[3-6]。
目前,三萜酸类化合物的提取方法包括溶剂浸提法、超高压提取法、机械化学提取法、超声辅助提取法、酶解提取法、微波提取法等[7-10],其中超声辅助提取法易于操作、节省溶剂、提取效率高、对环境友好,被广泛用于植物三萜酸类化学成分的提取。黑枣三萜酸[7]、枣果三萜酸[11]、柿果皮总三萜酸[12]等的超声辅助提取工艺均已被报道。近年来,有研究[13-15]显示三萜酸类化合物具有抗氧化作用,可以作为潜在抗氧化剂。目前,关于阿里红总三萜酸(total triterpenoid acids fromFomesofficinalisAmes,FOATTA)的提取及其抗氧化活性的研究报道较少。鉴于此,作者以黑龙江、新疆、吉林、云南等6个产地阿里红为原料,采用超声辅助法提取FOATTA,以FOATTA得率为评价指标,采用单因素实验结合响应面法优化提取工艺,比较不同产地FOATTA得率及抗氧化活性的差异,旨在为阿里红资源的深入开发提供数据支持。
1 实验
1.1 材料、试剂与仪器
新疆阿勒泰阿里红(批号191209),新疆维吾尔自治区维吾尔医院;新疆伊犁阿里红(批号211203),新疆乌鲁木齐维药药材市场;黑龙江阿里红(批号191008)、吉林阿里红(批号191225)、云南昆明阿里红(批号191116)、云南大理阿里红(批号191218),亳州亿弘堂药业有限公司。
齐墩果酸标准品、VC标准品、DPPH自由基,纯度(HPLC)≥99%,上海源叶生物科技有限公司;无水乙醇、香草醛、冰醋酸、高氯酸、铁氰化钾、三氯化铁,分析纯,天津大茂化学试剂厂;磷酸氢二钠、磷酸二氢钠,分析纯,上海国药集团化学试剂有限公司。
FW100型高速万能粉碎机,北京永光明医疗仪器有限公司;MAX-C6002型电子天平,深圳无限量衡器有限公司;KQ-5200DE型数控超声波清洗器,昆山超声仪器有限公司;Sigma-4k15型冷冻离心机,北京卓明贸易有限公司;722S型紫外可见分光光度计,上海菁华科技有限公司。
1.2 方法
1.2.1 齐墩果酸标准溶液的制备
精密称取干燥至恒重的齐墩果酸标准品5.0 mg于25 mL容量瓶中,用无水乙醇溶解并定容至刻度,得浓度为0.2 mg·mL-1的齐墩果酸标准溶液,于4 ℃下密封保存,备用。
1.2.2 测定波长的选择[3]
移取1 mL齐墩果酸标准溶液于15 mL具塞试管中,于80 ℃恒温水浴锅中至溶剂挥干,然后加入现配的5%香草醛-冰醋酸溶液(称取0.5 g香草醛,用冰醋酸定容至10 mL)0.4 mL和高氯酸溶液1.6 mL,摇匀,于60 ℃恒温水浴锅中水浴15 min;取出冷却后,加入8 mL冰醋酸,摇匀,静置反应10 min,以空白试剂(除标准溶液以外的试剂配制)为参比,在450~650 nm波长范围内进行扫描。结果发现,其最大吸收峰在547 nm处。因此,选择测定波长为547 nm。
1.2.3 标准曲线的绘制
分别移取0.0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL齐墩果酸标准溶液于15 mL具塞试管中,按照1.2.2方法测定547 nm处吸光度。以齐墩果酸质量浓度(c,mg·mL-1)作横坐标、吸光度(A)作纵坐标,绘制标准曲线,拟合得到线性回归方程为A=48.929c+0.0027,R2=0.9993。
1.2.4 总三萜酸得率的测定
将干燥的阿里红用粉碎机粉碎,过40目筛。精密称取1.0 g阿里红粉末,将超声功率设定为200 W、提取温度设定为50 ℃,在一定的料液比、乙醇体积分数、提取时间条件下提取FOATTA;抽滤,5 000 r·min-1离心10 min,上清液用相应提取溶剂定容;移取1.0 mL适当稀释,然后取0.2 mL样品溶液于15 mL具塞试管中,按照1.2.2方法操作,测定547 nm处吸光度,根据标准曲线方程得到FOATTA质量浓度,按式(1)计算FOATTA得率(%)[16]:
(1)
式中:c为样品溶液中总三萜酸质量浓度,mg·mL-1;V为样品溶液体积,mL;n为稀释倍数;m为阿里红粉末质量,g。
1.2.5 单因素实验
以FOATTA得率作评价指标,固定提取温度50 ℃、超声功率200 W,分别考察料液比(1∶20、1∶25、1∶30、1∶35、1∶40,g∶mL,下同)、乙醇体积分数(50%、60%、70%、80%、90%)、提取时间(10 min、20 min、30 min、40 min、50 min)对FOATTA得率的影响,每组实验平行做3次,结果取平均值。
1.2.6 响应面实验
在单因素实验的基础上,以料液比(A)、乙醇体积分数(B)、提取时间(C)为考察因素,以FOATTA得率为响应值,使用Design-Expert 13软件进行3因素3水平响应面实验,因素与水平如表1所示。

表1 因素与水平
1.2.7 体外抗氧化活性的测定
1.2.7.1 DPPH自由基清除能力的测定
参照文献[17],分别取浓度为1.0 mg·mL-1、1.5 mg·mL-1、2.0 mg·mL-1、2.5 mg·mL-1、3.0 mg·mL-1的样品溶液各2 mL,加入0.04 mg·mL-1DPPH自由基溶液(用无水乙醇定容)2 mL,避光反应0.5 h,于517 nm处测定吸光度(A1);以等体积VC标准溶液(用无水乙醇定容)为阳性对照,同法操作,测定吸光度(A2);以等体积无水乙醇代替样品溶液为空白对照,同法操作,测定吸光度(A0)。每组实验平行测定3次,结果取平均值。按式(2)计算DPPH自由基清除率(%):
(2)
1.2.7.2 Fe3+还原能力的测定
参照文献[18],分别取浓度为1.0 mg·mL-1、1.5 mg·mL-1、2.0 mg·mL-1、2.5 mg·mL-1、3.0 mg·mL-1的样品溶液各1 mL,加入pH值为6.6的0.2 mol·L-1磷酸盐缓冲液和1%铁氰化钾溶液各2.5 mL,在50 ℃水浴锅中加热反应20 min;取出,加入10%三氯乙酸溶液2.5 mL,5 000 r·min-1离心10 min,移取上清液2.5 mL于离心管中,分别加入蒸馏水2.5 mL和0.1% 三氯化铁溶液0.5 mL,混匀,放置10 min后,测定700 nm处吸光度;以等体积VC标准溶液(用无水乙醇定容)为阳性对照,同法操作,测定吸光度,每组实验平行测定3次,结果取平均值。以吸光度表示Fe3+还原能力,吸光度与Fe3+还原能力呈正比。
2 结果与讨论
2.1 单因素实验结果
2.1.1 料液比对FOATTA得率的影响(图1)

注:乙醇体积分数50%、提取时间20 min
由图1可知,FOATTA得率随料液比的减小,即提取溶剂用量的增加,先升高后降低,在料液比为1∶35时达到最高。这可能是因为,溶剂用量增加可以使溶剂充分接触药材粉末,有利于FOATTA从药材内部析出,提高了FOATTA得率;但是溶剂用量过多则会引起其它可溶性杂质溶出,减少FOATTA的溶出,导致其得率降低[19]。因此,选择适宜的料液比为1∶35。
2.1.2 乙醇体积分数对FOATTA得率的影响(图2)

注:料液比1∶35、提取时间20 min
由图2可知,随着乙醇体积分数的增大,FOATTA得率先升高后降低,特别是乙醇体积分数从50%增至60%时,FOATTA得率大幅升高,继续增至80%时,FOATTA得率达到最高。这可能是因为,FOATTA的溶解度会随着乙醇体积分数的增大而增大,但是乙醇体积分数过大时,阿里红中的一些醇溶性物质、色素等杂质会部分溶出,使得FOATTA溶解度降低,导致其得率降低,也会增大溶剂成本[20]。因此,选择适宜的乙醇体积分数为80%。
2.1.3 提取时间对FOATTA得率的影响(图3)

注:料液比1∶35、乙醇体积分数80%
由图3可知,随着提取时间的延长,FOATTA得率先升高后降低,在40 min时达到最高。这可能是因为,提取时间太短,FOATTA提取不充分;在提取时间为40 min时,FOATTA基本溶出;但提取时间过长,热效应和其它杂质的溶出会使FOATTA得率下降[15]。因此,选择适宜的提取时间为40 min。
2.2 响应面实验结果
2.2.1 回归方程和方差分析
响应面实验设计及结果如表2所示。

表2 响应面实验设计及结果
根据表2结果,利用Design-Expert 13软件对实验数据进行多元回归拟合分析,得到二次多项回归方程:Y=14.39-0.3587A+0.4263B+0.3925C+0.1700AB-0.1825AC-0.0325BC-0.4360A2-0.4110B2-0.7835C2。
对回归模型进一步进行方差分析,结果如表3所示。

表3 回归模型的方差分析

2.2.2 各因素交互作用分析
为考察两两因素对FOATTA得率的交互影响,对其作响应面图和等高线图,结果如图4所示。
图4可以直观地显示两两因素交互作用对FOATTA得率的影响,响应面坡度越陡,等高线密度越大,则说明两两因素交互作用较显著,对FOATTA得率影响较大。由图4可知,交互项AC的响应面坡度最为陡峭,等高线密度较大呈椭圆,对FOATTA得率影响较大;交互项AB、BC响应面坡度较平缓,等高线密度较稀疏,对FOATTA得率影响不显著,这与表3的方差分析结果一致。

图4 各因素交互作用对FOATTA得率影响的响应面图及等高线图Fig.4 Response surface plots and contour plots for effects of interaction between various factors on yield of FOATTA
2.2.3 验证实验
响应面法优化的FOATTA的最佳提取工艺为:料液比1∶33.050、乙醇体积分数86.054%、提取时间41.384 min,FOATTA得率预测值为14.579%。根据实际情况,将最佳提取工艺调整为:料液比1∶33、乙醇体积分数85%、提取时间40 min,在此优化条件下进行3次平行验证实验,FOATTA得率为14.510%,与预测值的相对误差为0.48%,进一步证明了该模型的可行性。
2.3 不同产地FOATTA得率的对比
采用最佳工艺提取6个产地的FOATTA,计算FOATTA得率,结果如表4所示。
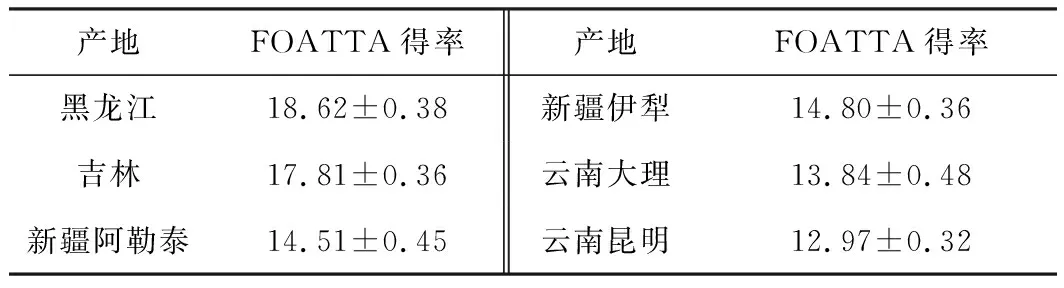
表4 6个产地FOATTA得率/%
由表4可知,黑龙江的FOATTA得率最高,云南昆明的FOATTA得率最低。
比较不同产地的FOATTA得率发现,东北地区的FOATTA含量明显高于新疆和云南地区,这种差异可能与产地的温度、湿度、光照等环境因素有关。黑龙江和吉林地处我国东北地区,土地肥沃,地势高寒,天然温差大,山环水绕的地理优势有利于潮湿空气进入形成降水,其优越的原始森林环境更适宜阿里红的生长,有效成分FOATTA的含量相对较高。虽然新疆是阿里红主要种植产地,与东北地区纬度接近,光照时间长,但昼夜温差不及东北地区,且气候干旱,降水量少,其FOATTA含量不及东北地区。而云南地区地处低纬度,属于亚热带,四季如春,气候特点不鲜明,昼夜温差较小,因此,FOATTA含量不及东北与新疆地区。
2.4 抗氧化活性分析
2.4.1 DPPH自由基清除能力的测定(图5)
由图5可知,FOATTA浓度在1.0~3.0 mg·mL-1范围内时,随着浓度的增加,其对DPPH自由基的清除率呈不断上升趋势;在实验浓度范围内,VC对DPPH自由基的清除率已经达到饱和状态,趋势平缓。在3.0 mg·mL-1浓度下,黑龙江FOATTA的DPPH自由基清除率最高, 达到了70.69%,云南昆明FOATTA的DPPH自由基清除率最低,仅为42.82%。6个产地的FOATTA含量越高,其对DPPH自由基清除能力越强(表4、图5)。虽然6个产地的FOATTA对DPPH自由基的清除率均低于同浓度VC,但仍然可以说明FOATTA具有一定的抗氧化能力。

图5 6个产地FOATTA对DPPH自由基的清除率Fig.5 Scavenging rates of DPPH free radicals by FOATTAfrom six producing areas
2.4.2 Fe3+还原能力的测定(图6)
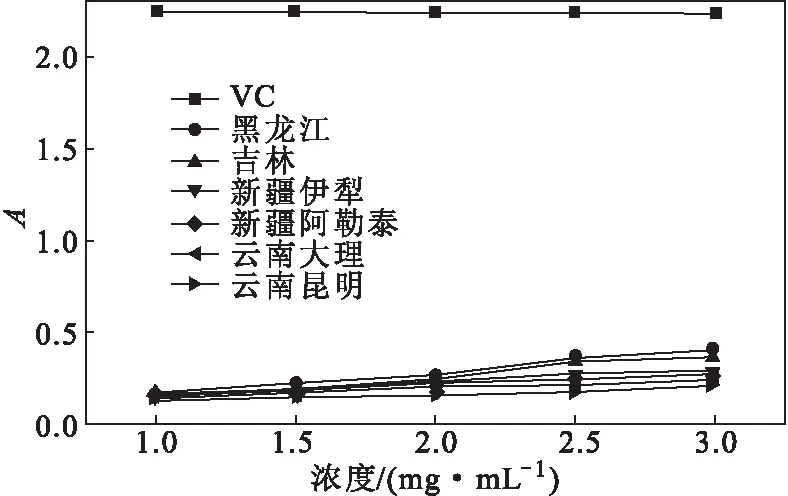
图6 6个产地FOATTA对Fe3+的还原能力Fig.6 Fe3+ reducing ability of FOATTA from six producing areas
由图6可知,FOATTA浓度在1.0~3.0 mg·mL-1范围内时,随着浓度的增加,其对Fe3+还原能力呈一定量效关系;在实验浓度范围内,VC的Fe3+还原能力达到饱和,基本无变化,明显高于各个产地FOATTA的Fe3+还原能力。不同产地的Fe3+还原能力大小为:黑龙江>吉林>新疆伊犁>新疆阿勒泰>云南大理>云南昆明,且不同产地的Fe3+还原能力也与FOATTA含量成正比。虽然各个产地FOATTA具有一定还原能力,但是整体均弱于VC。
3 结论
以新疆、黑龙江、吉林、云南等6个不同产地的阿里红为研究对象,采用单因素实验结合响应面法优化FOATTA超声辅助提取工艺,确定最佳的提取工艺为:料液比1∶33(g∶mL)、乙醇体积分数85%、提取时间40 min,在此条件下,FOATTA得率为14.510%。
比较不同产地的FOATTA得率发现,黑龙江的FOATTA得率最高,云南昆明的FOATTA得率最低。不同产地的FOATTA含量与其DPPH自由基清除率和Fe3+还原能力呈正比,表现出一定的抗氧化能力,但整体弱于VC。表明,FOATTA含量受地域、自然环境、气候等诸多因素影响,进而造成其抗氧化能力的差异。
本实验得到的FOATTA仅为粗提物,并未进行纯化,只对其抗氧化能力作了初步分析,FOATTA成分复杂,在后续实验中,将对FOATTA进行定性分析、结构分析、纯化工艺以及其它生物活性研究,为阿里红资源的充分利用和进一步开发其有效成分提供更多理论支撑。
