水冬瓜叶药材的质量标准研究
2023-01-17韩忠耀张林甦周福军
韩忠耀,陈 菊,张林甦,周福军
(1.黔南民族医学高等专科学校,贵州 558000;2.中国医科大学药学院,辽宁 110122;3.天津药物研究院,天津 300301)
水冬瓜叶来源于山茱萸科植物有齿鞘柄木Toricellia AngulataOliv.var.intermedia(Harms)Hu的干燥叶,药用部位根皮收载于《贵州省中药材、民族药材质量标准》(2003版)[1]及湖北中草药志[2]。有齿鞘柄木植物体根皮或叶中主要含有熊果酸、金丝桃苷、异槲皮苷、β-谷甾醇、3β-甲氧基-豆甾-7-烯、谷甾烷、β-胡萝卜苷、硬脂酸、软脂酸、syringo ylglycerol、2H-1-benzopyr-an-2-one、3,5-二甲氧基苯甲醛、10-griselinosidic acid、丁香树脂酚、豆甾醇、紫丁香苷[3-7]等化学成分。
课题组前期建立了水冬瓜根皮HPLC指纹图谱[8-9]、不同采收期大接骨丹树皮HPLC指纹图谱[10]、根皮部位总黄酮与浸出物NIR快速检测方法[11]、根皮部位提取工艺优化[12]、水冬瓜叶生药学研究及近红外快速真伪鉴别与含量测定方法[13-14]、抗炎镇痛谱效关系研究[15]等。相关文献记载山茱萸科植物有齿鞘柄木的药用部位为根、根皮、树皮及叶[16],相关研究表明,水冬瓜叶也具有深入开发、利用的价值,可作为根皮药用部位替代或补充药用植物资源[17]。当前,水冬瓜叶既未被历版《中国药典》收载,也未被地方标准收载,该药材在少数民族聚集地或民族医疗机构被广泛应用,为贵州少数民族用药,基于此,对民族药水冬瓜叶开展质量控制研究并建立系统化质量控制标准意义重大,且具有必要性。据相关文献报道,金丝桃苷具有抗急性肝损伤、抗抑郁、抗炎症、抗血栓、抗癌、抗菌、抗氧化应激和抗细胞凋亡等药理作用[18],鉴于此,本文拟以金丝桃苷作为民族药水冬瓜叶药材质量控制指标性化学成分。
本试验拟以黔产水冬瓜叶药材为研究对象,对10批次水冬瓜叶药材进行TLC定性鉴别,水分、总灰分、浸出物的含有量,并建立HPLC法测定金丝桃苷的含量,为民族药水冬瓜叶药材质量控制及临床用药提供参考与实验依据。
1 材料
1.1 仪器Agilent 1260型高效液相色谱仪(美国安捷伦科技有限公司);PX125DZH型电子天平(成都川弘科生物技术有限公司);SX-4-10型箱式电阻炉(天津市泰斯特仪器有限公司);101-3AB型烘箱(天津市泰斯特有限公司);三用紫外分析仪(上海嘉鹏科技有限公司);双列六孔水浴锅(常州中捷实验仪器制造有限公司);KQ3200型超声仪(昆山市超声仪器有限公司);WK-1000A型高速粉碎机(潍坊市北方制药设备制造有限公司)。
1.2 试药 金丝桃苷对照品(购自中国食品药品检定研究院,批号111521-201809,纯度为94.9%);硅胶GF254薄层板(青岛鼎康硅胶有限公司);甲醇(分析纯,购自天津科密欧化学试剂有限公司);乙醇(分析纯,购自天津科密欧化学试剂有限公司);乙腈(色谱纯,购自天津科密欧化学试剂有限公司);磷酸[分析纯,购自重庆川东化工(集团)有限公司];水为娃哈哈纯净水(浙江娃哈哈集团有限公司),其他试剂均为分析纯。
1.3 药材10批水冬瓜叶药材均为课题组从贵州遵义、黔南、铜仁等主要分布地自采的野生品,所有自采药材均由韩忠耀副教授鉴定为山茱萸科植物有齿鞘柄木Toricellia AngulataOliv.var.intermedia(Harms)Hu的叶,见表1。
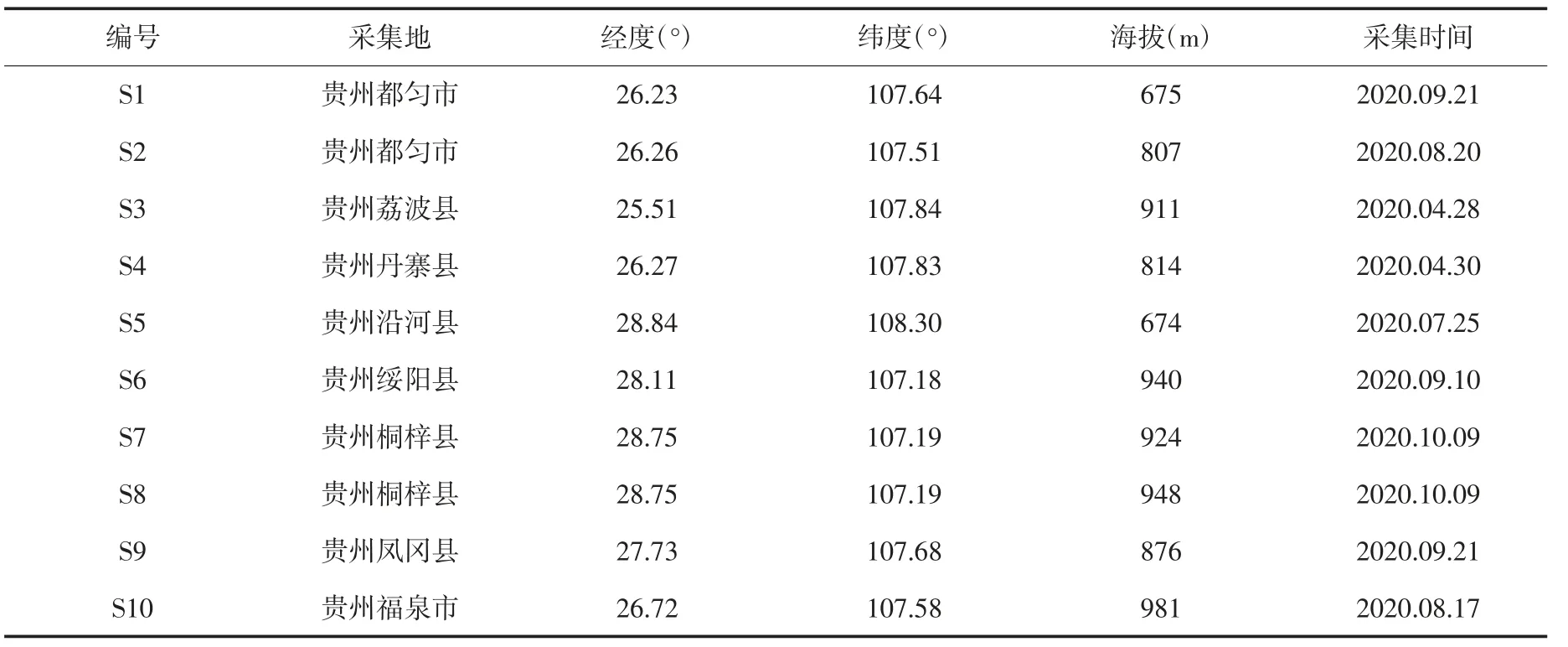
表1 药材来源
2 方法与结果
2.1 薄层色谱鉴别 称取10批次水冬瓜叶药材(编号见表1)粉末每份1 g,置具塞锥形瓶中,加甲醇20 ml,超声(功率:500 W,频率:40 kHz)处理20 min,过滤,滤液置蒸发皿中,水浴锅控温70℃蒸干,残渣加入甲醇2 ml溶解,作为供试品溶液;精密称取金丝桃苷对照品,加甲醇制成每1 ml含金丝桃苷约为1 mg的溶液,作为对照品溶液。参照2015版《中国药典》(四部)0502薄层色谱测定法[19],分别吸取供试品溶液、对照品溶液各10μl,点于同一硅胶GF254薄层板上,以乙酸乙酯-甲酸-水(33∶4∶2)为展开剂,置于展开缸中展开,取出、晾干,喷10%硫酸乙醇,晾干,三用紫外光灯254 nm下检视,在供试品、金丝桃苷对照品色谱相应的位置上显相同颜色的斑点,见图1。

图1 10批水冬瓜叶药材TLC色谱图
2.2 水分测定 取10批次水冬瓜叶药材(编号S1~S10)粉末适量,精密称定,参照2015版《中国药典》(四部)通则0832水分测定法第二法(烘干法)[19]进行水分检查,各批次药材平行3份,取平均值,结果见表2。10批次水冬瓜叶药材水分含量为6.34%~8.89%,均值为7.94%。参照文献[20],将10批次水冬瓜叶药材水分含量均值上浮30%作为限度标准,初步拟定水冬瓜叶药材水分含有量不得超过10.3%。
2.3 总灰分测定 取10批次水冬瓜叶药材(编号S1~S10)粉末适量,精密称定,参照2015版《中国药典》(四部)通则2302总灰分测定法[19],进行总灰分检查,各批次平行3份,取平均值,结果见表2。10批次水冬瓜叶药材总灰分含量为7.95%~11.62%,均值为9.06%。根据检测结果,初步拟定水冬瓜叶药材总灰分含有量不得超过12.0%。
2.4 浸出物测定 取10批次水冬瓜叶药材(编号S1~S10)粉末适量,精密称定,参照2015版《中国药典》(四部)2201浸出物测定法(冷浸法)[19],进行浸出物测定,溶剂为水,各批次平行3份,取平均值,结果见表2。10批次水冬瓜叶药材浸出物含量为29.48%~39.76%,均值为35.75%。根据检测结果,以浸出物不少于平均值的70%为最低限度要求计算,初步拟定水冬瓜叶药材浸出物含有量不得少于25.0%。
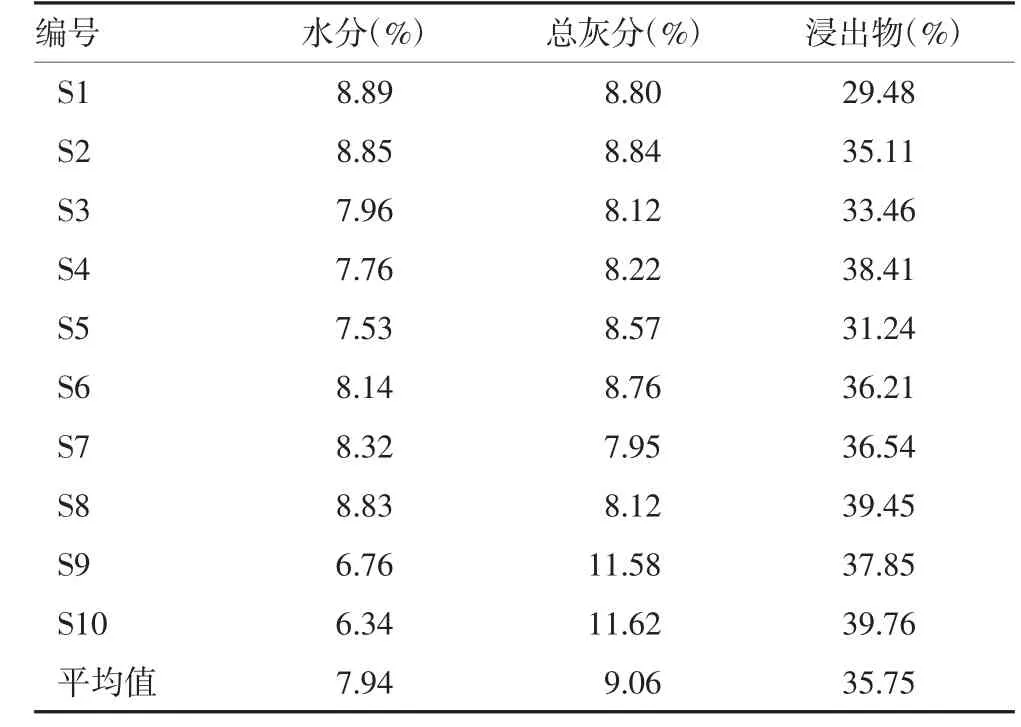
表2 10批水冬瓜叶药材水分、浸出物及灰分测定结果(n=3)
2.5 金丝桃苷含量测定
2.5.1 色谱条件与系统适用性试验Agela Promosil C18色谱柱(250 mm×4.6 mm,5μm);流动相为0.2%磷酸(A)-乙腈(C);柱温35℃;体积流量为1.0 ml/min;检测波长360 nm;进样量20μl;梯度洗脱条件:0~10 min,13%→19% C;10~20 min,19%→45% C;20~22 min,45%→70% C;22~25 min,70% C;25~25.1 min,70%→13% C;25.1~30 min,13% C,洗脱时间30 min,色谱图见图2。在此条件下,金丝桃苷理论塔板数大于8 000,与相邻成分色谱峰的分离度均大于1.5,且70%甲醇空白对照无干扰。
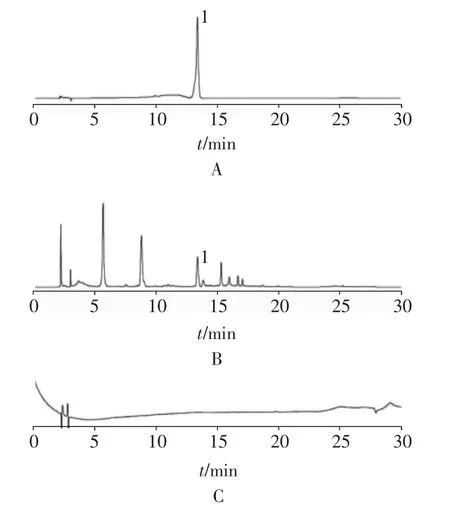
图2 对照品(A)供试品(B)空白对照(C)高效液相色谱图
2.5.2 溶液的制备
2.5.2.1 对照品贮备溶液的制备 取金丝桃苷对照品适量,精密称定,置于25 ml量瓶中,加入适量70%甲醇溶解后,再加70%甲醇稀释至刻度,摇匀,即得质量浓度为0.164 8 mg/ml的对照品贮备溶液。
2.5.2.2 供试品溶液的制备 分别称取S1~S10药材粉末(过50目药典筛)约1 g,精密称定,记录称样量,置具塞锥形瓶中,加70%甲醇50 ml,称定重量,水浴回流提取60 min,放冷,再称定重量,70%甲醇补足减失重量,摇匀,滤液用0.45μm微孔滤膜过滤,取续滤液,即得。
2.5.3 线性关系考查 分别精密吸取“2.5.2.1”项下金丝桃苷贮备液0.5、1.0、2.0、3.0和5.0 ml,置于10 ml量瓶中,加70%甲醇稀释至刻度,摇匀,即得1~5号对照品溶液。精密吸取上述对照品溶液(1~5号)及“2.5.2.1”项下金丝桃苷对照品贮备液(6号)各20μl,注入液相色谱仪,按照“2.5.1”项下色谱条件进样测定,记录峰面积。以峰面积为纵坐标(Y)、对照品的质量浓度为横坐标(X)作线性回归,得到金丝桃苷线性回归方程为Y=34 544X+182.67(r=0.999 2),线性范围为0.008 24~0.164 80 mg/ml。
2.5.4 精密度试验 精密吸取“2.5.3”项下4号线性金丝桃苷对照品溶液,按“2.5.1”项下色谱条件,连续进样6次,测得金丝桃苷色谱峰面积RSD为2.61%(n=6),结果表明仪器精密度良好。
2.5.5 稳定性试验 取S1供试品药材粉末1份,约1.0 g,精密称定,按“2.5.2.2”项下方法制备供试品溶液,于0、2、6、10、12和18 h,按“2.5.1”项下色谱条件进样,测得金丝桃苷峰面积的RSD为0.66%,说明样品溶液在18 h内稳定。
2.5.6 重复性试验 取S1供试品药材粉末共6份,每份约1.0 g,精密称定,按“2.5.2.2”项下方法制备供试品溶液,按“2.5.1”项下色谱条件进样,测得金丝桃苷含量RSD为1.44%,表明该方法重复性符合要求。
2.5.7 加样回收率试验 取同一批已知含量的样品(编号S1)粉末约0.5 g,共6份,分别置于具塞锥形瓶中,精密加入金丝桃苷对照品溶液3 ml(按“2.5.2.1”项下方法,另配制金丝桃苷质量浓度为0.302 4 mg/ml的对照品溶液),再分别加入70%甲醇97 ml,按照“2.5.2.2”项下方法制成供试品溶液,然后按照“2.5.1”项下色谱条件进样测定,记录峰面积。采用外标法计算样品中金丝桃苷的含量,并计算其加样回收率。结果,金丝桃苷的平均加样回收率为100.53%,RSD为2.67%(n=6),表明该方法准确度高。金丝桃苷的加样回收率测定结果见表3。

表3 金丝桃苷的加样回收率测定结果(n=6)
2.5.8 含量测定 分别称取S1~S10药材粉末,每份约1 g,按“2.5.2.2”项下方法制备成供试品溶液,按“2.5.1”项下色谱条件进样,记录峰面积,外标法计算金丝桃苷含量,结果见表4。由表可知,除S6和S9样品中金丝桃苷含量较低外(金丝桃苷含量分别为0.49和0.46 mg/g),其余批次药材金丝桃苷含量均高于1.18 mg/g。根据相关文献指标性成分含量判定标准[21-23],初步拟定金丝桃苷含量不低于0.46 mg/g,以干燥品计为0.51 mg/g,即按干燥品计算金丝桃苷含量不得低于0.051%。
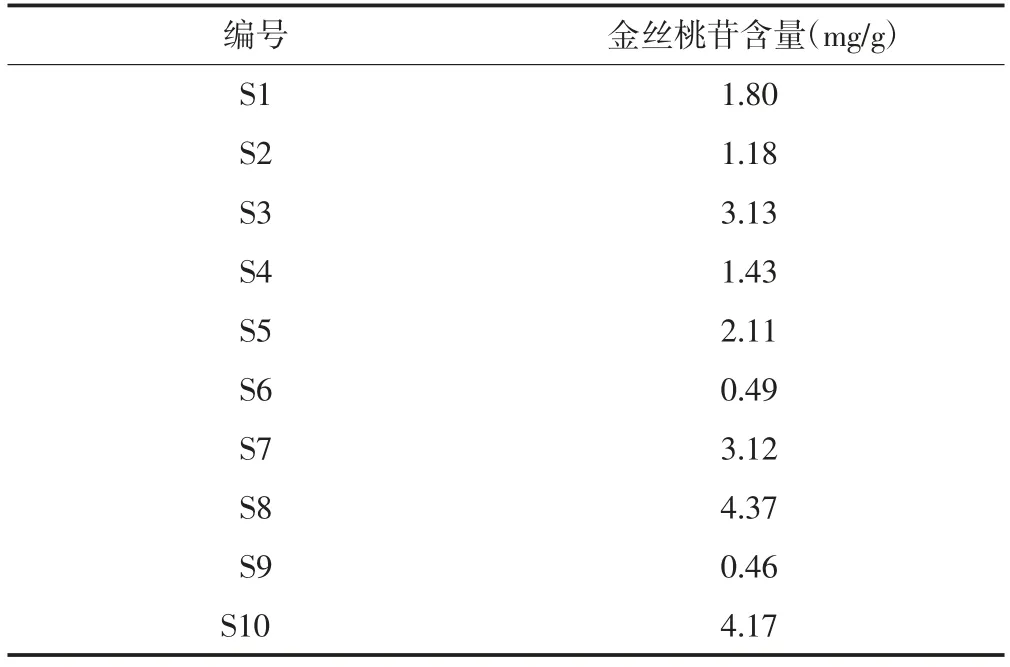
表4 金丝桃苷测定结果(n=3)
3 讨论
3.1 薄层色谱条件考查TLC研究过程中,考查了不同展开系统[乙酸乙酯-甲酸-水(30∶3∶2)、乙酸乙酯-甲酸-水(25∶2∶2)、乙酸乙酯-甲酸-水(33∶2∶2)、乙酸乙酯-甲酸-水(33∶4∶2)、乙酸乙酯-丙酮-甲酸(28∶3∶2)、正丁醇-丙酮-甲酸(28∶3∶2)]等条件下TLC结果,同时,也考查了各展开系统条件下硅胶H、硅胶G等不同硅胶薄层板对金丝桃苷TLC鉴别的影响,综合考虑,最终确定在硅胶GF254薄层板上,以乙酸乙酯-甲酸-水(33∶4∶2)为展开剂,作为金丝桃苷TLC鉴别条件。结果在上述条件下,TLC图成点性好、分离度高、斑点清晰可辨且荧光斑点清晰,表明本研究确定的TLC法耐用、可靠,可有效用于水冬瓜叶药材的定性鉴别。
3.2 供试品提取溶剂与提取方法的筛选 预试验考查了甲醇、70%甲醇、70%乙醇等溶剂,及超声提取、水浴回流提取等提取方法对水冬瓜叶中金丝桃苷含量的影响,发现70%甲醇水浴回流提取条件下,金丝桃苷含量相对较高,且峰形较好,分离度高,因此,确定70%甲醇水浴回流提取作为水冬瓜叶药材供试品的提取溶剂与提取方法。
3.3 HPLC分离条件筛选 预试验对HPLC分离条件进行了系统考查,筛选了甲醇-水、乙腈-水、甲醇-0.2%甲酸溶液、甲醇-0.2%醋酸溶液、甲醇-0.2%磷酸溶液、乙腈-0.2%甲酸溶液、乙腈-0.2%醋酸溶液、乙腈-0.2%磷酸溶液等流动相比例,最终发现乙腈-0.2%磷酸溶液分离效果最佳。采用Agilent 1260型高效液相色谱仪DAD检测器多波长筛选金丝桃苷检测波长,并参照《中国药典》中收载的有关金丝桃苷检测波长,发现360 nm下金丝桃苷(均大于1.50),峰高最高,且峰面积最大,表明金丝桃苷在此波长下吸收均较大,可用于金丝桃苷含量测定。
3.4 HPLC法耐用性考查 试验考查了Agela Promosil C18色 谱 柱(250 mm×4.6 mm,5μm)、Diamonsil C18色谱柱(250 mm×4.6 mm,5μm)等色谱柱,柱温(33和37℃),流速(0.9和1.1 ml/min),发现金丝桃苷峰形较好,可与相邻峰达到基线分离,且金丝桃苷含量测定结果无明显差异。
3.5 浸出物测定条件筛选 依据药材所含成分的理化性质,考查了不同提取溶剂(水、10%乙醇~无水乙醇、乙醚)在不同浸出方法下对浸出物的影响,最终确定用水作为溶剂,采用“冷浸法”进行浸出物测定。
综上所述,本试验对民族药水冬瓜叶TLC鉴别、水分含有量、总灰分含有量、浸出物含有量、金丝桃苷HPLC含量测定方法,进行了较为系统的研究,并初步拟定药材限量要求,质量标准可用于民族药水冬瓜叶药材的质量控制。
