智能医学在食管癌早期诊断及治疗中的应用进展
2023-01-17李佳怡石林林马丽霞高社干
李佳怡,刘 轲,石林林,喻 莹,马丽霞,高社干
智能医学,顾名思义,就是“智能”的“医学”,其中智能是手段,医学是目的[1]。从广义来说,是通过人工智能(artificial intelligence,AI)的方法,辅助或替代人类进行医疗行为的科学。因此,智能医学是一门集工科和医科之大成的交叉融合学科,其特征是人工智能、虚拟现实、大数据、移动互联网等信息技术与医学的融合和应用[2]。此外,还有智慧医疗、移动医疗、数字医疗等相关技术都属于智能医学的范畴[3]。
智能医学的应用十分广泛,几乎涵盖医学的所有领域,如医学影像识别、疾病预测、临床医疗智能决策、虚拟助理、药物研发、健康管理、生物技术、疾病辅助诊断等,可以实现疾病诊疗过程全覆盖[4]。目前我国在智能医学领域也颁布了很多政策来支持,见表1。此外,利用人工智能提取海量临床信息可以对由于个体基因、细胞、生理微环境、生活习惯和生存环境等差异造成的疾病异质性进行全面分析,可在治疗前期进行准确分类及制定个体化治疗方案,可在治疗后期及时进行疗效评估及治疗方案调整。
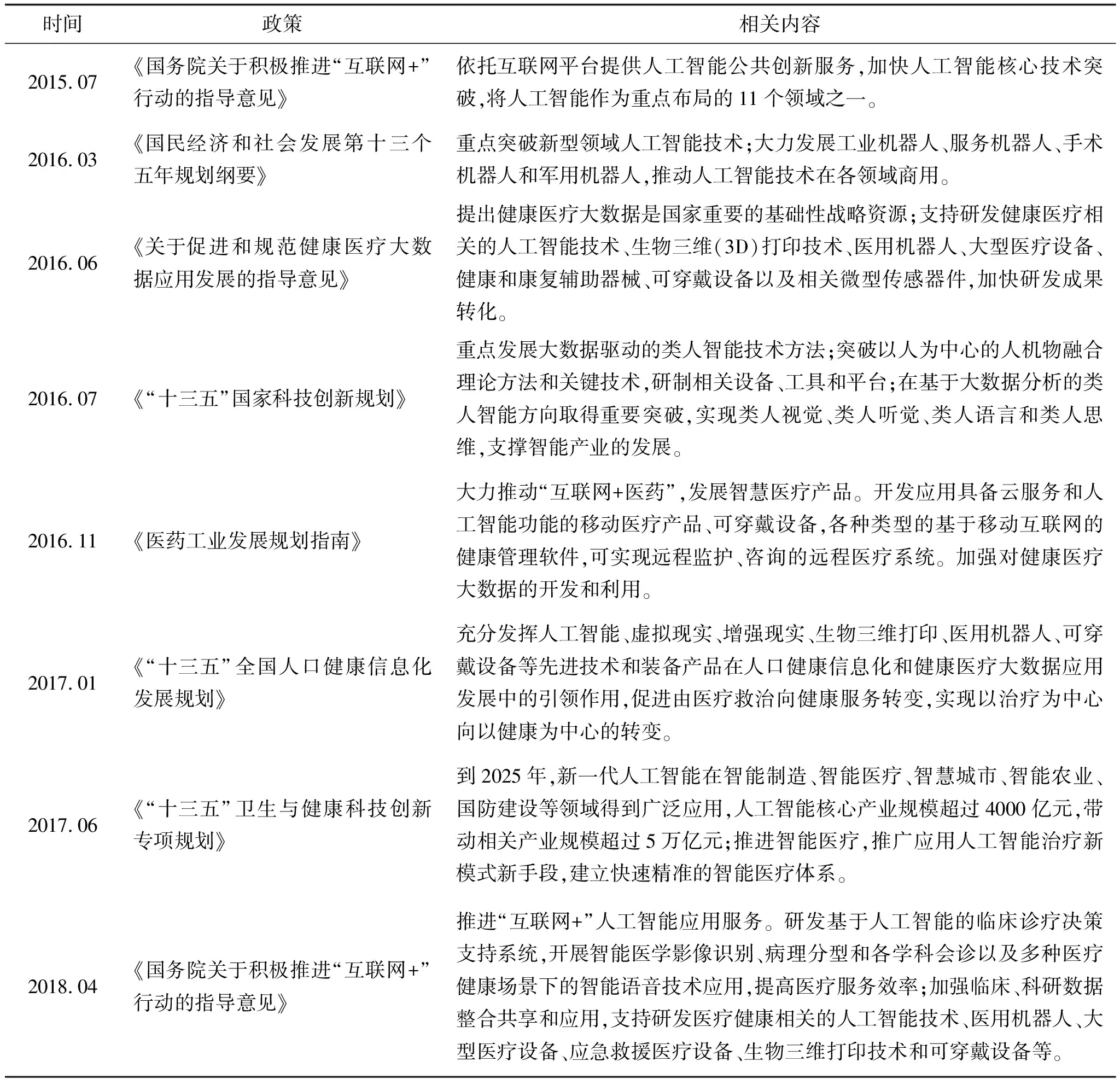
表1 中国智能医学政策支持
1 智能医学在食管癌流行病学研究中的应用
流行病学主要研究特定人群中疾病的分布、决定因素和防治措施,是预防医学的重要组成部分。流行病学最早用于揭示传染病流行的原因,随后又被用于研究非传染病的病因,尤其是恶性肿瘤、心脑血管疾病等一些慢性病。数据的收集和分析是流行病学研究的两个重要组成部分。随着信息搜索和采集由人工方式向多元化的智能方式的转变,可供人们使用的医疗数据越来越多,数据维度也越来越大。大量信息为人们了解疾病提供了全面的数据支撑,同时也带来了信息冗余的问题。传统方法难以处理规模如此庞大且复杂的数据,人工智能为此提供了一种好的思路和方法[5]。
1.1 决策树模型
决策树模型是一种常用的机器学习分类算法,采用树形结构对实例进行分类,符合人类的思维方式[6]。相对于传统的回归方法,决策树模型可简单、快速、准确地实现离散属性数据的分类。决策树由节点和有向边组成,其中节点包含一个根节点、若干个内部节点和若干个叶节点。内部节点表示一个特征或属性,叶节点表示一个类别。简单而言,决策树是一个多层if-else函数,其通过对各项指标进行多层if-else判断来获取目标属性的类别[7]。
一些学者采用决策树模型对食管癌进行了相关研究[8]。张继等综合考虑了性别、年龄、婚姻、入院诊断、术前住院天数、住院天数、护理天数、出院情况及手术方式等住院费用的影响因素,应用决策树构建了食管恶性肿瘤病例住院费用影响因素模型,该模型包含3层10个分类[9]。基于决策树的模型从多种影响因素中提出了分类规则,并得出各类别住院费用的参考值范围,对制定食管恶性肿瘤住院费用标准具有参考价值。许琼琼等进一步将住院天数作为影响变量纳入决策树模型,对食管癌患者的住院费用进行了研究。具体对南通市某肿瘤专科医院11 784例食管癌患者进行住院费用分析,以住院天数为影响变量,以性别、年龄、伴随疾病、并发症、治疗方法等作为分类节点,研究参数设置如下:决策树最大深度为3,父节点的最小样本数为100,子节点的最小样本数为50[10]。采用基于数据挖掘的决策树模型进行费用测算评价,为医保预付费制度的实施提供了依据。
1.2 支持向量机模型
支持向量机(support vector machine,SVM)是一种比较常见的机器算法,能够很好地实现分类和识别。支持向量机以统计学理论为基础,具有完美的数学形式和直观的集合解释。支持向量机的核心思路是在已知的样本数据条件下,通过构造最优分类面将样本数据分离。
支持向量机在食管癌的特征分类与预测方面也有相关研究。杨芳等利用主成分分析法(principal component analysis,PCA)和支持向量机SVM对新疆哈萨克族食管癌X射线图像进行特征提取、特征选择及分类研究[11]。利用基于灰度共生矩阵的纹理特征和小波变换的频域特征提取法,提出将受试者工作特征曲线(receiver operating characteristic curve,ROC)面积选择法和主成分分析法相结合的两步式特征选择法,利用Bayes和SVM分类器对图像进行分类以验证所提取特征的分类能力。结果表明SVM具有较好的分类性能,两步式特征选择法能有效地消除特征之间的共线性,极大提高了特征的分类能力。张天等利用支持向量机建立食管鳞状细胞癌术后生存期预测模型,并评估该模型判断食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)生存期的效能[12]。研究结果表明,ESCC-SVM模型由性别、T分期、组织学分级、淋巴结转移、TNM分期、14-3-36和gp96等7个最优属性组成;模型区分训练组和测试组ESCC五年整体生存率的最大ROC曲线下方的面积大小(area under curve,AUC)分别为0.96和0.86,准确率分别为97.7%和90.0%,明显优于目前临床应用的TNM分期(准确率分别为62.5%、67.5%)及其他各临床病理属性;ESCC-SVM与性别、T分期、组织学分级、淋巴结转移、TNM分期和14-3-36均显著相关。SVM在早期食管癌病理性质分类方面的高准确性和高特异性,可以协助医生根据每位患者的病情制定治疗方案,也可为治疗后评估疗效及更改治疗方案提供帮助。
1.3 BP神经网络
BP(back propagation)神经网络是一种按照误差反向传播来训练神经网络的方法,是一种应用十分广泛的人工神经网络。BP神经网络通常由3层组成:输入层、隐含层与输出层。一般而言,输入层神经元的个数与输入指标(如无症状人群的血液指标、环境因素和家族史等)个数相同,输出层的个数与类别数(如患病和不患病等)相同,隐含层的层数与神经元数均可以自定义。
PPP从设立、建设、运营到移交的整个运行周期都涉及税收问题,完善的税收政策有助于落实税收法定原则,增强项目主体参与的积极性;有助于全面贯彻风险—收益匹配原则,增强项目收益测算的准确性;有助于提升社会治理能力,增强项目的经济效益和社会效益。因此,完善和优化PPP税收政策对于推进政府和社会资本合作具有重要作用。
BP神经网络具有大规模并行、分布式处理、自组织、自学习等优点,目前已在胃癌、乳腺癌、宫颈癌、食管癌等恶性肿瘤的早期筛查中得到应用。薛佳殷等通过建立误差反向传播人工神经网络(back popagation artificial neural network,BP-ANN)预测模型分析本地区与胃部高危疾病有关的影响因素并评价模型预测效果,所建立的BP-ANN可以用于筛检胃癌高危人群[13](准确率:91.549%,AUC:0.929)。孔喜梅设计了两个BP神经网络对哈萨克族食管X射线图像进行分类识别,一个用于区分正常食管和病理食管,另一个用于区分蕈伞型、溃疡型和浸润型食管癌[14]。采用分类准确率和Kappa值来评价分类性能,结果表明基于BP神经网络的分类器取得了较高的分类准确率。徐继承等采用自制问卷,对调查对象的50项指标(如一般情况、饮食习惯、身体状况等)及是否患病进行分析,建立了基于修剪算法BP神经网络的食管癌发病预测模型[15]。随机选择样本中70%的病例作为训练集,其余作为测试集来测试模型预测精度,与C5.0决策树模型和传统Logistic回归模型的对比结果验证了所建模型的优越性。
1.4 卷积神经网络
卷积神经网络(convolutional neural networks,CNN)是一类包含卷积计算且具有深度结构的前馈神经网络,是深度学习的代表算法之一[16]。卷积神经网络具有表征学习能力,能够按其阶层结构对输入信息进行平移不变分类,在基于医疗数据和图像分析的疾病检测、分类等方面有良好的表现。
石善江等验证了一个基于卷积神经网络的人工智能系统技术模型,通过腾讯觅影人工智能系统技术模型对2 120张图像进行验证,同时在交给4名内镜医师进行诊断[17]。分析统计结果显示,基于卷积神经网络的人工智能模型用于早期食管癌预测的准确率为88.4%(1 875/2 120),敏感度为89.6%(258/288),特异度88.3%(1 617/1 832),每张图像的诊断时间为(0.25±0.03) s,均优于4名内镜医师,可在临床白光内镜中辅助内镜医师进行诊断[18]。利用人工智能高特异性和敏感性的优势,可应用到临床上早期食管癌筛查,提高确诊率,减轻医生在食管癌早期筛查领域的负担。
2 智能医学在食管癌早期诊断中的应用
2.1 支持向量机
SVM是在统计学习理论的VC维理论和结构风险最小化原则的基础上提出的一种新的模式识别技术,它追求的是在有限样本情况下的最优解[19]。近年来,支持向量机被用于对癌细胞、肿瘤组织的识别判别中,一是用于对相关癌症的高维基因数据筛选,得到有意义的基因表达变量;二是用于医学图像处理中,通过构造相应的支持向量机模型,提高医学图像的识别准确率[20]。
Sommen等研究了早期食管腺癌的计算机辅助诊断(computer-aided diagnosis,CAD)系统,提取了内窥镜图像的局部颜色和纹理特征,利用SVM对其进行分类,查全率和查准率分别为0.95和0.75[21]。Ghatwary等将黏膜分为4种组织病理学类型,并使用SVM和随机森林,对96名患者的557张图像进行了评价[22]。SVM分类器基于“一人一病”交叉验证,以96.05%的准确率取得了最佳的分类效果。准确的分类黏膜的组织病理学类型,对于预防食管癌的发生至关重要,该方法可以辅助医生判断,有助于食管癌疾病的早期预测干预[23]。Wang等通过基于计算机断层扫描的支持向量机模型诊断食管癌的淋巴结转移。对接受了术前化学疗法和根治性手术的131例食道癌患者[24],基于CT指标(肿瘤厚度,肿瘤长度,肿瘤CT值,淋巴总数,CT图像上的淋巴结,最大淋巴结的长轴和短轴大小)构建支持向量机模型并用来预测淋巴结转移。通过结果分析可以得出结论,基于CT指标的支持向量机模型可以帮助诊断食管癌的淋巴结转移。
2.2 随机森林
随机森林(random forests,RF)是一种利用多个分类树对数据进行判别与分类的方法,它在对数据进行分类的同时,还可以给出各个变量(基因)的重要性评分,评估各个变量在分类中所起的作用[25]。随机森林方法凭借其精度高、不易过拟合等优势,成为近年来生物医学及生物信息学热门的前沿研究领域之一[26]。
对于食管癌患者来说,淋巴结转移是影响食管癌治疗预后的重要因素[27]。冯飞跃等采用随机森林分类方法从转录水平分析,筛选出食管癌淋巴结转移相关基因,并对其进行功能聚类[28]。对食管癌淋巴结转移的标志分子及转移驱动机制方面研究的靶点选择具有重要的参考作用。对食管癌患者的预后进行预测可有助于个性化癌症治疗。Paul等提出了一种从正电子发射断层扫描(positron emission computed tomography,PET)图像和临床数据提取的新的特征选择策略,称为GARF(基于随机森林的遗传算法)。预测和预后结果均显示GARF的性能优于其他4种方法[29]。茹仙古丽·艾尔西丁等通过选取溃疡性、缩窄型和蕈伞型食管癌X线图像各560张,提取了灰度共生矩阵、灰度直方图和混合特征,通过调整参数进行分类研究,探讨了RF和C4.5决策树对X线食管造影图像分型中的应用,验证了分类器对特征的分类能力[30]。结果表明使用RF和C4.5决策树对溃疡型和缩窄型食管癌进行分类,灰度直方图特征的分类准确率比灰度共生矩阵特征的平均高10%,混合特征更适合于溃疡型、缩窄型食管癌的分类。而灰度直方图特征更适合于溃疡型、蕈伞型食管癌的分类,RF的分类能力比C4.5决策树高。此算法可为X线食管造影图像的分类提供参考。
2.3 卷积神经网络
与其他神经网络相比,卷积神经网络需要的参数相对较少,其在计算机视觉领域应用较广。由于CNN在大型图像处理方面的优势,目前CNN已经被大范围应用于医学图像的分类、检测、分割等领域。
Horie等应用卷积神经网络对384名食管癌和非食管癌被试者的8 428张内镜图像进行分析,仅用时27 s,就成功将食管癌患者给辨识出来(包括7个病灶直径<10 mm的病人),准确度达到98%[31]。Deng等开发了一套食管癌智能诊断系统。本方法需要采集食管癌医学图像,并与历年采集得到的与食管癌相关的医学图像进行比较,通过数据标注、图像预处理、数据增强、深度学习等步骤,最终建立食管癌图像智能诊断系统[32]。该方法提高了食管癌影像诊断识别率和医生工作效率,同时提高了基层医疗机构食管癌诊断水平,降低了食管癌患者死亡风险。Fumiaki等利用8 428张食管癌的训练图像,通过卷积神经网络发展了深度学习在食管癌智能检测方面的应用,该方法不仅适用于食管鳞癌,而且适用于食管腺癌[33]。研究者使用49例食管癌患者和50例非食管癌患者的1 118张测试图像评估了CNN在食管癌诊断方面的准确性[34]。CNN仅用27 s就得到了1 118张测试图像的分析结果,该方法正确检测出食管癌病例的敏感度为98%。如上所述,在早期食管癌诊断中,CNN可以应用于影像学检查,帮助医生早期发现癌症,提高食管癌早期确诊率,减少漏诊。
2.4 贝叶斯网络
贝叶斯网络(bayesian network),又称有向无环图模型(directed acyclic graphical model,DAGM),是一种概率图模型[35]。根据概率图的拓扑结构,该方法考察一组随机变量{x1,x2,…,xn}及其n组条件概率分布(conditional probability distributions,CPD)的性质[36]。
葛辉等采用多水平贝叶斯模型研究了2005年至2010年灵璧县各村庄食管癌死亡率空间分布特征。通过空间相邻关系,该方法评价了村庄空间结构对村庄食管癌死亡率交互影响作用[37]。他们分析的结论是食管癌死亡聚集性发生可能与这些区域存在着共同的危险因素或保护因子有关,这为探索分析食管癌危险因素提供依据。邵华飞等利用Bayes判别分析初步建立诊断食管癌淋巴结转移的各种CT征象的联合诊断模型[38]。利用自身检验法所得诊断模型的符合率为87.7%,误判率为12.3%。通过Bayes判别分析法所建立的不同CT征象对食管癌淋巴结转移的联合诊断模型具有一定的诊断价值,但诊断模型还有待进一步完善[39]。
杨守鑫等研究螺旋CT多平面重建技术(multiplanar reformantion,MPR)后综合横、矢、冠状面获得的淋巴结多平面形态学特征相较于传统CT扫描获得的横断面淋巴结形态学特征对食管癌转移淋巴结诊断效能的差异性[40]。仅以淋巴结短径作为食管癌转移淋巴结的诊断标准,淋巴结横断面短径和多平面短径作为诊断标准的曲线下面积分别为0.822、0.836,但差异无统计学意义。Doosti等采用马尔可夫链蒙特卡罗方法,得到了贝叶斯方法中效应大小的集合估计[41]。采用随机效应模型,对混合风险比率进行了分析。分析表明,与单纯手术及其它治疗相比,局部复发手术加紫杉醇、顺铂及放疗治疗效果更好。在排名方面,SPCRT(surgery+paclitaxel+cisplatin+radiotherapy)、放疗和手术是网络中的三种治疗方法。然而,算法的精度似乎优于贝叶斯方法,但在两种方法中,处理排序的结果都是相同的[42]。由此可见,这些计算方法有望在排查淋巴结转移和诊断发挥潜力,成为医生的好助手。我们需要更多地去发掘和掌握人工智能。
3 人工智能在食管癌治疗中的应用
为了满足日益增长的医疗需求,现代医疗技术正转向使用人工智能方法,人工智能不仅能够优化治疗方式,减少复杂的手术时间,提高手术效率,还能够针对不同的患者信息,建议个性化的治疗方法和药物剂量[43]。目前人工智能在食管癌治疗领域的应用还处于初级阶段,但在其他肿瘤治疗中的成功应用为食管癌的治疗提供了可借鉴的经验。
3.1 深度神经网络
放疗是使用高剂量的辐射来杀死癌细胞,但辐射对于病人的健康组织也会造成伤害,如果剂量“个性化”,就能减少对病人的负面影响。Lou在知名医学刊物《柳叶刀》发布论文,采用深度神经网络(deep neural networks,DNN)算法搭建AI框架,分析扫描并创建了预测治疗结果的图像特征,模型能够得到建议的最佳放疗剂量[44]。相比普通神经网络,DNN网络用较少神经元去拟合同样的函数,节省资源,表达能力更强。模型结合病人治疗前的X射线信息和电子病历信息,扫描输入到深度学习模型来训练AI系统,基于五折交叉验证的实验,80%的数据用来训练模型,20%的数据用来测试,评估了DNN的预测性能。让放疗真正做到个性化,最终把副作用降到最低,让治疗的失败率降低到5%以下[45]。
深度神经网络算法发展迅速,应用广泛,在癌症的相关治疗中有着不俗的表现,不仅能够给患者建议合适的放疗剂量,还能给患者推荐个性化的治疗方式[46]。在患者的治疗中提供出色的辅助作用,辐射出了精准医学的飞跃。深度神经网络基于大量数据的特性,提取有效的特征信息,通过网络内部复杂的结构对癌症的特征进行分析处理,找到有规律的模型[47]。有望在食管癌的治疗领域中发挥重要作用,基于大量的食管癌患者的图像信息,通过深度神经网络算法的学习和训练,得到反映出图像和治疗方式或者治疗模型之间关系的模型,为医师和患者提供辅助性决策和个性化的治疗建议。
3.2 贝叶斯网络
贝叶斯网络是一种概率图模型,模拟人类推理过程中因果关系的不确定性处理模型,以简单的结构和良好的性能受到人们的关注。Zhang采用贝叶斯网络和系统回顾的方法对食管癌放射治疗中的最佳中草药注射剂进行了分析,最终得到复方苦参注射液联合放疗是食管癌患者的最优选择[48]。贝叶斯网络用来有效地增加样本量,并为不同类型的中草药注射剂联合放疗对食管癌的治疗效果进行评估。贝叶斯方法通过大量的模拟,估计了感兴趣事件的概率分布,通过随机效应模型中的马尔可夫链蒙托卡罗(markov chain monte carlo,MCMC)方法以直观的解释产生了结果,而网络分析的研究方法与临床差异决定了随机效应模型的选择。研究共包含685个实验,其中有55个符合纳入研究的条件,每个实验包括12种中草药注射剂和4 114名参与者的信息[49]。分析得到,华蟾素和康艾注射液在提高1年和2年生存率方面有较大优势,慢病毒素注射液可以缓解药物的副作用,而复方苦参注射液可通过减少胃肠道反应和放射性食管炎对放疗患者提供治疗益处。
贝叶斯网络不仅过程简单,训练速度快,还能够在小样本的学习上达到较好的预测分类效果,是最优秀的分类器之一。凭借其出色的网络性能,能够在患者的治疗阶段中提供合适的个性化治疗方式,显著提高了患者的治疗效果。贝叶斯网络的不定性因果关联模型和强大的不确定性问题处理能力,能有效地进行多元信息表达与融合,可将诊断与决策相关的各种信息纳入网络结构中,按照节点的方式统一进行处理,有望在食管癌的治疗阶段对患者的治疗相关的各方面信息进行融合处理,为患者提供较好的手术方式建议和治疗药物建议,为患者的个性化治疗做出有效的辅助决策[51-53]。
3.3 其他AI方法高效率协助癌症治疗
传统的治疗方式中,磁共振成像(magnetic resonance imaging,MRI)能帮助放疗技术更加精准地攻击病灶,通过提供特殊的MRI设备,能够做到在放疗过程中追踪病灶[54]。而AI技术能够再推进一步,提高勾画精度和治疗效率。比如中国的柏视医疗,其鼻咽癌放疗临床靶区自动勾画系统可同时自动勾画GTV(肿瘤区)和CTV(临床靶区),将单个鼻咽癌患者的CTV勾画时间从2~4 h缩短到10 min内,勾画效果接近于鼻咽癌放疗专家的水平。
在图像引导放疗过程中,图像的准确定位至关重要,配准技术的准确度决定了放射治疗的有效性和准确性。Wu采用神经网络的方法提出了一种配准质量评估模型,以用于脑肿瘤放射治疗中的儿科患者,有效改善了放疗中2D/3D图像配准的鲁棒性。
除了放化疗和外科手术外,热消融也是癌症治疗的一种方法,通过借助热来治疗早期肿瘤,对于患者、特别是无法进行手术的患者来说是最佳的替代疗法之一。然而,执行热消融的医生通常没有有效的工具查看,并且在控制手术过程中易产生损伤,这意味着肿瘤可能切除不完整,也可能导致人体的健康组织损伤。而且,医生还需要等待长达24 h的时间才能知道手术是否有效。为应对这一问题的挑战,Techso Med开发出世界上第一个用于热消融的实时监控系统Bio Trace,将AI算法应用于超声设备上的图像数据,以此在热消融过程中执行监测和分析。该技术可跟踪组织的实时生物反应,让医生可以更好地了解癌症治疗的结果。
机器学习通过算法进行训练和自我迭代改进,能够同时处理数量庞大和复杂的数据,协助医生“精确”回答何种治疗方式更有效的问题[55]。其中乔良对246例中晚期食管鳞癌患者基础资料建立行性回归机器学习模型分析,发现机器学习可以有效预测患者生存期(输出模型可以解释生存期79.1%的变异)。王延峰团队与王立东团队合作,构建了基于支持向量机、随机神经网络、反馈式神经网络等预测模型,并用模型对五百多例食管鳞癌患者术后的生存期进行预测,预测精度能够达到80%以上,并筛查出白细胞计数、单核细胞计数、中性粒细胞计数、凝血酶原时间和国际标准化比例等5个能够显著影响生存期的指标[56]。
基于机器学习的AI算法应用广泛,以其强大的存储能力、海量的运算能力能够对患者各方面的信息进行综合考虑,从而给出个性化的治疗方案和精确的预测结果[57]。因此机器学习的特点决定了需要有大量的数据供其训练、学习,然而目前数据量小是制约机器学习精度的一个重要方面。后续的研究中,随着更多数据集的纳入,算法的进一步改良,机器学习有望在食管癌的个性化治疗及生存期预测等方面取得更加精确的结果。
4 展望
智能医学已在食管癌等恶性肿瘤的早期筛查、智能诊断、辅助治疗等方面取得了优于传统方法的成绩。目前AI已经在医疗系统的各个方面得到应用,但离人们对人工智能的期待还有一定差距,不过可以预见随着人工智能技术的不断发展,未来的医疗体系将进入强智能或全智能时代[58]。目前,人工智能正处于高速发展时期,各个国家出台了一系列支撑人工智能发展的政策。人工智能在医疗领域的应用,为医疗行业带来了深刻的变革和曙光。基于目前智能医学的发展问题与未来趋势,并结合我国人工智能起步晚的现状,食管癌AI模型及分类方法应结合临床大数据、智能设备技术、可识别的结构化数据等进行开发,在食管癌的基础研究、诊治与预后、药物开发等方面取得更大的突破,以推动食管癌的个体化精准医疗系统实现疾病诊断和治疗的精准化、精细化。
