牙龈卟啉单胞菌感染星形胶质细胞对食管癌细胞增殖、迁移及侵袭的影响
2023-01-17张顶彧郭静宜张秀森刘书培申刘青石林林高社干
张顶彧,郭静宜,张秀森,刘书培,申刘青,石林林,2,原 翔,2,高社干,2
食管癌(esophageal cancer,EC)发病率居我国恶性肿瘤的第五位,超过半数患者在确诊时已出现转移。虽然EC转移的恶性程度很高[1],但EC转移细胞在脑的定植是一个非常低效的过程,EC的脑转移非常罕见[2]。大脑微环境对侵入的细胞有强烈的选择性压力,可以消除大多数越过血脑屏障(blood-brain barrier,BBB)的癌细胞,正是大脑这种独特的微环境维持着生理上的动态平衡,并协调着对包括癌症在内的病理失调的反应[3]。
牙龈卟啉单胞菌(Porphyromonasgingivalis,Pg)已被确定为EC的重要风险因素[4]。研究表明,Pg感染可以显著增强EC细胞的增殖、迁徙及侵袭能力,促进食管癌细胞向远处转移[5]。并且Pg可以通过诱导EC细胞线粒体自噬,从而维持在EC细胞内的定植状态[6]。Pg的一过性菌血症可发生在刷牙、用牙线和咀嚼等常见活动中,也可在牙科手术中发生[7],导致Pg会向各种组织转移,包括冠状动脉和食道[4,8]。最新研究表明,Pg可以在脑内定植,改变大脑微环境,诱发阿尔兹海默症[9]。
星形胶质细胞(astrocytes,As)是脑微环境的重要组成部分,在维持大脑内稳态方面发挥许多功能,并在组织修复过程中发挥主要作用[10]。研究表明,Pg在大脑中的持续生长会影响大脑微环境,并导致特定细胞类型的分子模式发生改变[11]。而趋化因子C-C配体2(chemokine C-C motif ligand 2,CCL2)是主要由As产生的趋化因子[12]。CCL2的过表达可以加速肿瘤的生长,促进肿瘤的局部转移[13]。
本研究以鼠源星形胶质细胞(mouse astrocytes,MAs)和鼠源EC细胞(mouse esophageal carcinoma cells,AKR)为研究对象,通过检测感染Pg后MAs的CCL2变化,及其对AKR细胞增殖、迁移及侵袭能力的影响,初步探讨Pg感染对大脑微环境及EC脑转移的影响,为预防和靶向治疗脑转移提供新的思路。
1 材料与方法
1.1 材料
Pg标准菌株ATCC 33277来源于本实验室,AKR细胞购自Bluefbio生命科学公司,DMEM 培养基、胎牛血清均购自Thermo公司,胰蛋白酶、青链霉素混合液购自索莱宝公司,CCK-8试剂购自Thermo公司,DMSO购自Sigma公司,基质胶购自Biozellen公司,Transwell小室购自Corning公司,15%及10%PAGE凝胶快速制备试剂盒均购自雅酶公司,PVDF膜购自milipore公司,e-ECL发光显影液购自雅酶公司,MCP-1 Monoclonal Antibody (2D8)(CCL2)和C-C趋化因子受体2(C-C chemokine receptor type 2,CCR2)Polyclonal Antibody均购自Thermo公司,CCR2 antagonist 4 hydrochloride购自MCE公司,倒置显微镜购自Nikon公司,全自动酶标仪、细胞培养箱购自 Thermo 公司,凝胶成像分析仪购自Bio-Rad公司,荧光共聚焦显微镜购自ZEISS公司。
1.2 方法
1.2.1 细胞培养MAs细胞和AKR细胞均培养于含体积分数10%胎牛血清、1%双抗的DMEM高糖完全培养基中,于37 ℃、体积分数5% CO2培养箱中常规培养,细胞生长至80% 融合时传代或冻存。
1.2.2 Pg培养Pg标准菌株ATCC 33277,于37 ℃、厌氧条件下培养,取对数生长期细菌感染细胞。每次感染细胞前,革兰氏染色后形态学检测及16S rDNA特异扩增确定Pg 33277无变异、无其它细菌污染。
1.2.3 细胞感染与条件培养基制备MAs细胞生长至80%以上时,吸去原培养皿内的细胞培养液,用PBS清洗2次,加入胰蛋白酶1 mL,于37 ℃、体积分数5% CO2培养箱中消化5 min,加入2 mL DMEM高糖完全培养基终止消化。将消化后的细胞悬液1 000 r·min-1离心5 min,弃去上清,用1 mL DMEM高糖完全培养基重悬细胞,细胞计数,向新培养皿内加入(1~10)×106个MAs细胞,于37 ℃、体积分数5% CO2培养箱培养10~12 h至细胞完全贴壁。弃去原培养皿内的细胞培养液,用PBS清洗2次,加入无血清无双抗的DMEM培养基。培养Pg使其OD值达1.0~1.5,将Pg悬液12 000 r·min-1离心10 min后用DMEM重悬。按照预定的感染复数(multiplicity of infection, MOI)值,根据培养皿内的细胞数目加入相应数量的Pg,随后于37 ℃、体积分数5% CO2培养箱培养3 d。3 d后,收集细胞培养液,4 000 r·min-1离心20 min,使用0.22 μm孔径的滤器过滤,贮存于-20 ℃冰箱保存。
1.2.4 蛋白质印迹使用放射免疫裂解缓冲液(Thermo)从细胞中提取蛋白质。将感染Pg后的MAs细胞弃去细胞培养液,用PBS清洗3次,弃去多余水分,加入裂解缓冲液进行蛋白质提取。用BCA蛋白质定量试剂盒(SolarBio)测定蛋白质浓度。将30μg蛋白电泳法转移到PVDF膜上,用脱脂牛奶封闭后与CCL2(1∶1 000)、CCL2(1∶500)和GAPDH1(1∶2 000)一抗共同孵育。将羊抗兔抗体(1∶2 000稀释于TBST,Abcam)与羊抗鼠抗体(1∶2 000稀释于TBST,Abcam)二抗孵育。用e-ECL发光显影液检测信号,用凝胶成像系统(Bio-Rad)采集图像,用Image Lab软件(Version 3.0)定量测量相应蛋白条带的密度,并根据目标蛋白条带密度与内参蛋白条带密度之比计算。
1.2.5 免疫组织荧光将鼠脑石蜡切片放于60 ℃烤箱中烘烤1~2 h,然后迅速放入二甲苯中脱蜡30 min。随后将组织切片放入梯度酒精中进行梯度水化,取出组织切片后用自来水冲洗3 min,将0.01 mol·L-1柠檬酸抗原修复液(pH 6.0)倒入容器中,放入微波炉高火5 min,烧开后放入组织切片,低火15~20 min,自然冷却1 h以上。将组织切片置于保存盒中,PBST冲洗3次,每次3 min。每张切片组织上滴加50 μL过氧化物酶阻断剂,避光孵育10~15 min。PBST冲洗3次,每次3 min。去除切片上的PBST,每张切片组织上滴加50 μL二抗来源的非免疫血清,室温封闭10~30 min,倾去勿洗。每张切片上滴加50 μL按适当比例稀释后的CCL2(1∶200)一抗,室温孵育1~3 h。PBST冲洗5次,每次3 min。去除切片上的PBST,每张切片上滴加50 μL按适当比例稀释后的鼠源荧光二抗,室温孵育1 h。PBST冲洗5次,每次3 min。弃去切片上的PBST,每张切片上滴加50 μL按适当比例稀释后的GFAP(1∶200)一抗,室温孵育1~3 h。PBST冲洗5次,每次3 min。甩去切片上的PBST,每张切片上滴加50 μL按适当比例稀释后的鼠源荧光二抗,室温孵育1 h。PBST冲洗5次,每次3 min。加入防淬灭的DAPI进行核染色,10~30 min,使用荧光共聚焦显微镜观察或封片保存。
1.2.6 免疫细胞荧光在MAs传代培养时,将细胞接种到荧光小皿中,接种数目为每皿1 000个。可选择感染或不感染Pg。待细胞贴壁后,使用PBS洗涤3次,每次10 min。使用4%甲醛室温固定1~2 h后,PBS洗涤3次,每次10 min。使用0.2% TritonX-100透化5~10 min后,PBS洗涤3次,每次10 min。使用5%BSA室温封闭30~60 min。用1%BSA稀释CCL2(1∶200)一抗,将荧光小皿置于湿盒中,室温孵育1~4 h。PBS洗涤3次,每次10 min。用1%BSA稀释鼠源荧光二抗至合适浓度,于湿盒中,室温避光孵育30~60 min。使用PBS洗涤3次,每次10 min。用1%BSA稀释GFAP(1∶200)一抗,将荧光小皿置于湿盒中,室温孵育1~4 h。PBS洗涤3次,每次10 min。用1%BSA稀释鼠源荧光二抗至合适浓度,于湿盒中室温避光孵育30~60 min。使用PBS洗涤3次,每次10 min。加入防淬灭的DAPI染色10~30 min后用共聚焦显微镜观察。
1.2.7 CCK8细胞增殖实验取对数生长期的AKR细胞,调整细胞密度为2×103个·mL-1,以每孔100 μL的体积接种于 96 孔板。接种24 h后弃去孔内原培养基,加入感染Pg的MAs细胞所收取的条件培养基,对照组细胞则加入不感染Pg的MAs细胞所收取的条件培养基,每组设置 3 个平行孔,并设置只含条件培养基的空白调零孔。分别于处理后的0、24、48、72 h,在对应时间点的孔中加入 10 μL CCK-8,避光混匀后置于培养箱中孵育 1~4 h,酶标仪检测 450 nm 处的吸光度值。实验重复 3 次。
1.2.8 划痕实验将AKR细胞接种于6孔板中,每孔培养1×105个细胞,置于培养箱中,直至细胞融合率达70%~80%。用无菌吸管尖端在每孔中刮出一个缺口,并记录划痕的位置。每孔加入不同处理的条件培养基(无血清),置于培养箱中常规培养。每隔12 h在每孔细胞的同一位置拍摄照片,用ImageJ软件(Version 1.52)测量不同时间点每孔空白区域的大小,计算迁移面积。实验一式三份,每份3个平行样品。
1.2.9 Transwell侵袭、迁移实验使用胰蛋白酶消化AKR细胞,加无血清的条件培养基重悬计数,将100 μL含7.5×104个细胞的悬液接种于不含基质胶的Transwell小室上室或含有基质胶的小室上室,小室下室均加入含体积分数 10%胎牛血清的完全培养基800 μL,置于培养箱中分别培养 24、36 h,取出小室,结晶紫染色,棉签擦除小室上层细胞,倒置显微镜下观察,选取5个视野(×100) ,计数细胞。实验重复3次。
1.2.10 统计学处理运用GraphPad Prism 9.4.1进行统计学处理。蛋白印迹实验、CCK 8细胞增殖实验、平板克隆形成实验、划痕实验和Trans well侵袭实验结果均采用t检验,以α=0.05为检验水准,P<0.05为有统计学差异。
2 结果
2.1 Pg感染与MAs分泌CCL2表达呈正相关
首先,为了研究MAs细胞是否能够分泌CCL2,使用免疫荧光来验证MAs上CCL2的表达。细胞免疫荧光显示,CCL2(PA5-23037)主要与MAs特异性抗体胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)共定位(图1A)。免疫组织荧光则在鼠脑组织内验证了上述结果(图1B),证明了MAs细胞可以分泌CCL2。接下来,为了研究Pg对体外培养MAs细胞分泌CCL2是否会产生影响,对感染Pg和未感染Pg的MAs细胞进行蛋白质印迹检测,结果显示Pg感染的MAs细胞分泌CCL2的能力增加(图1C、D)。使用免疫荧光对Pg与MAs分泌CCL2的相关性进行验证,结果发现,与对照组相比,感染Pg后的MAs细胞分泌CCL2的荧光强度升高(图1E、F)。
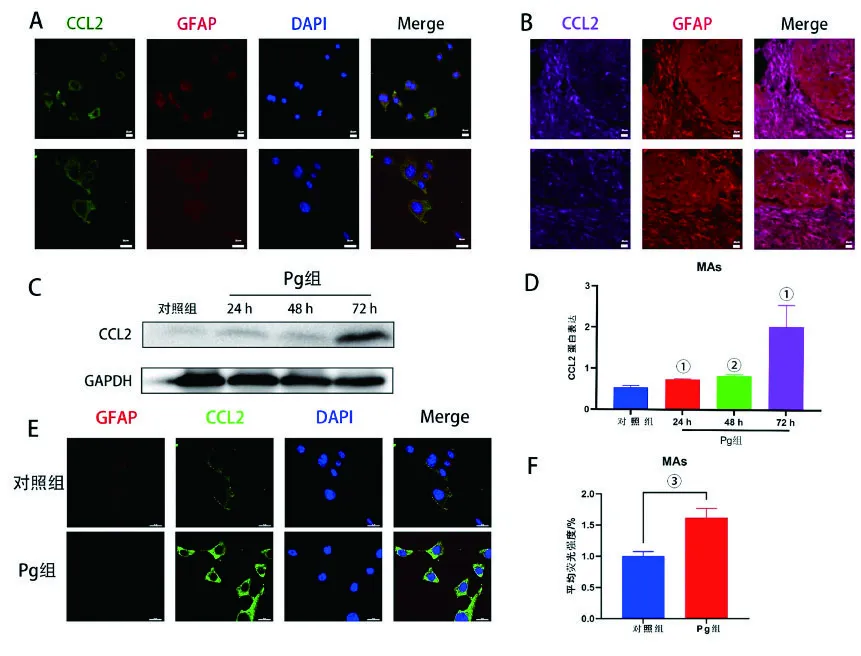
A:鼠源星形胶质细胞CCL2与GFAP免疫荧光共定位;B:C57小鼠脑组织CCL2与GFAP免疫荧光共定位;C:蛋白印迹法检测Pg感染对MAs细胞CCL2表达的影响;D:蛋白印迹结果量化图;E:免疫荧光显示Pg对MAs细胞CCL2表达的影响;F:免疫荧光结果量化图。结果以显示。①P<0.01;②P<0.001;③P<0.0001。
2.2 Pg感染MAs后促进AKR细胞的增殖、迁移及侵袭
为了进一步探究Pg感染MAs后脑微环境改变对肿瘤的影响,使用了条件培养基共培养法处理AKR细胞。为了避免Pg直接影响AKR细胞,所使用的条件培养基孵育MAs的时间都在48 h以上,且在加入AKR细胞的培养皿之前用滤器过滤(图2A)。结果显示,Pg感染MAs后的条件培养基培养AKR细胞,AKR细胞的增殖能力增强(图2B),且增殖能力与感染MAs的Pg数量呈正相关(图2C)。为了检测AKR细胞在与Pg感染MAs后的条件培养基共培养后,其迁移与侵袭能力的改变,使用划痕实验以及Transwell侵袭实验进行检测。结果显示,在划痕实验中,使用感染Pg的MAs条件培养基的AKR细胞比对照组细胞划痕愈合能力更强(图2D、E)。Transwell侵袭实验则显示,使用感染Pg的MAs条件培养基会使AKR细胞的侵袭能力更强(图2F、G、H)。上述结果表明,Pg感染MAs细胞后使AKR细胞的增殖、迁移和侵袭能力增强。
2.3 Pg通过星形胶质细胞的CCL2-CCR2轴促进AKR细胞的增殖、迁移及侵袭
研究表明,CCL2优先结合CCR2[14]。为了进一步研究星形胶质促进EC细胞增殖、迁移及侵袭的机制,决定研究在感染Pg的MAs条件培养基培养下的AKR细胞CCR2表达情况。Western印迹结果显示,使用感染Pg的MAs条件培养基培养的AKR细胞,其CCR2表达比对照组增强(图3A、B)。CCR2为趋化因子受体[15],接下来评估了阻断CCL2-CCR2轴是否会导致AKR细胞功能的改变。实验表明,当时用CCR2阻断剂(2 μmol·mL)处理AKR细胞后,使用感染Pg的MAs条件培养基的AKR细胞其增殖(图3C)、迁移(图3D、E)及侵袭能力均降低(图3D、F)。上述结果表明,Pg感染MAs后促进其分泌CCL2,与AKR细胞上的CCR2受体结合促进AKR细胞的增殖、迁移及侵袭。
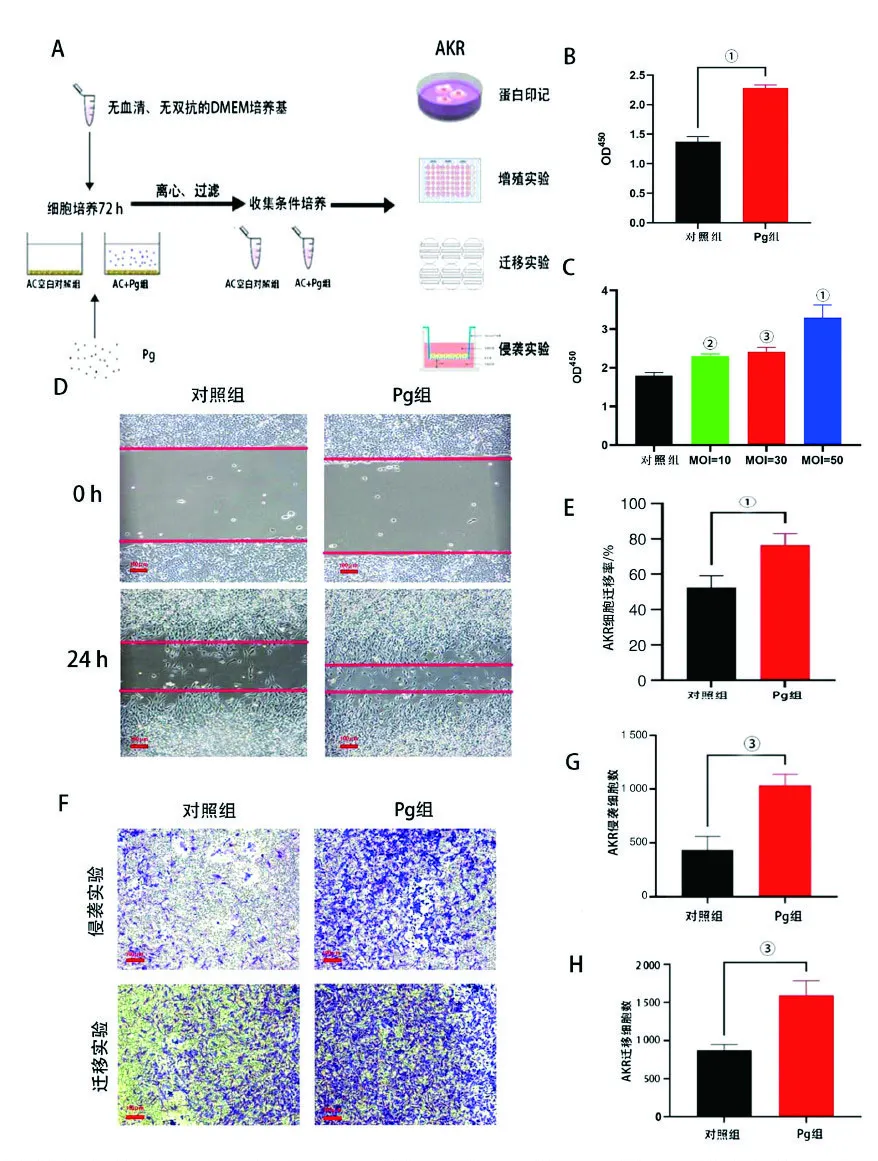
A:条件培养基制备示意图;B、C:CCK-8实验检测AKR细胞的增殖能力;D:划痕实验检测AKR细胞的迁移能力;E:迁移能力量化统计图;F:Transwell实验检测AKR细胞的迁移及侵袭能力;G、H:迁移及侵袭能力量化统计图。结果以显示。①P<0.0001;②P<0.05; ③P<0.01。
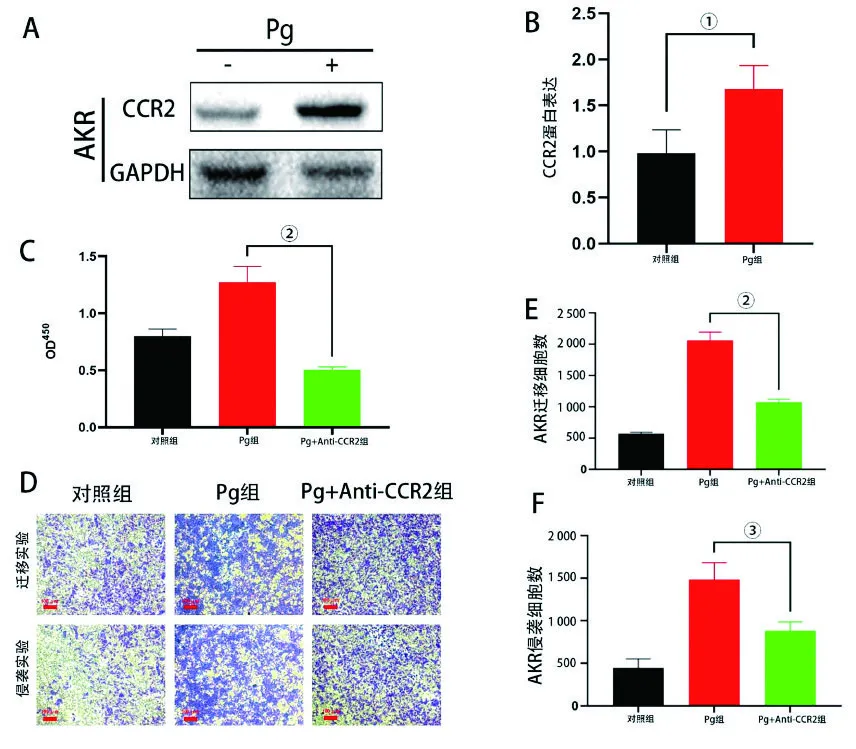
A:蛋白印迹法检测Pg感染MAs细胞的条件培养基对AKR细胞CCR2表达的影响;B:蛋白印迹结果量化图;C:CCK-8实验检测Pg感染MAs细胞的条件培养基中加入CCR2抑制剂后对AKR细胞增殖能力的影响;D:Transwell实验检测Pg感染MAs细胞的条件培养基中加入CCR2抑制剂后对AKR细胞的迁移及侵袭能力的影响;E、F:AKR细胞迁移及侵袭能力的影响。结果以显示。①P<0.05;②P<0.001;③P<0.01。
3 讨论
EC是常见的消化道肿瘤,全世界每年约有30万人死于EC[16]。EC脑转移缺乏筛选手段,且恶性程度大,中位生存时间往往不超过10个月[17]。Pg感染是诱发EC的关键因素之一,作为口腔疾病的关键致病菌,其含量异常增加能够导致口腔微生态失衡[19]。口腔微生态失衡不仅能够引起口腔局部组织破坏,还能够通过异常的全身免疫反应损伤远处组织,造成人体多种疾病的形成和进展[20]。同时,Pg已在大脑中被发现,可通过改变大脑微环境促进疾病的发生和发展[21]。因此,在EC脑转移中,Pg可能是促进EC向脑内定植及生长的潜在因素。
肿瘤脑转移的形成与脑部微环境的影响密切相关[22]。脑微环境对肿瘤在脑内的定植、生长有着密切关系,不仅会影响肿瘤的结构、功能和代谢,还会影响肿瘤细胞的核与胞质[23]。脑微环境包括肿瘤细胞周围的成纤维细胞、免疫和炎性细胞、胶质细胞等,其中就包括星形胶质细胞[24]。星形胶质细胞是哺乳动物脑内分布最广泛的一类细胞,参与了血脑屏障的构成,也是胶质细胞中体积最大的一种[25]。此外,星形胶质细胞可以分泌多种影响肿瘤转移的趋化因子,包括CXCL10、CCL2等[26]。
CCL2是CC类趋化因子家族成员[27]。作为在肿瘤微环境中重要并且研究广泛的趋化因子之一,CCL2通过自分泌或旁分泌促进肿瘤细胞生长与存活,参与肿瘤免疫耐受调节,诱导肿瘤血管生成,促进肿瘤侵袭和转移[28]。多项研究表明在乳腺癌、前列腺癌、肝癌、结肠癌、胰腺癌、胃癌和肺癌等肿瘤患者组织或血清中发现CCL2水平升高,且与肿瘤进展分级分期、侵袭转移和患者的预后密切相关[14]。星形胶质细胞分泌CCL2,而CCL2靶向肿瘤细胞的CCR2受体,促进肿瘤细胞的增殖与侵袭[29]。
在本研究中,通过免疫荧光及WB检测到Pg感染增强了MAs分泌CCL2的能力,验证了Pg对MAs的影响。接下来通过获取Pg感染后MAs的条件培养基,模拟了MAs与AKR细胞共培养的环境。在该条件培养下,通过CCK8实验、划痕实验和Transwell实验检测了AKR细胞的增殖、迁移及侵袭能力,证明了Pg感染后的MAs促进了AKR的增殖、迁移及侵袭,进一步验证了Pg可以通过影响脑微环境促进EC脑转移的猜想。最后,通过在条件培养基中加入CCR2抑制剂后观察AKR细胞的增殖、迁移及侵袭能力的变化,证明了MAs对AKR的促进作用是通过CCL2-CCR2轴来实现的。
综上所述,本研究初步证实了Pg在脑微环境中对MAs的调节机制。本研究的目的是为构建动物模型以及研究Pg感染人源星形胶质细胞后对食管鳞癌(esophageal squamous cell carcinoma,ESCC)脑转移影响做前期实验。根据研究结果推测,降低Pg在患者脑中的定植和降低星形胶质细胞CCL2的表达可能有助于预防和靶向治疗ESCC脑转移,并为其他癌症脑转移的预防和靶向治疗提供新的思路。
