大气压低温等离子体抑制甲状腺未分化癌CAL-62细胞生长的机制研究
2023-01-16张利伟宋文成王宏志
吴 慧,刘 芳,张利伟,3,刘 磊,4,宋文成,3*,王宏志,3*
(1.安徽医科大学 基础医学院,安徽 合肥 230032;2.中国科学院合肥物质科学研究院 安徽省医学物理与技术重点实验室,健康与医学技术研究所,安徽 合肥 230031;3.中国科学院 合肥肿瘤医院,安徽 合肥230031;4.安徽职业技术学院 环境与生命健康学院,安徽 合肥 230061)
甲状腺未分化癌是一种罕见的内分泌恶性肿瘤,具有易转移、发展迅速等特点,而且致死率高达50%以上[1].目前甲状腺未分化癌的常规治疗手段主要有手术、放疗、化疗和靶向治疗等,但是无论哪种治疗方式,患者预后并不良好[2-4],因此亟须一种新型有效的甲状腺未分化癌的治疗方式.
CAP是气体在电离状态下产生的物质,其主要成分包括紫外线、活性粒子、电子、离子等[5-6].因其具有可在大气压条件下产生、温度接近于室温等特点,故在生物医学领域具有良好的应用前景.研究表明,CAP在伤口愈合、杀菌、口腔医疗及癌症治疗等方面都具有重要作用[7-10].自从2007年首次发现CAP具有促进黑色素瘤细胞凋亡的作用后,等离子体抗癌作用成为研究的热点,目前已有研究报道CAP对于肺癌、宫颈癌、乳腺癌、肝癌、口腔癌等多种类型的癌症具有良好的抑制作用[11-14].一定剂量的CAP处理除了能诱导细胞凋亡以外,还可通过诱导细胞自噬和细胞坏死发挥作用.然而CAP抑制癌细胞的具体分子机制尚未明确.
笔者将CAP应用于抑制甲状腺未分化癌CAL-62细胞生长的研究,并使用生物信息学手段揭示等离子体处理对CAL-62细胞转录组变化情况,以探究等离子体抑制CAL-62细胞的分子机制,以期为CAP对甲状腺未分化癌的治疗提供一定的理论基础.
1 材料与方法
1.1 细胞系
人甲状腺未分化癌细胞株(CAL-62)购自广州赛库生物技术有限公司.
1.2 实验试剂和仪器
DMEM高糖培养基、磷酸盐缓冲液购自澳大利亚Gibco;胎牛血清购自上海双洳生物科技有限公司;胰蛋白酶细胞消化液、青霉素/链霉素(100×)购自生工生物工程股份有限公司;RIPA裂解液、硝酸纤维素膜、SDS-PAGE凝胶配置试剂盒购自碧云天公司;甲醇购自生工生物工程股份有限公司;Super SignalTMWest Pico PLUS化学发光底物购自Thermo公司;TRizol试剂盒购自Invitrogen公司;高纯氦气(99.999%)购自南京特种气体厂股份有限公司.倒置显微镜购自明美光电技术公司;化学发光仪购自Tanon公司.
1.3 方 法
(1)细胞培养.取对数生长期的贴壁细胞CAL-62接种于60 mm细胞培养皿中,使用含10%胎牛血清和1%青霉素/链霉素的DMEM培养基,在37 ℃,5% CO2条件下培养.
(2)CAP处理.使用介质阻挡放电等离子体装置,装置示意图如图1(a)所示.该装置的反应腔室内有4对由圆形铜板构成的高压电极和接地电极(直径分别为58 mm和62 mm),电极外有1 mm厚的石英玻璃作为阻挡介质.工作气体为氦气(99.999%),以2.67 L·min-1的流速由进气口进入,多余的空气可由出气口排出,峰值电压为6 kV.
细胞处理方式如图1(b)所示,将6×105个细胞接种于60 mm细胞培养皿中,过夜培养,待细胞完全贴壁后弃掉原培养基,加入5 mL新鲜的培养基,将孵育在培养基中的细胞放置到等离子体处理装置反应腔室中,通氦气90 s后再接通电源产生等离子体作用于细胞.对照组不进行等离子体处理,处理组等离子体处理30 s.

(a)CAP处理装置原理示意图;(b)CAP处理CAL-62细胞方法流程图.
(3)mRNA提取.细胞经等离子体处理30 s后置于细胞培养箱中培养12 h后,收集到离心管;按照TRizol试剂盒方法提取细胞中的总RNA,每次处理设置3个生物学重复.提取后的mRNA使用安捷伦2100生物分析仪评估mRNA的完整性.
(4)cDNA制备及测序.使用带有Oligo(dT)的磁珠富集mRNA,加入阳离子将mRNA随机打断;将随机引物加入片段化的mRNA中进行DNA一链的合成,进一步用dUTP代替dTTP合成DNA二链;对扩增好的cDNA进行末端修复、加“A”和接头连接,对连接产物进行PCR反应并检测文库质量;将PCR产物变性为单链,进行环化得到最终的cDNA文库,使用DNBSEQ平台测序.
(5)RNA-seq分析.使用SOAPnuke软件对测序所得的原始数据进行质控,去除具有接头污染、未知碱基含量大于5%、低质量的Reads,获得Clean Reads.然后将Clean Reads比对到参考序列,合格后进行基因定量分析、基于基因表达水平的各项分析(主成分、相关性、差异基因筛选等).设置|log2FC|≥1,q-value≤0.01(fold change, 简称FC,表示实验组/对照组的基因表达丰度差异倍数),筛选出的样品间差异表达基因674个,其中有287个上调基因和387个下调基因,分别对上调基因和下调基因进行KEGG pathway显著性富集分析.根据KEGG pathway注释分类,对差异基因进行功能分类,使用R软件中的phyper函数进行富集分析,计算p-value,然后对p-value进行FDR校正得到q-value.根据GO分类,对差异基因进行功能分类,并使用R软件中的phyper功能进行富集分析,计算p-value,然后对p-value进行FDR校正得到q-value.
(6)线粒体膜电位检测.CAP处理4 h后,根据线粒体膜电位试剂盒(JC-1, Solarbio,北京,中国)说明,丢弃原培养基,然后用PBS洗涤细胞2次.随后在每个培养皿中加入2 mL DMEM培养基,并在其中加入预先准备好的JC-1染色工作液并充分混合.再将培养皿置于培养箱中孵育20 min后弃去培养皿中液体,用预先准备好的JC-1染色缓冲液洗涤2次,弃去.最后在每个培养皿中再次加入2 mL DMEM培养基,在荧光显微镜下观察并记录荧光图像.采用Image J软件进行荧光定量分析.
(7)细胞迁移实验.细胞迁移实验在孔径为8 μm的24孔Transwell小室(Costar, 华盛顿哥伦比亚特区,美国)中进行.先将CAP处理后孵育4 h的细胞用胰蛋白酶消化,制备细胞悬液.然后对细胞悬液进行计数,使细胞数量约为1×105mL-1.在Transwell小室上室中加入200 μL不含胎牛血清的DMEM细胞悬液.在下室中添加500 μL含10% 胎牛血清的DMEM作为诱导剂,孵育约24 h后,用PBS洗涤细胞,再用4%多聚甲醛固定并用结晶紫染色.然后用棉签轻轻擦除未穿过上室膜的细胞,在低倍显微镜(100倍)下随机选择5个视野,观察并记录穿过上室膜的细胞数量.
1.4 数据分析
所有实验均重复3次,实验结果由平均值±标准差表示,采用t检验检测组间差异,p<0.05具有显著性差异.* * *p<0.001, * *p<0.01, *p<0.05.
2 结果与分析
2.1 CAP抑制CAL-62细胞生长
为了探究CAP处理对CAL-62细胞生长的影响,将对照组和CAP处理30 s的细胞于倒置显微镜下拍摄图片,分别记录CAP处理后0,6,12 h时CAL-62细胞的形态,结果如图2所示.图2显示,CAP处理12 h后,细胞的形状发生皱缩,细胞收缩变圆.而CAP处理后0 h细胞形态变化并不明显,处理6 h后细胞略有收缩,这说明CAP对细胞形态的影响是一个逐渐缓慢的过程,需要一定的作用时间.

图2 CAP处理后CAL-62细胞形态变化
2.2 CAP处理后CAL-62细胞转录组概况
设对照组和CAP处理组2组细胞,每组3个重复,测得6个转录组样品.每个样品平均产出6.73 GB数据,共检测到16 861个基因.通过比对对照组和CAP处理组的CAL-62细胞的转录组发现,共有674个基因差异表达(图3),其中287个基因上调表达,387个基因下调表达(|log2FC|≥1,q-value≤0.01).
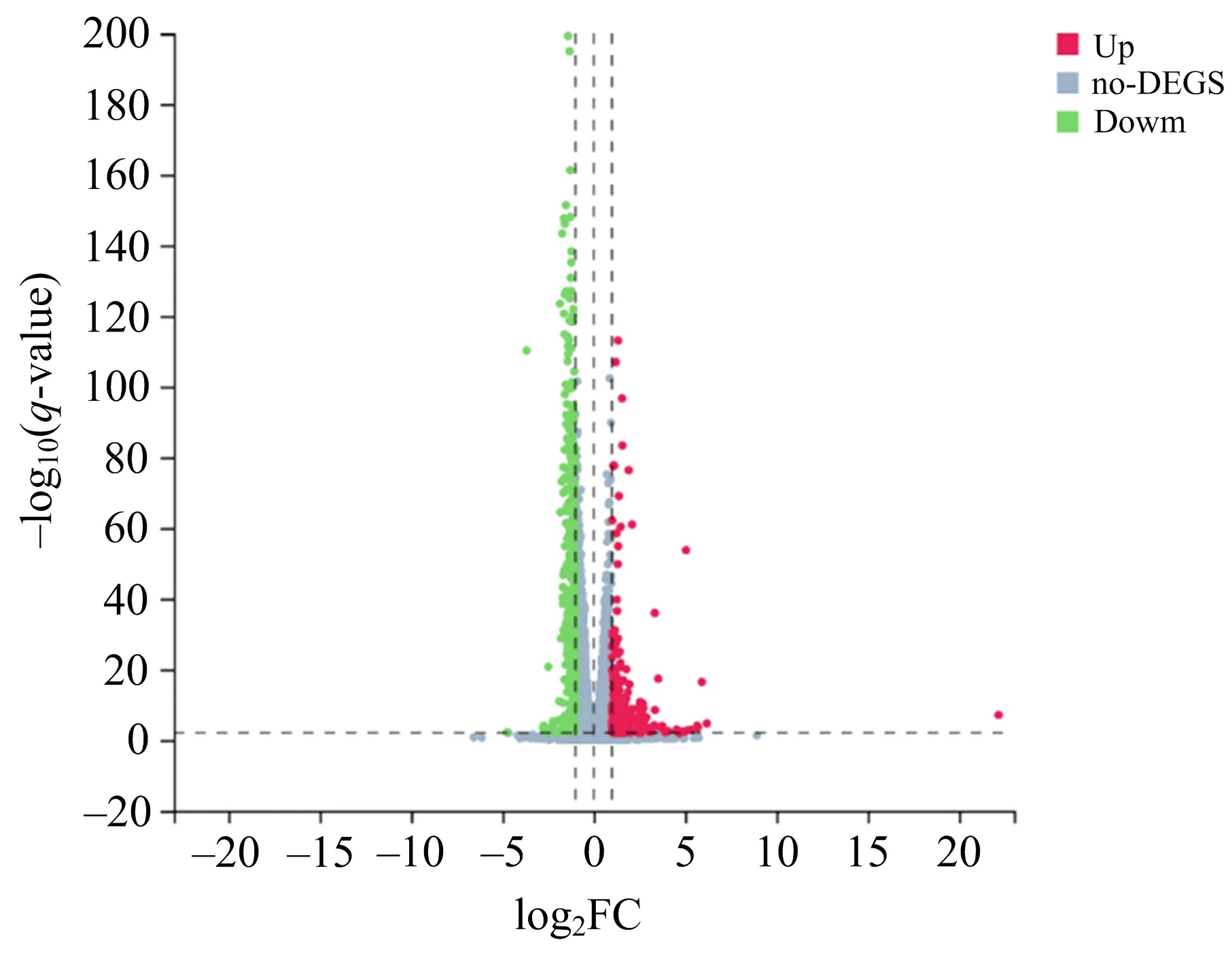
图3 CAP处理后细胞差异基因表达火山图
2.3 CAP处理前后转录组差异基因KEGG富集分析
分别将上调的287个差异基因和下调的387个差异基因进行KEGG富集分析,并筛选出20条富集最显著的通路,结果如图4所示.

(a)CAP处理后上调基因的KEGG富集;(b)CAP处理后下调基因的KEGG富集.
图4(a)显示,上调基因主要富集在MAPK信号通路、细胞因子-细胞因子受体相互作用、抗原过程及呈递等相关信号通路和癌症转录失调等中.其中,差异基因富集条目最多的通路是MAPK信号通路,说明CAP处理可以在一定程度上激活MAPK信号通路,从而进一步调节CAL-62细胞.图4(b)显示,下调基因主要集中在肌动蛋白细胞骨架调节、Rap1信号通路、癌症MicroRNAs、ErbB信号通路、FoxO信号通路、Notch信号通路等相关性信号通路中.
2.4 CAP处理前后转录组差异基因GO富集分析
同样的,将上调基因和下调基因分开进行GO富集分析,并展示其中差异最显著的20个条目,结果如图5所示.
图5(a)显示,上调表达的差异基因的GO富集中差异基因主要富集的条目是免疫反应、细胞凋亡过程、转录正调控和固有免疫反应.上调差异基因在细胞凋亡过程的富集说明CAP处理可以促进CAL-62细胞凋亡过程的发生.图5(b)显示,下调表达的差异基因的GO富集中差异基因主要富集的条目是磷酸化(含蛋白质磷酸化)、细胞对DNA损伤刺激的反应和GTPase活性正调控.

(a)CAP处理后上调基因的GO富集;(b)CAP处理后下调基因的GO富集.
2.5 CAP处理后CAL-62细胞基因的差异表达
按照|log2FC|≥1,q-value≤0.01,对差异基因进行筛选,筛选出了674个差异显著基因.分别对上调和下调的前20个差异基因制作其在对照组和CAP处理组的基因差异表达热图,如图6所示.其中CAP处理后BIK,CDKN1C等基因显著上调表达,TANC2,ESM1,CBL,DST,PLXNA2等基因显著下调表达.

(a)差异显著的前20个上调基因;(b)差异显著的前20个下调基因.
2.6 部分基因在肿瘤组织和癌旁组织的差异表达情况
接下来,为了探究显著差异表达的部分基因在肿瘤组织和正常组织中的表达情况,笔者基于TCGA数据库的数据信息对BIK,CDKN1C,TANC2,ESM1,CBL这5个基因在甲状腺癌组织和正常组织之间的表达情况进行了分析展示,结果如图7所示.

图7 5个基因在甲状腺癌中的表达水平
图7显示,BIK,CDKN1C,TANC2,ESM1,CBL基因在甲状腺癌组织和正常组织之间的表达存在显著差异,其中BIK和CDKN1C在甲状腺癌组织中的表达明显低于正常组;TANC2,ESM1和CBL在肿瘤中的表达明显高于正常组.说明低水平的BIK和CDKN1C表达更有利于甲状腺癌细胞的生存,而CAP处理导致的BIK和CDKN1C基因表达的上调,可以一定程度向正常组靠拢.同样,CAP处理后TANC2,ESM1和CBL表达下调也能达到这样的效果.
2.7 CAP处理CAL-62细胞引起基因差异表达验证
与对照组相比,CAP处理组的基因表达水平发生了很多变化.转录组分析显示APAF1,JNK等基因显著上调;AKT1,AKT3,PIK3等基因显著下调.因此,选择这些基因进行WB验证,实验结果如图8所示:CAP处理组的JNK,APAF1蛋白表达明显上调;AKT,PI3K的蛋白表达水平明显下调,与转录组结果一致,证明了转录组结果的准确性.
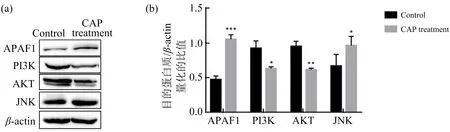
(a)CAP处理组和对照组差异基因表达WB验证;(b)WB条带量化统计.
2.8 CAP处理降低CAL-62细胞线粒体膜电位
线粒体膜电位下降是细胞早期凋亡的标志性事件.上述的结果表明CAP处理改变了CAL-62细胞的形态,进一步探究CAP处理对CAL-62细胞线粒体膜电位的影响.荧光定量分析结果如图9所示,与对照组相比,CAP处理组的绿色/红色荧光比值显著增加.表明CAP处理降低了CAL-62细胞的线粒体膜电位,诱导了细胞的早期凋亡.

(a)细胞线粒体膜电位的荧光图像;(b)荧光图量化统计.
2.9 CAP处理对CAL-62细胞迁移的作用
用Transwell实验探索CAP处理对CAL-62细胞迁移的影响,结果如图10所示,与对照组相比,CAP处理组的细胞迁移量显著减少,几乎没有细胞穿过上室膜.表明CAP处理明显抑制了CAL-62细胞的迁移.
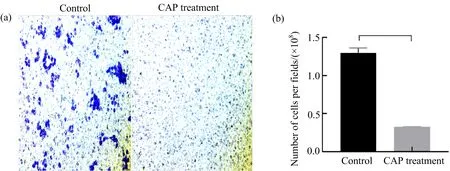
(a)用Transwell法分析CAP处理后CAL-62细胞的迁移情况;(b)跨膜细胞数量量化分析.
3 讨论与结论
虽然CAP的体外抗肿瘤作用被广泛证实,但是关于CAP对甲状腺癌抑制效果的报道较少.一项体外研究表明,CAP可以通过促进p-JNK,p-P38,caspase-3的表达引起甲状腺未分化癌细胞HTH83,U-HTH 7和SW1763发生细胞凋亡[14].此外,大气压低温等离子体对甲状腺乳头状癌细胞株(BHP10-3和TPC1)也具有良好的抑制效果,等离子体可以通过调控FAK/Src复合体来抑制MMP-2/-9和uPA的活性,进一步抑制细胞的迁移和侵袭[15].
笔者使用未处理的CAL-62细胞作为对照组,CAP处理的CAL-62细胞作为处理组,进行了一系列实验分析:
(1)使用未处理的CAL-62细胞作为对照组,CAP处理30 s的CAL-62细胞作为处理组,发现一定剂量的CAP处理后不久大部分细胞会经历形态收缩的变化过程,处理引起的细胞内溶液泄漏可以进一步导致细胞收缩和细胞起泡[16-17].而且CAP处理还会显著降低细胞的线粒体膜电位,诱导细胞早期凋亡.此外,细胞活力的下降是CAP杀伤癌细胞的重要表现之一,对于体外培养的癌细胞或者3D肿瘤模型,等离子体都具有良好的抑制细胞增殖的效果[18-20].
(2)通过转录组分析检测到的部分基因与癌症的发生与发展密切相关.BIK作为Bcl-2家族中的凋亡诱导蛋白,具有促进凋亡的作用,在非小细胞肺癌中抑制BIK的表达可以促进肿瘤的发生[21].CDKN1C基因是一种肿瘤抑制基因,在G1期起到调节细胞周期进程的作用,研究报道CDKN1C的表达在雌激素受体阳性/HER 2阴性的乳腺癌以及头颈部鳞状细胞癌患者的预后中具有重要作用[22-23].因此BIK,CDKN1C等基因的上调表达可以在一定程度上促进细胞凋亡,抑制细胞周期进程,从而发挥抑癌作用.ESM1与细胞的迁移密切相关,研究显示,ESM1可以作为下游分子参与胶质母细胞瘤的转移[24],而且沉默ESM1可以显著降低肝细胞癌的迁移和侵袭[25].笔者的Transwell实验结果也证明了CAP处理对CAL-62细胞迁移的抑制作用.此外,ESM1基因与肾癌患者的VEGFA表达呈现较强的相关性[26].CBL是一个原癌基因,可以作为许多信号转导途径的负调节器发挥作用[27].CAP处理引起的CAL-62细胞内ESM1,CBL等基因的表达水平的下调可以在一定程度上发挥抑制细胞迁移的作用.差异基因在某些信号通路的富集情况也能反应CAP对CAL-62细胞的抑制作用.Rap1信号通路在多种恶性肿瘤中过表达,是多条信号通路的分子开关,在肿瘤发生发展中发挥重要作用.下调差异基因在Rap1信号通路的显著富集说明CAP处理可以在一定程度上抑制Rap1信号通路.ErbB受体信号通过AKT,MAPK以及其他多种通路来调节细胞增殖、迁移、分化、凋亡,ErbB作为恶性肿瘤的治疗靶标之一,CAP处理导致的下调可在一定程度上降低CAL-62细胞的恶性程度.
(3)从转录组学水平探究了CAP对CAL-62细胞的影响,发现CAP处理可明显造成CAL-62细胞基因的差异表达,转录组学分析结果表明CAP处理后CAL-62细胞的基因表达发生明显改变,共检测到674个基因差异表达,其中287个基因上调表达,387个基因下调表达.其中BIK,CDKN1C等基因显著上调,TANC2,ESM1,CBL等基因显著下调.并且对差异基因进行了KEGG富集和GO分类,从转录组学水平探究了CAP抑制甲状腺未分化癌的分子机制,为CAP应用于甲状腺未分化癌的治疗提供了一定的理论基础.
