DNMT3B对甲状腺乳头状癌细胞增殖和侵袭的影响
2023-01-15夏莹莹李欣雨时康云王雯婧段菲凡
夏莹莹,李欣雨,时康云,王雯婧,段菲凡,李 强*
(1蚌埠医学院生命科学院细胞生物学系,蚌埠 233030;2安徽省癌症转化医学重点实验室;*通讯作者,E-mail:2812426235@qq.com)
甲状腺癌是一种常见的内分泌恶性肿瘤,患病率正在逐年增加,其中甲状腺乳头状癌(papillary thyroid cancer,PTC)是最常见的亚型[1]。甲状腺癌的常规治疗方法包括甲状腺切除术、放射性碘治疗和促甲状腺激素抑制治疗。虽然总体预后相对较好,但仍有一小部分患者出现了淋巴结转移、复发以及耐药等不良症状[2]。因此寻找新的诊断标记物对PTC的早期诊断和治疗具有重要意义。
DNA甲基化是基因表达调控重要的表型遗传修饰方式之一,与肿瘤的形成密切相关,DNA甲基化主要由DNA甲基转移酶(DNA(cytosine-5)-methyl-transferases,DNMTs)所催化[3]。目前,具有催化活性的DNMTs有3种:DNMT1,DNMT3A和DNMT3B。其中,DNMT3B是一类重要的甲基转移酶,具有从头甲基化的作用。研究表明,DNMT3B在肺癌、前列腺癌、肝细胞癌、黑色素瘤和膀胱癌[4]中显著高表达。然而DNMT3B在PTC中的作用尚不清楚。因此,本研究在甲状腺乳头状癌细胞株BCPAP中敲减DNMT3B,通过对BCPAP细胞增殖、迁移及侵袭能力的检测,探究了DNMT3B在PTC中发挥调控的分子机制,为PTC发病机制的研究提供新的方向和线索。
1 材料与方法
1.1 细胞株及主要试剂
人甲状腺滤泡上皮正常细胞Nthy-ori 3-1和甲状腺乳头状癌细胞株TPC1、BCPAP、K1均购自合肥维三生物科技有限公司,RPMI-1640培养基、DMEM培养基、胎牛血清以及胰蛋白酶均购自赛默飞世尔科技(中国)有限公司,si-NC和si-DNMT3B购自广州锐博生物技术有限公司,辣根过氧化物酶标记的羊抗兔/鼠二抗、极超敏ECL化学发光试剂盒、CCK-8溶液、RIPA细胞裂解试剂盒、BCA蛋白浓度测定试剂盒、基因组DNA提取试剂盒、EpiTect Bisulfite Kit试剂盒、转染试剂Lipo8000以及cDNA反转录试剂盒均购自上海碧云天生物技术有限公司,实时荧光定量PCR试剂2×Real Star Green Fast Mixture(with ROX Ⅱ)购自GenStar北京康润生物有限公司,一抗(DNMT3B,DAPK,Bax,RASSF1A,β-肌动蛋白)购自上海艾博抗贸易有限公司,Transwell小室和Matrigel基质胶购自美国康宁(Corning)公司。
1.2 细胞培养及siRNA转染
BCPAP细胞培养于含10%胎牛血清的DMEM培养基中。实验分为空白对照组(control组,不进行转染)、阴性对照组(si-NC组,转染不能干扰DNMT3B表达的阴性siRNA)和敲减DNMT3B组(si-DNMT3B组,转染可以干扰DNMT3B表达的siRNA)。转染对象为处于对数生长期的细胞,转染时细胞融合度达到70%,转染步骤严格按照Lipo8000转染试剂说明书进行,24 h后进行后续实验。
1.3 qRT-PCR检测DNMT3B,DAPK,Bax和RASSF1A基因的相对水平
收集甲状腺滤泡上皮正常细胞Nthy-ori 3-1和甲状腺乳头状癌细胞株TPC1、BCPAP、K1以及转染后的各组细胞,采用Trizol提取细胞总RNA,各取200 ng的RNA进行反转录,随后进行qRT-PCR检测,扩增条件为:95 ℃ 2 min,95 ℃ 15 s,60 ℃ 30 s,共40个循环,以β-actin为内参对照,最终Ct值采用2-ΔΔCt方法分析,引物序列见表1。

表1 qRT-PCR扩增引物序列Table 1 Primer sequences for RT-qPCR amplification
1.4 Western blot实验检测DNMT3B、DAPK、Bax和RASSF1A蛋白表达水平
收集甲状腺滤泡上皮正常细胞Nthy-ori 3-1和甲状腺乳头状癌细胞株TPC1、BCPAP、K1以及转染后的各组细胞提取总蛋白,取20 μg/孔上样,于10% SDS-PAGE进行电泳,电泳结束后使用PVDF膜转膜,5%脱脂奶粉常温封闭1 h,加入DNMT3B一抗(1 ∶1 000稀释),DAPK一抗(1 ∶1 000稀释),Bax一抗(1 ∶1 000稀释)和β-actin一抗(1 ∶1 000稀释)于4 ℃过夜孵育,TBST洗膜,二抗(1 ∶4 000稀释)室温避光孵育2 h,TBST洗膜,采用ECL化学发光法于凝胶成像仪显影拍照。
1.5 CCK-8法检测细胞增殖能力
将处于对数生长期的细胞消化计数,调整细胞密度为6 000个/孔的细胞悬液,取100 μl接种至96孔板。待细胞密度达到50%时进行转染,分别在转染0,24,48,72 h时,向每孔中加入10 μl CCK-8溶液,2 h后使用酶标仪检测450 nm时的OD值,绘制生长曲线。每次实验重复3次,每组设定3个复孔。
1.6 流式细胞术检测细胞凋亡
取空白对照组、阴性对照组和敲减DNMT3B组中处于对数生长期的BCPAP细胞,按5×105个/孔细胞接种于12孔板中,待细胞融合度达到80%进行转染,24 h后,收集上清和细胞于流式管中,流式细胞检测实验需要将前述3个组别中每个单独组别进一步分为分为双阴组(不加任何染液)、Annexin Ⅴ/FITC单染组和PI单染组以及Annexin Ⅴ/FITC和PI双染组,按照细胞凋亡检测试剂盒说明书进行操作,流式细胞仪检测细胞凋亡情况。并对早期凋亡区域细胞百分比进行统计求平均值。
1.7 Transwell法检测细胞迁移和侵袭能力
将转染后的各组细胞消化计数,按6×104个/小室的细胞密度接种于Transwell上室,下室加入完全培养基。24 h后,用4%多聚甲醛固定20 min,0.25%结晶紫染色30 min,清洗后统计跨膜细胞数并计算平均值。迁移抑制率(%)=(1-处理组迁移细胞个数/对照组迁移细胞个数)×100%。
将稀释好的基质胶(1 ∶100)加入Transwell小室中于37 ℃包被待用,随后,将转染后的各组细胞消化计数,按6×104个/小室的细胞密度接种于Transwell上室,下室加入完全培养基。24 h后用4%多聚甲醛固定20 min,0.25%结晶紫染色30 min,清洗后统计跨膜细胞数并计算平均值。侵袭抑制率(%)=(1-处理组侵袭细胞个数/对照组侵袭细胞个数)×100%。
1.8 甲基化特异性PCR检测
收集转染24 h的BCPAP细胞,提取细胞总DNA,随后进行亚硫酸氢盐修饰处理。该步骤大致如下:用0.2 mol/L的NaOH在37 ℃条件下使得DNA变性10 min,加入30 μl现配的10 mmol/L的氢醌与40.5%亚硫酸氢钠混匀液,50 ℃避光温育16 h,随后用DNA纯化柱洗脱,用0.3 mol/L的NaOH室温孵育5 min,之后用乙醇沉淀,收集并溶于20 μl的水中,随后取1 μl处理后的DNA进行PCR反应,反应条件为:94 ℃,5 min;94 ℃,30 s,52 ℃,30 s,72 ℃,30 s,45 cycles;72 ℃,10 min;4 ℃,扩增目的基因。反应结束后,取5 μl扩增产物进行2%的琼脂糖凝胶电泳分析。Image J软件分析条带的亮度,通过计算甲基化(methylated, M)与甲基化加上未甲基化(unmethylated, U)的比值即M/(U+M)来衡量DNA的甲基化程度。
1.9 统计学方法

2 结果
2.1 DNMT3B在不同甲状腺癌细胞系中的表达水平
qRT-PCR和Western blot实验结果表明,与正常人甲状腺细胞相比,DNMT3B在TPC-1细胞和K1细胞中的mRNA和蛋白水平较高(P<0.01),在BCPAP细胞中的mRNA和蛋白水平最高(P<0.01,见图1)。由于BCPAP细胞中DNMT3B表达量最高,因此选择BCPAP细胞进行后续研究。

与Nthy-ori3-1组比较,*P<0.05,**P<0.01图1 DNMT3B在不同甲状腺癌细胞系中的表达水平Figure 1 Expression of DNMT3B in different thyroid cancer cell lines
2.2 qRT-PCR和Western blot检测细胞中DNMT3B的表达
与control组和si-NC组相比,si-DNMT3B组BCPAP细胞中DNMT3B mRNA和蛋白表达水平显著降低(P<0.01,见图2)。表明si-RNA成功敲减DNMT3B在BCPAP细胞中的表达。

与control组和si-NC组比较,**P<0.01图2 BCPAP细胞中DNMT3B mRNA及蛋白表达水平Figure 2 Expression levels of DNMT3B mRNA and protein in BCPAP cells
2.3 敲减DNMT3B对BCPAP细胞增殖能力的影响
CCK-8法检测细胞增殖的结果显示,与control组和si-NC组比较,si-DNMT3B组BCPAP细胞在24,48,72 h时OD值明显减小(P<0.01,见图3)。表明敲减DNMT3B能够抑制BCPAP细胞的增殖能力。

与control组和si-NC组比较,**P<0.01图3 CCK-8实验检测敲减DNMT3B后对BCPAP细胞增殖能力的影响Figure 3 Influence of interfering DNMT3B on proliferation of BCPAP cells by CCK-8
2.4 敲减DNMT3B对细胞凋亡的影响
采用流式细胞术对BCPAP细胞凋亡情况分别进行检测,结果显示,si-NC组和si-DNMT3B组的早期凋亡细胞比例分别为(6.17±0.69)%,(6.36±0.48)%和(14.46±0.92)%,与control组和si-NC组比较,si-DNMT3B组细胞凋亡增加(P<0.01,见图4)。

与control组和si-NC组比较,**P<0.01图4 流式细胞仪检测敲减DNMT3B对BCPAP细胞凋亡的影响Figure 4 Effect of interfering DNMT3B on apoptosis of BCPAP cells detected by flow cytometry
2.5 敲减DNMT3B对BCPAP细胞迁移和侵袭能力的影响
敲减DNMT3B后,Transwell实验结果显示,与control组和si-NC组比较,si-DNMT3B组BCPAP细胞迁移和侵袭率显著降低(P<0.01,见图5)。表明敲减DNMT3B能够增强BCPAP细胞的迁移及侵袭能力。

与control组和si-NC组比较,**P<0.01,横线代表50 μm图5 Transwell实验检测敲减DNMT3B后对BCPAP细胞迁移及侵袭能力的影响Figure 5 Effect of interfering DNMT3B on migration and invasion of BCPAP cells by Transwell assay
2.6 敲减DNMT3B对细胞凋亡相关基因表达的影响
采用荧光定量PCR和Western blot检测敲减DNMT3B对细胞凋亡相关基因mRNA的蛋白水平表达的影响。荧光定量PCR结果显示,与control组和si-NC组比较,敲减DNMT3B组细胞凋亡相关基因DAPK,Bax和RASSF1A mRNA的表达增加。Western blot结果显示,与control组和si-NC组比较,敲减DNMT3B组细胞凋亡相关基因DAPK,Bax和RASSF1A蛋白的表达增加(P<0.01,见图6)。

与control组和si-NC组比较,**P<0.01图6 敲减DNMT3B对细胞生长及凋亡相关基因表达的影响Figure 6 Effects of interfering DNMT3B on cell growth and expression of apoptosis-related genes
2.7 敲减DNMT3B对细胞凋亡相关基因甲基化的影响
采用甲基化特异性PCR检测敲减DNMT3B对细胞凋亡相关基因甲基化的影响,结果发现,与si-NC组比较,si-DNMT3B组细胞凋亡相关基因DAPK、Bax和RASSF1A启动子区域的甲基化水平减少(见图7)。
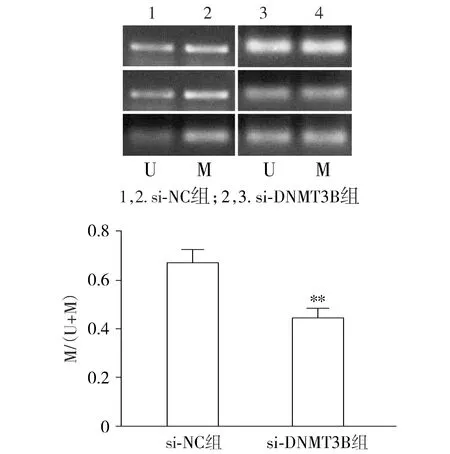
与si-NC组比较,**P<0.01;M代表着甲基化,U代表着未甲基化图7 甲基化特异性PCR检测敲减DNMT3B对细胞生长及凋亡相关基因甲基化影响Figure 7 Effect of interfering DNMT3B on methylation of cell growth and apoptosis-related genes detected by methylation specific PCR
3 讨论
DNA甲基化是最重要的表观遗传学修饰之一,而异常的CpG岛甲基化是人类肿瘤的一大特征,大量细胞DNA高甲基化可能导致基因组和染色体趋向不稳定,引起抑癌基因失活并导致癌症的发生[5]。DNA的低甲基化与DNA甲基化转移酶表达异常有关,其中DNMT3B的高表达并伴随着抑癌基因的高甲基化沉默已被证实与肝癌[6]、结肠癌[7]等多种癌症的发生发展密切相关。然而,DNMT3B的高表达与PTC的发生是否相关还未得到证实,且具体分子机制尚不清楚。本研究探究DNMT3B在体外对PTC细胞增殖及侵袭迁移的影响,采用si-RNA技术敲减DNMT3B后,用DNMT3B-siRNA转染BCPAP细胞,发现细胞增殖及侵袭迁移能力明显下降,凋亡率明显增加。说明敲减DNMT3B能够抑制PTC细胞的增殖和侵袭转移,促进其凋亡,与其他关于DNMT3B对于癌症作用的研究结果相似[8,9]。表明DNMT3B可能是PTC早期诊断的一个关键性标记物。
RASSF1A、DAPK和Bax是重要的凋亡相关基因,它们的高表达可以明显抑制许多肿瘤的发生发展,且研究表明这3个基因的启动子上存在明显的甲基化修饰[10]。本研究结果显示敲减DNMT3B可以显著减少RASSF1A、DAPK和Bax这3个基因的启动子甲基化水平,促进了这3个基因的表达,从而抑制了PTC细胞的增殖迁移和侵袭,这为其他肿瘤中探究DMNT3B是否具有类似调控机制提供了依据。同时,研究其他抑癌基因的甲基化修饰和表达有望为PTC发生发展的机制研究提供新的方向。且其他的甲基化修饰基因乃至不同类型的表观修饰(如m6A,乙酰化)基因是否也具有相似的作用同样值得研究。
综上所述,敲减DNMT3B能够有效抑制PTC细胞的增殖和侵袭迁移能力,并能促进细胞的凋亡,其机制可能与DNMT3B通过DNA甲基化调控细胞凋亡相关基因DAPK、Bax和RASSF1A的表达有关。本研究为PTC的治疗提供了理论基础,DNMT3B有望成为PTC新的诊断和治疗靶点,但关于DNMT3B影响PTC发生发展的具体分子机制有待进一步研究。
