达格列净通过mTOR自噬信号通路改善糖尿病肾病大鼠足细胞损伤
2023-01-15王脉桃张亚萍宋卫红
万 倩,周 华,惠 辉,王脉桃,张亚萍,宋卫红
(郴州市第一人民医院内分泌科,郴州 423000;*通讯作者,E-mail:331010403@qq.com)
糖尿病肾病(diabetic nephropathy,DN)是由长期未能控制的糖尿病引起的微血管并发症之一,是终末期肾功能衰竭发生的重要原因。DN临床特征为进行性蛋白尿、高血压、肾功能衰竭导致水肿和尿毒症症状[1]。当前DN的治疗包括以严格控制血糖和血压为主的早期治疗和以透析或肾移植等替代治疗为主的晚期综合治疗,旨在延缓DN的发展,降低DN患者心血管事件和死亡的风险。但这些治疗方法仍很有限,临床上缺乏有效的DN治疗策略[2]。因此,积极探索DN发病机制,开发治疗DN的新策略势在必行。研究报道[3,4],足细胞损伤在DN的发病机制中起重要作用。有研究表明[5],足细胞有着非常高的自噬水平,足细胞自噬主要通过降解蛋白质和细胞器来调节细胞稳态,而自噬功能紊乱是足细胞损伤的重要诱导因子。足细胞自噬过程有包括哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路在内的许多信号分子参与,研究发现[6],mTOR信号通路的激活与DN患者足细胞损伤的加速密切相关,提示mTOR信号通路介导的自噬功能障碍与DN疾病有关。钠-葡萄糖共转运体2(sodium-glucose co-transporter 2,SGLT2)抑制剂是一类新型的降糖药物,可减少葡萄糖从肾小管重吸收,促进葡萄糖从尿液中排出而发挥降糖作用,其降糖作用不依赖于胰岛素[7]。达格列净是一种SGLT2抑制剂,研究发现达格列净能保护牛血清白蛋白诱导蛋白尿小鼠的肾脏,减少蛋白尿,减少足细胞的损伤及丢失[8]。提示达格列净对足细胞有保护作用,但是其具体机制目前尚未完全清楚。因此,本研究通过建立DN大鼠模型,观察达格列净是否通过mTOR自噬信号通路改善DN大鼠足细胞损伤。
1 材料与方法
1.1 实验材料
SPF级Wistar雄性大鼠,购自常州卡文斯实验动物有限公司,动物生产许可证号:SCXK(苏)2021-0013。大鼠体质量200~240 g,8周龄,饲养于温度22~25 ℃,相对湿度50%~70%的实验动物房,人工光照明暗交替各12 h,自由饮水、进食。链脲佐菌素(streptozotocin,STZ)(纯度≥98%,规格100 mg)、柠檬酸缓冲液均购自上海翌圣生物科技股份有限公司;达格列净(纯度≥99%,规格10 mg)购自上海阿拉丁生化科技股份有限公司;雷帕霉素(纯度≥99%,规格20 mg)购自上海瀚香生物科技有限公司;高糖高脂饲料(10%蔗糖、10%猪油、10%蛋黄粉、1.5%胆固醇、0.5%胆酸钠、68%基础饲料)购自江苏省协同医药生物工程有限公司;空腹血糖(fasting blood glucose,FBG)、血肌酐(serum creatinine,Scr)、尿素氮(blood urea nitrogen,BUN)试剂盒、尿蛋白(urinary protein,UP)定量试剂盒、苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒均购自上海尚宝生物科技有限公司;足细胞标志蛋白nephrin和podocin、自噬效应蛋白Beclin-1、P62、微管相关蛋白轻链3Ⅱ(microtubule associated protein light chain 3Ⅱ,LC3Ⅱ)、mTOR兔单克隆抗体,p-mTOR、β-肌动蛋白(β-actin)兔多克隆抗体,辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔二抗均购自艾博抗(上海)贸易有限公司。
HEMIX-180型全自动生化分析仪购自日本Sysmex公司;One Touch型血糖仪购自美国Life Scan公司;CKX41-F32FL荧光倒置显微镜购自日本Olympus公司;HT7800型透射电子显微镜购自日本Hitach公司;LD-96B全自动酶标仪购自山东莱恩德智能科技有限公司;Gel Doc EZ凝胶成像系统购自美国BIO-RAD公司。
1.2 实验方法
1.2.1 DN模型建立 46只大鼠普通饮食饲养1周后,以随机数字表法分为对照组(NC组,n=10)和造模组(n=36)。NC组大鼠给予普通饮食4周后,腹腔注射35 mg/kg柠檬酸缓冲液。造模组大鼠参照文献方法[9]进行造模:大鼠给予高糖高脂饮食4周后,按35 mg/kg剂量一次性腹腔注射1% STZ溶液建立DN模型。72 h后检测大鼠尾静脉随机血糖≥16.7 mmol/L,表示糖尿病模型建立成功。大鼠持续高糖高脂饮食饲养1周,测定大鼠UP≥30 mg/24 h即为DN大鼠模型建立成功。造模组36只大鼠中30只成功建立DN大鼠模型,造模成功率为83.3%。
1.2.2 实验分组及给药干预 将造模成功的大鼠随机分为模型组(DN组)、达格列净组(Dapa组)、达格列净+雷帕霉素组(Dapa+Rapa组),每组10只。造模成功后第2天各组大鼠给药干预。Dapa组大鼠灌胃1 mg/kg达格列净,Dapa+Rapa组大鼠灌胃1 mg/kg达格列净后再灌胃给予1 mg/kg雷帕霉素,DN组和NC组大鼠均灌胃1 mg/kg生理盐水,各组大鼠均每天给药1次,持续给药12周。大鼠灌胃给药期间,NC组大鼠以普通饮食饲养,其余各组均以高糖高脂饮食饲养。
1.2.3 大鼠生化指标检测 末次给药后禁食不禁水12 h,收集大鼠24 h尿液,并经大鼠主动脉采集血液,于4 ℃ 4 000 r/min离心15 min收集上层血清。采用血糖仪检测大鼠FBG,按照试剂盒说明操作采用全自动生化分析仪测定大鼠SCr、BUN、24 h UP。
1.2.4 大鼠肾组织病理形态学观察 取大鼠右肾组织固定于4%多聚甲醛中48 h,石蜡包埋、切片(4 μm),取HE染色试剂盒按照使用说明书染色,显微镜下观察肾组织病理学变化。
1.2.5 大鼠肾脏足细胞变化观察 取约1 mm3大小的大鼠肾皮质组织分别于预冷的2.5%戊二醛和1%锇酸中固定,磷酸盐缓冲液(PBS)漂洗3次,梯度脱水加入丙酮,环氧树脂包埋、切片(厚度约50 nm),切片依次用柠檬酸铅和醋酸铀染色,透射电子显微镜下观察足细胞超微结构。
1.2.6 大鼠肾组织中足细胞标志蛋白、自噬蛋白及mTOR信号通路相关蛋白表达检测 采用Western blot法检测,取适量大鼠肾皮质组织,加入RIPA缓冲液提取组织蛋白,并用BCA法进行蛋白定量。取一定量蛋白加样经10% SDS-PAGE分离,转移至PVDF膜上,室温下将膜置于5%脱脂奶粉中封闭2 h,TBST洗膜,加入稀释后的podocin(1 ∶1 000)、nephrin(1 ∶1 000)、Beclin-1(1 ∶1 000)、P62(1 ∶1 000)、LC3Ⅱ(1 ∶1 000)、mTOR(1 ∶1 000)、p-mTOR(1 ∶1 000)一抗,以β-actin(1 ∶2 000)为内参,4 ℃孵育过夜,TBST洗膜,加入相应二抗(1 ∶5 000),室温孵育2 h,TBST洗膜,滴加ECL试剂显影,凝胶成像系统拍照,Image J软件分析蛋白条带灰度值。
1.3 统计学方法

2 结果
2.1 各组大鼠生化指标水平比较
与NC组比较,DN组大鼠血清FBG、SCr、BUN、24 h UP水平均升高(P<0.05);与DN组比较,Dapa组和Dapa+Rapa组大鼠血清FBG、BUN、Scr、24 h UP水平均降低(P<0.05);与Dapa组比较,Dapa+Rapa组大鼠血清FBG、BUN、Scr、24 h UP水平均降低(P<0.05,见表1)。
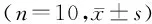
表1 各组大鼠生化指标水平比较Table 1 Comparison of biochemical index levels of rats between
2.2 各组大鼠肾组织病理形态变化比较
NC组大鼠肾小管和肾小球形状正常,结构清晰,肾组织结构未见明显损伤;DN组大鼠肾小球体积增大,基底膜明显增厚,系膜扩张,肾小管上皮细胞空泡变性,肾小管管腔萎缩塌陷,结构紊乱,存在大量炎性细胞浸润;Dapa组和Dapa+Rapa组大鼠肾脏病理损伤较DN组明显减轻,Dapa+Rapa组肾脏损伤改善更明显(见图1)。

图1 HE染色检测各组大鼠肾组织病理形态变化 (×200)Figure 1 Pathological changes of renal tissue in each group by HE staining (×200)
2.3 各组大鼠肾脏足细胞变化比较
NC组大鼠肾小球基底膜形态清晰,结构正常,足细胞形状规则,排列整齐,无足突融合;DN组大鼠肾小球毛细血管肿胀,系膜基质弥漫性增厚,足细胞发生足突融合,排列紊乱,裂空减少,可见明显线粒体嵴断裂或空泡化;Dapa组和Dapa+Rapa组大鼠足细胞可见部分足突融合,排列较整齐,整体情况与DN组比较可见不同程度改善,且Dapa+Rapa组改善程度优于Dapa组(见图2)。

图2 透射电镜观察各组大鼠肾脏足细胞变化 (×15 000)Figure 2 Changes of renal podocytes of rats in each group under transmission electron microscope (×15 000)
2.4 各组大鼠肾脏足细胞标志蛋白表达水平比较
与NC组比较,DN组大鼠肾组织nephrin、podocin蛋白表达水平均下降(P<0.05);与DN组比较,Dapa组和Dapa+Rapa组大鼠肾组织nephrin、podocin蛋白表达水平均升高(P<0.05);与Dapa组比较,Dapa+Rapa组大鼠肾组织nephrin、podocin蛋白表达水平均升高(P<0.05,见图3)。

与NC组比较,*P<0.05;与DN组比较,#P<0.05;与Dapa组比较,&P<0.05图3 Western blot法检测各组大鼠肾脏足细胞标志蛋白表达水平Figure 3 The expression level of podocyte marker proteins in rats in each group by Western blot
2.5 各组大鼠肾组织自噬蛋白及mTOR信号通路蛋白表达水平比较
与NC组比较,DN组大鼠肾组织Beclin-1、LC3Ⅱ蛋白表达水平降低,P62蛋白表达水平、p-mTOR/mTOR比值均升高(P<0.05);与DN组比较,Dapa组和Dapa+Rapa组大鼠肾组织Beclin-1、LC3Ⅱ蛋白表达水平均升高(P<0.05),P62蛋白表达水平、p-mTOR/mTOR比值均降低(P<0.05);与Dapa组比较,Dapa+Rapa组大鼠肾组织Beclin-1、LC3Ⅱ蛋白表达水平均升高(P<0.05),P62蛋白表达水平、p-mTOR/mTOR比值均降低(P<0.05,见图4)。

与NC组比较,*P<0.05;与DN组比较,#P<0.05;与Dapa组比较,&P<0.05图4 Western blot法检测各组大鼠肾组织自噬蛋白及mTOR信号通路蛋白表达水平Figure 4 The expression levels of autophagy protein and mTOR signal pathway proteins in renal tissue of rats in each group by Western blot
3 讨论
足细胞是一种肾小囊脏层上皮细胞,在肾小球滤过屏障中发挥重要作用。蛋白尿的出现与足细胞功能及形态学改变密切相关[10]。DN的特点是进行性蛋白尿,因此,对糖尿病肾损伤中足细胞的治疗干预可能是防治DN的有效策略。大量研究证实[11-13],通过抑制足细胞氧化应激和足细胞凋亡等途径减轻足细胞损伤可有效缓解DN进展。本研究建立DN大鼠模型,检测发现DN大鼠血清生化指标FBG、SCr、BUN、24 h UP水平均升高;大鼠肾小球体积增大,基底膜增厚,系膜扩张,存在大量炎性细胞浸润;足细胞发生足突融合,排列紊乱,可见明显线粒体嵴断裂或空泡化。提示DN大鼠模型构建成功,DN大鼠存在明显的足细胞损伤。研究表明[14],SGLT2抑制剂能够增加尿葡萄糖排泄,降低糖化血红蛋白和蛋白尿,可以延缓肾功能下降进程。达格列净是属于SGLT2抑制剂的新型降糖药物之一,动物和临床研究结果均显示[15,16],达格列净除降糖作用外,还具有肾脏保护作用。一项研究发现[17],达格列净治疗6周可减少近端肾小管标志物KIM-1和炎症标志物IL-6的尿排泄,达格列净降低蛋白尿的作用可能与降低肾小球压力和改善近端小管细胞完整性有关。也有研究报道[18],达格列净可通过调控相关蛋白表达防止足细胞损伤、肾小球病理和肾纤维化。本研究结果显示,达格列净干预后,DN大鼠血清FBG、SCr、BUN、24 h UP水平均明显降低,大鼠肾组织病理损伤和足细胞损伤均得到有效改善。证实达格列净可通过减轻足细胞损伤改善DN。
足细胞相关蛋白与足细胞的正常生物学功能密切相关。nephrin特异表达于肾小球足细胞,是最早发现的足细胞裂孔隔膜蛋白之一。nephrin可连接足细胞的次级足突,参与肾脏滤过屏障的正常发育并维持其正常功能。当nephrin表达发生变化时,肾滤过膜结构的完整性和屏障功能遭到破坏,最终导致蛋白尿的产生。podocin位于足细胞裂孔隔膜区域,具有发夹状结构,可增强nephrin诱导的信号转导,进一步激活信号转导通路[19,20]。在STZ诱导的DN大鼠中,肾小球中nephrin和podocin的表达密度和范围显著降低[21]。提示nephrin和podocin参与DN的发生发展,在DN的发病机制中起重要作用。本研究检测发现,DN大鼠肾组织nephrin、podocin蛋白表达显著降低,表明nephrin和podocin降低可能导致足细胞损伤,足细胞损伤参与了DN的发生发展。达格列净干预后DN大鼠肾组织nephrin、podocin蛋白表达升高,提示达格列净可逆转nephrin和podocin的下降,对足细胞具有保护作用。
自噬对维持细胞稳态及正常功能具有重大作用,自噬失调参与了多种疾病的发生。LC3是自噬的标记物,主要有胞浆型LC3Ⅰ和膜型LC3Ⅱ两种形式,当自噬形成时,LC3Ⅰ会酶解一小段多肽形成LC3Ⅱ,LC3Ⅱ/LC3Ⅰ比值的增加提示自噬的激活。Beclin-1是细胞自噬调节的关键蛋白,能与多种辅因子互相作用诱导自噬激活;P62蛋白是一种自噬底物,可通过与泛素化蛋白、自噬小体内膜上的LC3Ⅱ蛋白结合形成复合物将其运送到蛋白酶体进行降解,故而激活自噬会降低P62蛋白表达。目前越来越多的研究发现自噬与DN足细胞损伤密切相关。Fang等[22]研究显示高糖环境下培养的足细胞,通过用Beclin-1 siRNA抑制自噬,足细胞相关蛋白CD2AP及nephrin表达减少,从而导致肾小球滤过屏障受损。Wang等[23]研究结果显示促进细胞自噬可减轻高糖诱导的足细胞功能障碍。Wang等[24]研究结果也显示足细胞自噬失调加重DN,增强足细胞自噬可延缓DN进展。这些研究结果均表明足细胞自噬在DN发生发展中起着关键作用。本研究结果显示,DN大鼠肾组织中Beclin-1、LC3Ⅱ蛋白表达水平降低,P62蛋白表达水平升高;达格列净则可上调DN大鼠肾组织Beclin-1、LC3Ⅱ蛋白表达,下调P62蛋白表达。提示达格列净可通过调控自噬蛋白表达调节DN中自噬水平。
细胞自噬受多种信号通路的影响,其中mTOR信号通路为调控自噬的核心。过度激活的mTOR信号已被证实参与炎症性疾病、代谢性疾病及增殖性疾病等多种类型疾病。研究显示在DN足细胞中mTOR信号处于高度激活状态[25]。抑制mTOR信号转导通路增强足细胞自噬,可有效减轻DN蛋白尿、足细胞受损、肾纤维化等临床及病理表现[26]。足细胞中mTOR信号通路的激活是DN发生的关键步骤,阻断STZ诱导的糖尿病大鼠mTOR信号通路能够缓解肾脏肥大及系膜基质的积聚[27]。这些发现表明抑制足细胞mTOR活性可以保护足细胞并延缓DN的进展。本研究结果显示,达格列净作用于DN大鼠后,大鼠肾脏组织中mTOR磷酸化减少,提示达格列净抑制mTOR信号通路活化。将mTOR信号通路抑制剂雷帕霉素作用于DN大鼠发现,雷帕霉素增强达格列净对DN大鼠血清生化指标、肾组织病理损伤以及足细胞损伤的改善作用;雷帕霉素还增强达格列净对DN大鼠肾组织中足细胞标志蛋白和自噬相关蛋白的调控作用。此外,雷帕霉素联合达格列净作用显著抑制mTOR磷酸化。该结果提示,达格列净可能通过调控mTOR自噬信号通路改善DN大鼠足细胞损伤,从而延缓DN进展。
综上所述,达格列净能够有效调控足细胞自噬,减轻DN足细胞损伤,从而改善DN,其可能是通过调控mTOR自噬信号通路活性发挥肾脏足细胞保护作用。
