慢病毒介导的VEGF-RNAi对宫颈癌细胞C33A凋亡的影响
2023-01-15李茸,王娟
李 茸,王 娟
(西安交通大学第一附属医院肿瘤放疗科,西安 710061;*通讯作者,E-mail:wangjuan3890@163.com)
缺氧是实体瘤特异性的生理性异常。由于肿瘤的快速生长,实体瘤的体积不断增大,其组织内部无法获得足够的血液供应,出现氧的供求失调。正常组织中平均氧分压在40~60 mmHg,而将近50%的实体瘤中平均氧分压不足10 mmHg[1]。缺氧环境可诱导肿瘤生物学行为的适应和改变,这一影响主要表现在缺氧可诱导肿瘤细胞的基因组发生突变,并编码产生变异型蛋白,促进肿瘤细胞对缺氧环境的适应,主动逃避对其不利的环境,并增强其增殖能力,加速对周围组织的浸润以及转移[2]。随着缺氧时间的延长,肿瘤组织VEGF的表达进一步增强,促进了新生血管的发生。新生的滋养血管既为肿瘤组织带来了细胞生长、增殖所必需的氧气和营养物质,同时缓解因肿瘤组织快速生长而导致内部的缺氧状态,又为肿瘤细胞的血行转移提供了快捷通道。如果肿瘤的血管化程度越高,则患者预后越差,越容易发生远处转移[3]。VEGF及其受体通过介导血管内皮细胞表面的受体,导致血管内皮细胞的迁移和增殖,并且增强了血管的通透性,有利于肿瘤新生血管的生成[4]。如何高效地靶向抑制肿瘤细胞中VEGF基因的表达,进而阻断肿瘤血管生成信号或者直接作用于肿瘤血管内皮细胞,从而导致肿瘤细胞的凋亡,这有可能作为肿瘤治疗新的作用靶点。因此在本文的研究中,利用VEGF-shRNA慢病毒载体,探索慢病毒感染宫颈癌细胞C33A的适宜条件,同时观察病毒转染后VEGF基因沉默对宫颈癌细胞C33A凋亡的影响。
1 材料与方法
1.1 细胞株及主要试剂
宫颈癌细胞系C33A,由西安交通大学医学院中心实验室冻存,复苏后使用。促感染药物聚凝胺(Polybrene)和慢病毒载体系统购自上海吉凯基因技术有限公司。1640培养基、胎牛血清、DMSO和Trizol购自Gibco公司(美国)。0.25%胰酶,RIPA裂解液和Annexin Ⅴ-FITC凋亡检测试剂盒购自碧云天生物科技研究所。
1.2 细胞感染复数的测定
分别接种3×103~5×103个C33A细胞于96孔培养板各孔中,所加培养基体积为100 μl,细胞融合度为30%~50%时,进行病毒感染。干扰预试验分为对照组和实验组,每组均设置相同的梯度细胞感染复数(multiplicity of infection, MOI)值。对照组为正常情况下感染,即在完全培养基中直接加入病毒;实验组为感染时添加5 μg/ml的Polybrene,再加入病毒。感染前为细胞换液,吸去细胞上清,按不同分组情况加入所需的培养基90 μl,每组4个复孔。准备2个无菌的EP管,吸取10 μl×108TU/ml的病毒加入到第一个管子中,轻柔混匀。同样从第一管中吸取10 μl的病毒到第二管中,混匀。这样就得到了3个不同梯度的病毒:原液、10倍稀释、100倍稀释。同理稀释病毒液得到50倍稀释浓度。将上述4个不同梯度的病毒液,各取10 μl加到每组的4个孔中,则此时4孔的MOI分别为100,50,10,1。把细胞放回培养箱孵育。病毒感染12 h后观察细胞状态,病毒感染24 h后更换新鲜培养基。病毒感染72 h后,观察荧光表达情况。本小节的实验通过使用不同的病毒浓度,是否添加Polybrene,摸索慢病毒对C33A细胞的最佳感染条件。
1.3 病毒感染效率的检测
将处于对数生长期的C33A细胞胰蛋白酶消化,细胞计数后,用完全DMEM培养基(含10% FBS)将细胞浓度稀释至3×105/ml,移入无菌6孔板中,每孔2 ml;37 ℃,5% CO2饱和湿度条件培养箱中培养12 h后,更换培养液为含8 μg/ml聚凝胺的完全DMEM培养液(含10%FBS),2 ml/孔,根据前述实验得到的MOI值,加入适量病毒液至6孔板内;37 ℃,5% CO2饱和湿度培养箱中继续培养72 h后荧光显微镜下观察,随机选取20个视野,分别在荧光以及可见光下计数表达绿色荧光细胞数与总细胞数,计算感染效率。
1.4 C33A细胞的感染
选取生长状态良好的C33A细胞,常规消化制备细胞悬液,细胞计数后以1×105/孔的浓度接种于6孔板中,放入CO2培养箱中继续培养24 h。按照“1.2细胞感染复数的测定”摸索出的最佳感染条件,感染C33A细胞。病毒感染12 h以后观察细胞状态,病毒感染24 h后更换新鲜培养基。病毒感染72 h后,观察荧光表达情况。
1.5 慢病毒干扰对C33A细胞VEGF蛋白表达的影响
大量培养C33A细胞,将处于对数生长期的C33A细胞分为3组:空白对照组(实验中使用普通培养基,不添加病毒干扰)、阴性对照组(使用含有无意义链shRNA-scr的慢病毒载体)、实验组(使用含有VEGF-shRNA的慢病毒载体)。按照前述实验(1.2细胞感染复数的测定)摸索出的最佳感染条件,按上述分组分别感染C33A细胞。病毒感染12 h以后观察细胞状态,病毒感染24 h后更换新鲜培养基。病毒感染72 h后,观察荧光表达情况。再次更换完全培养基,继续培养24 h后终止培养。
使用Western blotting检测C33A细胞的VEGF蛋白表达。每瓶细胞加入400 μl RIPA(混合裂解液),裂解完后离心并提取细胞中的总蛋白。使用二辛可酸(bicinchoninic acid,BCA)法测定蛋白含量,分别配制工作液和稀释标准品,每管中加入200 μl BCA工作液,用酶标仪检测562 nm的OD值,根据得到的OD值编制标准曲线,再根据标准曲线计算样本的蛋白浓度。将已定量的蛋白样品5份加1份6×loading buffer(上样缓冲液)使其溶解充分,样品在沸水中加热让蛋白变性,计算出每个样本所需上样的体积。制备聚丙烯酰胺凝胶电泳并上样、转膜,放置5%脱脂牛奶中孵育。将VEGF兔抗人多克隆单抗(一抗)、兔抗人β-actin单克隆单抗分别稀释至1 ∶1 000~1 ∶2 000,将抗体溶液加到封口膜上,次日取出室温下用PBST(磷酸缓冲盐溶液)脱色摇床上洗涤。按上述方法稀释制备鼠抗兔二抗(1 ∶3 000),与膜接触后用PBST液洗涤后进行化学发光。对胶片拍照或扫描,通过凝胶图像处理系统分析条带的分子量以及净光密度值。
1.6 流式细胞术检测干扰后C33A细胞的凋亡
实验分组和细胞感染方法同前,其中每组各设3个重复,独立重复试验。从病毒感染后72 h开始重新计时,分3个时间点即24,48,72 h时分别终止培养细胞,按Annexin Ⅴ/PI双染法检测细胞凋亡情况。
1.7 统计学分析

2 结果
2.1 C33A细胞的感染复数
根据上述的实验分组,在荧光显微镜下观测病毒感染后C33A细胞的荧光表达情况。当感染复数(MOI)为100,呈现较明显的细胞毒性,C33A细胞部分凋亡,失去贴壁能力而漂浮于培养液中;当MOI为10和1时,病毒数量不足以感染多数C33A细胞,荧光镜下绿色荧光细胞数量不足30%;当MOI为50时,细胞状态良好,未见明显凋亡,荧光细胞数量超过50%(见图1)。使用促感染剂Polybrene能够明显提高病毒的感染效率,当MOI=50且使用5 μg/ml的Polybrene时,慢病毒感染对C33A细胞无明显细胞毒性并达到最佳感染效果,荧光细胞数量超过80%,此时为C33A细胞的最佳感染条件。
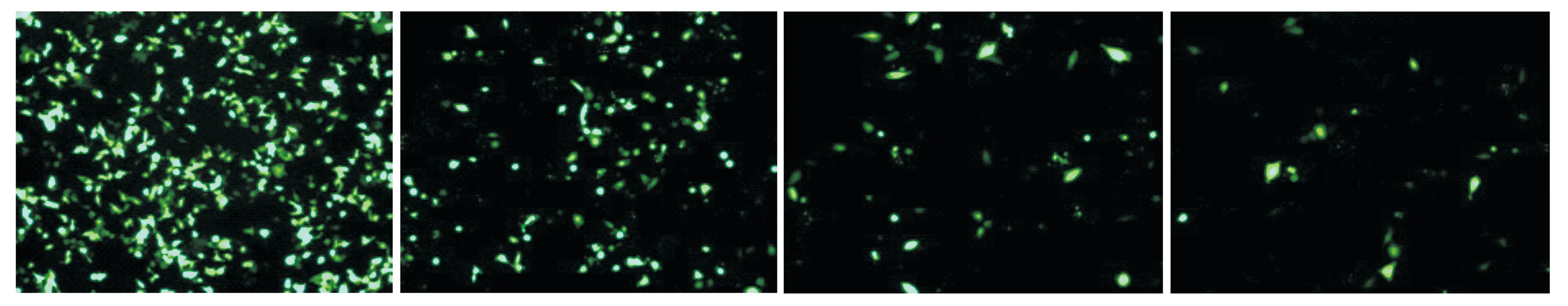
A.5 μg/ml Polybrene+MOI 50 B.MOI=50C.MOI=10D.MOI=1图1 不同条件下慢病毒对C33A细胞的感染差异 (×100)Figure 1 Infection efficacy of lentivirus to C33A cells under different conditions (×100)
2.2 病毒的感染效率
按表1条件换算不同培养体系下的病毒用量。
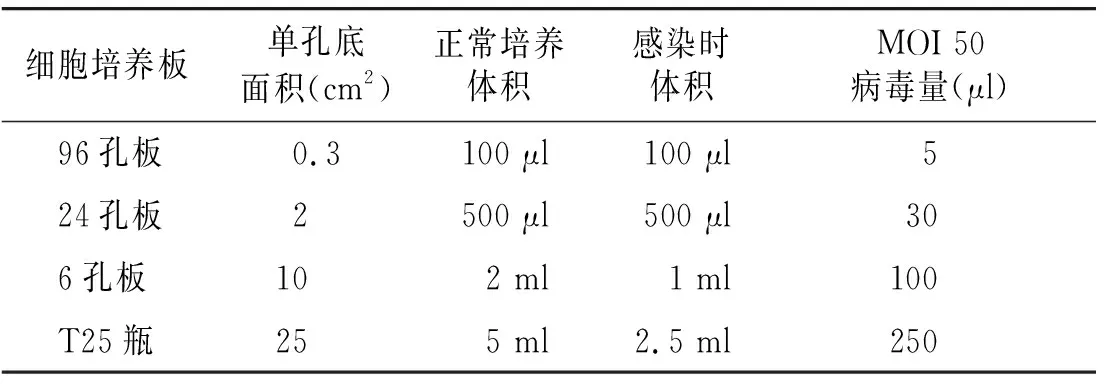
表1 病毒感染细胞所用培养基体积和病毒量参考Table 1 Volume of medium and amount of virus for virus infection
通过计算GFP报告基因的表达情况可估算出慢病毒的感染效率,结果显示当MOI=50且使用5 μg/ml的Polybrene时,LV-VEGF-shRNA慢病毒载体的感染效率约为83%(见图2)。此时慢病毒对C33A细胞达到最佳的感染率,同时对细胞毒性最小,肿瘤细胞存活率最高。
2.3 慢病毒干扰下调C33A细胞VEGF蛋白表达
提取各组C33A细胞的总蛋白,Western blotting检测C33A细胞中VEGF蛋白的表达情况如下:各组细胞均有VEGF蛋白表达,将空白对照组的VEGF蛋白表达量设置为“1”,实验组VEGF蛋白表达量与阴性对照组相比明显降低(23.3%±1.2%vs96.7%±1.8%,P<0.05,见图3)。上述结果提示C33A细胞在慢病毒载体介导的shRNA干扰下,VEGF蛋白的表达量明显降低。

与阴性对照组相比,*P<0.05图3 Western blotting检测病毒感染后C33A细胞的VEGF蛋白表达情况Figure 3 Expression of VEGF protein in C33A cells after virus infection by Western blotting
2.4 干扰后C33A细胞的凋亡情况
流式细胞仪检测结果显示:在24 h时,实验组的细胞凋亡率高于阴性对照组,以早期凋亡为主(见表2,图4)。随着作用时间的延长,实验组细胞的凋亡进一步加剧,在72 h时细胞的总凋亡率(早期凋亡和晚期凋亡之和)达到46%,早期凋亡和晚期凋亡细胞均可见,凋亡率与阴性对照组相比有显著性差异(P<0.05)。阴性对照组在72 h时,亦有部分细胞凋亡出现,以早期凋亡为主。

图4 病毒感染不同时间后C33A细胞的凋亡Figure 4 Apoptosis of C33A cells at different time points after virus infection

表2 流式细胞术检测干扰后C33A细胞的总凋亡率 (%)Table 2 Apoptosis rate of C33A cells after interference by flow cytometry (%)
3 讨论
在正常情况下,血管生成是高度有序的过程,是在严格监管下同时进行诱导血管生成和抑制血管生成的协同过程。这些影响因素包括从细胞中分泌的可溶性生长因子[5],如VEGF,血管紧张素、成纤维细胞生长因子(FGF)、血小板衍生的生长因子(PDGF)、转化生长因子(TGF-β)和膜蛋白结合分子(如整合素、钙黏素和ephrins等)。其他辅助细胞如毛细血管周皮细胞则起到血管支撑作用,并促进新生脉管系统的进一步发育成熟[6]。肿瘤细胞诱导血管生成的过程,模仿部分正常的血管生成过程,但肿瘤组织中VEGF的高水平表达赋予肿瘤血管其独特的性能[7]。VEGF及其受体的作用通过介导血管内皮细胞表面的受体,导致血管内皮细胞的迁移和增殖,并且增强了血管的通透性[8]。Olusola等[9]研究证明在原发性肿瘤中血管发生越多,肿瘤的预后就越差,这表明血管发生与肿瘤的转移有着直接的关系。因此,通过抑制VEGF的表达实现肿瘤的抗血管生成,能够抑制肿瘤的远处转移。
本研究成功构建了针对VEGF-shRNA慢病毒干扰载体,首先检测了C33A细胞的慢病毒感染复数MOI,本文中病毒MOI的测定是在96孔板中进行,下一步的实验反应体系将扩增。扩增的方法是保持细胞的密度,将培养基的体积按实际细胞数与预实验细胞数的比例放大,这样操作的结果可以保持病毒浓度不变[10]。当实验操作保持细胞密度不变时,就可以通过计算培养板中培养基的体积,而计算出细胞的总数。理论上加入相同浓度的病毒越多,被感染的细胞也会越多,但在实际操作中效果并不明显,因为慢病毒载体是一个接近100 nm大小的颗粒,在溶液上层中的病毒颗粒很少有机会接近细胞。感染时,减少培养基的体积反而能提高病毒的利用效率,相同的病毒在小体积中的感染效果要好于大体积中的。本文中最终验证在MOI为50的情况下且使用5 μg/ml的Polybrene时,慢病毒感染对C33A细胞无明显细胞毒性并达到最佳感染效果,感染效果超过80%。成功感染慢病毒后,C33A细胞VEGF蛋白的表达量明显降低,流式细胞仪检测结果显示感染后的C33A细胞凋亡率明显高于空白对照组,并随着作用时间的延长,细胞的凋亡进一步加剧,呈现明显的时间依赖性,因此通过RNAi沉默VEGF基因表达导致C33A宫颈癌细胞的凋亡。
同时我们发现携带有无意义shRNA的阴性对照组中,肿瘤细胞的生长同样受到了轻度的抑制,这可能和病毒对宫颈癌细胞的毒性有关,在使用大剂量病毒后,可能导致部分肿瘤细胞的凋亡,细胞分泌的减少导致了VEGF的表达下降[11]。这样的结果提示:相对于逆转录病毒载体(retrovirus,RV)、腺病毒载体(adenovirus,Ad)和腺相关病毒载体,慢病毒干扰载体因其较小的免疫原性和较高的病毒滴度,适合进行体内实验,而且慢病毒能够高效转染非分裂细胞和终末分化细胞,故尤其适用于其他方法难转染的原代细胞(如神经细胞、原代细胞和悬浮细胞)[12]。但在本实验中,当大剂量使用慢病毒载体时,仍然导致了部分肿瘤细胞的非预期凋亡,如何减轻慢病毒对肿瘤细胞的毒性作用,提高慢病毒针对肿瘤细胞的特异性,是下一步深入研究的方向。
