miR-143-5p靶向AGR2在肝癌细胞增殖和凋亡中的作用
2023-01-15杨林青潘龙飞田红卫
任 松,杨林青,潘龙飞,田红卫
(1西安交通大学第二附属医院普通外科四病区,西安 710004;2西安交通大学第二附属医院生物诊断治疗国家地方联合工程研究中心;3西安交通大学第二附属医院急诊科;*通讯作者,E-mail:rensong1982@126.com)
肝癌是全球癌症相关死亡的重要原因[1]。肝癌在我国是癌症相关死亡的第二大原因[2]。肝细胞癌占原发性肝癌的90%[3]。肝癌早期缺乏明显的症状,导致诊断时多为晚期,晚期患者的中位生存率仅为1~1.5年[4-6]。现有的治疗方法对晚期肝癌的治疗效果不佳,因此我国肝癌的整体5年生存率仅为10.1%[7]。为提高肝癌治疗效果,需开发新的治疗靶点。
microRNA作为治疗靶点是目前肝癌研究中最有前景的方向之一[8-10]。microRNA是一类大小为19~25个核苷酸的非编码RNA分子,可调节靶基因的转录后沉默[11]。microRNA与癌症的发生、发展和转移密切相关[12]。在肝癌中也发现microRNA的失调广泛涉及抑癌基因的失活和癌基因的激活[10]。miR-143-5p在胰腺癌和胃癌中低表达[13,14],但在肝癌中尚未见报道。本研究探讨了miR-143-5p在肝癌细胞系中的表达水平及其作用,为肝癌治疗提供可能的治疗靶点。
1 材料与方法
1.1 材料
正常肝细胞HL-7702和肝癌细胞(BEL-7402、HepG2、SMMC-7721、MHCC-97H和Hep3B)均购自中国科学院细胞库。miR-143-5p mimics、阴性对照mimics-NC、AGR2小分子干扰RNA(si-AGR2)和阴性对照si-NC购自上海吉玛制药技术有限公司。甲基噻唑基四唑(MTT)试剂盒购自于上海碧云天生物技术有限公司。逆转录酶PCR试剂盒和miR-X miRNA qRT-PCR TB Green购自日本TaKaRa公司,引物由日本TaKaRa公司合成。一抗兔抗人抗体Bax、Caspase-3和Bcl-2抗体购于美国Santa Cruz公司,二抗山羊抗兔抗体购于武汉博士德生物工程有限公司。Annexin Ⅴ-FITC/PI凋亡检测试剂盒购于北京索莱宝科技有限公司。双荧光素酶报告基因试剂盒购于美国Promega公司。Lipofectamine2000购于美国Invitrogen公司。
1.2 实验分组
按照Lipofectamine2000说明书,将对数生长的肝癌细胞BEL-7402和HepG2分别转染mimics-NC和miR-143-5p mimics,命名为mimics-NC组和miR-143-5p mimics组。采用MTT法、克隆形成实验、流式细胞术和Western blot分别检测mimics-NC组和miR-143-5p mimics组细胞增殖能力、克隆形成能力、凋亡率和凋亡相关基因(Bax、Caspase-3和Bcl-2)的表达。双荧光素酶报告基因检测mimics-NC组和miR-143-5p mimics组的荧光素酶活性。qRT-PCR和Western blot分别检测mimics-NC组和miR-143-5p mimics组AGR2的mRNA和蛋白表达。
再将肝癌细胞BEL-7402和HepG2分别转染si-NC和si-AGR2,命名为si-NC组和si-AGR2组。采用MTT、克隆形成实验和流式细胞术分别检测si-NC组和si-AGR2组细胞增殖能力、克隆形成能力和凋亡率。
1.3 MTT法检测细胞增殖能力
将肝癌细胞BEL-7402和HepG2按照1.2所述进行分组,将各组肝癌细胞接种在96孔板(5×103个细胞/孔)中。在第1,2,3,4,5天于每孔中加入MTT试剂,培养箱继续培养4 h。弃去上清液,每孔加入150 μl二甲基亚砜低速震荡使其溶解。用酶标仪测定490 nm吸光值。
1.4 实时荧光定量PCR(qRT-PCR)检测RNA表达
qRT-PCR检测正常肝细胞HL-7702和肝癌细胞(BEL-7402、HepG2、SMMC-7721、MHCC-97H和Hep3B)中的miR-143-5p表达。再采用qRT-PCR检测肝癌细胞BEL-7402和HepG2中mimics-NC组和miR-143-5p mimics组AGR2的mRNA表达。使用Trizol法提取总RNA,然后反转录为cDNA,再以cDNA为模板进行PCR扩增。U6作为miR-143-5p内参照,GAPDH作为AGR2内参照。miR-143-5p引物上游:5′-GGTGCAGTGCTGCATCT-3′,下游:5′-CTCAACTGGTGTCGTGGA-3′。AGR2引物上游:5′-ATGGAGAAAATTCCAGTG-3′,下游:5′-TTACAATTCAGTCTTCAG-3′;U6引物上游:5′-GCTTCGGCAGCACATATACTAAAA-3′,下游:5′-CGCTTCACGAATTTGCGTGTCAT-3′;GAPDH引物上游:5′-CCACATCGCTCAGACACCAT-3′,下游:5′-ACCAGGCGCCCAATACG-3′。采用2-ΔΔCt方法计算RNA的相对表达量。
1.5 Western blot检测Bax、Caspase-3、Bcl-2和AGR2蛋白表达
将肝癌细胞BEL-7402和HepG2按照1.2所述进行分组。采用RIPA裂解液提取各组细胞总蛋白。将等量的蛋白样品加入SDS-PAGE凝胶,进行电泳。再行转膜,将蛋白转移至PVDF膜。将转膜后的PVDF膜放入封闭液中封闭1.5 h。加入一抗Bax(1 ∶500)、Caspase-3(1 ∶500)、Bcl-2(1 ∶500)和AGR2(1 ∶200),在4 ℃静置过夜。洗膜后再加入二抗,置于37 ℃孵育2 h。再洗膜,使用化学发光法显影。
1.6 克隆形成实验检测细胞增殖
将肝癌细胞BEL-7402和HepG2按照1.2所述进行分组。取对数生长期的各组肝癌细胞,采用胰酶消化和反复吹打成单个细胞。接种于六孔板中,在细胞培养箱中培养14 d。用多聚甲醛固定30 min,PBS清洗后再用结晶紫染色15 min。清洗染色液后照相。克隆形成率=克隆数/接种细胞数×100%。
1.7 流式细胞术检测细胞凋亡
将肝癌细胞BEL-7402和HepG2按照1.2所述进行分组。将各组细胞收集到离心管内,用PBS洗涤2次并离心。加入结合缓冲液将细胞浓度调整为1×106/ml,取100 μl细胞悬液加5 μl Annexin Ⅴ/FITC避光孵育5 min。再加5 μl碘化丙锭溶液(PI)和400 μl PBS。用流式细胞仪检测。
1.8 生物信息学预测miR-143-5p的靶基因
运用靶基因预测网站RNA22预测miR-143-5p可能结合的靶基因。
1.9 双荧光素酶报告基因检测靶基因
构建靶基因AGR2的野生型和突变型荧光素酶报告载体,将它们分别与mimics-NC或miR-143-5p mimics分别转染到BEL-7402和HepG2细胞中,分为mimics-NC组和miR-143-5p mimics组。转染48 h后,使用双荧光素酶报告基因试剂盒检测各组的荧光素酶活性。以海肾荧光素酶作为内参。
1.10 统计学分析
全部数据采用SPSS18.0统计处理软件,两组之间比较进行独立样本t检验分析,多组之间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 miR-143-5p在正常肝细胞HL-7702和肝癌细胞中的表达
与正常肝细胞HL-7702相比,肝癌细胞BEL-7402、HepG2、SMMC-7721、MHCC-97H和Hep3B的miR-143-5p表达均明显下降(P<0.01,见图1)。

与正常肝细胞HL-7702相比,**P<0.01图1 qRT-PCR检测正常肝细胞HL-7702与肝癌细胞中miR-143-5p表达Figure 1 Expression of miR-143-5p in normal hepatocytes HL-7702 and hepatocellular carcinoma cells by qRT-PCR
2.2 过表达miR-143-5p抑制肝癌细胞BEL-7402和HepG2增殖
与mimics-NC组相比,miR-143-5p mimics组肝癌细胞BEL-7402和HepG2细胞中miR-143-5p表达水平明显上升(P<0.01,见图2),表明转染成功。
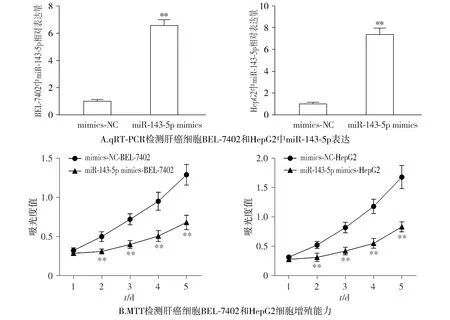
与mimics-NC组相比,**P<0.01图2 过表达miR-143-5p抑制肝癌细胞BEL-7402和HepG2的增殖Figure 2 Overexpression of miR-143-5p inhibits proliferation of BEL-7402 and HepG2 cells
与mimics-NC组相比,miR-143-5p mimics组BEL-7402和HepG2的细胞增殖能力和克隆形成能力明显下降(P<0.01,见图2,3)。

与mimics-NC组相比,**P<0.01图3 过表达miR-143-5p抑制肝癌细胞BEL-7402和HepG2的克隆形成能力Figure 3 Overexpression of miR-143-5p inhibits clone formation ability of BEL-7402 and HepG2 cells
2.3 过表达miR-143-5p促进肝癌细胞BEL-7402和HepG2凋亡
与mimics-NC组相比,miR-143-5p mimics组BEL-7402和HepG2细胞凋亡率明显上升(P<0.01,见图4);与mimics-NC组相比,miR-143-5p mimics组凋亡蛋白Bax和Caspase-3表达明显上升(P<0.01,见图5),抗凋亡蛋白Bcl-2表达明显下降(P<0.01,见图5)。
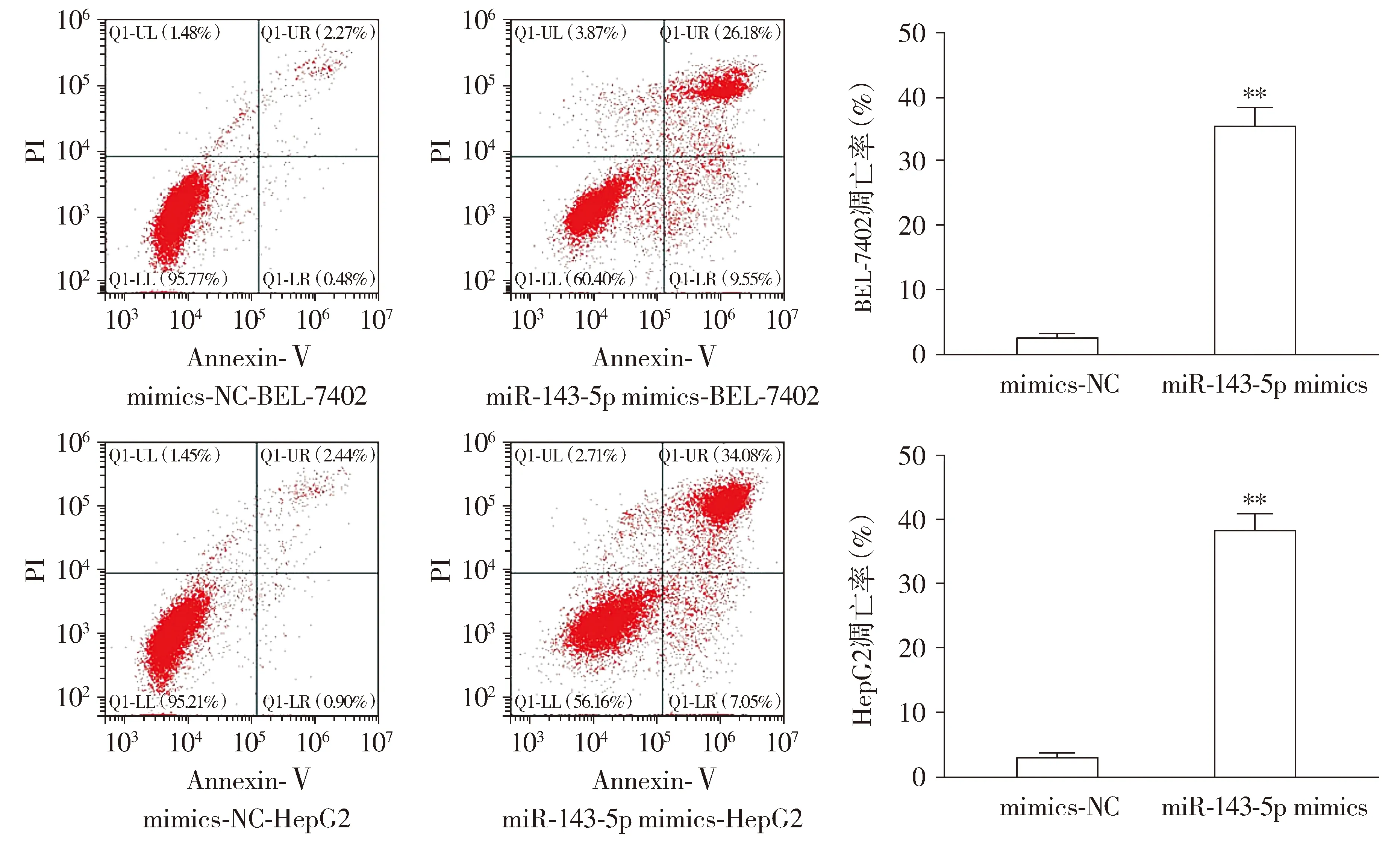
与mimics-NC组相比,**P<0.01图4 过表达miR-143-5p促进肝癌细胞BEL-7402和HepG2的凋亡Figure 4 Overexpression of miR-143-5p promotes apoptosis of BEL-7402 and HepG2 cells
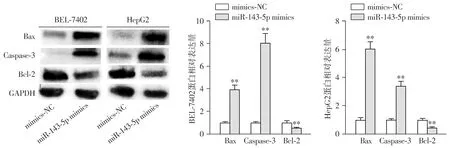
与mimics-NC组相比,**P<0.01图5 Western blot检测肝癌细胞BEL-7402和HepG2中mimics-NC组和miR-143-5p mimics组Bax、Caspase-3和Bcl-2表达Figure 5 Expression of Bax, Caspase-3 and Bcl-2 in BEL-7402 and HepG2 cells in mimics-NC group and miR-143-5p mimics group by Western blot
2.4 miR-143-5p靶向调控AGR2基因
通过RNA22网站预测基因AGR2与miR-143-5p存在结合位点,可能是miR-143-5p靶基因(见图6)。在肝癌细胞BEL-7402和HepG2细胞中,双荧光素酶报告基因试验显示,与共转染野生型AGR2质粒的mimics-NC组相比,共转染野生型AGR2质粒的miR-143-5p mimics组荧光素酶活性明显降低(P<0.01,见图6),表明AGR2是miR-143-5p的靶基因。
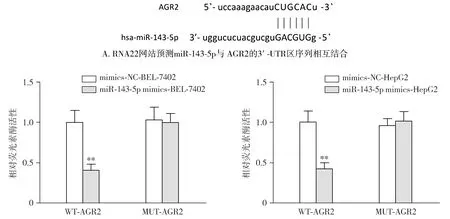
与mimics-NC组相比,**P<0.01B.双荧光素酶报告实验检测miR-143-5p与AGR2的靶向作用关系图6 肝癌细胞BEL-7402和HepG2细胞中miR-143-5p靶向调控靶基因AGR2表达Figure 6 MiR-143-5p targetedly regulates AGR2 expression in BEL-7402 and HepG2 cells
在肝癌细胞BEL-7402和HepG2细胞中,与mimics-NC组相比,miR-143-5p mimics组AGR2的mRNA的水平明显下降(P<0.01),AGR2的蛋白表达水平明显下降(P<0.01,见图7)。
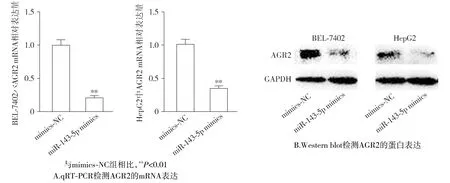
图7 过表达miR-143-5p抑制肝癌细胞BEL-7402和HepG2中AGR2的表达Figure 7 Overexpression of miR-143-5p inhibits expression of AGR2 in BEL-7402 and HepG2 cells
2.5 沉默AGR2基因表达抑制肝癌细胞增殖和促进凋亡
肝癌细胞BEL-7402和HepG2转染si-NC和si-AGR2后,si-AGR2组AGR2表达与si-NC组相比明显下降(P<0.01,见图8),表明转染成功。
与si-NC组相比,si-AGR2组BEL-7402和HepG2细胞增殖能力(P<0.01,见图8)和克隆形成能力明显下降(P<0.01,见图9)。与si-NC组相比,si-AGR2组细胞凋亡率明显上升(P<0.01,见图10)。
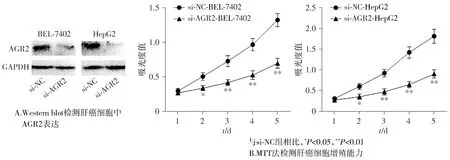
图8 沉默AGR2表达抑制肝癌细胞BEL-7402和HepG2增殖Figure 8 Silencing of AGR2 inhibits proliferation of BEL-7402 and HepG2 cells
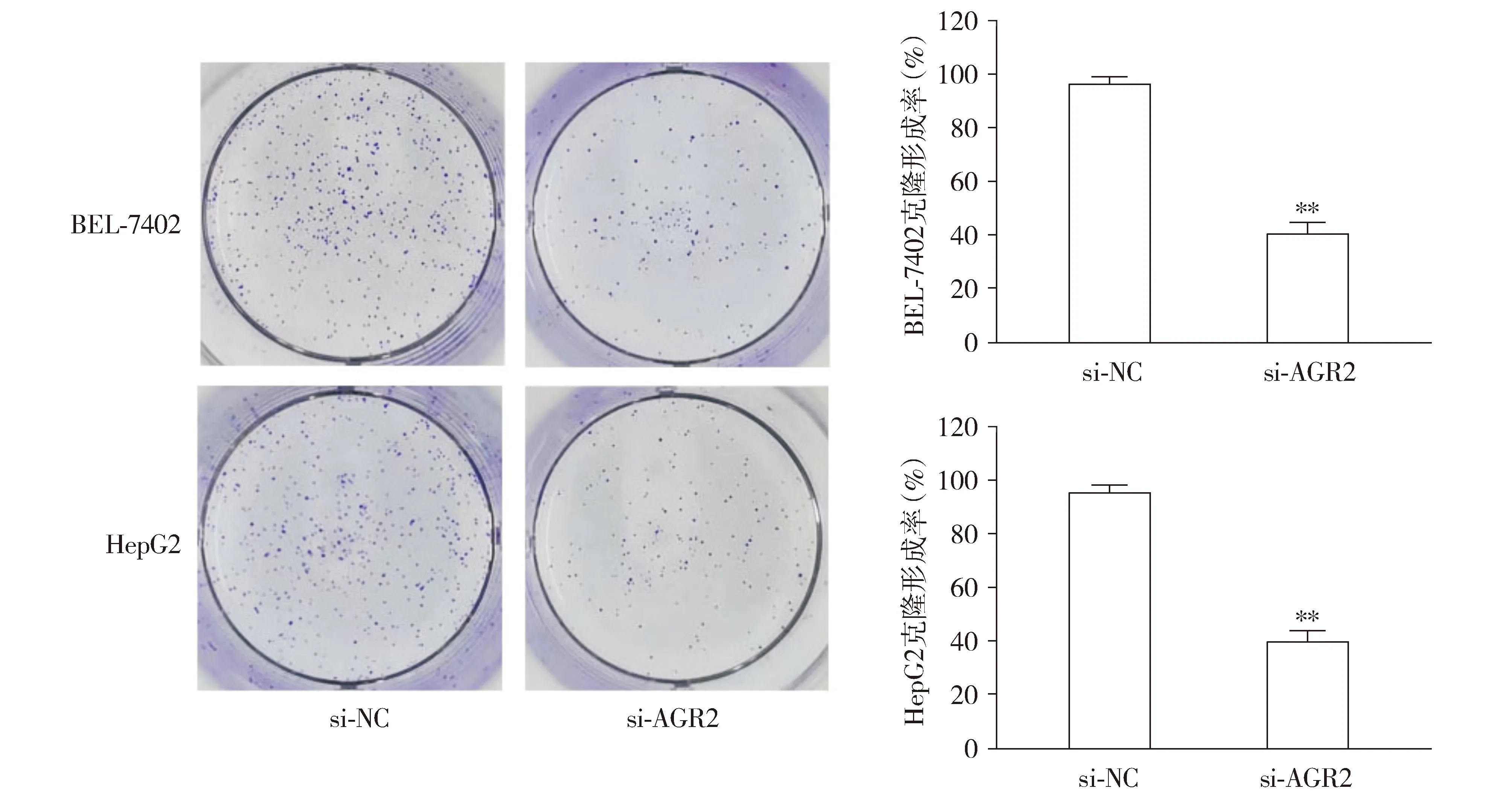
与si-NC组相比,**P<0.01图9 沉默AGR2表达抑制肝癌细胞BEL-7402和HepG2的克隆形成能力Figure 9 Silencing of AGR2 inhibits clone formation ability of BEL-7402 and HepG2 cells
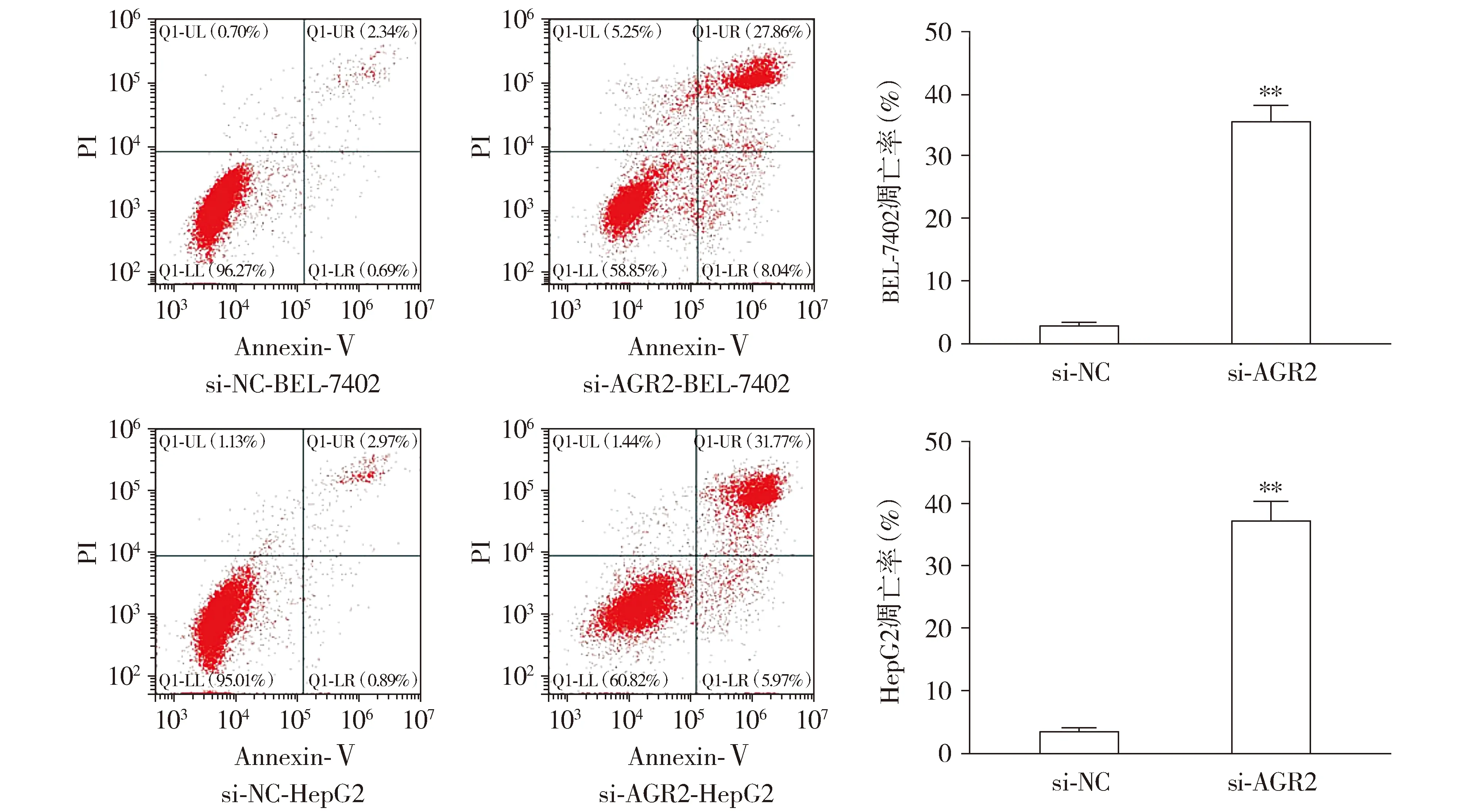
与si-NC组相比,**P<0.01图10 沉默AGR2表达促进肝癌细胞BEL-7402和HepG2凋亡Figure 10 Silencing of AGR2 promotes apoptosis of BEL-7402 and HepG2 cells
3 讨论
众多microRNA在肝癌中表达失调,在肝癌的发生发展过程中起着重要作用[8]。miR-21、miR-221和miR-222在肝癌中过度表达,通过负调控肝癌中的肿瘤抑制蛋白编码基因来促进肿瘤发生[15-17]。miR-122、miR-125b、miR-139、miR-101和let-7等microRNA在肝癌中表达下调,它们通过抑制肝癌的癌基因发挥抑制肿瘤作用[18-21]。microRNA已成为肝癌治疗最有希望的靶点之一。
我们的研究发现在肝癌细胞BEL-7402和HepG2中miR-143-5p表达下降。过表达miR-143-5p可以抑制肝癌细胞的增殖,促进凋亡,降低Bcl-2表达,升高Bax和Caspase-3的表达。表明miR-143-5p可能通过调控Bcl-2、Bax和Caspase-3促进肝癌细胞的凋亡。其他研究也发现,miR-143-5p在胰腺癌中低表达,上调miR-143-5p表达可抑制胰腺癌细胞增殖,促进凋亡和自噬[13]。miR-143-5p在多个胃癌细胞系中显著下调,过表达miR-143-5p可以抑制胃癌细胞增殖,促进凋亡[14]。miR-143-5p的过度表达可通过调控ELK1抑制宫颈细胞周期、增殖、迁移和侵袭,促进凋亡[22]。胆囊癌组织中miR-143-5p的下降与肿瘤大小、TNM分期及其生存率密切相关[23]。
我们通过预测网站预测显示AGR2可能是miR-143-5p的靶基因。双荧光素酶报告基因证实了AGR2为miR-143-5p的直接靶基因。过表达miR-143-5p可抑制AGR2的表达,进一步表明了miR-143-5p可与AGR2 mRNA结合。抑制AGR2的表达,可以抑制肝癌细胞的增殖,促进肝癌细胞凋亡。提示miR-143-5p可能通过靶向AGR2调控肝癌细胞的增殖和凋亡。miR-143-5p靶向调控AGR2还需挽救实验进一步证实。AGR2是一种癌基因,在各种癌症中普遍高表达,在肿瘤的发生、发展和转移中起着决定性的作用[24,25]。AGR2过表达可促进了肝癌细胞体外的增殖、迁移、侵袭能力和裸鼠模型体内的侵袭性[26,27]。高表达的AGR2通过激活ERK/AKT促进胰腺癌细胞增殖、迁移和侵袭,抑制凋亡[28]。AGR2在结肠癌干细胞高表达,促进干细胞成球能力,并且和结肠癌患者生存率密切相关[29]。AGR2水平升高可以促进非小细胞肺癌细胞的增殖和迁移,且AGR2表达升高的非小细胞肺癌患者预后较差[30]。
综上所述,上调miR-143-5p表达可能通过靶向抑制AGR2的表达,抑制肝癌细胞的增殖和凋亡,miR-143-5p有可能成为治疗肝癌的潜在靶点。肝癌细胞中miR-143-5p调控AGR2的机制还需挽救实验进一步证实。
