MEX3A对肺鳞癌细胞增殖和转移的作用及其机制
2023-01-15陈范才杨继承袁跃西
陈范才,杨继承,王 娇,袁跃西
(南华大学附属长沙中心医院胸心外科,长沙 410000;*通讯作者,E-mail:yxdoctor@sina.com)
肺癌是一种常见的恶性肿瘤,统计数据显示2020年肺癌患者近23万人,死亡13.5万人,给患者及其家属带来了巨大的负担[1]。非小细胞肺癌(NSCLC)约占肺癌病例的85%,其中肺鳞状细胞癌和肺腺癌是非小细胞肺癌的主要亚型。而与肺腺癌相比,肺鳞癌的早期诊断和治疗策略仍然有限,研究表明由于确诊时较晚,肺鳞癌患者的5年总生存率仅为17.7%,预后较差[2]。因此,新的靶分子对于改善肺鳞癌的治疗和预后至关重要。一些分子异常与肺鳞癌细胞的增殖、侵袭和生存不良有关,研究这些异常分子的生物学功能将大大加快新型有效治疗策略的发展[3]。MEX3A是一种RNA结合蛋白(RBPs),具有高度保守的RNA结合结构域和C端环指结构域。大量研究表明MEX3A在各种恶性肿瘤的发展中扮演着复杂多样的角色,MEX3A在mRNA和基因表达的转录后过程中起着关键作用[4,5]。研究报道MEX3A在三阴乳腺癌和食管鳞状细胞癌中发挥促癌基因的作用,促进肿瘤的恶性进展[6,7]。但Xu等[8]研究发现MEX3A通过调控AKT抑制宫颈癌细胞的增殖和上皮间质转化(epithelial-mesenchymal transitions, EMT)。这些研究表明MEX3A可能在不同类型的癌细胞中发挥双向调节功能。MEX3A在肺腺癌中被报道为癌基因[9],但是MEX3A在肺鳞癌中的作用尚不清楚。本文通过研究MEX3A在肺鳞癌组织中的表达水平及MEX3A在肺鳞癌细胞中发挥的作用,探讨其促进肺鳞癌增殖和转移的作用机制。
1 材料与方法
1.1 试剂来源
二甲苯和无水乙醇购自深圳中粤化学有限公司(中国深圳);Histomouse SP Broad Spectrum DAB IHC检测试剂盒购自Invitrogen试剂公司(美国);牛血清白蛋白购自北京阳光生物科技有限公司(中国北京);苏木素购自solarbio试剂公司(中国北京);免疫组化二抗试剂盒购自丹麦DAKO试剂公司;肺鳞癌细胞株H226购自中国科学院细胞库(中国上海);RPMI-1640培养基购自SparkJade试剂公司(中国山东);胎牛血清和青链霉素双抗购自Gibco公司(美国);MEX3A敲减质粒和MEX3A过表达质粒购于上海吉玛基因技术有限公司(中国上海);TRIzol试剂购自Invitrogen试剂公司(美国);RNA提取试剂盒购自睿时生物科技有限公司(中国上海);反转录试剂盒和qRT-PCR试剂盒购自TaKaRa公司(日本);MEX3A和内参GAPDH引物由生工生物技术有限公司合成(中国上海);CCK-8试剂购自BestBio公司(中国南京);Transwell小室购自Corning公司产品(美国);RIPA蛋白裂解液Cell Signaling试剂公司(美国);BCA蛋白质测定试剂盒购自上海炎熙生物科技有限公司(中国上海);PVDF膜购于GE试剂公司(中国上海);MEX3A、兔源PI3K、p-PI3K、AKT、p-AKT、GAPDH和HRP偶联的二抗购于英国Abcam公司。
1.2 生物信息学分析资料
肺鳞癌转录组测序数来自于GEPIA(http://gepia.cancer-pku.cn/detail.php)的官方网址,共获得肺鳞癌组织样本486例,正常肺组织样本338例,分析MEX3A在肺鳞癌和正常肺组织的表达水平。
1.3 临床组织样本
收集2013年1月至2015年7月期间入住我院的肺鳞癌患者的肿瘤组织及其匹配的远离肿瘤组织3 cm的癌旁组织,并包埋切片制成石蜡切片。手术标本必须满足以下纳入标准:①组织病理学证实为肺鳞癌组织;②无其他恶性肿瘤;③术前未进行全身治疗;④具备完整的临床病理参数,包括年龄、性别、肿瘤大小、TNM分期、淋巴结转移、生存时间(生存随访均超过5年);⑤具有患者知情同意书。共纳入肺鳞癌和癌旁组织标本各58例。手术组织标本的使用由我院伦理委员会批准(批准文号:2012-084),并根据世界医学协会赫尔辛基宣言进行。
1.4 免疫组化检测肺鳞癌和癌旁组织中MEX3A蛋白的表达
石蜡切片经二甲苯脱蜡、水化后在10 mmol/L柠檬酸盐缓冲液(pH 6.0)中微波进行抗原修复,并采用链霉亲和素过氧化物酶对石蜡包埋的切片进行免疫染色。样品用3%牛血清白蛋白在室温下封闭15 min后,将样品与1 ∶100稀释的抗MEX3A一抗在4 ℃下孵育过夜。PBS洗涤3次后,加入辣根过氧化物酶(HRP)偶联的聚合物二抗在室温下孵育30 min。采用3,3′-二氨基联苯胺溶液检测免疫信号。由两名病理学家在放大倍数为4倍和20倍的光学显微镜中独立观察染色切片的4个视野。每种蛋白质的染色强度分为4个等级(强度评分):0分(阴性)、1分(弱棕色)、2分(中度棕色)和3分(强棕色)。阳性细胞的百分比评分为0分(≤10%)、1分(11%~25%)、2分(26%~50%)、3分(51%~75%)和4分(>75%)。使用以下公式计算最终染色分数:强度分数×百分比分数。最终得分>1定义为高表达,最终得分≤1定义为低表达。
1.5 细胞培养、分组和转染
肺鳞癌细胞株H226在RPMI-1640细胞培养基中培养,并补充有10%的胎牛血清和1%的青霉素/链霉素的混合物,放置在37 ℃下含有5% CO2的培养箱中培养。H226细胞生长较好时,将H226细胞以每孔2×105个接种于6孔板内,分为NC组、sh-MEX3A组和oe-MEX3A组。其中NC组细胞中加入5 μl Lip 2000和5 μg对照质粒,sh-MEX3A组细胞中加入5 μl Lip 2000和5 μg MEX3A敲减质粒,oe-MEX3A组细胞中加入5 μl Lip 2000和5 μg MEX3A过表达质粒。转染48 h后,通过qRT-PCR和Western blot检测干扰效率。
1.6 qRT-PCR检测各组细胞中MEX3A mRNA表达
细胞采用TRIzol试剂裂解,RNA提取试剂盒提取细胞样中总RNA。将总RNA按照反转录试剂盒说明书逆转录为cDNA,以cDNA为扩增模板按照qRT-PCR试剂盒说明书进行荧光定量PCR,PCR体系为:2×SYBR Premix Ex Taq 12.5 μl,DNA模板2 μl,正向引物(10 μmol/L)0.5 μl,反向引物(10 μmol/L)0.5 μl,用双蒸水补充至25 μl。将反应体系混匀后采用ABI 7500PCR仪得到每个样品的循环阈值(threshold cvcle,Ct),按照2-ΔΔCt公式计算细胞中MEX3A mRNA的相对表达量。MEX3A正向:5′-TGGAGAACTAGGATGTTTCGGG-3′,反向:5′-GAGGCAGAGTTGATCGAGAGC-3′。内参GAPDH正向:5′-CGGCAGAGCGATAAGACCT-3′,反向:5′-CGGCAGAGCGATAAGACCT-3′。
1.7 CCK-8实验检测各组细胞增殖能力
将转染MEX3A敲减质粒和MEX3A过表达质粒的H226细胞重悬并计数,以2 000个细胞接种到96孔板中,每组设置6个重复孔,并接种5 d的细胞孔,放置在37 ℃下含有5% CO2的培养箱中培养。分别于培养的第1,2,3,4,5天时每个细胞孔更换100 μl新鲜培养基,并加入10 μl CCK-8试剂,于450 nm处的检测细胞光密度(OD值)以评估细胞活力。
1.8 Transwell实验检测各组细胞转移能力
将转染MEX3A敲减质粒和MEX3A过表达质粒的H226细胞重悬,无血清培养基洗3次,计数后将1×104个细胞接种在Transwell小室的聚碳酸酯膜上(8 μm孔径),并在下室中加入含有20% FBS的100 μl的培养基。孵育10 h后,用棉签小心地去除膜上未迁移的细胞,而膜上的细胞经4%多聚甲醛固定,结晶紫染料染色。在显微镜下随机选择5个不重叠的视野计算迁移细胞数目。
1.9 Western blot实验检测蛋白表达水平
细胞在含有蛋白酶/磷酸酶抑制剂混合物的蛋白缓冲液中裂解,经高速离心去除细胞碎片后获得蛋白裂解液。根据二辛可宁酸(BCA)测定法检测和计算蛋白质浓度。将20 μg等量的蛋白质加入十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶中,并将凝胶转移到聚偏二氟乙烯膜(PVDF)中。牛奶封闭后,将PVDF膜与MEX3A、PI3K、p-PI3K、AKT、p-AKT一抗稀释液(稀释浓度均为1 ∶1 000)孵育过夜。然后,将PVDF膜与兔、鼠二抗(稀释浓度均为1 ∶8 000)孵育。最后采用ECL试剂盒检测蛋白条带。
1.10 统计学方法
所有实验重复3次,数据均用均数±标准差表示,使用Graph Pad Prism软件作图展示。并采用SPSS 20.0统计软件进行分析,计数资料组间比较采用χ2检验。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步组间两两比较采用LSD-t检验。通过Kaplan Meier法绘制患者生存曲线,Log-Rank法进行统计检验,P<0.05为差异有统计学意义。
2 结果
2.1 MEX3A在肺鳞癌组织中表达上调
GEPIA网站分析显示MEX3A在肺鳞癌组织中的表达显著高于正常肺组织中的表达(P<0.05,见图1)。免疫组化检测MEX3A在肺鳞癌组织中的表达显著高于癌旁组织中的表达(55.17%vs36.21%,P<0.05,见图2和表1)。
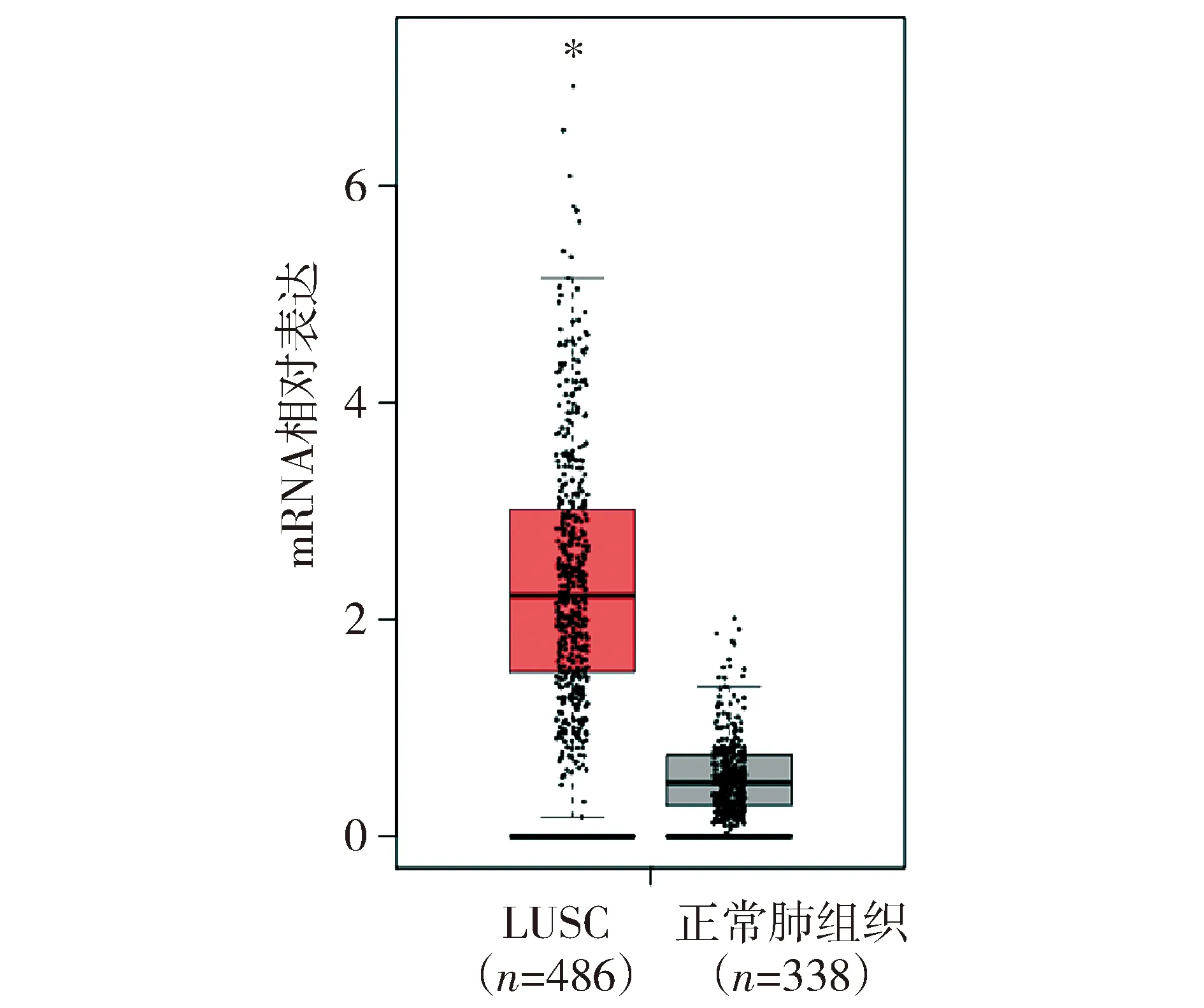
与正常肺组织相比,*P<0.05图1 GEPIA网站分析MEX3A在肺鳞癌组织中的表达Figure 1 MEX3A expression in lung squamous tissue by GEPIA website analysis
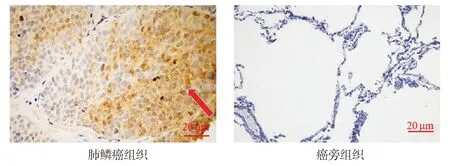
图2 免疫组化检测MEX3A蛋白在癌旁组织及肺鳞癌组织中表达情况的表达 (×100)Figure 2 MEX3A protein expression in lung squamous carcinoma tissue and adjacent tissue by immunohistochemistry (×100)
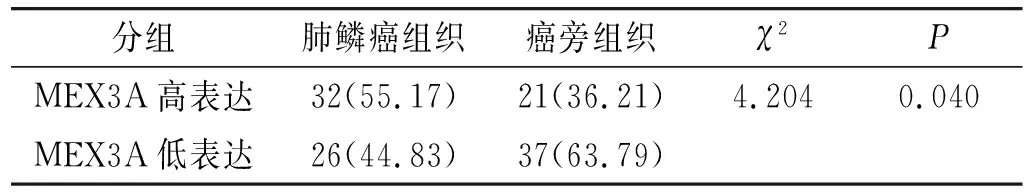
表1 MEX3A蛋白在肺鳞癌组织和癌旁组织中的表达 例(%)Table 1 The expression of MEX3A protein in lung squamous carcinoma tissue and adjacent tissue cases(%)
2.2 MEX3A表达与肺鳞癌患者病理参数的关系
卡方检验分析MEX3A蛋白与肺鳞癌患者病理参数的关系,结果显示高表达MEX3A与肺鳞癌患者年龄、性别、肿瘤大小无关(P>0.05),与患者TNM分期、淋巴结转移显著相关(P<0.05,见表2),TNM分期晚期的肺鳞癌患者中MEX3A表达上调,淋巴结转移的肺鳞癌患者中MEX3A表达上调。
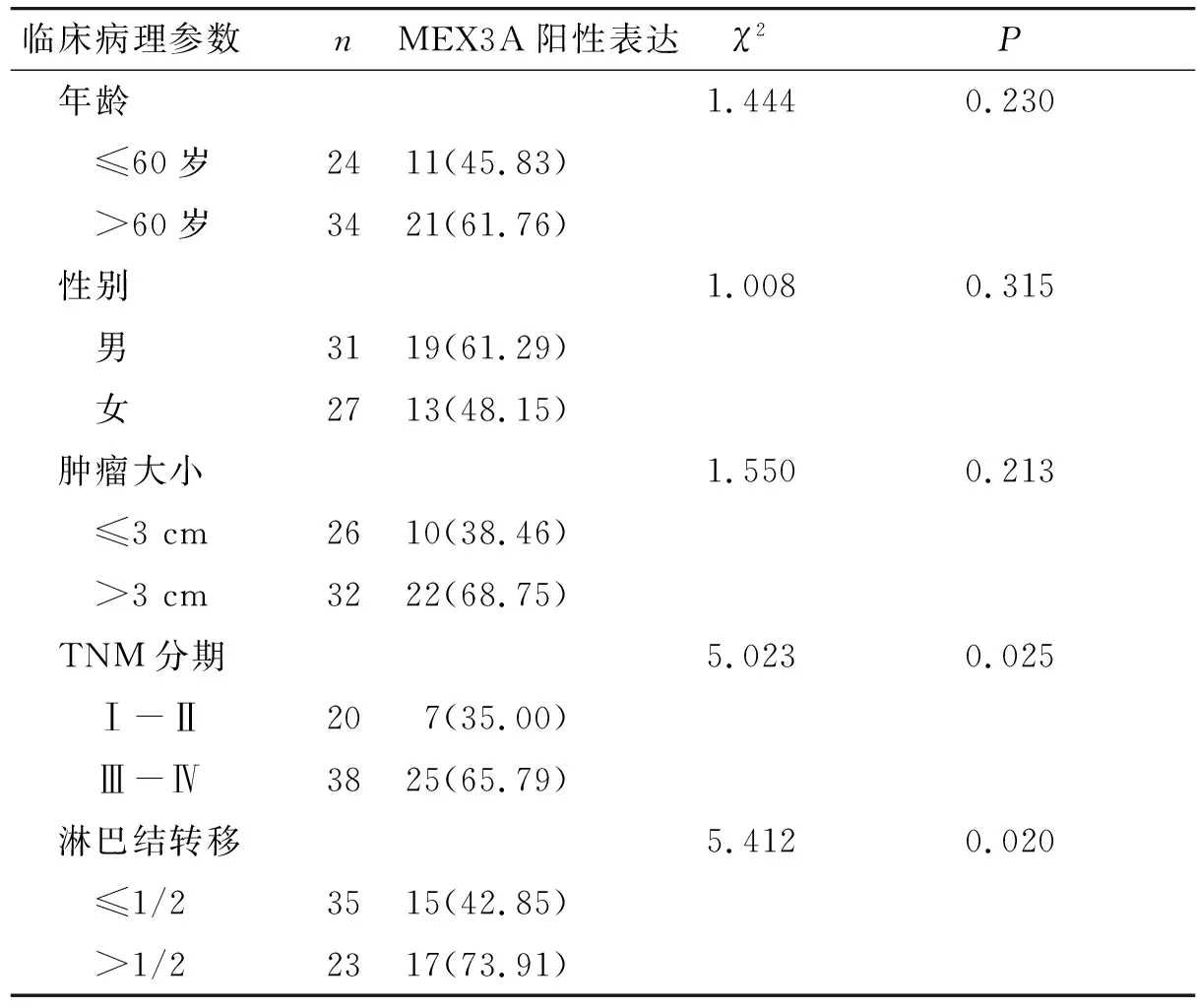
表2 MEX3A蛋白在肺鳞癌组织中的表达与临床病理参数之间的关系 例(%)Table 2 Relationships between MEX3A protein expression and clinicopathological parameters in lung squamous carcinoma tissues cases(%)
2.3 MEX3A表达与肺鳞癌患者预后的关系
Log-Rank法统计检验显示与低表达MEX3A的肺鳞癌患者相比,高表达MEX3A的肺鳞癌患者预后较差(χ2=4.029,P=0.045,见图3)。

图3 Log-Rank检验分析MEX3A蛋白在肺鳞癌组织中表达与患者预后的关系Figure 3 Relationship of MEX3A protein expression in lung squamous tissues with patients’ prognosis By Log-Rank analysis
2.4 MEX3A质粒转染肺鳞癌细胞效果
qRT-PCR结果显示MEX3A mRNA在NC组、sh-MEX3A和oe-MEX3A组H266细胞中的相对表达分别为1.24±0.21,0.16±0.05和3.89±0.44。与NC组相比,sh-MEX3A组肺鳞癌细胞中MEX3A的表达显著降低(t=8.665,P<0.001),oe-MEX3A组肺鳞癌细胞中MEX3A的表达显著增加(t=9.414,P=0.003,见图4A)。
Western blot结果显示MEX3A蛋白在NC组、sh-MEX3A和oe-MEX3A组H266细胞中的表达分别为1.21±0.24,0.18±0.03和2.14±0.18。与NC组相比,sh-MEX3A组肺鳞癌细胞中MEX3A的表达显著降低(t=7.376,P=0.001),oe-MEX3A组肺鳞癌细胞中MEX3A的表达显著增加(t=5.369,P=0.003,见图4B)。

图4 MEX3A质粒转染肺鳞癌细胞效果Figure 4 Efficacy of MEX3A plasmid transfection in lung squamous cell carcinoma cells
2.5 MEX3A对细胞增殖能力的影响
CCK-8检测结果显示:与NC组相比,sh-MEX3A组肺鳞癌细胞增殖能力显著降低(P<0.05),oe-MEX3A组肺鳞癌细胞增殖能力显著增加(P<0.05,见图5)。

与NC组相比,*P<0.05图5 CCK-8检测各组H266细胞增殖能力Figure 5 The proliferation ability of H266 cells in NC group, sh-MEX3A group and oe-MEX3A group by CCK-8
2.6 MEX3A对细胞转移能力的影响
Transwell实验检测结果显示NC组、sh-MEX3A和oe-MEX3A组H266细胞转移细胞数目分别为(45.33±7.24)个,(27.67±5.36)个和(79.67±6.51)个。与NC组相比,sh-MEX3A组肺鳞癌细胞转移能力显著降低(t=3.396,P=0.019),oe-MEX3A组肺鳞癌细胞转移能力显著增加(t=6.109,P=0.002,见图6)。

图6 Transwell检测各组H266细胞转移能力 (×100)Figure 6 The invasion ability of H266 cells in NC group, sh-MEX3A group and oe-MEX3A group by Transwell assay (×100)
2.7 PI3K/AKT信号通路检测
western-blot检测结果显示,与NC组相比,sh-MEX3A组肺鳞癌细胞中p-PI3K和p-AKT蛋白表达显著降低(P<0.05),oe-MEX3A组肺鳞癌细胞中p-PI3K和p-AKT蛋白表达显著增加(P<0.05),而PI3K和AKT蛋白均无明显改变,差异无统计学意义(见图7)。

与NC组相比,*P<0.05图7 Western blot检测各组H266细胞中PI3K/AKT信号通路蛋白表达Figure 7 Expression of PI3K/AKT signal pathway-related proteins in H266 cells in NC group, sh-MEX3A group and oe-MEX3A group by Western blot
3 讨论
MEX-3蛋白参与包括胚胎发育、上皮稳态、免疫功能和代谢等核心生物过程的调节,其异常表达与肿瘤的发生也密切相关。MEX3基因包含两个异质核核糖核蛋白K同源(KH)结构域(命名为KH1和KH2),这两个氨基酸的保守区域通过KH结构域结合RNA发挥作用[10]。现已发现在人类中Mex3家族有4种同源蛋白MEX3A、MEX3B、MEX3C和MEX3D,其中MEX3A是Mex3家族的重要组成部分,其最初是在秀丽隐杆线虫中被发现,具有约70个氨基酸的保守区,是一种翻译调节蛋白,抑制秀丽隐杆线虫早期胚胎中Pal-1的翻译[11]。其在肝癌、乳腺癌和胰腺导管腺癌等肿瘤的恶性进展中均发挥重要作用,可作为治疗肿瘤的潜在分子靶点[5,6,12]。然而,其在肺鳞癌中的生物学效应和潜在调节机制仍然知之甚少。
GEPIA是一个网络应用程序,分析基于TCGA和GTEx数据库中的9 736个肿瘤和8 587个正常样本中的基因表达。本文采用GEPIA分析发现MEX3A的转录水平在肺鳞癌组织中的表达显著上调。Yang等[5]采用TCGA数据库分析发现在肝癌组织中MEX3A表达上调,并且组织学分级越高,其表达越高。MEX3A的高表达与较差的肝癌患者存活率显著相关。为了验证GEPIA的分析结果及分析MEX3A与肺鳞癌患者临床参数及预后的关系,本文采用IHC检测MEX3A蛋白在肺鳞癌组织中的表达水平,结果显示与癌旁组织相比,肺鳞癌组织中MEX3A蛋白的表达显著增加,与GEPIA的分析结果具有一致性,同时分析发现MEX3A在TNM分期晚期和淋巴结转移的患者中表达显著高于在TNM分期早期和无淋巴结转移患者中的表达。表明MEX3A在肺鳞癌发生发展中发挥促癌基因的作用。这也与先前的研究报道具有相似性,包括MEX3A的高表达与三阴乳腺癌的恶性进展和预后不良有关[6],以及MEX3A表达升高与肺腺癌预后和转移不良有关[9]。本文生存分析显示与MEX3A低表达的肺鳞癌患者相比,MEX3A高表达的肺鳞癌患者预后较差。表明MEX3A可以作为肺鳞癌患者预后生物标志物。
研究显示MEX3A在乳腺癌、胰腺导管腺癌中促进肿瘤细胞增殖和转移[6,12],增殖和转移是肿瘤重要的恶性表型,组织水平提示MEX3A与肺鳞癌增殖和转移相关。本文采用敲减肺鳞癌细胞H226内源性MEX3A和过表达外源性MEX3A,CCK-8和Transwell实验结果显示敲减MEX3A的表达显著抑制H266细胞的增殖和转移能力,而过表达MEX3A显著促进H266细胞的增殖和转移能力,表明MEX3A促进肺鳞癌细胞的增殖和转移能力,促进肺鳞癌的恶性进展,与Liang等[9]结果相似,表明MEX3A在肺鳞癌和肺腺癌中均发挥促癌基因的作用。朱贝等[13]报道MEX3A在NSCLC细胞系中表达升高,干扰MEX3A抑制NSCLC增殖、侵袭及迁移能力,并诱导细胞凋亡和细胞周期阻滞。但是MEX3A促进肺鳞癌增殖和转移的机制仍需进一步探讨。
MEX3A在肺腺癌中通过调控PI3K/AKT信号通路促进肿瘤转移,同时在三阴乳腺癌中MEX3A同样通过调控PI3K/AKT信号通路促进肿瘤细胞的增殖和转移能力。PI3K/AKT信号通路是肿瘤恶性生物学行为相关的重要通路之一,其激活促进细胞增殖、凋亡、侵袭转移和耐药等多种表型[14]。PI3K/AKT信号通路在肺鳞癌中可作用抗肿瘤活性的重要靶点[15]。那么在肺鳞癌中MEX3A是否通过激活PI3K/AKT信号通路促进细胞增殖和转移。PI3K蛋白是PI3K/AKT信号通路的关键蛋白,其激活后磷酸化为p-PI3K蛋白,促进其下游蛋白AKT的磷酸化,p-PI3K和p-AKT蛋白的表达增加,表明PI3K/AKT信号通路的活化[16]。本文采用Western blot检测发现sh-MEX3A显著抑制p-PI3K和p-AKT蛋白的表达,oe-MEX3A显著促进p-PI3K和p-AKT蛋白的表达,表明MEX3A通过活化PI3K/AKT信号通路促进肺鳞癌细胞增殖和转移能力,与其在三阴乳腺癌和肺腺癌中发挥的作用机制一致,但是Xu等[8]报道MEX3A通过抑制Akt信号通路和EMT参与了宫颈癌的抗肿瘤活性。表明MEX3A在不同的肿瘤中可能发挥相反的作用。 综上所述,MEX3A在肺鳞癌组织中表达上调,其高表达与肺鳞癌恶性病理参数和预后不良相关。MEX3A促进肺鳞癌细胞增殖和转移能力,可能是通过激活PI3K/AKT信号通路发挥作用。MEX3A是肺鳞癌预后不良及抗肿瘤治疗的潜在分子靶点。
