体外循环心脏术后并发压力性损伤预测模型的建立
2023-01-14樊小倩仲怀凤陈晴晴
樊小倩,孙 晴,仲怀凤,陈晴晴,陆 真
体外循环是一种利用一系列人工装置暂时代替心肺功能的医疗技术,因其能够在心脏直视手术时有效保障心脏以外器官的供血,已逐渐成为心脏手术的重要辅助技术[1]。但体外循环心脏手术作为一类难度大、风险高、时间长的术式,术后常会出现压力性损伤等并发症[2]。压力性损伤表现为局部皮肤或软组织损伤,这不仅会给病人带来痛苦,影响原发疾病的康复进程,而且会增加病人的医疗负担和医务人员的工作量,易引起护患矛盾。近年来众多学者对术后压力性损伤的关注度有所提高,但其发生率依然是居高不下,这也是医院的重大质量和成本问题[3]。对相关影响因素的认知不足,以及缺乏有效的风险预测工具是对压力性损伤防控的重要阻碍。列线图是一种分布在平面上的可视化模型,近年来为各类临床不良事件的预测提供了有效的途径。已有研究[4]表明列线图适用于压力性损伤的风险评估。基于此,本研究在筛选体外循环心脏术后并发压力性损伤的影响因素的基础上,构建列线图预测模型,以期为早期筛查压力性损伤高风险病人,制定相应的干预措施提供参考。
1 资料与方法
1.1 一般资料 选取2021年1月至2022年1月于我院行体外循环心脏手术的病人作为研究对象。纳入标准:(1)年龄≥18岁,均首次行体外循环辅助下心脏外科手术;(2)围手术期存活,术后顺利转入ICU;(3)临床资料完整。排除标准:(1)合并智力、行为或情感障碍等精神类疾病;(2)术前已存在局部皮肤组织破损或影响皮肤观察的疾病;(3)合并肝、肾功能不全、免疫系统、血液系统等疾病;(4)妊娠期、哺乳期妇女。本研究共入组543例病人,男365例,女178例,年龄18~74岁,平均(60.47±11.04)岁;手术类型:瓣膜成形/置换术274例、房间/室间隔缺损修补术222例、左心房/右心房黏液瘤摘除术47例。本研究已经江苏省人民医院伦理委员会审批通过(批号20200621004)。
1.2 方法
1.2.1 分组 参照2016年美国国家压疮咨询委员会(National Pressure Ulcer Advisory Panel,NPUAP)[5]对压力性损伤的定义,对术后72 h内受压部位组织损伤进行观察,并基于压力性损伤发生情况对病人进行分组。
1.2.2 资料收集 参考既往文献[6-8],结合我院专家意见收集病人临床资料:性别、年龄、体质量指数、吸烟史、糖尿病、高血压、术前贫血(男性Hb <120 g/L,女性,Hb <110 g/L)、术前前白蛋白水平、围手术期使用类固醇药物、手术体位、术中最低体温、体外循环时间和手术时间。
1.3 统计学方法 采用χ2检验、logistic回归分析、列线图、校准曲线、ROC曲线和决策曲线。
2 结果
2.1 压力性损伤发生情况 543例病人中发生压力性损伤164例,发生率30.2%。发生部位:尾骶部及臀部78例(47.6%),背部31例(18.9%),手臂及手部21例(12.8%),足部18例(11.0%),耳部16例(9.8%)。基于此将病人分为压力性损伤组(n=164)和非压力性损伤组(n=379)。
2.2 体外循环心脏术后并发压力性损伤的单因素分析 单因素分析结果显示:2组病人不同年龄、贫血、前白蛋白水平、术中最低体温、体外循环时间和手术时间资料间差异均有统计学意义(P<0.01)(见表1)。
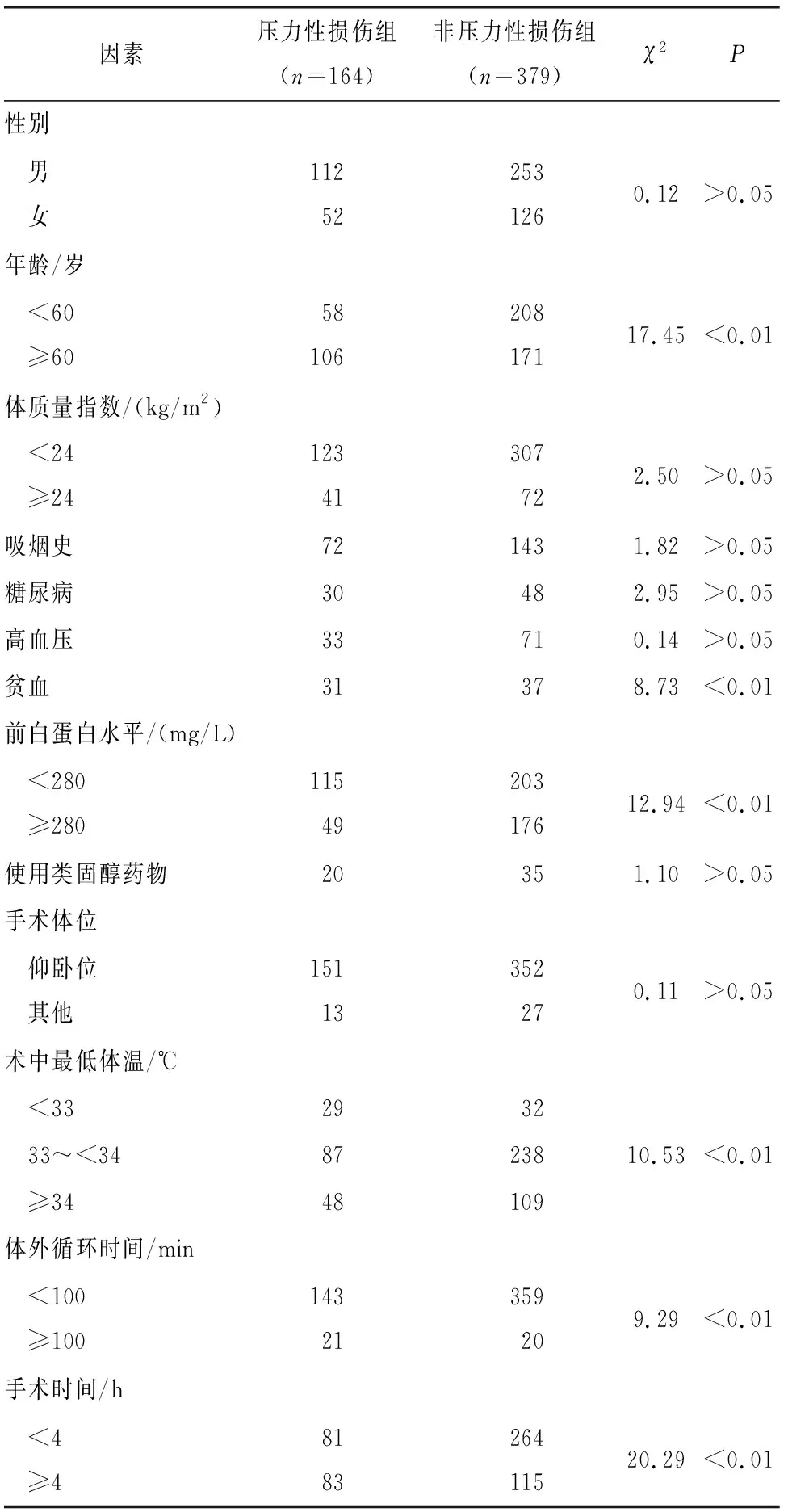
表1 体外循环心脏术后并发压力性损伤的单因素分析
2.3 体外循环心脏术后并发压力性损伤的多因素logistic回归分析 以压力性损伤发生情况为因变量(合并压力损伤=1,无压力损伤=0),以单因素分析中有统计学意义的因素(年龄:<60岁=0,≥60岁= 1;贫血:否=0,是=1;前白蛋白水平:≥280 mg/L=0,<280 mg/L=1;术中最低体温:<33 ℃=0,33~<34 ℃=1,<33 ℃=2;体外循环时间:<100 min=0,≥100 min=1;手术时间:<4 h=0,≥4 h=1)为自变量,进行二分类logistic回归分析,结果显示,术中最低体温项P>0.05,最后筛选出年龄≥60岁、贫血、前白蛋白水平<280 mg/L 、体外循环时间≥100 min和手术时间≥4 h是体外循环心脏术后并发压力性损伤的独立危险因素(P<0.05~P<0.01)(见表2)。
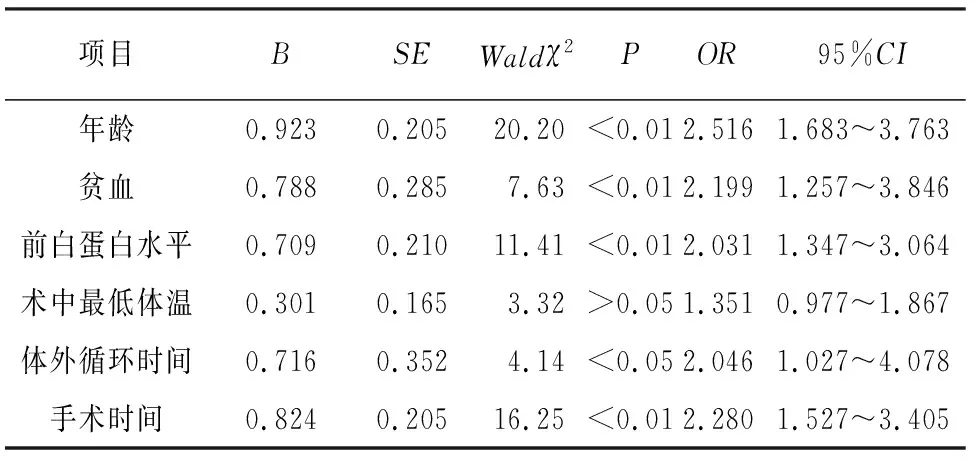
表2 体外循环心脏术后并发压力性损伤的多因素logistic回归分析
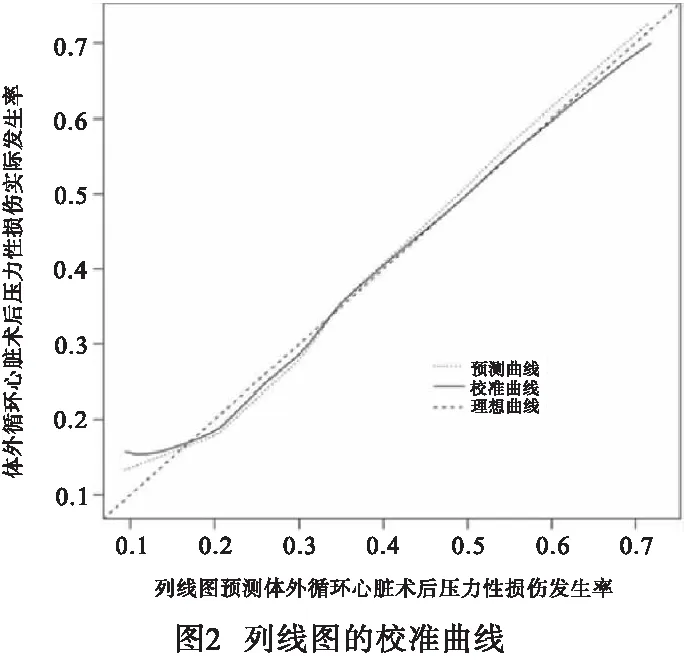
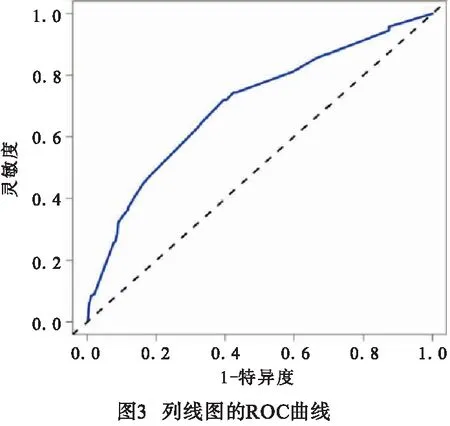
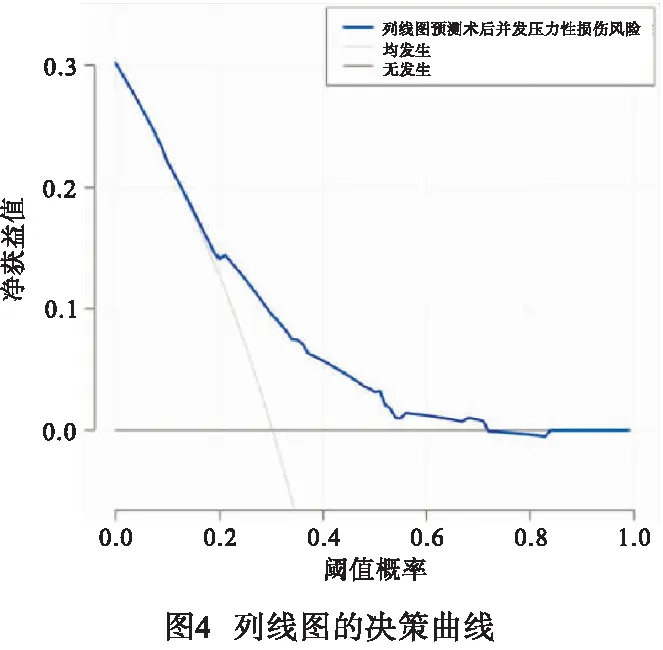
2.4 预测体外循环心脏术后并发压力性损伤风险的列线图模型的建立与验证 基于上述危险因素构建预测体外循环心脏术后并发压力性损伤风险的列线图模型见图1。模型验证结果显示:C-index为0.714;校准曲线趋近于理想曲线(见图2);ROC曲线下面积(AUC)为0.702(95%CI:0.681~0.727)(见图3);决策曲线表明,在10%~70%范围内,列线图预测体外循环心脏术后并发压力性损伤风险净获益(见图4)。

3 讨论
压力性损伤在外科术后较为常见,与病人的内在因素和死亡率密切相关,准确评估风险、合理分配资源以及后续干预是应对这一重要安全威胁的关键[9]。本研究显示体外循环心脏术后压力性损伤的发生率高达30.2%,与国内外报道[10-11]中心脏术后压力性损伤的29.5%和33.5%的发生率相近,提示体外循环心脏手术病人应作为术后压力性损伤的重点防控对象。此外,压力性损伤部位以尾骶部及臀部、背部等居多,这可能与病人术中体位多为仰卧位有关,应注重缓解该部位压力源,加强骨隆突和支撑区的保护。
本研究筛选出年龄≥60岁、贫血、前白蛋白水平<280 mg/L 、体外循环时间≥100 min和手术时间≥4 h是体外循环心脏术后并发压力性损伤的独立危险因素。国内外研究[12-13]也提出高龄是压力性损伤的危险因素。这可能是因为老年人机体呈退行性变化,血液循环能力下降,受压部位血流术后难以迅速恢复。此外老年人皮肤松弛,皮下脂肪和肌肉萎缩,新陈代谢较慢,更易发生皮肤损伤。蒋琪霞等[14]报道血红蛋白水平低会增加术后压力性损伤的发生率。血红蛋白数量决定了红细胞运输氧的能力,贫血可造成组织器官缺氧。而体外循环心脏手术过程中自体血回输会损伤红细胞,进一步加重肌肉、皮肤组织缺氧,继而导致受压组织易损伤。由于半衰期仅为1.9 d,前白蛋白是较白蛋白更灵敏的营养状态评估指标。有研究[15]显示低前白蛋白可诱发组织水肿,会导致局部受压组织对压力的耐受能力下降,从而易引起压力性损伤,本文结果与之相符。徐永红[2]报道体外循环时间>100 min是压力性损伤的危险因素,本文结果与之一致。分析原因,可能是因为体外循环过程中血液暴露在异物表面,会发生红细胞损伤,长时间可导致其携氧能力下降,受压组织的微动脉和微静脉之间的血液循环缺氧,从而易诱发压力性损伤。此外,非生理状态的体外循环可诱导大量炎症因子产生,引起全身炎症反应,这可能会加重病人受压部位的组织损伤。SCHOONHOVEN等[16]报道手术时间超过4 h是压力性损伤的危险因素,本文结果与之一致。由于术中一般不允许体位变化,所以手术时间越长,会导致局部组织受压时间越久,持续的循环不畅可降低组织对缺血缺氧的耐受能力,继而增加压力性损伤的风险[17]。本文单因素分析显示2组病人术中最低体温情况差异明显,这可能是因为病人在完成心内操作后的复温具有高代谢的需求,据报道[18]体温每升高1 ℃,组织代谢需要增加10%,体温越低,复温时受压部位组织氧耗越高,越易发生局部组织损伤。但多因素分析结果显示术中最低体温项P>0.05,因此体温与压力性损伤的相关性仍需进一步探究。
既往报道[19]提出有效的压力性损伤预测模型能够帮助医护人员更具战略性地部署关键资源,和实施针对风险状况的干预措施,既能降低压力性损伤的患病率,又可以提高成本效率。ALOWENI等[20-21]分别采用数学模型和随机森林模型对压力性损伤的发生风险进行预测,均取得了一定的成果。但相比之下,本研究构建的列线图模型不仅可视可读,直观简洁,而且摒弃了复杂的公式运算,通过线段的长短反应各个危险因素对压力性损伤的贡献程度,易于理解和使用。同时,列线图模型的验证结果显示,C-index为0.714,校准曲线趋近于理想曲线,在表明该模型具有良好的预测精准度;ROC曲线的AUC为0.702(95%CI:0.681~0.727),表明模型对体外循环心脏术后并发压力性损伤的识别能力较强,区分度较好;决策曲线表明,在10%~70%范围内,列线图预测体外循环心脏术后并发压力性损伤风险净获益,表明该模型准确预测范围较广。除有助于早期筛查压力性损伤高风险人群外,模型中的各项危险指标也为个体化干预提供了方向,如加强老年病人的脆弱老化皮肤的护理,术后进行体位调整干预和人工搬运时要小心,需使用器械时要确保型号合适,贴合度好。术前要做好血红蛋白和前白蛋白的评估,及时纠正病人贫血或低前白蛋白状态。围手术期应加强体温管理,尽量避免体温过低或波动幅度过大。应熟悉各类心脏手术步骤和主刀医生习惯,术中迅速且准确完成消毒、器械传递、清点物品等干预工作,尽可能缩短体外循环和手术时间。
综上所述,临床应对年龄≥60岁、贫血、前白蛋白水平<280 mg/L 、体外循环时间≥100 min和手术时间≥4 h的行体外循环心脏手术的病人予以高度重视,警惕其发生压力性损伤。本次构建的列线图模型能够有效预测体外循环心脏术后并发压力性损伤的风险。本研究的局限性:样本均取自单中心,数据可能存在选择性偏倚。收集变量有限,对于压力性损伤的影响因素筛选可能存在遗漏。因此,后续研究需纳入更多中心的样本、收集更多的变量来对模型进行验证和完善。
