帕金森病和抑郁症患者脑组织Brodman9区域共同差异基因的生物信息学分析
2023-01-14赵淑敏陈冉冉张晶晶
白 雪, 赵淑敏, 陈冉冉, 张晶晶
(内蒙古自治区赤峰市医院神经内科, 内蒙古 赤峰 024000)
帕金森病(Parkinson Disease,PD)是一种以黑质多巴胺能神经元进行性丢失为主要病理表现,肌强直和行动迟缓为核心运动症状,容易伴发认知和精神障碍等非运动症状的慢性神经退行性疾病,我国65岁以上人群患病率为1.7%[1]。抑郁症(Major depressive disorder,MDD)是一类情绪低落、快感缺失、意志活动减退等为主要症状的情绪障碍。认知症状是MDD重要的3个维度之一,病程中持续存在损害[2]。PD患者常伴发抑郁和认知损害症状,PD和MDD共病能够降低患者自身运动功能认知,更容易导致抽象推理等认知功能缺陷,影响生活质量。前额叶皮层Brodman9(BA9)区域在认知、运动和记忆相关功能中起着重要作用,此区域GABA能神经传递缺陷参与MDD发病过程[3]。PD患者BA9区也存在神经元损伤、路易小体形成、以及线粒体功能和蛋白折叠相关通路的转录组异常[4],重复经颅磁刺激前额叶背外侧皮层的能够改善PD患者伴发的MDD和认知功能障碍[5]。因此,PD和MDD患者可能在BA9区域存在共同的分子病理变化。本研究中,我们利用生物信息学方法,分析PD和MDD患者在BA9区的共同差异基因及富集通路,挖掘关键致病基因,为PD和MDD共同发病机制研究提供参考。
1 材料与方法
1.1芯片数据来源与预处理:应用在线GEO数据库(http://www.ncbi.nlm.nih.gov/geo/)下载GSE20168、GSE54567、GSE54568和GSE54570的芯片数据。其中,GSE20168数据使用GPL96平台,包含14例PD患者和15例对照患者的BA9区域脑组织转录组数据,PD和对照脑组织来源于美国马里兰大学脑组织库、哥伦比亚大学纽约脑组织库、弗吉尼亚州西洛杉矶脊髓液资源VA医疗中心、哈佛大学麦克莱恩医院和迈阿密脑组织银行。PD诊断标准为通过神经病理学诊断证实的PD患者,排除具有其他神经病理疾病病例。对照组要求无脑部疾病病史。GSE54567数据使用GPL570平台,包含14例MDD和14例对照患者的BA9区域脑组织转录组数据;GSE54568数据使用GPL570平台,包含15例MDD和15例对照患者的BA9区域转录组数据;GSE54570数据使用GPL570平台,包含15例MDD和15例对照患者的BA9区域转录组数据;MDD和对照脑组织来源美国纽约州哥伦比亚大学精神病学研究所人类生物学中心脑库,MDD入组标准:生前依据美国DSM-Ⅲ-R精神障碍诊断标准诊断重度抑郁暴力自杀病例。排除毒理学筛查中有精神药物或非法药物中毒,因长期痛苦的疾病死亡或内科疾病猝死患者。对照组入组标准:没有精神障碍,没有使用药物,由于自杀以外的原因且没有长时间的痛苦的突然死亡患者。全部数据使用R软件(版本号为3.6.3)调取limma包的normalizeBetweenArrays函数标准化处理。
1.2差异表达基因提取及共表达差异基因分析:我们分别对4个芯片数据集进行差异表达分析,首选调取limma包分析各个数据集的差异表达基因(Differential genes,DEGs),使用P<0.05并logFC绝对值≥0.3作为标准筛选差异基因,应用ggplo2包绘制火山图和热图。然后提取GSE20168、GSE54567、GSE54568和GSE54570数据DEGs并依据表达上调或下调进行韦恩图分析,鉴定PD和MDD患者BA9区共表达差异基因。
1.3差异基因富集分析:基因本体(Gene Ontology,GO)数据库把基因的功能分成了三类:生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)。应用GO数据库可以了解目标基因在CC.MF和BP三个层面上有什么关联。京都基因百科全书和基因组(Kyoto Encyclopedia of Genes and Genomes,KEGG)的PATHWAY数据库整合了当前在分子互动网络的知识。我们使用R语言调取clusterProfiler包(V3.14.3)分别对PD和MDD的上调或下调DEGs进行GO和KEGG富集分析。应用p.adj<0.05且qvalue<0.2作为有意义富集条目的筛选条件进行筛选,并对排名前10的GO条目和KEGG通路绘制气泡图展示。应用GO plot包(V1.0.2)绘制和弦图展示PD和MDD涉及的共同GO_BP条目及各自涉及DEGs。
1.4蛋白-蛋白相互作用网络及关键基因分析:为了系统分析PD和MDD共表达DEGs生物学功能,我们将共表达DEGs导入String数据库(V11.5; https://string-db.org)分析表达蛋白质间相互作用(PPI)网络,互作评分设置为0.15。然后将String数据库分析的蛋白相互作用数据导入cytoscape软件(V3.9.1)作图展示蛋白相互作用网络。使用CytoHubba插件根据最大团中心性(MCC)方法对PPI网络中的基因进行从高到低排序,确认前10位关键DEGs。
2 结 果
2.1差异表达基因:GSE20168数据分析显示:与对照组相比,PD患者存在12548个DEGs。MDD患者与对照组比较,GSE54567数据获得21655个DEGs,GSE54568数据也有21655个DEGs,GSE54570数据获得12548个DEGs。应用P<0.05并logFC绝对值≥0.3作为条件筛选后,GSE20168数据中上调DEGs 736个,下调DEGs 829个;GSE54567数据中上调DEGs 13个,下调DEGs 14个;GSE54568数据中上调DEGs 64个,下调DEGs 82个;GSE54570数据中上调DEGs33个,下调DEGs34个(图1A)。将四个数据集上调及下调DEGs分别进行韦恩图分析(图1B),结果显示PD(GSE20168)和MDD(GSE54567、GSE54568、GSE54570)患者均上调的DEGs有21个,分别为:SLC35E1、ATP8B1、TSR1、ZNF721、RIOK3、FBXW12、ZNF160、POLR1B、CACNA1I、MZT2B、PGF、RP11-403P17.4、RPL23AP32、DBT、PRR11、USP34、LRRFIP1、DSERG1、DIP2A、AEBP1和DNAJB2基因,均表达减少的DEGs有13个,分别为:NPTX2、PCSK1、SST、PPP1CB、SEC22B、ENPP4、NME5、CAPZA2、GLRB、ITFG1、GLIPR1、TM6SF1和DUSP6基因。相应结果使用热图展示(图1C)。

图1 DEGs表达可视化
A.火山图展示各数据集DEGs:红色的点代表高表达的DEGs,蓝色的点代表低表达的DEGs,筛选条件:P<0.05并logFC绝对值≥0.3;B.韦恩图分析PD和MDD共表达DEGs(左侧:上调DEGs,右侧:下调DEGs);C.热图展示共表达DEGs水平(左侧:PD样本,右侧:MDD样本),红色代表高表达信号,蓝色代表低表达信号。
2.2DEGs功能富集分析:PD患者上调的736个DEGs功能富集分析获得有意义GO_BP条目188条,包括铜离子解毒、铜离子应激反应、细胞对铜离子的反应等(图2A,左侧),GO_CC条目41条,GO_MF条目12条;获得KEGG通路17条,前10位包括人乳头瘤病毒感染、MAPK信号通路、胰岛素抵抗、mTOR信号通路等(图2A,右侧)。PD患者下调的829个DEGs功能富集分析发现有意义GO_BP条目383条,包括神经元投射发育的调节、树突发育及形态发生、囊泡定位、学习或记忆等(图2B,左侧),GO_CC条目164条,GO_MF条目56条,获得KEGG通路41条,包括阿尔茨海默病、帕金森综合症、肌萎缩侧索硬化、亨廷顿病、脊髓小脑性共济失调等通路(图2B,右侧),多数为神经退行性疾病相关通路。MDD患者上调DEGs功能富集分析未获得有意义BP、CC、MF条目及KEGG通路;下调DEGs功能富集分析获得有意义GO_BP条目84条,包括认知、学习和记忆、细胞因子产生的负调控等条目(图2C)。
韦恩图分析显示PD与MDD下调DEGs有5个共同的GO_BP富集条目,分别是:GO:0007611(学习与记忆)、GO:0050890(认知)、GO:0007612(学习)、GO:0051384(对糖皮质激素的反应)、GO:0008306(联想学习)条目,提示PD和MDD均存在认知、学习、记忆及糖皮质激素反应通路功能障碍。这些共同条目在PD患者涉及的基因主要包括:NPTX2、ATXN1、PAFAH1B1、NLGN4X、VIP、PLCB1、BRINP1、FEN1、SHC3、CDK5、BHLHB9、SERPINF1、KRAS等45个基因(图2E,左侧),在MDD患者涉及的基因主要包括:NPTX2、ARC、CRH、CRHBP、HLA-DRA、X3CR1、FOS、JUN、CLDN5、BTG2等14个基因(图2E,右侧)。
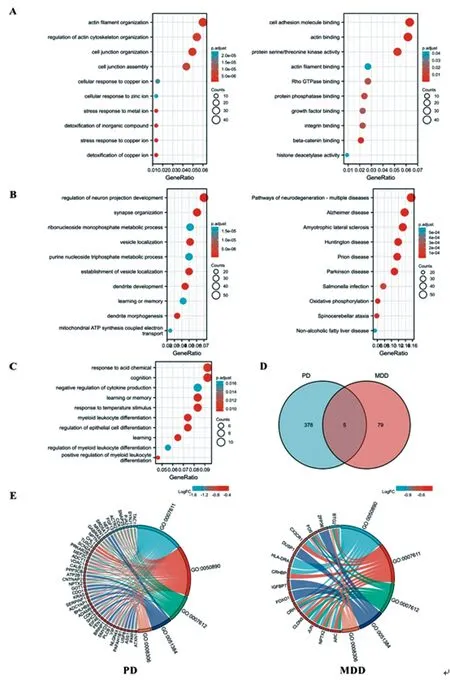
图2 PD与MDD患者DEGs GO和KEGG富集分析可视化
A.PD患者上调DEGs在GO_BP条目(左侧)和KEGG(右侧)通路前10位;B.PD患者下调DEGs在GO_BP条目(左侧)和KEGG(右侧)富集通路前10位;C.MDD患者下调DEGs在GO_BP条目前10位;D.PD和MDD患者下调DEGs在GO_BP条目韦恩图分析;E.左侧:和弦图展示PD患者共差异GO_BP条目及涉及DEGs,右侧:和弦图展示MDD患者共差异GO_BP条目及涉及DEGs。
2.3PPI网络及关键DEGs分析:为了了解PD和MDD共同DEGs表达蛋白间相互作用及鉴定关键基因,我们使用在线工具String及cytoscape软件构建了34个共同DEGs表达蛋白的PPI网络(图3A),进一步使用CytoHubba插件分析了PPI网络中的前10个关键DEGs,关键程度从高到低排序依次为NPTX2、PCSK1、SLC35E1、ATP8B1、DUSP6、SST、TSR1、SEC22B、PPP1CB、ZNF721基因(图3B)。在这些基因中,NPTX2、PCSK1、DUSP6、SST、PPP1CB基因在PD和MDD患者BA9区域均显著表达下调(图3C,3D,P<0.05)。
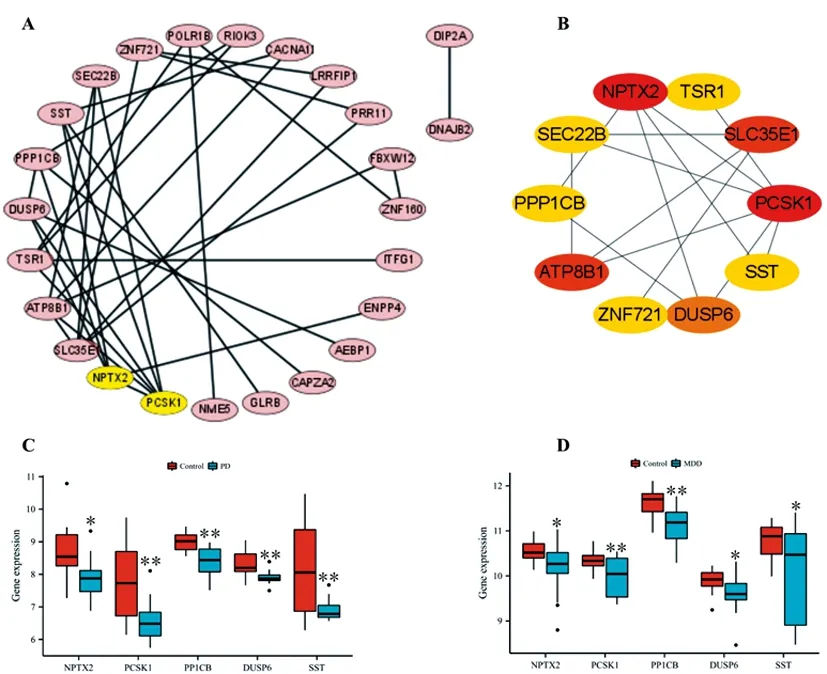
图3 PD和MDD共同DEGs PPI网络及关键基因分析A.PD和MDD共同DEGs的PPI网络图;B.关键DEGs的PPI;C.PD患者关键下调DEGs表达箱图;D.MDD患者关键下调DEGs表达箱图,*P<0.05,**P<0.01
3 讨 论
MDD是PD的常见伴发疾病,并且越来越多证据显示MDD患者更容易患PD[1]。PD和MDD患者均会出现前额叶病理变化及认知功能障碍,我们推测前额叶认知相关通路异常可能是PD和MDD共同的致病基础。在本研究中,我们应用GEO数据库中PD和MDD患者BA9区域的转录组数据进行生信分析,结果发现PD和MDD患者前额叶BA9区域存在34个共同的DEGs,其中上调21个,下调13个。DEGs功能富集分析显示PD和MDD存在5个共同的GO_BP条目,主要与认知、学习、记忆有关。进一步的PPI网络作图及关键基因分析显示NPTX2、PCSK1、DUSP6、SST、PPP1CB基因表达减少可能是PD和MDD在基因表达层面共同的改变。
人类前额叶整合来自众多输入结构的信息,并通过与其他皮层和皮层下区域的连接将更新的信息汇聚到输出结构,发挥认知过程、情绪调节、动机和社交能力。分子影像研究发现PD早期前额叶区域多巴胺摄取增加,但在疾病晚期中外侧和内侧前额叶多巴胺和D2受体明显减少,患有抑郁症的PD患者左侧背外侧前额叶皮层活动显著降低,且内侧额叶网络的失活与认知损伤相关[6],恢复内侧前额叶皮层的突触可塑性能够改善帕金森病小鼠模型抑郁样行为[7]。因此,深入研究PD和MDD患者前额叶区域分子病理改变对于理解PD合并MDD的发病机制和制定治疗策略具有重要意义。我们的研究发现PD和MDD患者在前额叶BA9区存在共同的认知、学习、记忆功能相关条目及相应DEGs,说明前额叶区域认知相关基因表达改变可能是PD和MDD患者共同的分子病理基础。约20%~33%的PD患者在诊断时已经出现轻度认知障碍,高达60%~80%的PD患者在12年内进展为帕金森痴呆。MDD同样可导致前额叶抑制及认知灵活性受损,出现认知中不灵活的负面偏见,包括僵化的负面信念等。20~50%的MDD患者伴有认知障碍,经常导致患者对认知功能恶化的抱怨,而认知缺陷导致对抑郁的抱怨。因此,前额叶区域认知相关基因的表达变化也可能是PD容易伴发MDD及痴呆的原因。
目前,已知的PD和MMD共同相关基因极少,有研究报道国人Tef、5HTR1A、SLC6A15和TPH2单核苷酸多态性改变可能与PD伴发MDD相关,这些基因均与5羟色胺等神经递质合成、调控及代谢相关。我们发现编码神经元五聚体蛋白Ⅱ的NPTX2基因在PD和MDD的BA区域均表达减少,而该基因主要参与γ氨基丁酸(GABA)信号调节,在神经元激活和脑源性神经营养因子诱导下,主要神经元突触前表达释放NPTX2蛋白,调节其和GABA能中间神经元之间的兴奋性突触传递,较低的NPTX2水平能够降低GABA能抑制信号传导[8]。本研究发现PD患者BA9区域NPTX2表达减少与既往研究不一致,既往全基因组表达芯片研究发现NPTX2在PD患者黑质和大脑皮层路易小体内表达上调[9],我们认为这可能与PD病程及脑组织取材部位不同有关,因为同为α突触核蛋白相关疾病,路易体痴呆患者脑脊液中NPTX2表达减少且与α突触核蛋白水平及视觉空间域认知下降有关,该结果支持我们的发现[10]。动物实验显示NPTX2表达减少能够导致小鼠抑郁样症状及海马区域炎症反应激活[8]。α突触核蛋白在多巴神经元内异常聚集是PD的重要病理表现,我们认为异常聚集α突触核蛋白可能促进PD患者神经元突触丧失和功能减少,继而NPTX2表达减少,导致NF-κB信号通路激活和脑内炎症反应过渡激活,从而出现抑郁症状,NPTX2表达变化与PD合并MDD的关系值得深入研究。
我们还发现BA9区PCSK1、DUSP6、SST、PPP1CB基因表达降低在PD和MDD同时存在,PCSK1是中枢黑皮质素系统成分阿片黑皮质素原(POMC)的重要表达调控基因,PCSK1缺失导致POMC不能剪接为促肾上腺皮质激素(ACTH)和α-黑色素细胞刺激素(α-MSH),参与机体应激反应、能量平衡、免疫调节等生理活动[11],而应激障碍、能量平衡和免疫调节异常均是PD和MDD发病的重要机制。DUSP6基因编码的双特异性磷酸酶6是蛋白酪氨酸磷酸酶亚家族的成员,可以使细胞外信号调节蛋白激酶1/2去磷酸化,从而调节信号并影响细胞氧化应激、增殖、分化和凋亡,下调DUSP6诱导锥体神经元兴奋性和应激敏感性,增加DUSP6表达能够减轻六羟基多巴对多巴胺神经元的损伤。SST基因编码生长抑素,能够调控GABA神经元异质性神经递质,在神经退行性疾病和精神疾病表达较低,包括PD和MDD[12]。PPP1CB基因可编码蛋白磷酸酶(PP1)的一个亚基,PP1是重要的丝/苏氨酸蛋白磷酸酶,与蛋白激酶作用相反,使蛋白脱磷酸化,参与昼夜节律调节[13],而昼夜节律异常是PD、MDD和认知障碍患者常见症状。上述这些基因可能参与了PD和MDD在前额叶共同的发病分子机制。
综上,虽然我们的研究尚缺乏实验验证,但仍能为PD和MDD共同发病分子机制研究提供重要线索,前额叶BA9区域认知通路功能障碍及NPTX2等关键基因表达减少可能是PD和MDD共同的分子病理。
