新加肾元方调控RIPK1/RIPK3/MLKL通路对高糖诱导的糖尿病肾病肾小球足细胞损伤的影响
2023-01-14郑玲,陈立,王月
郑 玲, 陈 立, 王 月
(湖北文理学院附属医院 襄阳市中心医院, 湖北 襄阳 441021)
糖尿病肾病是由糖尿病患者长期血糖控制不佳引起的一种慢性并发症,主要特征为肾脏微血管损伤、肾小球滤过率下降等,患者常伴有尿微量白蛋白增多、水肿、高血压、贫血等临床症状,影响正常生活[1,2]。目前研究指出,血流动力学异常、氧化应激、细胞凋亡等引起的肾小球滤过屏障破坏与糖尿病肾病密切相关[3]。蛋白尿与肾脏损伤相关,肾小球滤过率则与肾小球足细胞结构、功能相关。足细胞数量减少与坏死性凋亡相关,而坏死性凋亡途径受TNF-α激活并与RIPK1/RIPK3/MLKL信号通路密切相关[4]。现阶段,糖尿病肾病的治疗以降血糖、降血压和控制饮食为主,但即使严格控制血糖和血压,预后仍不理想[5]。所以研究糖尿病肾病的发病机制与新型药物仍是研究人员的关注重点。中医讲,糖尿病肾病患者大多脾肾阳虚,新加肾元方是一种中药方剂,方剂纳入人参、炙黄芪、制附片、肉桂、淮山、熟地黄等多种中药材,起到温阳补肾效果[6]。本研究旨在探索新加肾元方中对糖尿病肾病起作用的活性成分,并分析新加肾元方对高糖诱导的糖尿病肾病大鼠肾小球足细胞损伤及RIPK1/RIPK3/MLKL通路的影响,现报道如下:
1 材料与方法
1.1材 料
1.1.1动物:健康清洁级SD大鼠70只,雄性,6月龄,体质量(230±10)g,许可证:SYXK(鲁)2017-0001,合格证:37009200009757。饲养于12h光照/12h黑暗、温度(25±1)℃、相对湿度(50±10)%的动物房内,饲养期间自由摄食、饮水。实验前先适应性喂养7d。
1.1.2药物:新加肾元方:人参6g、炙黄芪15g、制附片10g、肉桂10g、淮山30g、熟地黄15g、怀牛膝15g、泽泻10g、山茱萸10g、丹参10g、菟丝子10g、炙甘草3g,乏力者人参10g,大便溏稀者加茯苓15g,食欲差者加砂仁6g,畏寒肢冷制附子15g,药物由襄阳市中心医院药房提供。
1.1.3试剂及仪器:链脲佐菌素;肌酐测定试剂盒;尿素氮测定试剂盒;TNF-α ELISA试剂盒;IL-6 ELISA试剂盒;One Touch Ⅱ型血糖仪及配套试纸,RM 2135轮转型切片机,全自动生化分析仪,光学显微镜,垂直电泳仪。
1.2方 法
1.2.1造模、分组及给药:从70只大鼠中随机选12只为正常对照组,另58只建立模型:高糖高脂饲料喂养4周,按35mg/kg一次性腹腔注射给予1%的STZ溶液,继续高糖高脂饲料喂养1周,尾静脉采血测定随机血糖,并随机取5只大鼠进行肾组织病理学检查,以大鼠随机血糖≥16.7mmoL/L且肾组织出现明显病理学改变视为糖尿病肾病大鼠造模成功,共成功48只,随机分为模型组,阳性对照组,新加肾元方低、高剂量组,各12只。药物干预剂量如下:阳性对照组给予厄贝沙坦水溶液0.017g/kg灌胃,新加肾元方低、高剂量组分别给予0.72g/kg、1.44g/kg灌胃,正常对照组、模型组等体积生理盐水灌胃,1次/d,连续12周。
1.2.2蛋白尿、血清肌酐和尿素氮水平:大鼠经药物干预12周后入代谢笼,取24h尿液,离心取上清,检测尿液中蛋白含量;用药结束,麻醉,取腹主动脉血,离心取血清,检测其余指标。
1.2.3HE染色观察肾组织病理形态:药物干预结束后处死大鼠,部分肾组织-80℃冰箱保存待用,剩余部分于10%中性甲醛固定1d,梯度乙醇脱水,石蜡包埋、切片。切片烘干后,二甲苯透明,无水乙醇处理5min,梯度乙醇各处理2min,清洗,苏木素染色5min,清洗,0.5%盐酸酒精分化,流水清洗返蓝。0.5%伊红染色2min,清洗1min,脱水,二甲苯透明,中性树胶封片。镜下观察。
1.2.4透射电镜观察肾小球足细胞超微结构变化:步骤同上,透射电子显微镜下观察肾小球足细胞超微结构的改变。
1.2.5TUNEL染色检测肾组织细胞凋亡情况:切片脱蜡至水,加蛋白酶K(20μg/mL),温育,洗3次,5min/次,0.3%过氧化氢溶液室温处理10min,洗3次,5min/次,加血清,温育20min;加TdT反应液,湿盒避光孵育45min,冲洗,加过氧化物酶标记的抗体,湿盒避光30min,洗4次,5min/次,在组织切片上加显色液,光镜下观察染色情况。
1.2.6ELISA检测肾组织TNF-α、IL-6水平:取部分肾组织研磨,100mg肾组织/1mL预冷生理盐水匀浆,匀浆液5000r/min离心15min,取上清,BCA法测定蛋白浓度。TNF-α、IL-6单克隆抗体包被ELISA板,加标本、标准品和生物素化的抗大鼠抗体,标本、标准品中的待测因子与孔中生物素化的抗大鼠抗体及包被于酶标板上的单抗结合,形成免疫复合物,洗去游离成分,加辣根过氧化物酶标记的亲合素,经底物显色液显色,测450nm OD值,绘制曲线求出TNF-α、IL-6浓度。
1.2.7WB检测肾组织RIPK1/RIPK3/MLKL通路相关蛋白表达:肾组织研磨,100mg肾组织/1mL预冷RIPA裂解液,匀浆液12000r/min离心15min,取上清,BCA法测定蛋白浓度,各管上清加5×Loading buffer50μL,100℃煮沸15min,蛋白变性。10% SDS-PAGE分离蛋白样品,转膜,封闭2h,TBST洗3次,抗RIPK1、RIPK3、MLKL、WT-1、β-actin抗体(1∶1000)孵育过夜,次日加入二抗1∶5000),孵育1h,洗膜,检测蛋白。
1.2.8新加肾元方中所含活性成分收集与筛选:中药系统药理学分析平台(TCMSP)检索新加肾元方的活性成分,筛选出活性成分较高的化合物,并查阅相关文献作为补充。
1.2.9新加肾元方中不同活性成分与RIPK1/RIPK3/MLKL的分子对接:TCMSP数据库中检索方剂中活性成分的2D结构,YASARA分子模拟软件去H2O、加H质子化和添加缺失原子,Cytoscape对人参、炙黄芪、肉桂、制附片的有效成分进行分析,PyMOL、AutoDock Vina等软件对关键成分及主要靶点进行分子对接。
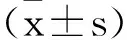
2 结 果
2.1大鼠蛋白尿、血清肌酐和尿素氮水平:与正常对照组相比,模型组大鼠蛋白尿、血清肌酐和尿素氮水平增加(P<0.05);与模型组相比,阳性对照组、新加肾元方低、高剂量组大鼠蛋白尿、血清肌酐和尿素氮水平下降(P<0.05);阳性对照组与高剂量组大鼠蛋白尿、血清肌酐和尿素氮水平差异无统计学意义(P>0.05),见表1。

表1 大鼠蛋白尿血清肌酐和尿素氮水平
2.2大鼠肾组织病理形态:正常对照组肾组织形态正常,无异常改变;模型组大鼠肾小球基底膜变厚,系膜细胞增生,肾小管浊肿变性,肾间质纤维化;阳性对照组、新加肾元方低、高剂量组肾组织病理形态改变较模型组出现不同程度减轻,见图1。
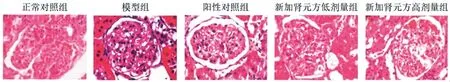
图1 大鼠肾组织病理形态(×400)
2.3大鼠肾小球足细胞超微结构变化:正常对照组大鼠肾小球足细胞超微结构正常,无异常改变;模型组大鼠足细胞足突融合或消失,基底膜增厚;阳性对照组、新加肾元方低、高剂量组大鼠肾组织超微结构病理形态改变较模型组出现不同程度改善,见图2。

图2 大鼠肾小球足细胞超微结构变化(×7000)
2.4大鼠肾组织细胞凋亡情况:与正常对照组相比,模型组大鼠凋亡指数增加(P<0.05);与模型组相比,阳性对照组、新加肾元方低、高剂量组大鼠凋亡指数下降(P<0.05);阳性对照组与高剂量组凋亡指数差异无统计学意义(P>0.05),见表2,图3。

图3 大鼠肾组织细胞凋亡情况(×200)

表2 大鼠肾组织细胞凋亡指数
2.5大鼠肾组织TNF-α、IL-6水平:与正常对照组相比,模型组大鼠TNF-α、IL-6水平增加(P<0.05);与模型组相比,阳性对照组、新加肾元方低、高剂量组大鼠TNF-α、IL-6水平下降(P<0.05);阳性对照组与高剂量组TNF-α、IL-6水平差异无统计学意义(P>0.05),见表3。

表3 大鼠肾组织TNF-α IL-6水平
2.6大鼠肾组织RIPK1/RIPK3/MLKL通路相关蛋白表达:与正常对照组相比,模型组大鼠RIPK1、RIPK3、MLKL蛋白表达增加,WT-1蛋白表达下降(P<0.05);与模型组相比,阳性对照组、新加肾元方低、高剂量组大鼠RIPK1、RIPK3、MLKL蛋白表达下降,WT-1蛋白表达增加(P<0.05);阳性对照组与高剂量组RIPK1、RIPK3、MLKL、WT-1蛋白表达差异无统计学意义(P>0.05),见表4、图4。

图4 RIPK1/RIPK3/MLKL通路相关蛋白表达

表4 RIPK1/RIPK3/MLKL通路相关蛋白表达
2.7新加肾元方的活性成分的筛选:新加肾元方的主要中药成分为人参、炙黄芪、制附片、肉桂。在TCMSP中检索人参、炙黄芪、肉桂所有成分数据,设置口服生物利用度OB≥30%,药物相似性DL≥0.18,同时筛去无对应靶点的成分,最终筛选出人参主要活性成分22个,炙黄芪主要活性成分20个、制附和肉桂主要活性成分0个,见表5。

表5 新加肾元方的活性成分的筛选
2.8分子对接分析:在TCMSP中检索人参、炙黄芪、肉桂、制附片的有效成分并进行分析,根据degree结果得出新加肾元方中评分较高的活性成分有人参中的Celabenzine、炙黄芪中的Mairin。运用PyMOL、AutoDock Vina等软件对关键成分及主要靶点进行分子对接,见图5、图6。同时对主要有效成分作用于RIPK1、RIPK3、MLKL的结合能进行了测定。RIPK1、RIPK3、MLKL的晶体结构从uniprot中下载,序列号4NEU、7MX3、5KO1,分辨率为2.57、3.23、2.16,人参中的Celabenzine、炙黄芪中的Mairin与RIPK1、RIPK3、MLKL的结合能分别为-5.3、-6.42、-5.48和-5.39、-7.71、-5.41,由此可见新加肾元方中的核心有效成分炙黄芪中的Mairin与RIPK3形成构象能量低,结构稳定,结合活性较高,见表6。

表6 新加肾元方中活性成分与靶点的结合能

图5 新加肾元方中主要活性成分与RIPK1、RIPK3、MLKL作用的2d图

图6 新加肾元方中主要活性成分与RIPK1、RIPK3、MLKL的结合模式
3 讨 论
研究表明[3],2016年全世界大约有4.2亿人群患者有糖尿病,这些糖尿病患者中绝大多数为2型糖尿病,典型表现为喝水多、吃饭多、尿多和体重减轻,该病目前无法治愈,确诊后需终身服用药物,因此严重影响了患者的生活质量。糖尿病易引发糖尿病肾病的并发症,约20%左右的糖尿病患者患有糖尿病肾病,该病是多因素相互作用产生的结果,也是是造成终末期肾脏病的最主要原因,该病主要的病理行为包括肾小球滤过率增加、基底膜增厚和细胞外机制的积累,但具体的发病机制仍有待研究。研究指出,糖尿病肾病的发病与足细胞损伤密切相关,而坏死性凋亡是足细胞损伤与数量减少的重要原因,且坏死性凋亡为糖尿病肾损伤的一种重要细胞死亡模式,不依赖Caspase激活且具有典型坏死样形态,其通过RIPK1/RIPK3/MLKL途径进行调节[6]。新加肾元方是具有温阳补肾、益气养阴、健脾利尿效用的中药方,而糖尿病肾病患者恰以脾肾阳虚型多见,因此,本研究旨在探索新加肾元方对高糖诱导的糖尿病肾病大鼠肾小球足细胞损伤及RIPK1/RIPK3/MLKL通路的影响,并分析其可能的作用机制。
中医认为糖尿病肾病从气阴两虚到阴阳两虚最终发展到气血阴阳俱虚的过程,血瘀证贯穿疾病始终。所以治疗糖尿病肾病应温阳补肾,益气养阴,这对疾病的治疗非常关键。新加肾元方是补肾益气的中药方剂,对糖尿病肾病亦具有治疗效果,药剂中人参大补元气、补脾益肺、生津液、安神,为君药;炙黄芪益气补中滋补脾肺,制附片温补阳气,肉桂补元阳、暖脾胃、除积冷、通血脉,淮山补脾胃亏损、治气虚衰弱,熟地黄滋阴、补血、治阴虚血少、腰膝痿弱,怀牛膝补肝益肾,为臣药;泽泻治肾炎水肿、肾盂肾炎、肠炎泄泻、小便不利,山茱萸补血固精、补益肝肾、调气、补虚、明目、强身,丹参可治肾孟肾炎,菟丝子补肾、肝、脾,为佐药,炙甘草益气滋阴,通阳复脉为使药,上述药物共用以达温阳补肾、益气养阴、健脾利尿的功效。在TCMSP检索中发现新加肾元方中的人参主要活性成分22个,炙黄芪主要活性成分20个,这对糖尿病肾病的治疗具有着重要意义。研究中也指出,新加肾元方干预后,糖尿病肾病大鼠蛋白尿、血清肌酐、尿素氮水平、凋亡指数、TNF-α、IL-6水平下降,肾组织病理改变及肾小球足细胞超微结构改变得到缓解,这提示新加肾元方可改善糖尿病肾病大鼠肾功能,减轻肾组织损伤。
研究指出,坏死性凋亡是经RIPK1/RIPK3/MLKL通路调节的糖尿病肾损伤的一种细胞死亡模式,且坏死性凋亡是肾小球足细胞损伤、减少的原因[7]。相关研究指出,TNF-α可激活TNFR1诱导RIPK1的表达,Caspase-8是凋亡、坏死性凋亡的关键,抑制Caspase-8激活,RIPK1去泛素化招募RIPK3,RIPK1/RIPK3复合招募并磷酸化MLKL,MLKL孔通过允许离子流入、细胞膨胀和膜溶解导致坏死性细胞死亡并诱发炎症,所以,RIPK1与RIPK3形成复合体以及MLKL的磷酸化是坏死性凋亡的特异标志,MLKL扮演坏死性凋亡执行器角色,MLKL的N-端直接诱导膜破裂[8]。WT-1存在于足细胞核,是足细胞特异性标志以反映足细胞损伤程度及数量。本实验中,新加肾元方干预后,糖尿病肾病大鼠TNF-α,IL-6表达下降,RIPK1/RIPK3/MLKL蛋白表达下降、WT-1蛋白表达增加,这提示新加肾元方通过调控RIPK1/RIPK3/MLKL通路减轻肾损伤。
综上所述,新加肾元方通过多成分、多靶点调控RIPK1/RIPK3/MLKL信号通路的表达水平,减轻肾组织病理损伤,改善肾小球足细胞超微结构变化,抑制肾组织细胞凋亡,降低炎症因子TNF-α、IL-6水平,缓解炎症反应,保护肾功能。
