竹笋发酵中挥发性物质及菌群多样性动态分析
2023-01-13张雅雯钟源郭爱玲唐丹萍齐豫川
张雅雯,钟源,郭爱玲*,唐丹萍,齐豫川
(1.华中农业大学 食品科技学院,武汉 430070;2.柳州市柳南区现代农业产业服务中心,广西 柳州 545027;3.中国科技开发院广西分院,南宁 530012)
麻竹笋(Dendrocalamuslatiflorus),别名甜竹、大绿竹、瓦坭竹,禾本科植物[1]。麻竹笋单个体积较大,重量约为4~5 kg,且种植面积大、产量高,是我国当前笋量最高的品种[2]。相较于其他竹笋而言,麻竹笋味道鲜美、肉质脆嫩、营养丰富,含有大量氨基酸、矿物质、维生素等,广受人们喜爱。但是由于新鲜竹笋中植酸含量较高,有一定苦涩味,过多的植酸还会妨碍人体对铁、镁、锌、铜、锰等矿物质的吸收,发酵腌制可以改善竹笋的口感与风味。到目前为止,竹笋发酵过程中特征性风味物质产生的作用机制暂不明确,为实现酸笋特征风味的定向调控,提升风味品质,需要深入探究酸笋中微生物与发酵过程中产生的挥发性特征风味物质的内在联系,为阐明微生物对特征香气组分生成的调控机制提供了理论依据和技术支撑。
本研究应用顶空固相微萃取-气相色谱-质谱联用技术(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)对麻竹笋自然发酵过程中的挥发性成分进行分析,获得竹笋发酵不同阶段的特征风味物质;应用高通量测序(high-throughput sequencing,HTS)对麻竹笋发酵过程中微生物菌群结构变化进行测定[3];最后基于Pearson相关性分析优势菌群与主要特征风味成分之间的关系,旨在阐明自然发酵过程中特征风味组分形成与微生物菌群之间的关系,为酸笋规模化生产加工提供理论依据。
1 材料和方法
1.1 材料与试剂
新鲜麻竹笋:广西来宾;食盐(食品级):四川宜宾丰源盐业有限公司。
1.2 仪器与设备
Agilent 7000D气相色谱-质谱联用仪 美国Agilent公司;50/30 μm DVB/CarboxenTM/PDMS StableFlexTM(二乙烯基苯/碳分子筛/聚二甲基硅氧烷)萃取头 美国Supelco公司;Centrifuge 5420 高速离心机 德国Eppendorf公司;SHP-250生化培养箱 上海精宏实验设备有限公司;15 mL气相色谱进样瓶;Vortex-2G560E涡旋振荡器 Scientific Industries Inc.;Veriti 96-Well 9902梯度基因扩增仪 Applied Biosystems公司;3-16P 24 孔离心机 Sartorius公司;BE-1100四维旋转混匀仪 海门市其林贝尔仪器制造有限公司;DynaMagTM-96 Side Skirted磁力架 赛默飞世尔科技公司。
1.3 方法
1.3.1 样品制备
将1 000 g新鲜麻竹笋去壳、洗净,取中间部分切成条(7 cm×1 cm×1 cm)后,置于1 L玻璃瓶中,加入矿泉水,置于25 ℃自然发酵。在腌制的第 1,15,30,45天分别取样进行挥发性成分和微生物多样性的测定。
1.3.2 挥发性风味物质的测定
取酸笋样品 3 g 和发酵液2 mL 放入15 mL 顶空样品瓶中,水浴平衡20 min,萃取头 250 ℃老化5 min。GC 条件:色谱柱使用 HP-5MS(30 m×0.25 mm×0.25 μm),HS-SPME法为自动进样,解吸时间为 5 min。柱箱升温程序:40 ℃保持2 min,以5 ℃/min 的速度升至 120 ℃,保持2 min,再以7 ℃/min 的速度升至220 ℃,保持5 min,最后以7 ℃/min 的速度升至240 ℃,保持5 min。 MS 条件:传输线温度260 ℃。离子能级70 eV,采用Scan(全扫描)模式,扫描质荷比范围为35~400 m/z[4]。
1.3.3 DNA提取
将30 mL酸笋发酵液样品从-80 ℃冰箱中取出,融化后置于50 mL离心管中,4 ℃高速离心机12 000 r/min离心10 min,加入200 μL缓冲液SH混匀,涡旋5 s,4 ℃放置10 min。12 000 r/min离心3 min,加入500 μL缓冲液 GFA,混匀。加入10 μL磁珠悬浮液 G,振荡混匀。将离心管放置于磁力架上静置30 s,加入700 μL去蛋白液 RD,振荡混匀5 min。将离心管放置于磁力架上静置30 s,加入700 μL漂洗液 PWD,振荡混匀 3 min。重复上述步骤1次后将离心管置于磁力架上,室温晾干5~10 min,加入50~100 μL洗脱缓冲液TB,振荡混匀,置于56 ℃孵育5 min,期间振荡混匀3回,每回3~5 次。 将 DNA 溶液转移至一个新离心管中,并于适当条件下保存。采用天根生化科技(北京)有限公司基因组提取试剂盒提取样品中所有微生物的总DNA。使用酶标仪对提取的核酸进行浓度检测,PCR 扩增后的产物进行电泳检测,在凝胶成像仪下观察电泳结果。根据电泳结果用Image J 软件定量,目的条带亮于或者接近500 bp Marker时,预估可以一次建库成功。
1.3.4 文库构建及测序
检测合格的DNA样品经纯化、PCR扩增、电泳检测、Image J 软件定量、混样过柱纯化、切胶回收等过程完成文库构建,对构建好的文库使用Illumina NovaSeq 6000(NovaSeq 6000,Illumina)进行上机测序。宏基因测序在百迈客生物科技股份有限公司进行。
1.3.5 数据处理
将GC-MS所得的挥发性风味物质与标准质谱库NIST 11 Library匹配,选取相似度大于50的物质进行分析。同时对总离子流色谱图用峰面积归一化法定量,计算出各组分的相对百分含量[5]。采用Origin 2018绘图,SPSS软件和R语言进行相关性分析[6]。
2 结果与分析
2.1 挥发性风味物质的变化
2.1.1 发酵过程中挥发性风味物质的测定
通过HS-SPME-GC-MS从竹笋发酵过程中共分离鉴定出88种挥发性风味物质,其中包含醇类17种、酯类20种、胺类2种、醛类8种、酮类7种、烷烃类13种、烯烃类4种、酸类5种、醚类7种、酚类5种,其中酚类、醇类和酯类物质为主要挥发性成分。
发酵1 d的酸笋中共鉴定出31种挥发性成分,相对含量为55.75%。主要有胺类1种(43.913%),醇类8种(1.472%),酯类3种(0.438%),醛类3种(0.736%),酮类1种(0.377%),烷烃类7种(1.757%),烯烃类3种(0.254%),醚类5种(6.805%)。胺类物质相对含量明显高于其他发酵时间的样品,其中胺类化合物为二甲胺,具有刺激性气味。发酵15 d的酸笋中共鉴定出34种挥发性成分,相对含量为82.81%。主要有胺类1种(0.025%),醇类5种(0.898%),酯类12种(2.219%),醛类2种(0.41%),酮类4种(0.681%),烷烃类2种(0.484%),酸类3种(13.726%),醚类1种(0.293%),酚类4种(64.074%)。酚类物质出现且含量高,其中主要酚类化合物为对甲酚(44.265%),具有刺激性气味。发酵30 d的酸笋中共鉴定出23种挥发性成分,相对含量为89.954%。主要有醇类4种(0.344%),酯类6种(0.294%),醛类3种(0.7%),酮类3种(0.145%),烷烃类2种(0.074%),酸类2种(12.159%),酚类3种(76.238%)等。酸类物质中主要为酮丙二酸(7.123%)和乙酸(5.036%),对甲酚含量进一步增加,达到72.359%。发酵45 d的酸笋中共鉴定出30种挥发性成分,相对含量为84.056%。主要有醇类6种(1.694%),酯类6种(0.993%),醛类3种(0.139%),酮类2种(0.146%),烷烃类4种(0.247%),烯烃类1种(0.16%),酸类2种(5.448%),醚类3种(6.539%),酚类3种(68.69%)等。在发酵后期,酚类物质是酸笋挥发性物质中测得的含量最高的一类物质,主要是对甲酚、苯酚、2-甲氧基-5-甲基苯酚等。酚类物质常会产生刺激性气味,且阈值较低,对酸笋的风味产生重要影响。发酵过程中1-辛烯-3-醇含量不断增加,1-辛烯-3-醇具有蘑菇、薰衣草、玫瑰和干草香气。胺类随着发酵的进行逐渐减少,酸类在发酵后期产生了乙酸和乳酸,乙酸有刺鼻的醋酸味,对酸笋气味有一定影响。

表1 竹笋自然发酵过程中含量增加的挥发性成分Table 1 Volatile components with increased content during natural fermentation of bamboo shoots

续 表

表2 竹笋自然发酵过程中含量减少的挥发性成分Table 2 Volatile components with reduced content during natural fermentation of bamboo shoots

续 表

表3 竹笋自然发酵过程中先出现后消失的挥发性成分Table 3 Volatile components that appear first and then disappear during natural fermentation of bamboo shoots

续 表
由表1~表3可知,在发酵过程中新出现或含量增加的物质共有24种,其中有4种醇类、6种酯类、2种醛类、1种酮类、4种烷烃类、1种烯烃类、2种酸类、2种醚类、2种酚类。环庚醇、环辛醇、乙酸、对甲酚等都是在发酵过程中产生的,且含量较高;随着发酵过程的进行,含量减少或消失的物质共有29种,其中有7种醇类、3种酯类、1种胺类、3种醛类、1种酮类、7种烷烃类、3种烯烃类、4种醚类。发酵过程中胺类物质大量减少,醇类物质中,正己醇含量明显减少,反式-2-辛烯醛也呈现下降趋势,烷烃类含量减少明显;在发酵中期先出现又消失的物质共有32种,其中有6种醇类、11种酯类、1种胺类、3种醛类、4种酮类、2种烷烃类、3种酸类、2种酚类。主要物质有酮丙二酸、4-甲氧基苯酚等,发酵中期产生多种酯类物质,如甘油亚麻酸酯、异别胆酸乙酯等。二甲醚、苯酚等物质含量变化无明显规律。
2.1.2 竹笋发酵过程中各类挥发性风味物质的变化
发酵过程中各类挥发性风味物质相对含量的变化情况见图1。

图1 麻竹笋不同发酵时间的挥发性风味物质的相对含量Fig.1 Relative content of volatile flavor substances in Dendrocalamus latiflorus at different fermentation time
对比可知,竹笋在发酵过程中挥发性风味物质的相对含量存在差异,其中酚类、酸类和醇类占主导地位。
在整个发酵过程中,共鉴定出5种酚类,占总挥发性风味物质的60%以上。发酵15 d时酸笋样品有酚类4种,相对含量高达64.074%,发酵30 d时酸笋样品有酚类3种,相对含量增加到76.238%。发酵45 d时酚类含量略有降低。乳酸菌具有去羧基、去酯化、去甲基化和去糖基化的能力,不同乳酸菌能产生特定酶(例如,淀粉酶、木聚糖酶、单宁酶和蛋白酶[7]),然后通过脱羧反应等转化为邻酚类物质。酚类中对甲酚的占比最高,其次是苯酚和2-甲氧基-5-甲基苯酚。对甲酚具有刺激性气味、焦皮臭、动物臭且阈值较低,为0.047 mg/kg,在整个发酵过程中相对含量较高,对风味影响较大。蔡玥等[8]利用GC-MS也在发酵酸笋中检测出了大量对甲酚。朱照华[9]研究表明,竹笋原材料中含有大量的酪氨酸,在发酵过程中酪氨酸大量降解,则酪氨酸有极大可能性转化为对甲苯酚,成为影响酸笋风味的重要挥发性物质。苯酚具有特殊的臭味和燃烧味,但其阈值较高,为5.9 mg/kg,对风味影响不大。
酸类的相对含量仅次于酚类,种类有5种,阈值普遍较低,对发酵酸笋的整体风味影响较大。在整个发酵过程中相对含量先升高后降低,发酵15 d时检测到的酸类相对含量最高,为13.726%。其中相对含量最高的是酮丙二酸,发酵30 d时其他相对含量较高的物质还有乙酸(5.036%),发酵45 d时还产生了少量乳酸。
醇类物质共有19种,在整个发酵过程中相对含量先减少后增加。醇类物质具有令人愉悦的香味。其中正己醇和1-辛烯-3-醇含量较多,正己醇有淡青的嫩枝叶气息,微带酒香、果香和脂肪气息,阈值为0.05 mg/kg。1-辛烯-3-醇具有蘑菇、薰衣草和干草香气,其阈值较低,为0.002 mg/kg[10]。发酵前期含有较多顺-2-甲基环戊醇,发酵后期产生环庚醇和环辛醇。
具有复合香味的酯类在整个发酵过程中相对含量较少但种类较多。其中辛酸乙酯在发酵前期含量较多,具有水果香气和白兰地的酒香味,阈值较低,为0.65 mg/kg。苯甲酸乙酯和棕榈酸乙酯在发酵中、后期含量较多,均呈现先减少后增加的趋势,苯甲酸乙酯稍有水果气味,阈值为0.06 mg/kg,棕榈酸乙酯呈微弱蜡香、果爵和奶油香气,但由于其阈值较大,大于2 mg/kg,对酸笋风味的影响不大。苯丙酸乙酯在发酵后期产生,也具有水果类香气。
醛类物质的气味阈值普遍较低,对酸笋风味的形成具有较为重要的影响。己醛有豆类香气[11],识别阈值为0.21 mg/kg,可能对酸笋风味有一定贡献。反式-2-辛烯醛呈脂肪和肉类香气,并有黄瓜和鸡肉香味,香味阈值较低。
此外,2-戊基呋喃在整个发酵过程中的相对含量较高,具有蔬菜芳香[12],阈值较低,为0.004 8 mg/kg[13];发酵前期二甲胺含量高,后期二甲胺不再检测出来,由此可以推断,发酵可以降低二甲胺等有害物质的含量。
2.2 微生物多样性变化
在细菌菌群结构分析(见表4)中,发酵初期样品中的优势细菌包括乳球菌属(35.395%)、魏斯氏菌属(23.330%)、肠杆菌科(2.279%);发酵15 d样品中的优势细菌有乳杆菌属(52.350%)、乳球菌属(41.246%);发酵30 d样品中的优势细菌有片球菌属(2.262%)、魏斯氏菌属(28.190%);发酵末期酸笋样品中的优势细菌主要为乳杆菌(66.665%)。肠杆菌科随着发酵时间的推移逐步减少,这是由于乳酸菌发酵产酸,抑制了肠杆菌的生长。乳杆菌多为兼性厌氧菌,具有较强的耐酸能力,更适合在发酵中、后期的低氧环境下生长代谢[14]。
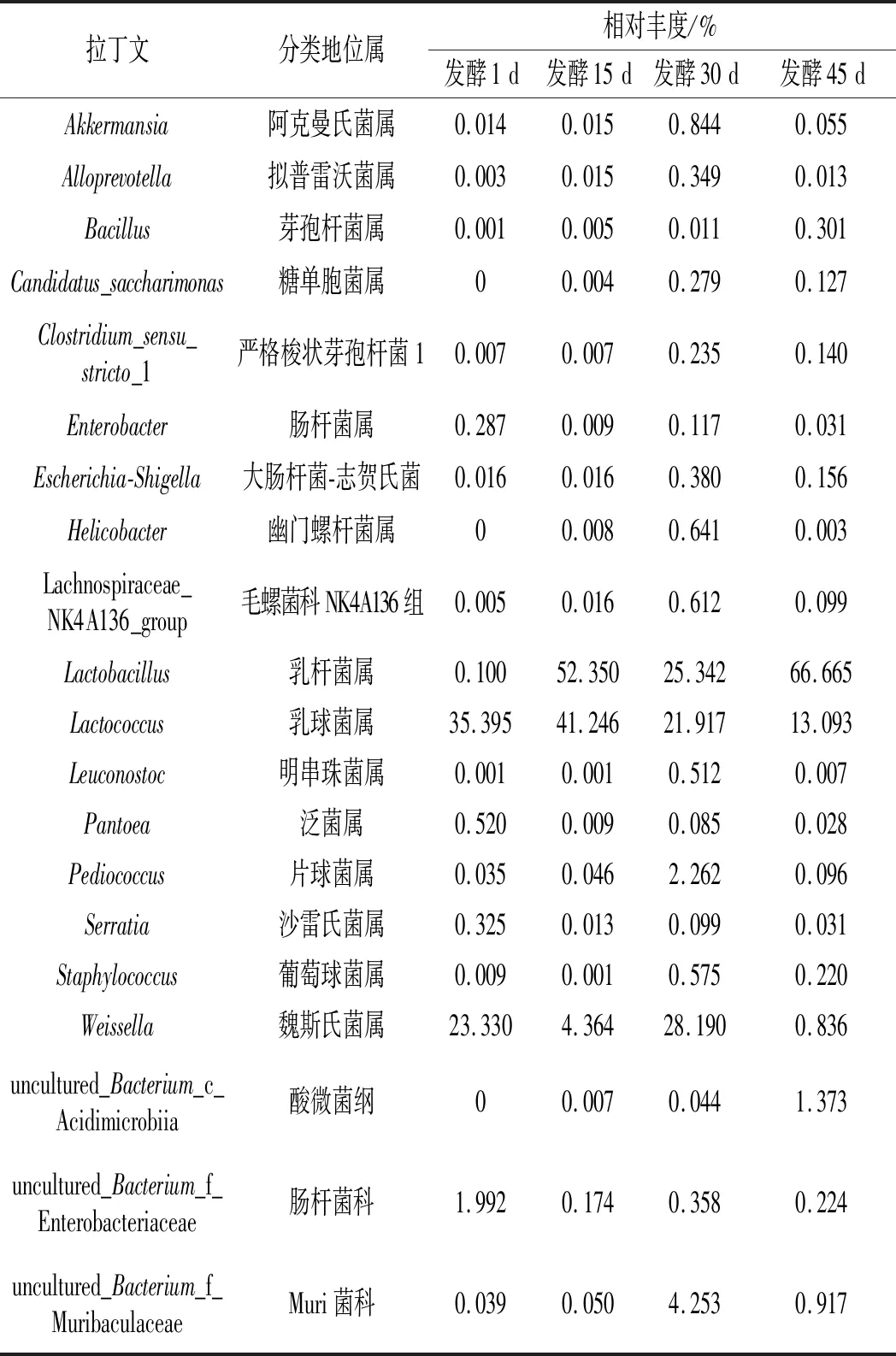
表4 竹笋自然发酵过程不同阶段细菌菌群结构分析Table 4 Analysis of bacterial community structure at different stages of natural fermentation of bamboo shoots
根据菌群结构分析结果,从中筛选出相对丰度较高的4个属水平分类群,分别为乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)和片球菌属(Pediococcus),其在不同样品中的相对丰度见图2。通过比较发现,1 d时乳球菌属含量最高,15 d和45 d时占比最高的为乳杆菌属,30 d时魏斯氏菌属含量最高。在整个发酵过程中,乳杆菌属整体含量上的趋势为先上升后下降再上升,1 d时几乎没有,15 d时为52.45%,30 d时为25.35%,45 d时为66.6%;乳球菌属整体含量上的趋势为先上升后下降,1 d时占 35.4%,15 d时占41.2%,后期降至10%~20%;魏斯氏菌属在发酵过程中在0%~30%之间变动,且无明显规律;片球菌属含量在发酵前期几乎没有,30 d时出现且含量为2.3%。由以上规律可推测,泡菜发酵过程中起主导作用的是乳杆菌属;在发酵初期作用显著的是乳球菌属和魏斯氏菌属。这与佟婷婷等[15]提出的魏斯氏菌属在此发酵过程中起到了启动菌的作用的猜想符合。而整体的乳酸菌含量呈现先增加后减少的趋势,这与文献[16]中的结果一致。
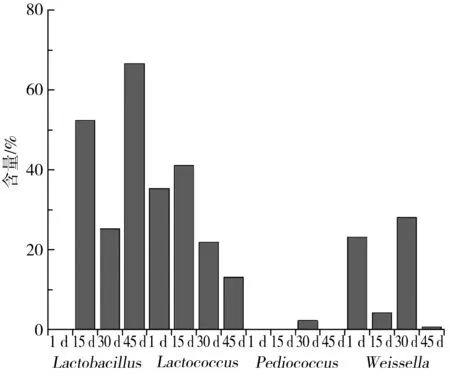
图2 发酵过程中乳酸菌属水平之间的相对丰度比较Fig.2 Comparison of relative abundance of Lactobacillus during fermentation
2.3 微生物与挥发性风味物质
酸笋中挥发性风味物质的变化受竹笋种类、地域、发酵条件和微生物种群等多种因素的影响,微生物种群可能是酸笋中挥发性风味物质形成的关键因素[17-20]。如Yang等[21]研究认为明串珠菌能显著提高泡菜中挥发性风味物质丁酸乙酯、4-异硫氰基-1-丁烯和2-庚酮的含量。还有研究认为不同菌株之间的代谢互补,会产生一些单菌株无法产生的新的挥发性化合物,并且还会增加挥发性化合物的含量,从而提高泡菜香气的复杂度[22]。而植物乳杆菌和戊糖片球菌共接种发酵可增加醇类、酯类、醛类、烃类和腈类化合物[23]。
由表5可知,乳杆菌属和乳球菌菌属与发酵过程中的挥发性风味物质大多呈正相关;糖单胞菌、严格梭状芽孢杆菌、葡萄球菌等在发酵过程中与大多数挥发性风味物质呈负相关。乳杆菌属与F5(苯甲酸乙酯)、F6(苯丙酸乙酯)、F7(棕榈酸乙酯)、F10(大马酮)、F17(苯酚)都呈正相关,且相关系数较大;乳球菌属与F4(辛酸乙酯)、F9(反式-2-辛烯醛)、F11(3-乙基-5-(2-乙基丁基)十八烷)呈正相关,与F13(乙酸)、F20(2-甲氧基-5-甲基苯酚)呈显著负相关;魏斯氏菌属与F17(苯酚)呈显著负相关。在发酵酸笋中含量最高的特征风味物质F18(对甲酚)与糖单胞菌、严格梭状芽孢杆菌、片球菌属、明串珠菌属、葡萄球菌属等都存在相关性。
3 结论
本研究以麻竹笋为原料,采用HS-SPME-GC-MS联用技术对麻竹笋自然发酵中挥发性成分进行分析,结果表明,在整个发酵过程中共检测出88种挥发性化合物,含量较多的为酚类、醇类、酯类、酸类、醚类;酮类、烷烃类、烯烃类、醛类比较少。对甲酚是酸笋中特殊味道的主体成分,同时,在研究过程中也发现,二甲胺等有害物质随着发酵过程的进行而消失。环辛醇、环庚醇、乙酸、乳酸、苯酚等物质在发酵中、后期形成。
通过高通量测序对自然发酵过程不同时期的菌群结构分析发现,在竹笋发酵的初期、中期和末期菌群结构多样性显著改变。发酵初期优势细菌菌群主要有乳球菌属、魏斯氏菌属和肠杆菌属等;中期优势细菌菌群主要有明串珠菌属和片球菌属;末期优势细菌菌群主要是乳杆菌属等。
菌群与特征挥发性风味物质的相关性分析发现,乳杆菌属和乳球菌菌属与发酵过程中的挥发性风味物质大多呈正相关;糖单胞菌、严格梭状芽孢杆菌、葡萄球菌等在发酵过程中与大多数挥发性风味物质呈负相关。在发酵酸笋中含量最高的特征风味物质对甲酚与糖单胞菌、严格梭状芽孢杆菌、片球菌、明串珠菌、葡萄球菌等都存在相关性。研究结果阐明了麻竹笋自然发酵过程中挥发性物质形成与微生物菌群之间的关系,为酸笋中优势功能菌株的筛选和定向发酵提供了基础数据。

表5 麻竹笋自然发酵过程优势菌群与挥发性风味物质的相关性数据Table 5 Correlation data of dominant microbial community and volatile flavor substances during natural fermentation of Dendrocalamus latiflorus

续 表
