QuEChERS-HPLC测定郫县豆瓣酱中真菌毒素污染的研究
2023-01-13阳凤娇李珍艳吴雪琪张良曾沛斌
阳凤娇,李珍艳,吴雪琪,张良,曾沛斌*
(1.四川大学 华西公共卫生学院/华西第四医院,成都 610044;2.西华大学 食品与生物工程学院,成都 610039)
郫县豆瓣酱是中国传统发酵食品,迄今已有300多年的历史,被列为中国非物质文化遗产。郫县豆瓣酱不仅生产工艺十分独特,也因其红润油亮、酱香浓厚等特点在我国酱类调味品中独树一帜,被誉为“川菜之魂”,更是我国著名的地理标志性产品[1]。郫县豆瓣酱的发酵生产过程包括制瓣、制椒、后熟等流程[2-5],多种真菌(以霉菌为主)在发酵过程中起到了关键作用,赋予了郫县豆瓣酱特殊的风味,但随之而来的是潜在真菌毒素污染的问题,特别是多种曲霉产生的黄曲霉毒素和赭曲霉毒素。黄曲霉毒素是一类具有肝毒性、致突变、免疫抑制和致癌性的化合物,国际癌症研究机构将其归为Ⅰ类致癌物;赭曲霉毒素具有肾毒性、肝毒性、致畸性和免疫抑制等特性,为Ⅱ类致癌物[6-10]。两类真菌毒素的热稳定性高,且毒性易累积,长期摄入将一定程度上提高患癌风险[11]。本课题组在前期研究中,利用深度测序技术,首次深度解析了郫县豆瓣酱后熟发酵过程中的微生物演替规律,发现郫县豆瓣酱后熟发酵核心物种中存在一定丰度的黄曲霉和赭曲霉[12];同时,从不同来源(工厂、作坊、家庭自制)豆瓣酱中发现了不同程度的黄曲霉毒素B1污染[13]。但是,除黄曲霉毒素B1以外,郫县豆瓣酱中其他真菌毒素的污染情况还有待调查。
与此同时,前期豆瓣酱真菌毒素污染的调查多采用酶联免疫吸附法(enzyme-linked immunosorbent assay, ELISA),但此法易出现假阳性反应,且定量结果不稳定[14-16]。高效液相色谱法(high performance liquid chromatography,HPLC)是国标推荐的用于黄曲霉毒素(aflatoxins, AFs)和赭曲霉毒素A(ochratoxin A,OTA)检测的另一种方法,且有研究表明,相比于ELISA,HPLC对真菌毒素具有更好的检测效能[17]。在HPLC检测流程中,样本的前处理十分重要,目前国标中推荐的样本前处理方法是固相净化柱法,成本较高。QuEChERS(Quick,Easy,Cheap,Effective,Rugged,Safe,QuEChERS)是近年来快速发展起来的一种样本前处理技术,具有快速、简单、成本低、高效、安全等特点,已大量应用于多种样本(如饲料、谷物、果蔬、香料等)的前处理和真菌毒素检测中[18-24]。但是,尚未有研究报道利用QuEChERS-HPLC法对豆瓣酱中的真菌毒素进行检测。
因此,本研究建立和优化了针对豆瓣酱的QuEChERS-HPLC法,见图1。对其中5种真菌毒素即黄曲霉毒素B1(aflatoxin B1, AFB1)、黄曲霉毒素B2(aflatoxin B2, AFB2)、黄曲霉毒素G1(aflatoxin G1, AFG1)、黄曲霉毒素G2(aflatoxin G2, AFG2)和赭曲霉毒素A(ochratoxin A, OTA)的污染情况进行了全面调查;揭示了郫县豆瓣酱中除AFB1之外最受关注的4种真菌毒素的污染状况,为豆瓣酱真菌毒素低成本定性、定量检测提供了方法学支撑,为后续发酵工艺的优化和食品质量安全控制提供了理论依据。

图1 QuEChERS-高效液相色谱法测定郫县豆瓣酱中5种真菌毒素含量的流程Fig.1 Process of determination of five mycotoxins' content in Pixian broad bean paste by QuEChERS-HPLC
1 材料与方法
1.1 材料与试剂
5种真菌毒素标准品(纯度>98%):黄曲霉毒素B1(2.00 μg/mL)、黄曲霉毒素B2(2.15 μg/mL)、黄曲霉毒素G1(2.00 μg/mL)、黄曲霉毒素G2(1.90 μg/mL)、赭曲霉毒素A(10.00 μg/mL),均购自坛墨质检标准物质中心。
甲醇、乙腈、正己烷(均为色谱纯)、三氟乙酸(分析纯)、氯化钠(优级纯):天津市科密欧化学试剂有限公司;无水硫酸镁粉末、柠檬酸钠、柠檬酸氢二钠(均为优级纯):天津市光复精细化工研究所;乙二胺-N-丙基硅烷(PSA,NanoChrom公司)、次氯酸钠(均为分析纯):天津市津东天正精细化学试剂厂;冰乙酸(分析纯):天津市致远化学试剂有限公司;超纯水(实验室一级水):赛默飞世尔科技公司。
1.2 仪器与设备
UltiMate®3000 RSLC快速液相色谱仪(配备荧光检测器)、ST16R 低温高速离心机 赛默飞世尔科技公司;NanoChrom ChromCore C18柱(250 mm×4.6 mm,5 μm) 纳谱分析技术(苏州)有限公司;NEVAP系列氮吹仪 美国Organomation公司;生物安全柜、0~4 ℃和-22 ℃冰箱 青岛海尔生物医疗股份有限公司。
1.3 方法
1.3.1 豆瓣酱样品前处理
1.3.1.1 试样提取
将豆瓣酱样品用组织匀浆机捣碎,混匀备用,称取两份2 g(精确到0.1 g)试样于50 mL离心管中,分别加入20 mL乙腈-水(84∶16,体积比)和20 mL乙腈-水-冰乙酸(84∶15∶1,体积比)提取液,充分振荡后超声提取10~20 min,备用。
1.3.1.2 试样净化、浓缩
每份样品中加入4 g无水硫酸镁、1 g氯化钠、1 g柠檬酸钠、0.5 g柠檬酸氢二钠,涡旋振荡1 min后于6 000 r/min下离心5 min。离心结束后取全部上清液于另一50 mL离心管中,加入3 g无水硫酸镁、0.5 g PSA粉末,涡旋振荡1 min后于10 000 r/min下离心2 min。离心结束后取全部上清液转移至15 mL离心管中,分别得到AFs和OTA 的提取液。将装有提取液的离心管置于氮吹仪上,50 ℃水浴下氮吹至近干。
1.3.1.3 试样转移
AFBs提取液:氮吹结束后,在15 mL离心管中依次加入200 μL三氟乙酸、800 μL乙腈-水(1∶9,体积比),涡旋 30 s 溶解残留物,室温黑暗条件下衍生 20 min,衍生结束后,使用一次性无菌注射器吸取全部液体,经0.22 μm滤膜过滤,于进样瓶中以备进样。
OTA 提取液:氮吹结束后,在15 mL离心管中加入1 mL 初始流动相乙腈-水-乙酸(48∶51∶1,体积比),涡旋30 s溶解残留物,使用一次性无菌注射器吸取全部液体,经0.22 μm 滤膜过滤,于进样瓶中以备进样。
1.3.2 标准溶液配制
1.3.2.1 AFs混合标准溶液
AFs混合标准储备液配制:准确移取AFB1和AFG1标准储备溶液各 0.25 mL,AFB2和 AFG2标准储备溶液各0.15 mL于1 mL 棕色容量瓶中,加入乙腈定容。密封后混匀,标记为黄曲霉毒素混合工作液1。取100 μL黄曲霉毒素混合工作液1于另一1 mL棕色容量瓶中,加入乙腈定容,密封混匀,标记为黄曲霉毒素混合工作液2。取100 μL黄曲霉毒素混合工作液2于另一1 mL 棕色容量瓶中,加入乙腈定容,密封混匀,标记为黄曲霉毒素混合工作液3。3种黄曲霉毒素混合标准工作液均于-20 ℃下避光保存,备用。
AFs混合标准工作液配制:分别准确移取黄曲霉毒素10,50 μL混合标准工作液3、20,50 μL 混合标准工作液2和10,20,40 μL混合标准工作液1于进样瓶中,分别作为标准系列 1,2,3,4,5,6,7,均加入 200 μL 三氟乙酸,再加入乙腈-水(1∶9,体积比)定容至1 mL,混匀后于黑暗中衍生 20 min。各混合标准系列中4种黄曲霉毒素浓度见表 1。
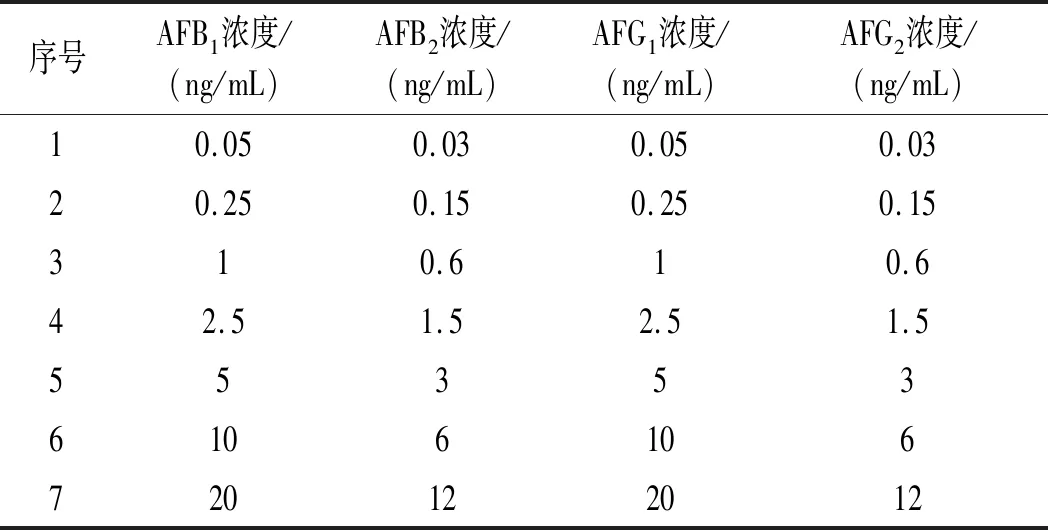
表1 黄曲霉毒素混合标准液浓度Table 1 Concentration of aflatoxin mixed standard solution
黄曲霉毒素单型标准溶液配制:配制表1中相应浓度的4 种单型黄曲霉毒素标准溶液,衍生后经HPLC确定各自的保留时间,并以此作为定性依据。
1.3.2.2 OTA 标准溶液
OTA 标准储备液配制:准确移取OTA 标准储备溶液100 μL于1 mL棕色容量瓶中,加入甲醇-乙腈(50∶50,体积比)定容,密封后混匀,标记为OTA 标准工作液1。取100 μL OTA 混合工作液1于另一1 mL棕色容量瓶中,加入甲醇-乙腈(50∶50,体积比)定容,密封混匀,标记为 OTA 标准工作液2。两种 OTA 标准工作液均于-20 ℃下避光保存,备用。
OTA 标准工作液配制:分别准确移取黄曲霉毒素10,50,100 μL混合标准工作液2和20,50 μL混合标准工作液1于进样瓶中,加入流动相定容至1 mL,混匀后配制成浓度分别为1,5,10,20,50 ng/mL 的OTA 标准系列溶液。
1.3.3 色谱条件
AFs的测定:色谱柱:NanoChrom ChromCore C18柱(150 mm×4.6 mm, 5.0 μm);柱温:40 ℃;样品温度25 ℃;进样体积50 μL;分析时间13 min;流速1.0 mL/min;流动相A为水,流动相B为甲醇-乙腈(50∶50,体积比);梯度洗脱程序:40% B(0~6 min),75% B(8~10 min),100% B(10.2~11.2 min),24% B(11.5~13 min);激发波长:360 nm,发射波长:440 nm。
OTA 的测定:色谱柱:NanoChrom ChromCore C18柱(250 mm×4.6 mm,5 μm);柱温:35 ℃;样品温度25 ℃,进样体积50 μL,分析时间15 min;流速1 mL/min;流动相为水-乙腈-冰乙酸(51∶48∶1,体积比)的混合溶液;洗脱程序:流动相梯度洗脱(0~15 min);激发波长:333 nm,发射波长:460 nm。
2 结果与分析
2.1 确定色谱条件
流动相梯度洗脱的程序对于通过HPLC 实现对4种黄曲霉毒素同时定量来说十分重要。实验表明,根据GB 5009.22—2016第二法提供的洗脱程序不能得到4个单独的黄曲霉毒素色谱峰,即无法对4种黄曲霉毒素同时定量。之后发现提高初始流动相中有机相的比例能有效改善这种情况,当梯度洗脱程序为40% B(0~6 min),75% B(8~10 min),100% B(10.2~11.2 min),24% B(11.5~13 min)时,色谱图上呈现4个完全独立的色谱峰,意味着利用上述洗脱程序,能用预先配制的黄曲霉毒素混合标准溶液实现对4种黄曲霉毒素的单独定量,见图2。赭曲霉毒素A 的洗脱程序为水-乙腈-冰乙酸(51∶48∶1,体积比)的混合溶液等度洗脱15 min,标准曲线呈良好的线性关系,意味着利用上述洗脱程序能实现对赭曲霉毒素的准确定量,色谱图见图3。
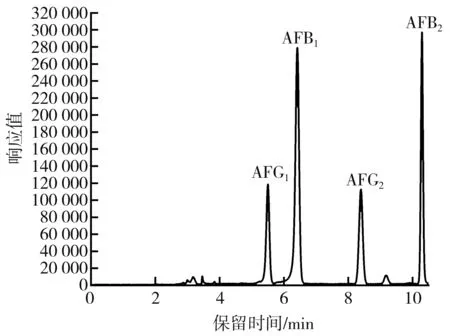
图2 经高效液相色谱分离的黄曲霉毒素混合标准工作液色谱图Fig.2 Chromatogram of aflatoxin mixed standard working solution separated by HPLC注:浓度为黄曲霉毒素混合标准序列7(AFB1、AFG1浓度为20 ng/mL,AFB2、AFG2 浓度为12 ng/mL)。
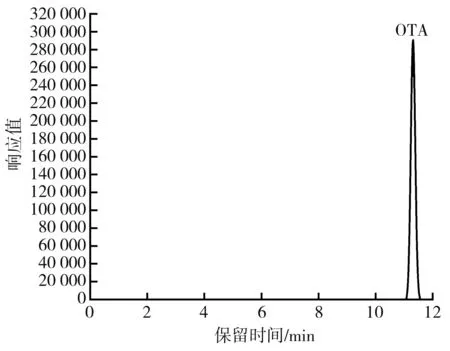
图3 经高效液相色谱分离的赭曲霉毒素标准工作液色谱图Fig.3 Chromatogram of ochratoxin standard working solution separated by HPLC注:赭曲霉毒素标准溶液浓度是50 ng/mL。
2.2 确定提取条件
在实验过程中,样本提取液的选择直接影响回收率的高低,选择提取效率高的提取液能让实验获得较高的回收率,本实验对黄曲霉毒素和赭曲霉毒素的提取液进行了优化。提取液乙腈-水(84∶16,体积比)对豆瓣酱样品中黄曲霉毒素的提取率较高,加标回收率为74.26%~112.92%,虽然在低浓度时回收率较低,但是豆瓣酱样本基质复杂,综合考虑可接受。该提取液对赭曲霉毒素的提取率低,加标回收率在40%~50%,分析赭曲霉毒素的化学结构发现其含有羧基基团,这会导致其在碱性和中性环境中极不稳定,易降解损失,提取液中添加适量甲酸或乙酸可有效提高回收率[25]。因此,将赭曲霉毒素提取液更换为乙腈-水-冰乙酸(84∶15∶1,体积比)后,回收率为87.35%~108.79%,达到要求,同时该研究还发现,若利用上述提取液作豆瓣酱中黄曲霉毒素的提取液,则黄曲霉毒素的回收率会降低到60%~70%,因此最后分别选用乙腈-水(84∶16,体积比)和乙腈-水-冰乙酸(84∶15∶1,体积比)作为豆瓣酱样本中黄曲霉毒素和赭曲霉毒素的提取液。
2.3 确定衍生条件
在实验过程中发现尽管高浓度的混合黄曲霉毒素标准工作液的色谱峰完全分离,但存在AFB1与AFG1色谱峰响应值极低甚至无响应值的问题,导致无法进行后续的定性、定量工作。考虑到可能是AFB1与AFG1本身的荧光信号较弱,因此加入一定量三氟乙酸作衍生剂,向AFB1与AFG1结构中嵌入特殊的荧光基团以提高检测时的灵敏度。实验表明,向氮吹后所得产物中加入200 μL三氟乙酸、800 μL乙腈-水(1∶9,体积比),在室温黑暗条件下衍生20 min后,AFB1和AFG1色谱峰的响应值均显著提高(见图4),可用于后续的定性定量工作。
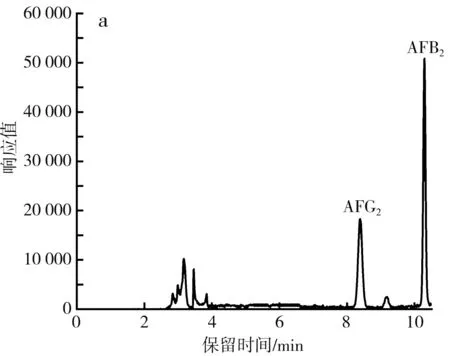
图4 衍生前后黄曲霉毒素色谱图对比Fig.4 Comparison of aflatoxin chromatograms before and after derivatization注:a为衍生前黄曲霉毒素标准工作液色谱图,b为衍生后黄曲霉毒素标准工作液色谱图;浓度为黄曲霉毒素混合标准序列4(AFB1、AFG1 浓度为2.5 ng/mL,AFB2、AFG2 浓度为1.5 ng/mL)。
2.4 去除基质效应干扰
选取不含真菌毒素的郫县豆瓣酱样本(基质),加入前述不同浓度的真菌毒素标准工作液,采用相同的处理方法,计算各真菌毒素的回收率,发现本实验测定的4种黄曲霉毒素的回收率均在50%左右,未能满足方法学要求,赭曲霉毒素的回收率为87.35%~108.79%,满足方法学要求。同时用加入空白样本后的黄曲霉毒素标准曲线斜率与最初黄曲霉毒素标准曲线斜率的比值评价郫县豆瓣酱样本对黄曲霉毒素的基质效应,比值在0.8~1.2视为基质效应不明显,比值大于1.2视为基质增强效应,比值小于0.8视为基质抑制效应。豆瓣酱样本中AFB1、AFB2、AFG1、AFG2的基质效应均小于0.8,因此在测定黄曲霉毒素的含量时,必须去除郫县豆瓣酱样本的基质干扰。本实验采用基质匹配的标准曲线进行定量校准,将4种黄曲霉毒素的回收率水平提高至74.26%~112.92%。
2.5 标准曲线、检出限、定量限结果
根据样本中5种真菌毒素,分别配制不同浓度的黄曲霉毒素混合标准溶液和赭曲霉毒素标准溶液,选取真菌毒素空白的样本作为基质,按照1.3.1中流程进行分析,以各组分的峰面积作为纵坐标,各真菌毒素的浓度作为横坐标,分别得到黄曲霉毒素和赭曲霉毒素标准工作曲线。将配制好的最低浓度真菌毒素标准溶液添加到空白样品中,按照上述方法进行处理进样,信噪比S/N=3为检出限,S/N=10为定量限。结果显示,5种真菌毒素的基质标准工作曲线线性关系良好,决定系数R2均大于0.99。

表2 真菌毒素的线性关系、检出限和定量限Table 2 Linear relationship, limit of detection and limit of quantification of mycotoxins
由表2可知,本研究方法检出限为0.01~0.16 μg/kg,其中,黄曲霉毒素B1、黄曲霉毒素B2的检出限和定量限均低于GB 2761—2017《食品中真菌毒素限量》中的相应指标。
2.6 方法的加标回收率实验
由于不同豆瓣酱样本的基质效应可能存在差别,为探究其对实验结果的影响,本实验针对3个不同的豆瓣酱空白样品设计了低、中、高3 个水平进行每种真菌毒素的加标回收率实验,计算相对标准偏差(relative standard deviation, RSD)。5种真菌毒素的加标回收率和RSD见表3,说明本实验方法满足实验要求。
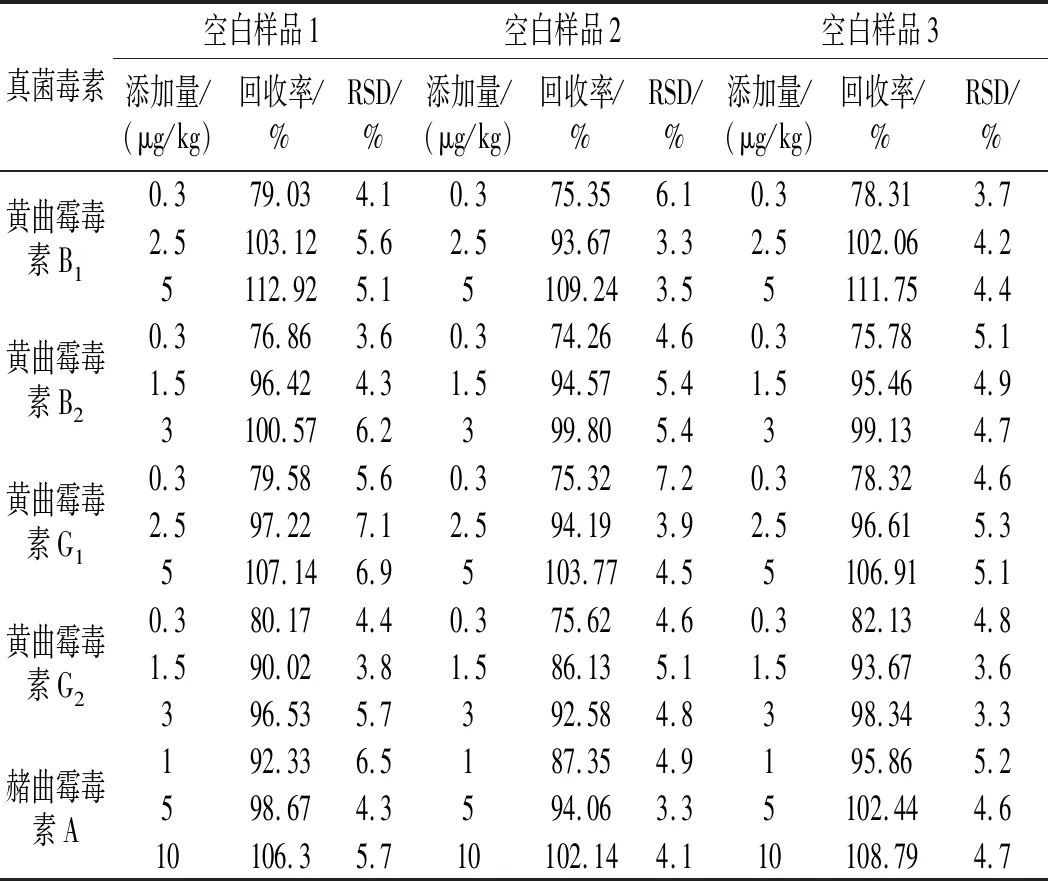
表3 不同豆瓣酱空白样品的加标回收率及精密度(n=3)Table 3 Spiked recovery rates and precision of different broad bean paste blank samples (n=3)
2.7 郫县豆瓣酱样品检测结果
对从四川省成都市取样的60份郫县豆瓣酱样品进行了黄曲霉毒素含量的测定,检测结果见表4,共在22份样本中检出真菌毒素,并且上述阳性样本中只存在1种真菌毒素的污染,真菌毒素的污染率为36.7%。6份样品检出AFB1,浓度范围为0.12~9.24 μg/kg,参考GB 2761—2017的限量标准(5.0 μg/kg),有3份超过限量值;8份样品中检出AFB2,浓度范围为0.06~0.43 μg/kg;5份样品中检出AFG1,浓度范围为0.12~12.64 μg/kg;3份样品中检出AFG2,浓度范围为0.06~1.93 μg/kg;同时对上述60份郫县豆瓣酱样品进行了赭曲霉毒素A含量的测定,共有8份样品检出OTA,浓度范围为6.01~15.30 μg/kg,阳性样本的检测结果见表4。

表4 郫县豆瓣酱样本真菌毒素含量的检测结果Table 4 Detection results of mycotoxin content in Pixian broad bean paste samples
3 结论
本研究建立了QuEChERS-高效液相色谱法测定豆瓣酱中5种真菌毒素含量的方法。样品分别经乙腈-水(84∶16,体积比)和乙腈-水-冰乙酸(84∶15∶1,体积比)提取黄曲霉毒素和赭曲霉毒素A,加入2008版改良QuEChERS法盐包振摇离心,取上清液氮吹;黄曲霉毒素提取液氮吹后加入三氟乙酸进行衍生,赭曲霉毒素A提取液氮吹后直接用初始流动相定容,进样后经C18色谱柱分离,色谱峰保留时间定性,基质匹配的真菌毒素标准溶液用外标法定量,5种真菌毒素在各自的质量浓度范围内线性关系良好。采用QuEChERS作前处理,成本远低于目前普遍采用的免疫亲和柱法,操作更加简单快捷,同时也可去除大部分基质干扰物,结合高效液相色谱法可实现对郫县豆瓣酱中黄曲霉毒素和赭曲霉毒素的准确定性定量。该方法经过优化后对5种真菌毒素的检出限达到0.01~0.03 μg/kg,灵敏度较高,满足产品质量监督的要求。
本研究在郫县豆瓣酱样品中检出5种真菌毒素,其中黄曲霉毒素B2和赭曲霉毒素A 的污染率最高,均为13.3%,其次是黄曲霉毒素B110%,黄曲霉毒素G18.3%和黄曲霉毒素G25%。可以看出B族黄曲霉毒素的污染率高于G族黄曲霉毒素,越来越多的研究表明这可能与样本中存在的产毒真菌有关[26-27],一项针对辣椒粉中产毒真菌的研究表明,在辣椒粉中分离出的所有产黄曲霉毒素的菌株中,96.9%的菌株只产生B族黄曲霉毒素,仅3.1%的菌株同时产生B族和G族黄曲霉毒素[28];黄曲霉毒素B1作为Ⅰ类致癌物,各个国家都对黄曲霉毒素B1在食品中的限量做了明确且严格的规定,包括我国在内的大多数国家都规定了黄曲霉素B1在调味品中的最大含量为5 μg/kg,除此之外,欧盟还规定了总黄曲霉毒素(AFs)在调味品中的最大含量为10 μg/kg,但我国缺乏调味品中对AFs含量的规定;赭曲霉毒素A 作为Ⅱ类致癌物,欧盟规定其在调味品中的限量为15 μg/kg[29],本研究在60份豆瓣酱中检出8份OTA 为阳性,有6份含量均超过了10 μg/kg,有1份为15.2 μg/kg,超过了欧盟的限量标准,与此同时我国还没有豆瓣酱中OTA 限量的规定,因此为了避免食品安全问题的发生,有必要建立豆瓣酱或者调味品中AFs和OTA 的限量标准。
