人肝癌细胞MHCC-97L组蛋白乙酰化位点修饰水平变化的研究
2023-01-13张建栋李梁和程海玉姜洞彬杨勤詹玮
张建栋 李梁和 程海玉 姜洞彬 杨勤 詹玮
作者单位:550004 贵阳 贵州医科大学临床医学院(张建栋,姜洞彬);贵州医科大学附属肿瘤医院胃肠外科(李梁和);贵州医科大学附属医院肛肠外科(程海玉,詹玮);贵州医科大学病理生理学教研室(杨勤)
肝癌是人类最常见的恶性肿瘤之一,最新一项流行病学调查显示,亚太地区肝脏疾病死亡的患者中43.6%为肝癌患者,高于美国33.9%及欧洲地区39.4%[1]。由于肝脏结构和功能特殊性,肝癌早期确诊和就诊率不高,是肝癌病死率偏高和5年生存率较低的原因之一[2-4]。肝癌的发生、发展被认为与异常的组蛋白乙酰化修饰水平关联密切,在肝癌细胞组蛋白H3的肽链结构中,位于第9位的赖氨酸常常发生乙酰化修饰 (histone H3 lysine 9 acetylation, acH3K9) 异常,而关于肝癌细胞组蛋白H3K14、H3K18、H3K27位点的乙酰化修饰的研究鲜有报道。本实验旨在探索人肝癌细胞株MHCC-97L中组蛋白乙酰化修饰的相关位点的变化情况,以期了解相关位点组蛋白乙酰化与肝癌发生之间的相关性,旨为临床肝癌的早期诊疗和药物靶点设计和药物开发提供参考。
材料与方法
一、细胞株及主要试剂
人正常肝细胞株LO2及人低转移性肝癌细胞株MHCC-97L由贵州医科大学病理生理实验室保存;胎牛血清、DMEM培养基购自Gibco公司;DNaseⅠ、彩虹Maker购于Solarbio公司;细胞裂解液、蛋白酶抑制剂、BAC蛋白定量试剂盒、Annexin V-FITC/PI细胞凋亡检测试剂盒、AlexaFiuor488标记山羊抗小鼠IgG(H+L)、DyLight549标记山羊抗兔IgG(H+L)均购自上海碧云天公司;E-Plate检测板购自埃森生物有限公司;acH3K14、acH3K18、acH3K27抗体购于Abcam公司,低速多管架自动平衡离心机TDZ-WS,购于湖南湘仪实验室仪器开发有限公司。
二、主要方法
(一)体外细胞培养 复苏人正常肝LO2细胞及人低转移性肝癌MHCC-97L细胞,分别置于含青、链霉素及10%胎牛血清的DMEM培养基中培养(温度37 ℃,CO2体积分数5%),根据细胞生长状态,及时进行培养基换液,细胞传代,取对数生长期细胞用于实验研究。
(二)RTCA检测细胞增殖情况 向E-Plate检测板中加入培养基并测定背景阻抗值;向相同培育条件下的两组E-Plate检测板中加入适量状态良好的人正常肝LO2细胞或人低转移性肝癌MHCC-97L细胞,室温超净台内放置30 min;后置于37 ℃、CO2体积分数为5%、饱和湿度的培养箱,于培养箱中予RTAC xcell-Ligence动态观察对数增长的LO2细胞或MHCC-97L细胞,进行实时动态的细胞增殖检测并将二者的增长曲线绘制成图。
(三)免疫荧光实验对比细胞凋亡情况 分别取对数生长期的人正常肝LO2细胞、人低转移性肝癌MHCC-97L细胞于培育皿中孵育培养,培养48 h后使用Annexin V-FITC/PI双染法,顺序加入Annexin V-FITC结合液15 μL/皿,Annexin V-FITC 5 μL/皿,PI 10 μL/皿,室温摇床避光孵育20 min,倒置荧光显微镜下观察细胞形态,分析细胞凋亡情况。
(四)提取细胞核及核蛋白制备 通过核浆分离技术提取人正常肝LO2细胞及人低转移性肝癌MHCC-97L细胞核蛋白,按每1×106个细胞比率加入裂解液100 μL,核蛋白酶抑制剂1 μL,冰上裂解30 min,以60 g转速低温离心10 min,-80 ℃下保存待用[5]。
(五)Western Blot检测组蛋白乙酰化位点修饰情况 将提取的核蛋白分别置入120 g/L的SDS-PAGE中电泳,使用甲醇湿法电转移法,转膜,PVDF膜室温下以5%脱脂奶粉摇床封闭2 h;加入单克隆抗体(一抗,分别采用组蛋白乙酰化修饰位点H3K14、H3K18、H3K27抗体1:1000及H3抗体1:400),4 ℃下低温过夜;加入TBS洗涤液,洗膜后3~4次,再放入用TBS(按1∶1000稀释的辣根过氧化物酶标记的羊抗兔二抗以及羊抗鼠二抗),于室温下摇床上反应1 h进行标记;TBS洗涤液洗膜,加入曝光液,进行化学发光法显色,曝光后以H3为内参,通过Image Lab图像软件定量分析H3K14、H3K18、H3K27组蛋白条带灰度值,对比其乙酰化修饰水平。
三、统计学方法
用SPSS 24.0统计软件进行数据分析。计量资料采用均数±标准差表示,对数据进行t检验或相关分析。以P<0.05为差异有统计学意义。
结 果
一、人正常肝细胞株LO2与人低转移性肝癌细胞株MHCC-97L细胞形态图比较
在相同的生长条件下培养,人低转移性肝癌细胞株MHCC-97L细胞核体积大,呈多形性,核分裂增多。

注:A.LO2(×200);B.MHCC-97L(×200)
二、人正常肝细胞株LO2与人低转移性肝癌细胞株MHCC-97L两种细胞株增殖对比
根据RTCA结果显示,在相同条件下,培养初期人低转移性肝癌细胞株MHCC-97L与人肝细胞株LO2均保持一定的增殖速度,MHCC-97L细胞株增殖速度高于LO2细胞株,两组细胞株增殖数目均与时间呈正比。随培养时间的推移,LO2细胞株增殖速度逐渐下降,相同条件下培育48 h后,人肝细胞株LO2细胞指数趋于稳定,而人低转移性肝癌细胞株MHCC-97L有无限增殖趋势,增殖速度明显大于LO2细胞株(P<0.05,见表1)。

表1 两组细胞株细胞指数水平随培养时间增加的对比(±s, n=3 )
三、细胞凋亡情况
经Annexin V-FITC/PI法染色后,凋亡早期的细胞,细胞膜会被绿染,荧光显微镜下观察发现,正常LO2细胞、MHCC-97L细胞48 h后自然凋亡情况差异不大。

注:A.LO2;B.MHCC-97L
四、LO2与MHCC-97L细胞acH3K14、acH3K18、acH3K27位点乙酰化位点修饰水平
通过Western Blot法检测分析,与LO2细胞株相比,MHCC-97L细胞株中acH3K14、acH3K18、acH3K27位点乙酰化修饰后的蛋白量表达较正常细胞株更低,差异有统计学意义(P<0.05,见图3及表2)。
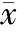
表2 两组细胞株间acH3K14、acH3K18、acH3K27相对表达水平的比较(H3, ±s, n=6 )
讨 论
肝癌早期检出率不高,多数患者被确诊为肝癌时已达晚期[5],提升早期诊断率与治疗途径,是肝癌防治的艰巨任务。国内外研究[6-8]陆续证实,肺癌、乳腺癌、前列腺癌及甲状腺癌患者中乙酰化的组蛋白表达低于同类正常人,组蛋白乙酰化修饰水平的异常是癌症发生、发展的潜在通路。

图3 Western blot检测LO2与MHCC-97L的acH3K14、acH3K18、acH3K27位点乙酰化修饰情况
针对肝癌细胞中组蛋白乙酰化修饰水平对肝癌进展的影响,研究表明人肝癌细胞中H3组蛋白乙酰化水平明显低于人正常肝细胞[9],且已有学者通过对手术切除肝癌组织的研究发现,人肝癌组织的H3组蛋白乙酰化水平明显低于临近的非癌变的正常肝脏组织[10]。肝脏组蛋白H3乙酰化水平下调与肝癌发生相关,有学者预测这可能是组蛋白H3乙酰化水平降低,间接导致抑癌基因转录的沉默而诱导肝癌发生[11-12]。组蛋白乙酰化修饰多发生在H3组蛋白赖氨酸残基上的9、14、18、23位点[13],国内学者张婷[14]通过免疫共沉淀实验鉴定出人肝癌细胞中组蛋白H3K9位点的乙酰化水平较人正常肝细胞低。学者Wang等[15]通过人正常肝细胞、人肝癌细胞、人肝癌转移细胞系进行对比研究,结果证实人肝癌细胞组蛋白H3乙酰化表达下调,肝癌转移细胞表达水平较肝癌细胞的H3乙酰化更低。关于肝癌发生、发展过程中具体哪些位点发生变化,以及这些位点的变化与肿瘤发生的关系罕见报道,尚无报道证实转移性人肝癌细胞中组蛋白H3K14、H3K18及H3K27位点修饰水平的变化情况。
本研究以人正常肝细胞株LO2为对照,对比研究低转移性肝癌细胞株MHCC-97L的组蛋白乙酰化水平,Western Blot法检测acH3K14(组蛋白H3位于第14位的赖氨酸发生乙酰化修饰,histone H3 lysine 14 acetylation)、acH3K18、acH3K27修饰水平是否存在异常。研究结果显示相比正常肝细胞株LO2,低迁移肝癌细胞株MHCC-97L的acH3K14、acH3K18、acH3K27修饰水平出现明显下调,提示以上位点组蛋白乙酰化修饰水平的下调程度可能与肝癌细胞的发生有关,这与已有相关肝癌组蛋白乙酰化的研究具有一致性。组蛋白乙酰化与去乙酰化之间保持动态平衡,特定位点组蛋白乙酰化修饰水平的改变,也可激活或沉默基因的转录[16],这一特性为肿瘤早期的临床诊疗和药物开发提供了一种思路。国外学者已通过实验证实,组蛋白修饰水平的异常发生在肝癌早期[17],通过检测H3组蛋白特定位点如K36甲基化修饰的表达水平,可对肝癌的生物学特征如血管浸润程度、异质性及分化程度等情况进行判断[18-19],使得从表观遗传分子水平进一步诊治肝癌成为可能。本研究对于肝癌组蛋白特定位点乙酰化水平改变的探讨可揭示它们在肝癌发生中的作用,且有可能为肝癌早期诊断提供新思路,有助于寻找防治肝癌的可能靶点。
肝癌的发生是多因素参与的复杂过程,本研究探讨了肝癌细胞中相应组蛋白修饰位点乙酰化的变化情况,acH3K14、acH3K18及acH3K27修饰水平下调与肝癌发生存在关联,而是否可通过改变上述组蛋白位点的乙酰化水平影响肝癌细胞状态,仍需进一步的实验证实。
利益冲突声明:所有作者均声明不存在利益冲突。
