原发性肝癌发生KRAS基因突变患者的超声特征及KRAS基因突变与淋巴结转移的相关性
2023-01-13黄诗雯曾美惠
黄诗雯 曾美惠
作者单位:363000 福建漳州 联勤保障部队第九〇九医院(厦门大学附属东南医院)超声科
HCC起病隐匿,早期临床表征并不显著,中晚期会伴有肝区疼痛、黄疸、发热、乏力、纳差、进行性消瘦及自发性低血糖和红细胞增多等表现[1-2]。与多数癌症相似,其发病机制尚未完全明确,但可以明确的是恶性肿瘤的发生发展过程均离不开基因和蛋白的调控作用[3]。随着医疗科技的发展,个体化药物和靶向药物治疗已逐渐成为治疗肿瘤患者的新方向。目前有与结肠癌相关的研究显示,KRAS基因突变可致使其自身磷酸化,并长期处于激活状态,导致KRAS基因突变患者对于抗表皮生长因子(epidermal growth factor receptor,EGFR)药物应答不佳,且BRAF V600E突变的患者可能无法从EGFR药物治疗中取得较好的临床效果[4-6]。美国国家综合癌症网络(NCCN)明确提出,KRAS基因状态对EGFR单抗靶向药物的临床疗效预测价值较高,建议行常规检测。索拉非尼是可有效延长肝癌患者生存时间的小分子多靶点药物,可直接作用于CRAF和BRAF,延缓肿瘤进展,但其总体治疗有效率仍不十分理想[7]。
资料与方法
一、一般资料
纳入2018年3月至2021年3月联勤保障部队第909医院收治的原发性肝癌患者168例,根据淋巴结转移情况将其分为肝癌伴肝外转移患者组(n=63)和无肝外转移组(n=105)。肝癌伴肝外转移组年龄38~74岁,无肝外转移组患者年龄35~73岁。两组患者年龄、性别、AFP水平及有无手术和介入治疗等资料差异无统计学意义(P>0.05),见表1。所有患者及其法定代理人均知晓该研究方案且签署同意书,该方案通过医院伦理委员会的批准。
二、纳排标准
纳入标准:①原发性肝癌诊断参照《原发性肝癌的分层筛查与监测指南(2020版)》[8]相关标准;②入院前未接受过任何抗肿瘤治疗;③均经病理学明确诊断为原发性肝癌;④未合并其他恶性肿瘤。
排除标准:①继发性肝癌;②合并其他恶性肿瘤;③合并重要脏器严重疾病者;④临床资料不全者。
三、方法
KRAS基因突变检测:分别采集两组患者的外周血各10 mL,通过TAKARA基因提取试剂盒提取血液中的DNA,测量基因组DNA在260 nm波长时的A值。双链DNA浓度=A260×样品稀释倍数×(50/1000)。应用人类KRAS/NRAS基因突变联合检测试剂盒对KRAS基因突变情况进行检测。免疫组化检测KRAS蛋白表达:将切片置于65℃烤箱中烘烤3 h,脱蜡、水化;PBS冲洗3次,3 min/次。抗原修复:加入氧化酶阻断溶液(试剂A),于室温下孵育10 min;除去PBS,加入正常非免疫动物血清(试剂B),在室温下孵育10min后,去除血清,滴加一抗,4℃过夜或室温下孵育60 min。PBS冲洗3次,3 min/次;将PBS除去后,滴加二抗,室温孵育10 min;PBS冲洗3次,每次3 min;将PBS除去后,滴加链霉菌抗生物素、过氧化酶溶液(试剂D),孵育10 min,PBS冲洗3次,每次3 min;加入新鲜配制的DAB溶液,显微镜下观察3~10 min;经自来水冲洗后,苏木素复染10 min,PBS冲洗反蓝20 min;梯度酒精脱水干燥,以中性树胶封固,并分析结果。肝脏的彩色多普勒成像:使用彩超仪3.5 M探头对整个肝脏及其周围脏器的回声进行探测,记录肝脏肿瘤直径、结节个数,并进行血流分级。Ⅰ级:瘤体及周边可见血流信号,血流信号呈稀疏星点状;Ⅱ级:肿瘤体内及其周边线状血流信号≥3条;Ⅲ级:瘤体内及其周边可见秘技彩色血流信号。并记录肝脏血管内侵袭情况和彩色血流特点,测定体内血流阻力指数(RI)。
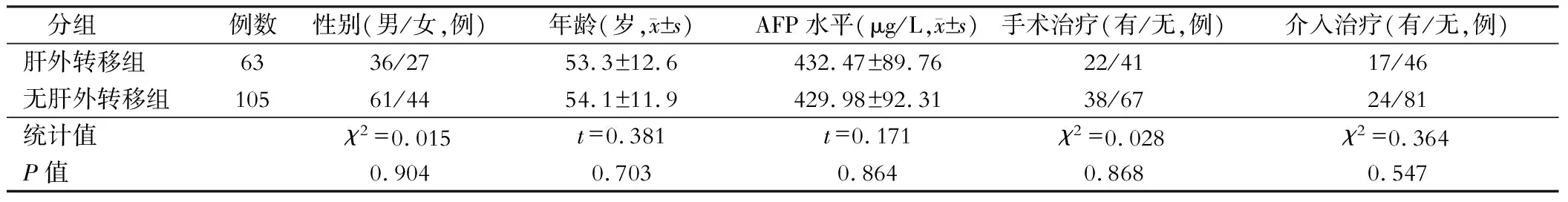
表1 两组患者的一般资料对比
四、统计学方法
结 果
一、两组患者的KRAS突变情况
168例肝癌患者中,36例患者发生KRAS基因突变,均为肝外转移组患者,基因突变率为57.14%(36/63),无肝外转移组患者KRAS基因突变率为0,差异有统计学意义(χ2=76.364,P<0.05)。
二、KRAS蛋白高表达与低表达患者的超声特征比较
将36例KRAS基因突变的原发性肝癌患者根据KRAS蛋白表达水平再次分组,结果显示,KRAS高表达组与KRAS低表达组对比,除肿瘤大小差异无统计学意义(P>0.05)外,肿瘤结节个数、肿瘤包膜、血流分级Ⅲ级及血管侵袭等,差异均有统计学意义(均P<0.05)。见表2。

表2 KRAS高表达与低表达组超声特征比较[例(%)]
三、KRAS蛋白表达和肿瘤结节数与RI的关系
KRAS蛋白高表达组RI为1.36±0.14,高于KRAS蛋白低表达组的0.58±0.07,肿瘤结节数≥2的14例患者RI为1.08±0.09,肿瘤结节数为1个患者的RI为0.57±0.05,差异有统计学意义(t=18.725、21.897,P<0.05)。
四、 超声特征参数与肝癌组织中KRAS蛋白表达水平的相关性分析
logstic二元回归分析结果显示,肝癌组织中KRAS蛋白的表达水平与肿瘤结节个数、肿瘤包膜、血流分级、血管侵袭情况及RI等超声参数均显著相关。KRAS蛋白的表达水平越高,肿瘤的包膜形成减少,肿瘤结节个数越多,血管侵袭情况越严重,血流分级和RI值越高。见表3。

表3 超声特征参数与肝癌组织中KRAS蛋白的表达水平的相关性分析
讨 论
RAS基因是一种细胞内信号传导蛋白类原癌基因,其表达蛋白位于细胞膜内侧,是一种GTP/GDP结合蛋白,在EGFR信号通路中具有重要的调控作用[9-11]。RAS蛋白可作为分子开关调控信号传递至细胞内。目前已知与人类肿瘤相关的特征性RAS基因包含HRAS、NRAS和KRAS 3种。一旦基因发生突变,RAS会相应的出现异常活化,继而对细胞生长和生化过程起到促进作用,引发肿瘤[12]。突变的RAS癌基因种类与肿瘤类型存在一定的联系,如HRAS基因突变多见于泌尿系统肿瘤,NRAS基因突变在造血系统肿瘤中更为常见,KRAS基因突变则在结直肠癌、肺癌、胰腺癌及呼吸道肿瘤中更为常见。KRAS的肝脏特异性突变可直接引发肝细胞癌和肝内胆管癌[13, 14]。且NCCN也明确指出,KRAS基因状态可作为预测EGFR单抗靶向药疗效的良好指标。KRAS基因突变虽可使抗EGFR药物治疗失去效果,但KRAS基因突变患者却仍有从索拉非尼治疗中取得临床获益的可能,因此,评估肝癌患者KRAS基因突变情况具有重要的意义。本研究168例肝癌患者中共检出36例患者KRAS基因突变,伴肝外转移组患者KRAS基因突变率高于无肝外转移组患者,表明KRAS基因突变与肝癌伴肝外转移显著相关,与尹小兰等[15]研究结论基本一致。
本研究还发现,KRAS蛋白在肿瘤结节数≥2个、肿瘤包膜(-)、血流分级Ⅲ级及血管侵袭情况(+)的患者中表达水平较肿瘤结节数1个、肿瘤包膜(+)、血管侵袭情况(-)及血流分级Ⅰ、Ⅱ级的患者明显偏高。有研究显示,瘤体的超声血流系数可能与肿瘤的部分基本生物学特征存在相关性[16]。研究发现肝癌组织中KRAS蛋白的表达水平与肿瘤结节数、肿瘤包膜、血流分级、血管侵袭情况均显著相关。KRAS蛋白的表达水平越高,肿瘤的包膜形成减少,肿瘤结节数越多,血管侵袭情况越严重。表明KRAS基因可能参与了肝癌瘤体血管形成过程。
RI可用于评价动脉血流阻力,不会受到测量方位及测量角度的影响,因此,其测量值可有效反映真实情况。本研究结果提示,肝肿瘤结节数量越多,RI值也越高。分析其原因在于肿瘤的肝内转移增加,导致血供需求增加,进而使得肝动脉的血管直径和最大流速也随之升高,血管分支数量增加,走向异常,动脉血流收缩和波动性增强。由于肿瘤瘤体内的供应血管管壁无平滑肌,且弹性不佳,再加上肿瘤假包膜的破坏、门静脉癌栓及动静脉瘘生成,导致肿瘤内血管形成窦腔,舒张末期血流速度减慢,致使RI升高。本研究还发现RI值与KRAS基因表达显著相关,KRAS基因表达水平随RI值升高而增加。
综上所述,发生KRAS基因突变的肝癌患者KRAS基因表达与其淋巴结转移和多普勒超声影像特征显著相关,分析肝癌患者的KRAS基因突变情况联合术前超声多普勒超声可有效提高临床对肝癌的诊断效率,指导临床选择更为合理的治疗方案。本研究仍存在一定的不足之处,如纳入的患者样本量较小,未在肝癌疾病治疗前检测KRAS基因突变情况,对其靶向治疗的临床价值加以明确,今后仍需进一步扩大化的中心试验深入探索。
利益冲突声明:所有作者均声明不存在利益冲突。
