原发性肝脏肉瘤3例超声造影特征及病理分析并文献复习
2023-01-13臧加伟李丽陈晓谭碧星
臧加伟 李丽 陈晓 谭碧星
作者单位:050000 石家庄 河北省人民医院超声科
原发性肝脏肉瘤(primary liver sarcoma, PLS)是一种罕见的恶性间叶源性肿瘤,以小儿及50~60岁多见,约占全部肝肿瘤的0.1%至2%[1-2]。PLS的临床症状和体征缺乏特异性[1-2],肿瘤标志物一般也为阴性。而 PLS病理涉及种类繁多,影像表现极其复杂,且此类肿瘤与肝脏上皮源性肿瘤的影像表现也互有重叠,因此术前误诊率极高。本研究通过回顾性分析3例PLS的二维超声及超声造影(contrast-enhanced ultrasound,CEUS)表现,并结合病理进行分析,探讨PLS的二维超声及CEUS表现特征,并复习相关文献,旨在提高对该病的认识,同时为临床制定诊疗方案提供依据。
资料与方法
一、病例资料
回顾性分析2019年12月—2021年6月河北省人民医院2例经手术及1例经组织学穿刺病理证实PLS患者的临床及病理资料,包括年龄、性别、肝炎病史、临床表现、肝功能、肿瘤标记物、病理及免疫组化;3例均行二维超声及CEUS检查并分析图像特征及增强模式。
二、检查方法
3例患者均采用Philips EPIQ7诊断仪,常规二维灰阶及彩色多普勒及能量超声扫查肝脏,观察病灶的部位、大小、边界、形态、内部回声、数目和血供特征;选择典型病灶最佳扫查切面,进入造影条件,造影剂为SonoVue(Bracco公司), 肘静脉注射1.2 mL,分别于动脉期(8~30 s)、门脉期(31~120 s)及延迟期(121 s以后)采集图像并分析增强模式。
结 果
一、临床特征
3例患者均为男性,中位年龄55(52~58)岁。皆因上腹部疼痛或不适感入院,仅1例患者有乙型肝炎合并丙型肝炎病史,AFP轻度增高,为8.4 ng/mL,CA19-9 增高,为104.9 ng/mL,但肝功能正常;其余2例均无肝炎病史,且肿瘤标记物均正常,但其中1例AST轻度升高(见表1)。
二、二维超声及超声造影表现
3例患者中2例病灶为单发,位于肝右叶,最大径分别约为19 cm、10 cm,1例病灶为多发,较大者位于肝右叶,最大径约为9 cm。3例PLS二维超声表现为类圆形或不规则形混合回声团,呈膨胀性生长,界限清楚;彩色多普勒周边可见少许血流信号。3例PLS的CEUS动脉期病灶均表现为边界清晰,有包膜,其中2例呈不均匀稍高或高增强,内部呈“火焰”征,1例周边呈高增强;中心伴大部囊变坏死及出血,呈无增强。病灶门脉期开始缓慢廓清,呈低增强,整体廓清较肝转移瘤(LM)速度慢、程度低,始终未呈“黑洞”征(见表1、图1)。
三、病理结果
3例患者中2例经手术及1例经组织学穿刺病理证实为PLS。病理诊断:1例为低度恶性黏液炎症性纤维母细胞肉瘤,免疫组化:CKpan(-),Vimentin(+),S100(-)。1例为癌肉瘤(肝细胞癌Ⅲ级+癌肉瘤+梭形细胞肉瘤),免疫组化:肝细胞癌:CKpan(+),HepPar-1(灶状+),CD34(显示毛细血管化),GPC3(灶状+);癌肉瘤:CKpan(+),Vimentin(+);肉瘤:CKpan(-),Vimentin(+)。1例为高级别肌纤维母细胞肉瘤,免疫组化:CKpan(-),Vimentin(+),Desmin(+),SMA(部分+),S100(-)。见表1、图2。
讨 论
PLS是一种起源于肝脏血管、淋巴管、肌肉、脂肪、纤维等间叶组织的罕见的恶性肿瘤[1- 2],种类繁多,包括:血管肉瘤(AS)、平滑肌肉瘤(LMS)、未分化胚胎肉瘤(UES)、上皮样血管内皮瘤(EHH)、恶性纤维组织细胞瘤(MFH)、癌肉瘤(CS)等[1-7]。根据组织来源可将PLS分为血管源性肉瘤及非血管源性肉瘤两类[6]。PLS的发病机制仍不清楚,有研究表明暴露于硫酸盐[1- 2]、氯乙烯、砷和使用雄性激素[5]可能是其危险因素。
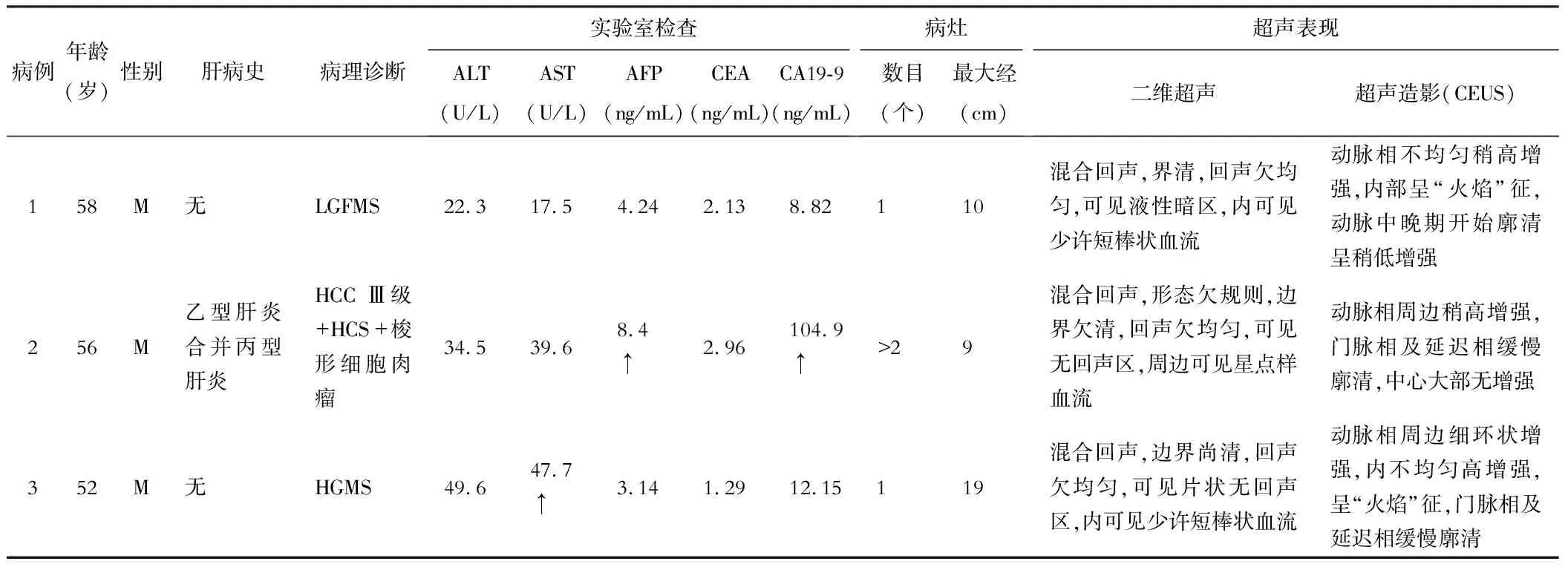
表1 临床特征及二维超声及超声造影表现

A:病例2 HCS,二维超声示肝右叶混合回声团,周边少许血流,CEUS:动脉期呈环形增强,门脉期及延迟期缓慢廓清,中心伴出血呈无增强;B:病例3 HGMS,二维超声示肝右叶混合回声团,周边散在血流,CEUS:动脉期呈不均匀高增强,内部呈“火焰”征,门脉期及延迟期逐渐减退本组3例分别为低度恶性黏液炎症性纤维母细胞肉瘤(LGFMS)、癌肉瘤(hepatic carcinosarcoma, HCS)、高级别肌纤维母细胞肉瘤(HGMS)。
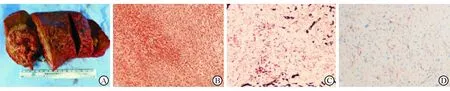
A:HCS,大体标本图,肝内肿物切面呈灰黄灰红,局部质糟脆,伴有坏死出血;B:HCS、LGFMS、HGMS均Vimentin染色(+)(×200);C:HCS,CKpan染色(+)(×200);D:HGMS,SMA染色(部分+)(×200)
由于PLS极为罕见,临床症状隐匿,无特异性,可表现为腹痛、可触及肿块、发热、出血/破裂和体质量减轻[1-7],且缺乏特异性肿瘤标志物,无明显乙型肝炎和(或)丙型肝炎病史相关性,影像表现各异,因此给PLS的早期诊断带来一定困难,通常发现时已是晚期[1-2]。本组3例患者均仅表现为右上腹不适、疼痛,而1例AST轻度升高,可能是由于肿瘤体积较大而使肝功能受损所致。此外,1例HCS AFP轻度升高及CA199升高,伴乙型肝炎合并丙型肝炎病史,可能与肉瘤成分来源于肝细胞或胆管上皮细胞有关[8]。
本组3例PLS的二维超声特点为:单发的、体积巨大的类圆形或不规则形混合回声团,呈膨胀性生长,界限清楚;彩色多普勒可见少许血流信号。这与其内部成分构成相关,肿瘤恶性程度高,生长速度快,多为囊实性,实性成分多位于肿瘤边缘,囊性成分由厚薄不均的不规则软组织分隔,且与囊壁实性成分相延续[9],因此PLS二维超声多表现为边界清楚、回声不均匀的巨大肿块。
PLS的CEUS表现总结为以下几点:①病灶多边界清晰,有包膜;②病灶实性部分或周边动脉期呈不均匀稍高或高增强,内部呈“火焰”征;③病灶内伴有大部囊变、坏死或出血时,中心可呈无增强;④病灶门脉期开始缓慢廓清,呈低增强,整体廓清较LM速度慢、程度低,始终未呈“黑洞”征。CEUS特征中,病灶边界清晰与肿瘤体积巨大挤压周围组织所致边缘致密,或周围肝组织纤维大量增生而形成假包膜有关;肿瘤内部动脉期表现为索条或纤维间隔样强化[9],呈“火焰”征,可能是因为肿瘤外周实质延续的向心性纤维样分隔呈放射状分布,其内伴行有肿瘤血管,造影微泡动脉期快速灌注所致;而病灶内增强不均匀或存在无增强区,这与肿瘤内部存在由外周实质向心延续的纤维间隔、肿瘤细胞生长速度不一致导致的局部缺血坏死液化、出血或存在黏液基质等多种原因有关,本组病例中LGFMS伴粘液样变,HCS伴出血,HGMS伴囊变坏死;病灶门脉期开始缓慢廓清,呈低增强,整体廓清较LM速度慢、程度低,始终未呈“黑洞”征,这与肿瘤内血管走行迂曲,静脉管径小、密度低,缺乏回流的淋巴网等,或者存在大量癌栓导致造影剂滞留在肿块微血管床内有关。HCS中包含癌与肉瘤2种成分,影像学上因两者所占比例不同呈现多种表现,造影表现与肿瘤内肉瘤样变的程度密切相关,文献研究显示[10],尤其是在超声造影动脉期,部分肉瘤样变者呈整体高增强,完全肉瘤样变者呈环状高增强,本组病例中HCS属于完全肉瘤样变。
虽然PLS的CEUS有一定的特征性,但诊断的金标准仍是病理学检查。PLS病理切面多呈鱼肉样;镜下,肉瘤大多不成巢,弥漫生长,与间质分界不清,间质的结缔组织一般较少,而血管常较丰富,故肉瘤多经血道转移。PLS免疫组化中波形蛋白(Vimentin)、结蛋白(Desmin)和平滑肌肌动蛋白(SMA)阳性,而细胞角蛋白(CK)、S100蛋白和神经元特异性烯醇化酶(NSE)阴性[11]。本组病例中,间叶性肿瘤标志物Vimentin均呈阳性。但由于PLS组织来源不同,肿瘤细胞分化呈现多样性,内部成分也有所不同。其中,LGFMS存在具有中至低细胞结构的纤维和粘液区域[12],Vimentin多呈阳性。HCS组织学包含癌和肉瘤两种成分,多数情况下,肿瘤呈巨块状,其中心常伴坏死和出血,而外周为具有纤维基质的存活的癌组织[13],因此,上皮性肿瘤标志物CK、上皮膜抗原(EMA)与Vimentin同时呈阳性。HGMS是由梭形肿瘤细胞组成,大部分梭形细胞异形性明显,细胞质界限不清,以Vimentin、肌动蛋白(Actin)、α-SMA和/或Desmin呈阳性为主[14]。此外,高分子量的钙调素结合蛋白的缺失也是HGMS的特异性表现,据此可以与平滑肌肿瘤相鉴别。
PLS超声造影有其特点,但仍需与以下疾病相鉴别:①巨块型肝癌,病灶多以实性成分为主,囊性坏死区多位于中心,多伴乙型肝炎或丙型肝炎病史,AFP升高,CEUS增强模式呈“快进快出”,可伴癌栓形成。②肿块型胆管细胞癌(IMCC),多伴黄疸等胆道梗阻症状,常见肝包膜回缩、“靶状”外观和周围胆管扩张,CA199升高,CEUS呈边缘轻度强化,中心无或有轻度分隔,廓清速度较快。③肝脓肿,临床表现右上腹疼痛、高热寒战、白细胞增高,CEUS多呈厚环状不均匀高增强,内部呈“蜂窝状”或“分隔状”,且脓肿壁多持续强化,廓清缓慢。④肝肉瘤样癌(HSC),HSC与HCS均含有癌和肉瘤两种成分,可能伴肝硬化病史,AFP及CA199升高,CEUS表现与肿瘤内肉瘤样变程度有关。⑤LM,多表现为肝内多发大小不等结节或团块,呈“牛眼”征或“空泡”征,受原发肿瘤病理及血供的不同灌注增强表现较复杂,由于LM血供来源于肝动脉,基本无门静脉参与供血,动脉期早期迅速增强,形状均匀或呈环状,典型者表现为厚环样增强,门脉期及延迟期病灶增强迅速消退,呈“黑洞”征。
PLS具有异质性和可变性[1-2],且生长迅速,通常预后不佳[2-3]。目前,相关文献很少,且证据水平较低,对这类肿瘤的治疗选择尚无共识。在这种情况下,PLS总平均生存期为2~23个月,5年生存率在0~64%之间,平均21%, R0切除术,即完全性手术切除手术是唯一的治疗方法[3- 4]。相关研究无法确定系统使用化疗或放疗的有效性[2-4],早期诊断和治疗至关重要。
综上所述, 超声造影在PLS的诊断中具有良好的特征性表现,可为临床诊断提供依据,提高诊断的准确性,避免漏诊或误诊,延误治疗。但本文的局限性主要是病例数较少。下一步研究需增加样本量,进一步探讨超声造影在不同病理类型的PLS的应用价值,并根据研究结果不断优化PLS的造影增强模式,使其诊断效能显著提高。
利益冲突声明:所有作者均声明不存在利益冲突。
