一种新型糖苷水解酶的异源表达及酶学性质研究
2023-01-12徐龙威雍婕周海燕
徐龙威,雍婕,周海燕
一种新型糖苷水解酶的异源表达及酶学性质研究
徐龙威,雍婕,周海燕*
(湖南农业大学生物科学技术学院,湖南 长沙 410128)
为得到MtGH6最优的表达宿主,构建了质粒pET21a–MtGH6、pBES–MtGH6、pPICZαA–MtGH6,以大肠埃希菌BL21、枯草芽孢杆菌RIK1285及毕赤酵母GS115为工程菌,对MtGH6进行异源表达及分离纯化,并对表达MtGH6的3个宿主菌的生长状况、产酶量、纯化回收率、酶活力等参数进行比较分析。结果表明:大肠埃希菌BL21及枯草芽孢杆菌RIK1285在生长稳定后,OD值维持在1.5,而毕赤酵母GS115生长稳定后,OD值维持在2.0;毕赤酵母GS115生产的MtGH6为77 mg/L,纯化回收率为15.40%,产酶量和纯化回收率均高于大肠埃希菌BL21、枯草芽孢杆菌RIK1285生产的MtGH6;由毕赤酵母GS115表达的MtGH6的酶活力为15.60 U/mg,由大肠埃希菌BL21及枯草芽孢杆菌RIK1285表达的MtGH6分别为7.45、10.06 U/mg,说明毕赤酵母GS115是MtGH6的最优表达宿主;对其分泌的MtGH6的酶学性质展开研究,结果表明在降解微晶纤维素的反应中,该酶最适pH为8.0,最适温度为60 ℃,添加0.5 mmol/L Mn2+可使其活性提高,表明MtGH6在生物燃料生产中可能具有良好的应用前景。
糖苷水解酶;异源表达;宿主菌;酶学性质
农业的快速发展产生了大量的农业废弃物,如玉米纤维、玉米秸秆、甘蔗渣、稻壳等[1]。木质纤维素作为植物细胞壁的主要成分(占生物量的50%左右)在农业废弃物中占有较大的比重[2];因此,如何回收木质纤维素,值得社会的广泛关注。木质纤维素通过预处理可以得到纤维素,而纤维素可进一步通过酸法、碱法、酶法转化为糖类[3];糖经过发酵可最终转化为生物乙醇,故木质纤维素的回收利用可用于生物质的能源开发[4];而生物酶法相较于酸法和碱法对于环境污染的破坏最小,是值得提倡的处理方法[5]。
在采用酶法预处理木质纤维素的研究中,存在2种类型的纤维素酶系统:一种是厌氧细菌(如热梭状芽孢杆菌)中被称为纤维素体的酶复合体,它由一种非酶支架蛋白组成,与各种酶亚基结合,协同降解纤维素和半纤维素,是一种复合纤维素酶系统[6];另一种是由丝状真菌和好氧细菌中的胞外纤维素酶组成的非复合纤维素酶系统,也可协同降解纤维素[7],常用于工业。
通过理性及非理性蛋白质设计技术挖掘并开发具有工业应用潜力的新型纤维素酶一直是研究的热点[8]。选取合适的宿主菌进行蛋白异源表达非常重要。本研究中,以MtGH6为目标蛋白,在大肠埃希菌、枯草芽孢杆菌、毕赤酵母3种不同宿主菌中对MtGH6进行异源表达,比较分析不同宿主在表达MtGH6时的生长状况、产酶量、纯化回收率、酶活力等参数,以确定此异源蛋白的最优表达宿主,旨在为纤维素酶MtGH6的工业化应用提供理论依据。
1 材料及方法
1.1 材料
pET21a–MtGH6、pBES–MtGH6的质粒和枯草芽孢杆菌RIK1285由中国科学院微生物研究所吴边组惠赠;质粒pPICZαA–MtGH6、大肠埃希菌Top10、大肠埃希菌BL21、毕赤酵母GS115由湖南农业大学生物工程研究所提供;LB培养基为大肠埃希菌培养基;含有3种氨基酸(色氨酸、蛋氨酸、赖氨酸)的TB培养基为枯草芽孢杆菌培养基;YPD培养基、BMGY培养基、BMMY培养基为常用毕赤酵母培养基。基因克隆所用引物见表1。

表1 PCR所用引物
1.2 方法
1.2.1目标酶基因在宿主菌中的转化与鉴定
1) 携带质粒pET21a–MtGH6的大肠埃希菌BL21的转化与鉴定。将质粒pET21a–MtGH6转入Top10商业感受态细胞中进行克隆,涂布于含有氨苄青霉素的LB平板中过夜培养,筛选阳性克隆,用试剂盒提取质粒后,导入大肠埃希菌BL21中。引物pET21a–MtGH6–F及pET21a–MtGH6–R用于菌落PCR验证。
2) 携带质粒pBES–MtGH6的枯草芽孢杆菌RIK1285的转化与鉴定。采用平板划线法活化枯草芽孢杆菌RIK1285,挑取单克隆至2 mL1×MC培养基中,37 ℃、220 r/min培养5 h,将400 μL的培养基放入新的EP管中,加入5 μL的质粒pBES–MtGH6,在37 ℃、220 r/min条件下培养2 h,5000离心,收集沉淀,留100 μL混匀菌体,涂布于含有卡那霉素的LB平板中,得到携带质粒pBES–MtGH6的枯草芽孢杆菌RIK1285。引物pBES–MtGH6–F及pBES–MtGH6–R用于菌落PCR验证。
3)携带质粒pPICZαA–MtGH6的毕赤酵母GS115的转化与鉴定。通过引物pPICZαA–F和pPICZαA–R克隆载体pPICZαA,再经引物pPICZαA–MtGH6–F和pPICZαA–MtGH6–R克隆MtGH6编码基因,回收获得的基因片段,使用RI及I酶切回收的基因片段,将酶切产物连接后得到重组质粒pPICZαA–MtGH6,再转入Top10感受态细胞中。使用含有博莱霉素的LB平板筛选阳性克隆并测序。检测无误后,将质粒pPICZαA–MtGH6导入毕赤酵母细胞中。引物pPICZαA–F和pPICZαA–R用于菌落PCR验证。
1.2.2MtGH6粗酶的表达及分析
1) MtGH6粗酶在大肠埃希菌中的表达及分析。将携带表达载体pET21a–MtGH6的大肠埃希菌BL21(DE3)接种于LB培养基(含50 μg/mL氨苄青霉素)中,运用生长曲线仪测量其生长曲线,37 ℃下培养至OD600约0.8。此时,加入0.5 mmol/L的异丙基硫代–β–D半乳糖苷(IPTG),30 ℃下孵育48 h,诱导MtGH6的表达。离心(8000、10 min、4 ℃) 后收集细胞,在含有20 mmol/L Tris–HCl(pH 7.9)、500 mmol/L NaCl和20 mmol/L咪唑的缓冲液中冰冻超声裂解细胞。通过离心(14 000,30 min,4 ℃)和过滤(0.22 μm Filter,Millex),除去沉淀物,得到细胞提取液,收集上清液,得到粗酶。使用Bradford法测量其蛋白浓度,计算其产酶量。
2) MtGH6粗酶在枯草芽孢RIK1285中的表达及分析。将携带表达载体pBES–MtGH6 的枯草芽孢杆菌RIK1285接种于含有色氨酸、蛋氨酸、赖氨酸及卡那霉素的TB培养基中,运用生长曲线仪测量其生长曲线;30 ℃下孵育48 h,180 r/min离心,收集上清液,往上清液中添加无水CaCl2至10 g/L,沉淀磷酸盐,调pH至7.5,离心(6500、20 min、4 ℃)后收集上清液,缓慢加入硫酸铵至饱和度达100%,离心回收沉淀,80%丙酮3次洗涤沉淀, Tris–HCl 缓冲液(pH 7.9)重悬沉淀,0.22 μm滤膜过滤,得到粗酶。采用Bradford法测量其蛋白浓度,计算其产酶量。
3) MtGH6粗酶在毕赤酵母GS115中的表达及分析。将携带pPICZαA–MtGH6质粒的毕赤酵母GS115接种于5 mL YPD培养基,30 ℃、250 r/min培养12 h,取1 mL培养液转至50 mL BMGY培养基;30 ℃、250 r/min培养24 h,离心收集菌体,转接于含1.5%甲醇的50 mL BMMY培养基,运用生长曲线仪测量其生长曲线,30 ℃、250 r/min再培养84 h后离心分离菌泥与上清液;在上清液中缓慢加入硫酸铵至饱和度达100%,离心收集沉淀后对沉淀物进行透析。收集透析袋内的液体,0.22 μm滤膜过滤,得到粗酶。采用Bradford法测量其蛋白浓度,计算其产酶量。
1.2.3重组蛋白MtGH6的纯化
将MtGH6粗酶添加至含有镍离子填料的层析柱中(His Tagged Protein Purification Kit,康为世纪),用50 mL 结合缓冲液 A(含有20 mmol/L Tris–HCl (pH 7.9)、500 mmol/L NaCl、40 mmol/L咪唑)洗涤,以20 mmol/L Tris–HCl (pH 7.9)、500 mmol/L NaCl和200 mmol/L咪唑作为洗脱缓冲液。选取质量分数为15%的蛋白胶,采用SDS–PAGE法鉴定纯化效果,Bradford法测量其蛋白浓度,计算MtGH6的回收率。
1.2.4不同宿主菌生产的MtGH6的酶活性比较
在含有10 mg/mL微晶纤维素的20 mmol/L Tris–HCl缓冲液(pH 7.9)中加入0.1 mL的MtGH6,60 ℃下孵育10 min后,加入1.5倍体积的DNS试剂终止反应,混合物煮沸5 min后测量OD540。纤维素外切酶活性的单位(U)定义为以微晶纤维素为底物,每分钟释放1 μmol还原糖的酶的量。
1.2.5MtGH6的酶学性质研究
1) pH和温度对MtGH6的影响。为研究温度对酶活力的影响,在20~90 ℃的温度范围内以10 ℃为1个温度梯度,测定MtGH6在不同温度下的酶活力。为研究pH对MtGH6酶活性的影响,配置了4种不同pH值的反应底物缓冲液:pH 4.0~6.0 的柠檬酸盐缓冲液、pH 6.0~8.0 的磷酸盐缓冲液、pH 7.0~9.0 的Tris–HCl缓冲液、pH 8.0~10.0 的甘氨酸–氢氧化钠缓冲液。在不同pH值的反应体系下,分别测定MtGH6的酶活性。
2) 金属离子对MtGH6的影响。在反应溶液中分别加入0.5 mmol/L 的MgCl2、CaCl2、MnCl2、FeCl3、CoCl2、ZnCl2、BaCl2,研究不同金属离子对MtGH6活性的影响,以未添加金属离子的样品为对照,测定其相对酶活力。
3) MtGH6的动力学分析。在最适反应条件下,测定不同质量浓度微晶纤维素(2~16 mg/mL)对酶催化效率的影响,以此来计算动力学参数。
1.3 数据分析
采用英国UVItec的凝胶成像系统拍摄核酸及蛋白电泳图;采用芬兰百奥斯科林公司的生长曲线仪FP–1100–C记录大肠埃希菌BL21、枯草芽孢杆菌RIK1285、毕赤酵母GS115的生物量变化;采用赛默飞世尔科技公司的多功能酶标仪Varioskan LUX计算酶浓度及还原糖的变化;采用Origin 2018 64Bit进行数据分析;采用Office 2019绘图。
2 结果与分析
2.1 MtGH6在BL21、RIK1285、GS115中的转化与鉴定结果
质粒pET21a–MtGH6、pBES–MtGH6、pPICZαA–MtGH6的各个转录元件见图1。运用NCBI网站中的Blast功能进行多序列比对,比对结果符合理论设计,分别导入BL21、RIK1285、GS115中,菌落PCR结果(图2)显示成功导入。
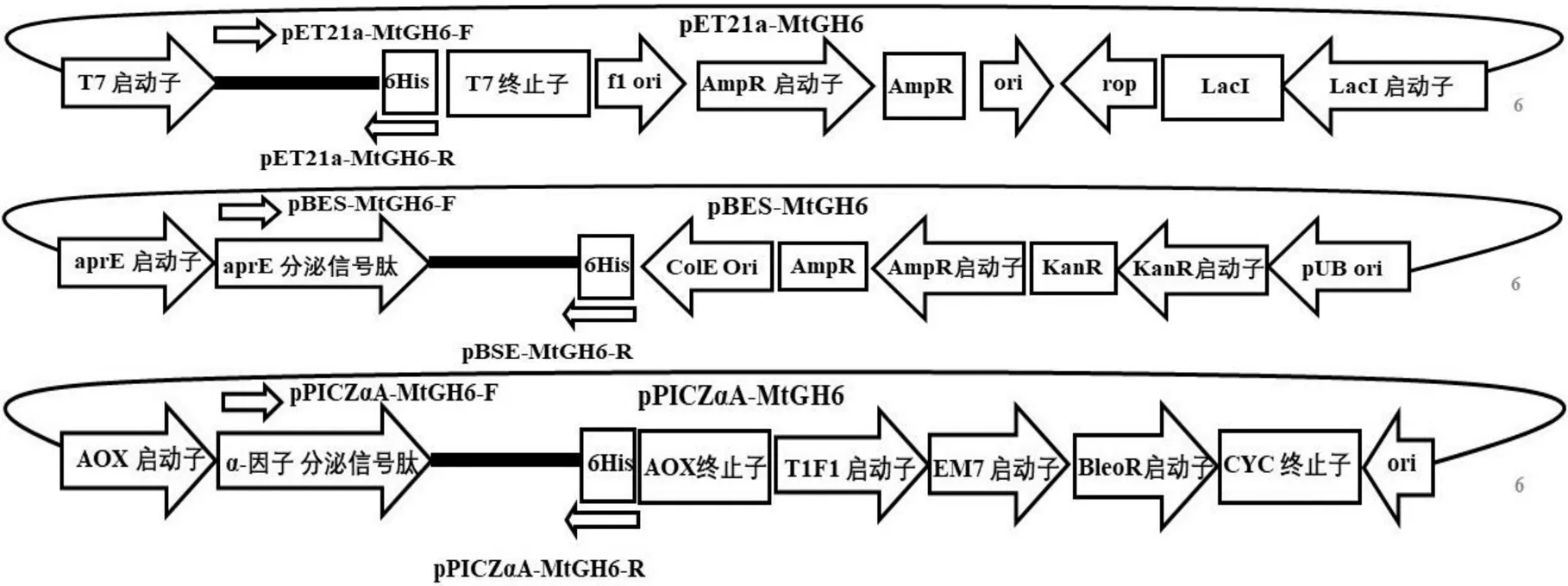
图1 pET21a–MtGH6、pBES–MtGH6及pPICZαA– MtGH6的质粒图谱
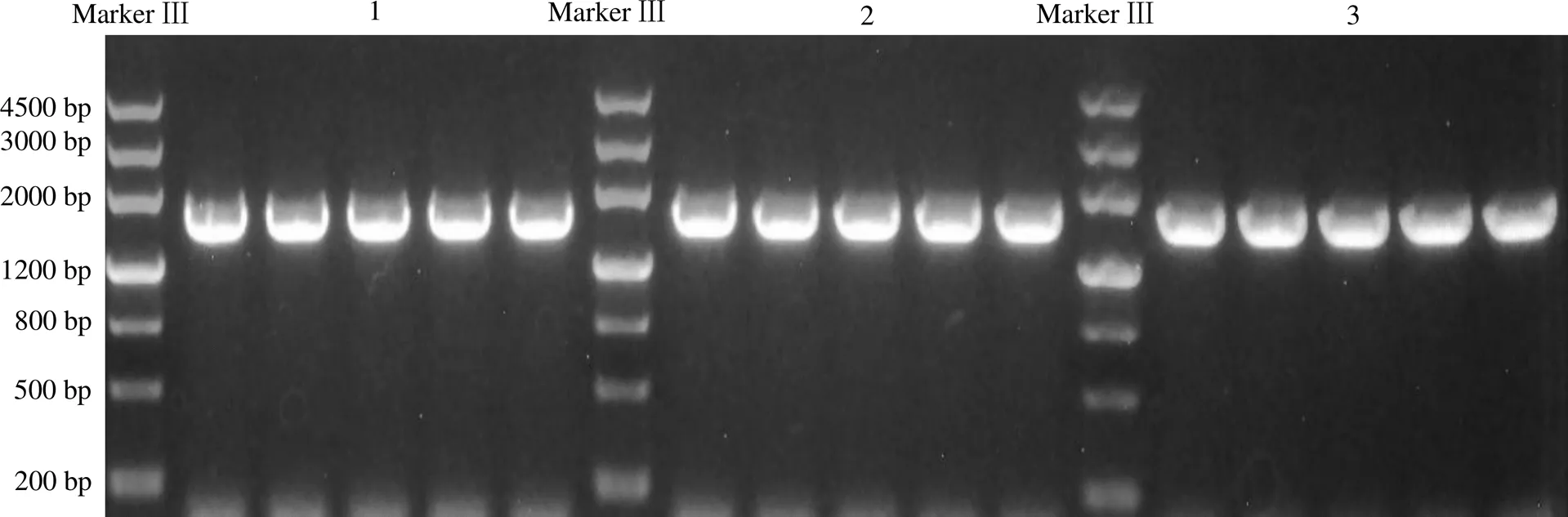
1 携带重组质粒pET21a–MtGH6的大肠埃希菌BL21菌落PCR结果;2 携带重组质粒pBES–MtGH6的枯草芽孢杆菌RIK1285菌落PCR结果;3 重组质粒pPICZαA–MtGH6的毕赤酵母GS115的菌落PCR结果。
2.2 重组蛋白MtGH6在大肠埃希菌BL21、枯草芽孢杆菌RIK1285、毕赤酵母GS115的表达
2.2.1大肠埃希菌BL21、枯草芽孢杆菌RIK1285、毕赤酵母GS115的生物量变化
使用生长曲线测序仪测得大肠埃希菌BL21、枯草芽孢杆菌RIK1285、毕赤酵母GS115的生长曲线。从生长曲线(图3)可以看出,大肠埃希菌BL21、枯草芽孢杆菌RIK1285在4 h后开始进入对数生长期,而后生物量维持稳定,OD600均为1.5;毕赤酵母在接种40 h后生物量又开始增加,再经过10 h后保持不变,OD600为2.0。
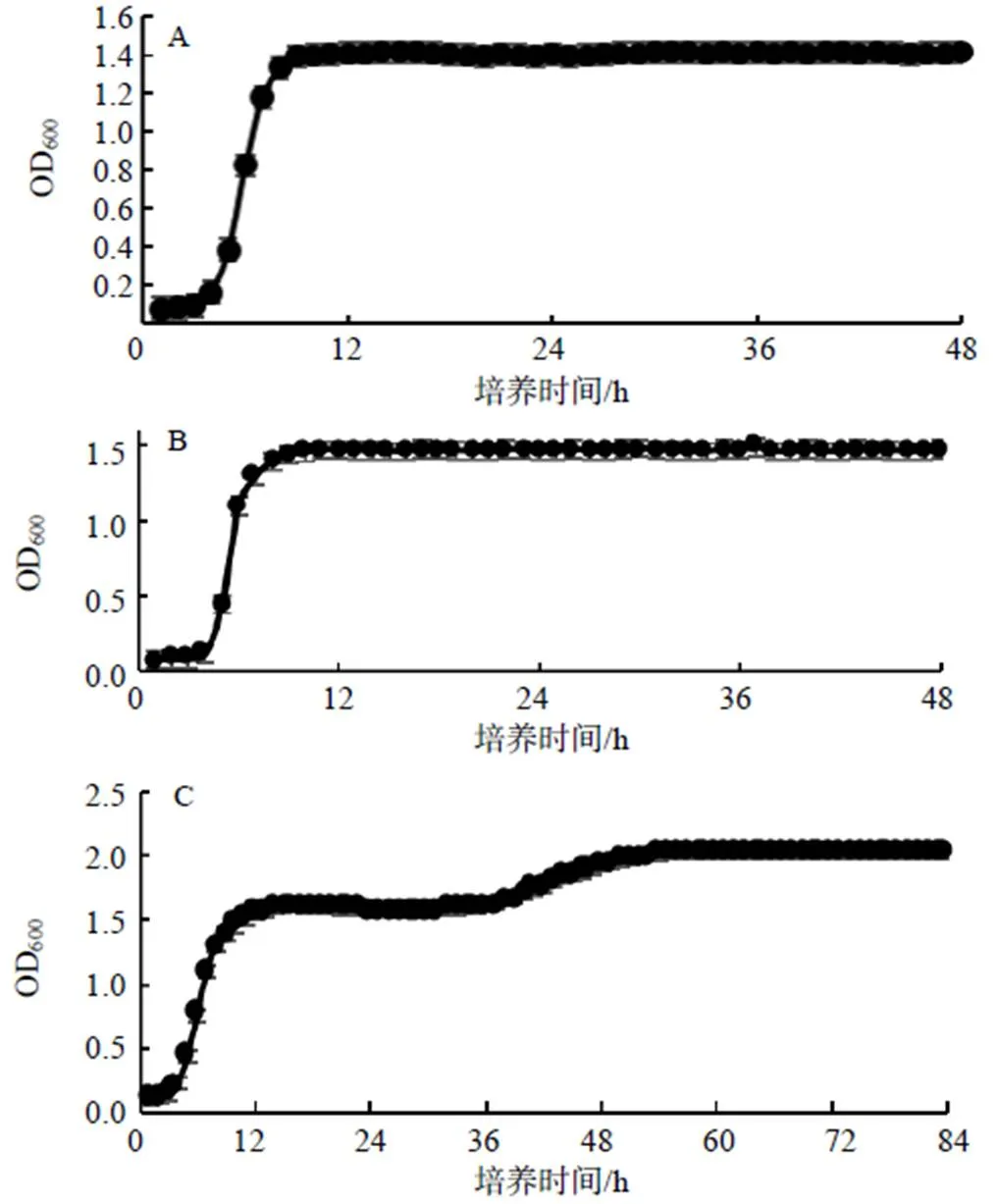
A 大肠埃希菌BL21的生长曲线;B 枯草芽孢杆菌RIK1285的生长曲线;C 毕赤酵母GS115的生长曲线。
2.2.2大肠埃希菌BL21、枯草芽孢杆菌RIK1285、毕赤酵母GS115生产的MtGH6粗酶的鉴定
使用大肠埃希菌BL21表达MtGH6,其启动子为T7强启动子,Lac乳糖操纵子元件添加诱导剂IPTG后可诱导蛋白的表达;超声法破碎后,离心得到粗酶,采用Bradford法测其浓度为2.70 mg/mL,体积为20 mL,总产酶量为54 mg。SDS–PAGE验证后发现,培养基上清液中无蛋白表达,而菌泥破碎后的上清液及沉淀中均有蛋白表达(图4–A)。究其原因,可能是破碎不够彻底,仍有部分蛋白存在于菌泥中;也有可能是蛋白质的错误折叠导致包涵体的形成。
以枯草芽孢杆菌RIK1285为表达宿主,收集上清液,盐析、洗涤后测得粗酶的质量浓度为1.53 mg/mL,体积为20 mL,总产酶量为30.6 mg。枯草芽孢杆菌RIK1285菌泥及上清盐析液的SDS–PAGE结果(图4–B)表明MtGH6只存在于上清中。究其原因可能是添加了信号肽aprE,使枯草芽孢杆菌RIK1285生产的蛋白向培养基中分泌。
毕赤酵母GS115表达MtGH6时,其启动子为AOX1,在甲醇的诱导下,生成了大量的MtGH6,将收集的上清液盐析并透析后,测得MtGH6的粗酶质量浓度为2.76 mg/mL,体积为20 mL,总产酶量为55.2 mg。从毕赤酵母GS115菌泥及培养基上清盐析液的SDS–PAGE结果(图4–C)可以看出,MtGH6以可溶的形式大量存在于上清中。究其原因可能是α因子信号肽使目标酶分泌于培养基中。
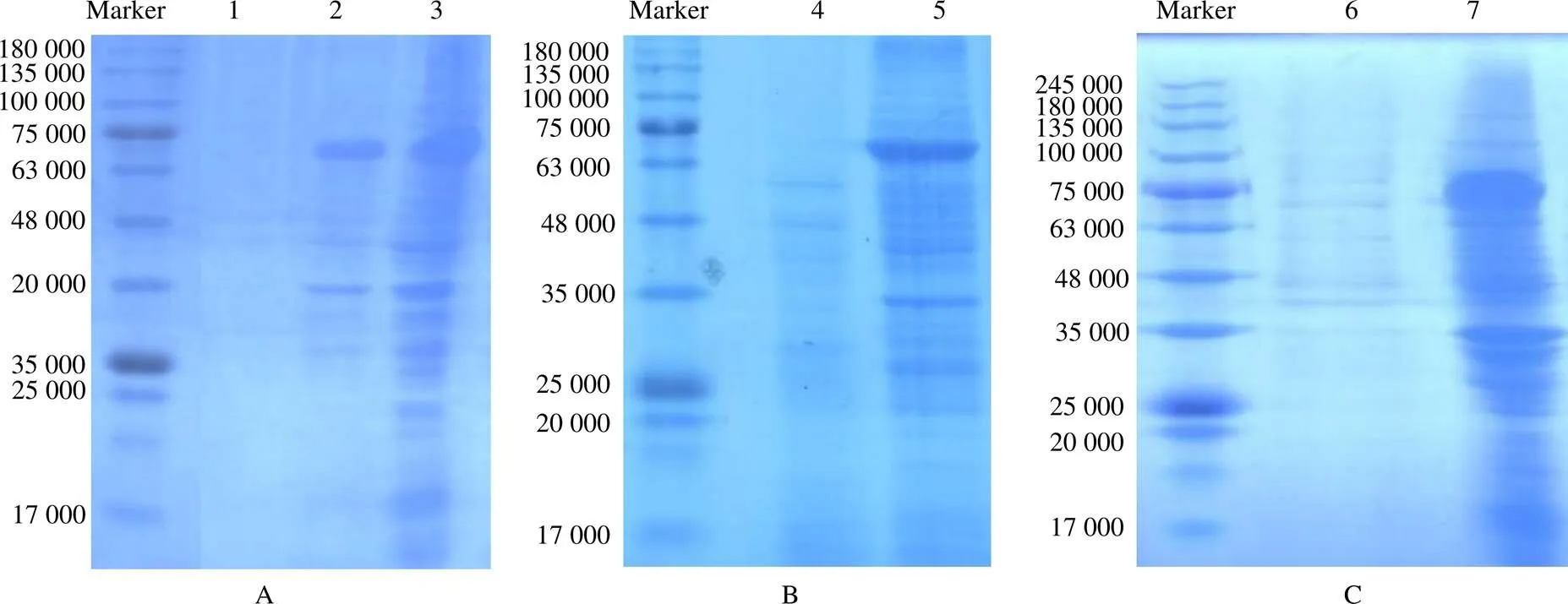
泳道1为大肠埃希菌BL21的培养基上清;泳道2为大肠埃希菌的破碎后沉淀;泳道3为大肠埃希菌BL21破碎后的上清;泳道4为枯草芽孢杆菌RIK1285的菌泥;泳道5为枯草芽孢杆菌RIK1285上清的盐析液;泳道6为毕赤酵母GS115的菌泥;泳道7为毕赤酵母GS115上清盐析后的透析液。
2.3 由大肠埃希菌BL21、枯草芽孢杆菌RIK1285、毕赤酵母GS115生产的MtGH6纯酶鉴定
从表2可以看出,毕赤酵母GS115生产的MtGH6为77 mg/L,大肠埃希菌BL21及枯草芽孢杆菌RIK1285生产的MtGH6分别为56、32 mg/L;毕赤酵母GS115生产的MtGH6回收率为15.40%,大肠埃希菌BL21及枯草芽孢杆菌RIK1285生产的MtGH6回收率分别为10.37%和10.45%。可见,毕赤酵母GS115生产的MtGH6的产量和纯化效率都较高。将得到的纯酶采用SDS–PAGE法鉴定,测得MtGH6的表观相对分子质量为68 000 (图5),与理论值相符。
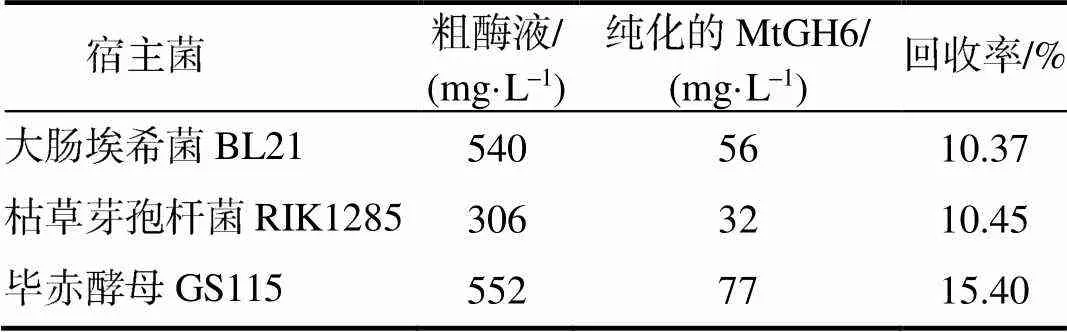
表2 MtGH6的纯化参数
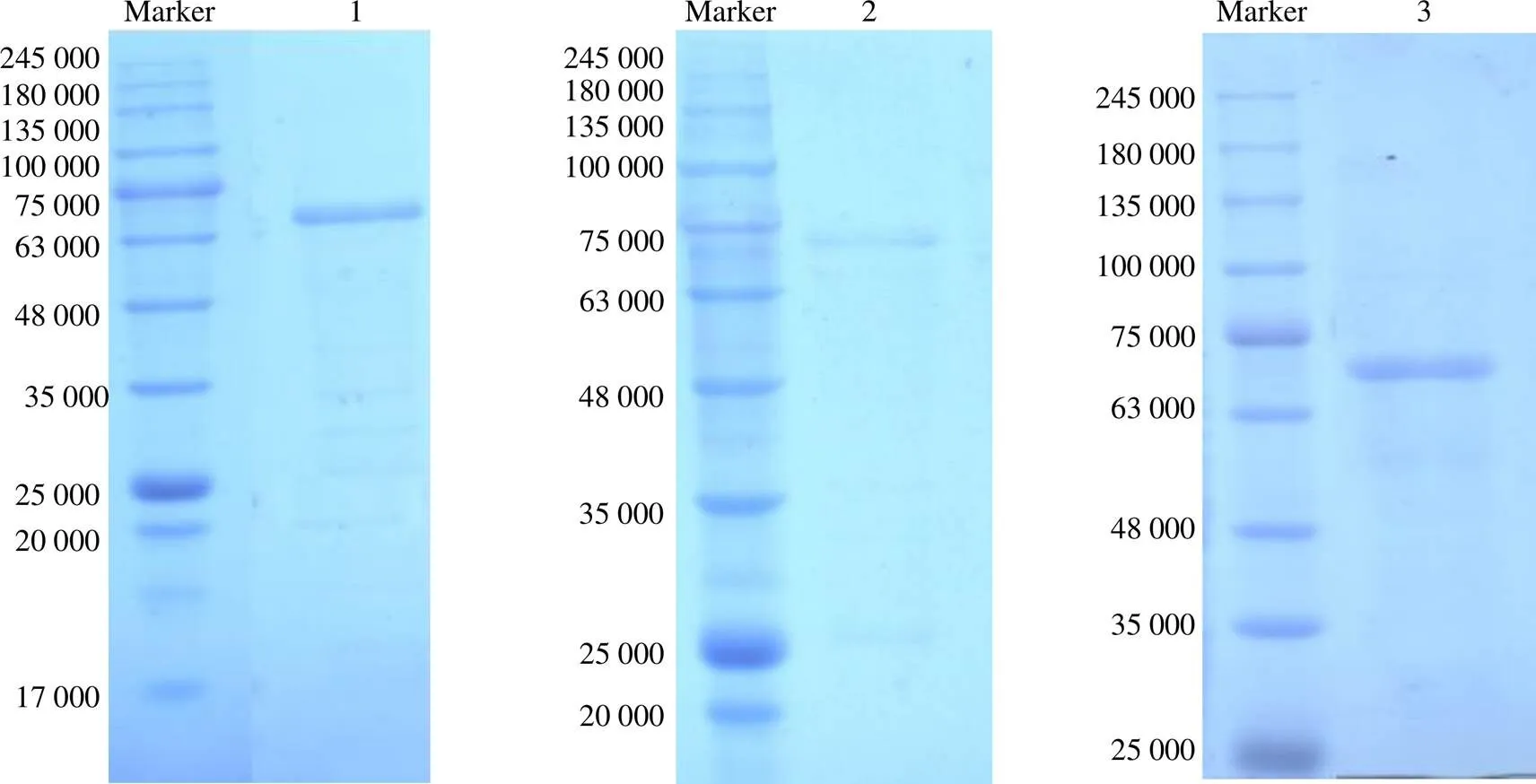
泳道1为大肠埃希菌BL21表达的MtGH6亲和层析分离结果;泳道2为枯草芽孢杆菌RIK1285表达的MtGH6亲和层析分离结果;泳道3为毕赤酵母GS115表达的MtGH6亲和层析分离结果。
2.4 由大肠埃希菌BL21、枯草芽孢杆菌RIK1285、毕赤酵母GS115生产的MtGH6酶活性比较
由于不同表达系统对于MtGH6的修饰及翻译过程不同,MtGH6在不同宿主中表达的酶活性也不一样。比较(图6)发现,毕赤酵母GS115生产的MtGH6降解微晶纤维素的酶活力最大,为15.60 U/mg,高于枯草芽胞杆菌RIK1285生产的MtGH6的酶活力(10.06 U/mg)及大肠埃希菌BL21生产的MtGH6的酶活力(7.45 U/mg)。不同宿主表达的MtGH6酶活力方差分析结果(表3)显示,值为5.80×10–6,检验统计量大于检验临界值Fcrit。说明3种单因素存在显著性差异,毕赤酵母GS115为MtGH6最优的表达宿主。

图6 不同宿主菌表达的MtGH6的酶活力

表3 来源于不同宿主的MtGH6酶活力的方差分析结果
2.5 MtGH6的酶学性质分析
MtGH6在不同温度下的催化速率如图7所示。从图7可以看出,其表观最适温度为60 ℃,在较宽的温度范围(50~70 ℃)下,相对酶活性仍高于60%。
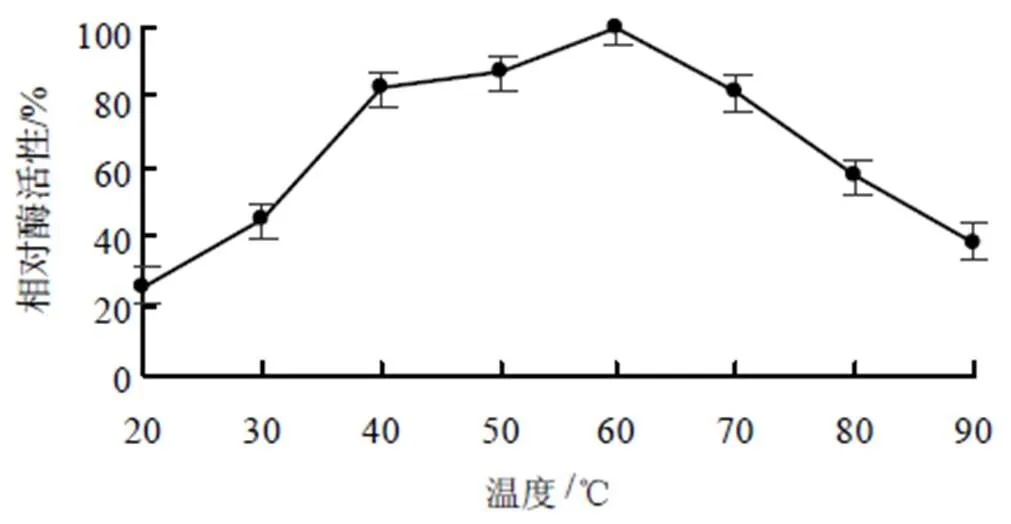
图7 不同温度下MtGH6的酶活性
从图8可以看出,在酸性环境下,MtGH6的酶活性较弱,随着pH值的下降,其酶活性也逐渐减小;其在pH 6~10范围内有着较好的稳定性和较高的酶活性,在pH为8的Tris–HCl缓冲液中MtGH6的酶活性最高。
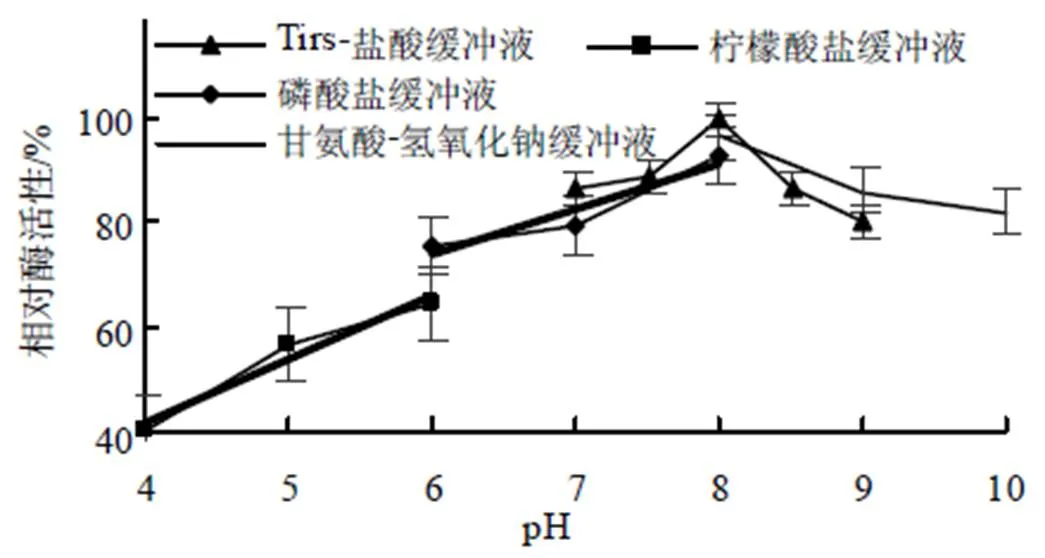
图8 不同pH条件下MtGH6的酶活性
酶残基与二价金属离子之间的配合可能会引起蛋白质结构的改变,对催化速率或其他性质产生影响。从图9可以看出,Mg2+和Ca2+对酶活性的影响并不显著。0.5 mmol/L的Fe3+、Zn2+、Ba2+对反应有明显的抑制作用;0.5 mmol/L的Co2+对反应速率有轻微的促进作用;添加Mn2+后,酶活性显著提高。表明金属离子在酶促反应时,可作为激活剂,促进酶更好地作用于底物。

图9 不同金属离子条件下MtGH6的酶活性
依据不同底物浓度下MtGH6的酶活力,测定其动力学常数,结果如图10所示。在0.5 mmol/L Mn2+存在下,MtGH6的米氏常数m和转化数cat分别为(7.83±3.70) mg/mL、(72.01±29.01)/s。基于这些参数,测定catm值为(14.10±10.37) mL/(mg·s)。同时,在没有 Mn2+的情况下,m、cat和catm值为(7.78±3.08) mg/mL、(37.49±11.77)/s 和(6.43±4.06) mL/(mg·s),推测 Mn2+能通过提高催化效率而不是底物亲和力来增加 MtGH6的酶活力。

图10 MtGH6在不同底物浓度下的比活力
3 结论与讨论
在现代生物技术高速发展的背景下,纤维素酶由于能水解β–1,4糖苷键,能将纤维素高分子材料变为小分子糖类,在实际生产及生活中具有重要作用。分子生物学的出现使得利用异源宿主进行蛋白质和蛋白质复合体的过度表达成为可能。大肠埃希菌具有极快的生长动力学,可以获得高细胞密度,且培养基和试剂价格低廉,表达构建体的转化简单[9]。枯草芽孢杆菌能够利用各种信号肽非特异性地分泌重组蛋白,与革兰阴性菌宿主相比优势明显[10]。毕赤酵母可以生长到非常高的细胞密度,具有可用且受严格调控的强启动子,因而被广泛用于生物制药和工业酶的生产[11]。
本研究中,以糖苷水解酶MtGH6为研究对象,构建了质粒pET21a–MtGH6、pBES–MtGH6、pPICZαA–MtGH6,选取大肠埃希菌BL21、枯草芽孢杆菌RIK1285及毕赤酵母GS115作为工程菌对MtGH6进行了异源表达及分离纯化,并对表达MtGH6的3个宿主菌的生长状况、产酶量、纯化回收率、酶活力等参数进行了比较分析。
生物量方面,大肠埃希菌BL21及枯草芽孢杆菌RIK1285在生长稳定后,OD值维持在1.5,而毕赤酵母GS115生长稳定后,OD值维持在2.0,表明毕赤酵母GS115的生长状况更好,更有利于产酶。造成此现象的原因可能是BMMY培养基较LB培养基及TB培养基营养成分更丰富。
产酶量方面,毕赤酵母GS115生产的MtGH6为77 mg/L,大肠埃希菌BL21及枯草芽孢杆菌RIK1285生产的MtGH6分别为56、32 mg/L,产酶量因选用启动子不同而有所差异。研究[12]表明,枯草杆菌表达系统虽可成功表达一些异源基因,但存在蛋白质产量低的缺点,限制了其应用潜力,本研究结果也验证了这一现象。大肠埃希菌BL21和毕赤酵母GS115采用的是强启动子T7启动子和AOX1启动子,所以产酶量高于枯草芽孢杆菌RIK1285;而大肠埃希菌BL21是一种致病细菌,含有内毒素(脂多糖),易形成包涵体[13],作为表达宿主有其局限性,从SDS–PAGE结果可看出其在沉淀损失了许多:因此,从产量及蛋白损失情况看,毕赤酵母GS115表达MtGH6具有显著优势。
纯化回收率方面,毕赤酵母GS115生产的MtGH6回收率为15.40%,大肠埃希菌BL21及枯草芽孢杆菌RIK1285生产的MtGH6回收率分别为10.37%和10.45%,说明毕赤酵母生产的蛋白中MtGH6所占比重更高,诱导效果更好。
酶活力方面,由毕赤酵母GS115表达的MtGH6的酶活力为15.60 U/mg,由大肠埃希菌BL21及枯草芽孢杆菌RIK1285表达的MtGH6分别为7.45、10.06 U/mg,说明毕赤酵母GS115是MtGH6的最优表达宿主。究其原因可能是毕赤酵母表达系统具有独特的翻译后修饰功能,由其分泌的重组蛋白MtGH6相较于其他2种表达系统的酶活力更高。
近年来,国内外不断有新型的纤维素酶被挖掘与研究。ISLAM等[14]筛选到芽孢杆菌、芽孢杆菌、气单胞菌,测得所产的纤维素酶的最适温度皆为40 ℃,最适pH值为7。杨丽娜等[15]从腐烂秸秆与腐殖质土壤样品中分离出的纤维素降解菌芽孢杆菌属()微生物NP29所产纤维素酶的反应最适pH为4.5,最佳反应温度为65 ℃;杨力权等[16]从稻草堆肥中筛选得到一株产高温纤维素酶的木霉属菌株M1,其所产纤维素酶的最适反应pH为4.4,最适反应温度为75 ℃。本研究中,由毕赤酵母GS115表达的MtGH6,其降解微晶纤维素的最适pH为8.0,相较于上述纤维素酶,其在较宽的pH范围(pH 6~10)内维持着较高的酶活性。
碱法是木质纤维素的预处理方法之一[17]。杨俊换等[18]在油茶籽壳发酵产羧甲基纤维素酶的优化实验中,使用了碱法来对油茶籽壳进行预处理。MtGH6在碱性环境中的高活性,使其能够减少原材料经碱法预处理后的中和成本。本研究中,MtGH6作用于微晶纤维素的最适温度为60 ℃,且在50~70 ℃ 温度范围内稳定性较高。在大规模微生物发酵产酶过程中,通常使用蒸汽法对原材料进行灭菌,而MtGH6适应于高温环境,能大大减少原材料的冷却成本。此外,在工业发酵产酶过程中,常需要添加微量元素,以调节微生物代谢活动。本研究结果表明,添加Co2+和Mn2+能增强MtGH6的酶活力,而Mg2+和Ca2+对MtGH6的酶活力无干扰,Fe3+和Zn2+及Ba2+对MtGH6的酶活力有明显的抑制作用:因此,如需大规模发酵生产MtGH6,应避免Fe3+和Zn2+及Ba2+的添加。
综上所述,由毕赤酵母GS115表达的MtGH6具备优良的耐热性,在较宽的pH范围内维持着较高的酶活性,添加Mn2+能显著提高MtGH6的酶活力,推测MtGH6在生物燃料生产中可能具有较好的应用前景。
[1] CHANG C C,LI R D.Agricultural waste[J].Water Environment Research,2019,91:1150–1167.
[2] FATMA S,HAMEED A,NOMAN M,et al. Lignocellulosic biomass:a sustainable bioenergy source for the future[J].Protein and Peptide Letters,2018,25(2):148–163.
[3] KUCHARSKA K,RYBARCZYK P,HOŁOWACZ I,et al.Pretreatment of lignocellulosic materials as substrates for fermentation processes[J].Molecules,2018,23(11):2937.
[4] SRIVASTAVA N,RATHOUR R,JHA S,et al. Microbial beta glucosidase enzymes:recent advances in biomass conversation for biofuels application[J]. Biomolecules,2019,9(6):220.
[5] CAPOLUPO L,FARACO V.Green methods of lignocellulose pretreatment for biorefinery development[J]. Applied Microbiology and Biotechnology,2016,100 (22):9451–9467.
[6] BOMBLE Y J,BECKHAM G T,MATTHEWS J F,et al. Modeling the self-assembly of the cellulosome enzyme complex[J].The Journal of Biological Chemistry,2011,286(7):5614–5623.
[7] ENGER M D,SLEEPER B P.Multiple cellulase system from[J].Journal of Bacteriology,1965,89(1):23–27.
[8] TUAN L Q A.Rational protein design for enhancing thermal stability of industrial enzymes[J].Engineering and Technology,2020,8(1):3–17.
[9] FERNÁNDEZ F J,VEGA M C.Choose a suitable expression host:a survey of available protein production platforms[J].Advances in Experimental Medicine and Biology,2016,896:15–24.
[10] GU Y,XU X H,WU Y K,et al.Advances and prospects ofcellular factories:from rational design to industrial applications[J].Metabolic Engineering,2018,50:109–121.
[11] TÜRKANOĞLU ÖZÇELIK A,YıLMAZ S,INAN M.promoters[J].Methods in Molecular Biology (Clifton,N.J.),2019,1923:97–112.
[12] LI W F,ZHOU X X,LU P.Bottlenecks in the expression and secretion of heterologous proteins in[J].Research in Microbiology,2004,155(8):605–610.
[13] BHATWA A,WANG W,HASSAN Y I,et al. Challenges associated with the formation of recombinant protein inclusion bodies inand strategies to address them for industrial applications[J].Frontiers in Bioengineering and Biotechnology,2021,9:630551.
[14] ISLAM F,ROY N.Screening,purification and characterization of cellulase from cellulase producing bacteria in molasses[J].BMC Research Notes,2018,11(1):445.
[15] 杨丽娜,杨明明,龚月生.产耐热性纤维素酶菌株的分离·鉴定及其酶学性质研究[J].安徽农业科学,2012,40(14):8103–8105.
[16] 杨力权,周连广,陈贵元,等.一株产高温纤维素酶菌株的筛选、鉴定及其酶学性质研究[J].中国饲料,2019(11):40–44.
[17] 何士成,彭太兵,孙曼钰,等.碱处理中温度对不同底物特性木质纤维素结构及酶解的影响[J].江苏农业科学,2017,45(21):292–296.
[18] 杨俊换,郭华,欧阳晶.用响应面法优化油茶籽壳发酵产羧甲基纤维素酶的条件[J].湖南农业大学学报(自然科学版),2014,40(4):416–420.
Heterologous expression and enzymatic properties of a novel glycoside hydrolase
XU Longwei,YONG Jie,ZHOU Haiyan*
(College of Bioscience and Biotechnology, Hunan Agricultural University, Changsha, Hunan 410128, China)
In order to obtain the optimal expression host of MtGH6, we used plasmid pET21a-MtGH6,pBES-MTGH6 and pPICZαA-MtGH6 to express the MtGH6 by use ofBL21、RIK1285 andGS115. The growth status, enzyme production, purification efficiency and enzyme activity of the three host bacteria expressing MtGH6 were compared and analyzed. The results showed that the OD valueBL21 andRIK1285 remained at 1.5 after stable growth, while that ofGS115 remained at 2.0 after stable growth. MtGH6 produced byGS115 was 77 mg/L, and the purification recovery was 15.40%. The enzyme production and purification recovery were higher than those produced byBL21 andRIK1285. The enzyme activity of MtGH6 expressed byGS115 was 15.60 U/mg, and the activity of MtGH6 expressed byBL21 andRIK1285 was 7.45 U/mg and 10.06 U/mg, respectively, indicating thatGS115 was the optimal host for MtGH6 expression. The enzyme properties of MtGH6 secreted byGS115 were studied. The results showed that the optimum pH and temperature of this enzyme were 8.0 and 60 ℃, and the addition of 0.5 mmol/L Mn2+could increase its activity, indicating that MTGH6 had a good application prospect in the production of biofuels.
glucoside hydrolase; heterologous expression; host bacteria; enzymatic property
Q556+.2
A
1007-1032(2022)06-0650-09
徐龙威,雍婕,周海燕.一种新型糖苷水解酶的异源表达及酶学性质研究[J].湖南农业大学学报(自然科学版),2022,48(6):650–658.
XU L W,YONG J,ZHOU H Y.Heterologous expression and enzymatic properties of a novel glycoside hydrolase[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(6):650–658.
http://xb.hunau.edu.cn

2022–03–08
2022–11–24
湖南农业大学“双一流”建设工程(SYL201802002)
徐龙威(1997—),男,湖南长沙人,硕士研究生,主要从事微生物学研究,xlwhnau1101@163.com ;*通信作者,周海燕,博士,教授,主要从事蛋白质工程、微生态研究,sws001@163.com
10.13331/j.cnki.jhau.2022.06.004
责任编辑:毛友纯
英文编辑:柳正
