大蒜提取物对B16F10细胞内黑色素生成的抑制作用
2023-01-12姚欣曾洁琳沈衡平刘朕范丽霞杨安平刘辉
姚欣,曾洁琳,沈衡平,刘朕,范丽霞,杨安平,刘辉*
大蒜提取物对B16F10细胞内黑色素生成的抑制作用
姚欣1,曾洁琳1,沈衡平2,刘朕1,范丽霞1,杨安平1,刘辉1*
(1.佛山科学技术学院医学院,广东 佛山 528000;2.欧露莲生物科技(广东)有限公司,广东 佛山 528051)
采用MTT法测定大蒜提取物、二胜肽和六胜肽3种物质对B16F10细胞活力的影响,且在非毒剂量下,分别评价此3种物质对B16F10细胞黑色素生成和细胞形态的影响;在单因素试验基础上,采用正交试验设计大蒜提取物、二胜肽和六胜肽组合物中各组分的用量,检测组合物对B16F10细胞黑色素生成抑制率的影响,并利用Western blot检测最佳组合物对黑色素合成相关蛋白TYR、TRP–1和TRP–2表达的影响。结果表明:0.00~2.50 µg/mL的大蒜提取物、0.00~4.00 µg/mL的二胜肽或六胜肽对B16F10细胞的细胞活力和细胞形态均没有显著影响;大蒜提取物在0.00~2.50 µg/mL、二胜肽和六胜肽在0.00~4.00 µg/mL内呈剂量依赖性的抑制黑色素的生成;当大蒜提取物、二胜肽、六胜肽质量浓度分别为2.50、1.00、0.50 µg/mL时的组合物抑制黑色素的生成作用效果最佳;该最佳组合物对黑色素合成相关蛋白TYR、TRP–1和TRP–2的表达具有明显的抑制作用,表明组合物抑制黑色素的生成与TYR、TRP–1和TRP–2蛋白水平的降低有关。
B16F10细胞;大蒜提取物;二胜肽;六胜肽;黑色素;细胞活力;细胞形态;抑制作用
黑色素在保护皮肤和眼睛方面发挥了重要作用。黑色素过量会导致皮肤颜色加深,严重者可引起黄褐斑、黑色素瘤等皮肤疾病,严重影响人们的身心健康[1]。黑色素的生物合成受到复杂的信号通路及多种酶调控,其中酪氨酸酶(TYR)、酪氨酸酶相关蛋白1(TRP–1)和酪氨酸酶相关蛋白2(TRP–2)在黑色素生成的调节中起着重要作用,抑制TYR、TRP–1和TRP–2的表达可以显著抑制黑色素的生成[2]。化妆品应用最多的美白剂有熊果苷、曲酸等,但现有研究[3–4]表明上述物质均具有一定的安全问题。寻找安全、高效的美白剂已成为社会迫切的需求。随着人民对化妆品安全的关注与日俱增,对天然植物中活性成分的开发利用也越来越重视,成为近年来化妆品功效的研究热点,寻求天然、绿色、安全的美白剂已成为化妆品研究的必然方向。现已发现有多种食品或药食同源来源的天然成分具有较好的抑制黑色素作用。陈易彬等[5]研究发现,黑木耳甲醇提取物具有良好的抑制黑色素细胞形成活性。王勇恒等[6]研究发现,川芎提取物通过抑制细胞内酪氨酸酶活性、清除ROS双靶点的方式发挥美白作用。
大蒜为百合科植物大蒜(L.)的鳞茎,是日常生活中最常见的药食两用的植物之一,已有数千年的应用历史。大蒜富含蛋白质、低聚糖和多糖类、矿物质等营养物质[7],具有开胃健脾、驱寒除湿、抗菌、提高机体免疫力等功效[8–9]。现代药理研究表明,大蒜具有降血糖[10]、抗肿瘤[11–12]、调节免疫[13]、抗氧化[14]、保护心血管[15]等活性;因其对多种细菌、真菌、病毒等病原微生物有不同程度的抑制或杀灭作用,又被称为“天然抗生素”[7]。化学成分研究表明,其主要包括有机硫类、皂苷类、黄酮类、多酚类等成分[16–17]。大蒜提取物已被纳入了化妆品原料名称目录,二胜肽和六胜肽因其具有抗氧化、修复皮肤等作用也已被广泛应用于化妆品中[18–21]。前期,笔者对上述3种物质作为活性添加剂制成的化妆品进行了皮肤的刺激性实验[22],实验中发现该产品除上述添加剂已报道的功能外,还具有一定的抑制黑色素生成作用,是哪一类添加剂发挥了作用,以及怎么样的组合才能发挥最好的抑制黑色素生成作用还不清楚。笔者采用小鼠黑色素瘤B16F10细胞模型,对大蒜提取物、二胜肽和六胜肽抑制黑色素的生成作用进行研究,旨在为该组合物在美白化妆品方面的应用及大蒜的综合开发利用提供依据。
1 材料与方法
1.1 材料
大蒜提取物、二胜肽、六胜肽均由欧露莲生物科技(广东)有限公司提供;B16F10黑色素瘤细胞购自上海酶研生物科技有限公司。
1.2 主要试剂与仪器
二甲基亚砜、氢氧化钠购自上海麦克林生化科技有限公司;3–(4,5–二甲基噻唑–2)–2,5–二苯基四氮唑溴盐(MTT)购自Sigma;Tyrosinase(TYR)、Tyrosinase related protein–1(TRP–1)、Tyrosinase related protein–2(TRP–2)和β–actin购自Cell Signaling Technology;DMEM培养基、胎牛血清购自Gibco。
JJ500电子天平、JJ224BC万分之一分析天平为常熟市双杰测试仪厂产品;CSH–ZY–00032锐思捷纯水系统为厦门锐思捷水纯化技术有限公司产品;BioTek Epoch全波长酶标仪为BioTek产品。
1.3 方法
1.3.1细胞培养
用含体积分数1%双抗和10% FBS的DMEM培养基,在37 ℃、体积分数为5% CO2的培养箱中培养B16F10细胞,待细胞长满后按1∶3进行传代。
1.3.2大蒜提取物和二胜肽及六胜肽处理后B16F10细胞活力的测定
按照张瑞雪等[23]的方法,采用MTT法观察3种物质对B16F10细胞活力的影响,分别用0.00、1.25、2.50、5.00、10.00、20.00 µg/mL的大蒜提取物,0.00、0.25、0.50、1.00、2.00、4.00 µg/mL的二胜肽或六胜肽与B16F10细胞共孵育24 h,然后检测其细胞活力。
1.3.3大蒜提取物和二胜肽及六胜肽处理后B16F10细胞形态的观察
根据细胞活力试验结果,按照张向娜等[24]的方法,分别选择非毒剂量下的0.00、0.50、1.00、1.50、2.50 µg/mL的大蒜提取物,0.00、0.25、0.50、1.00、2.00、4.00 µg/mL的二胜肽或六胜肽与B16F10细胞共孵育24 h,再观察细胞的形态。
1.3.4大蒜提取物和二胜肽及六胜肽处理后B16F10细胞黑色素含量的测定
按照于海鑫等[25]方法,分别选择非毒剂量下的0.00、0.50、1.00、1.50、2.50 µg/mL的大蒜提取物,0.00、0.25、0.50、1.00、2.00、4.00 µg/mL的二胜肽或六胜肽与B16F10细胞共孵育24 h,检测细胞中黑色素含量。
1.3.5大蒜提取物和二胜肽及六胜肽组合物对B16F10细胞黑色素生成的抑制作用的正交试验
参照文献[24]的方法,基于单因素试验结果,大蒜提取物、二胜肽和六胜肽分别采用3个质量浓度水平,设计3因素3水平的正交试验(表1)。以B16F10细胞黑色素生成抑制率为考察指标。

表1 大蒜提取物和二胜肽及六胜肽组合物正交试验的因素水平
1.3.6黑色素合成相关蛋白TYR和TRP–1及TRP–2的表达分析
为探究大蒜提取物、二胜肽和六胜肽组合物抑制黑色素生成的作用机制,通过Western blot检测最佳组合物对B16F10细胞黑色素合成相关蛋白表达量的影响。参照文献[26]的方法,根据正交试验结果,取对数生长期B16F10细胞接种于96孔培养板中,于37 ℃、体积分数5% CO2培养箱中培养24 h后加药;每孔加最佳浓度组合物,设3个重复,培养24 h后收集细胞;用BCA法测蛋白浓度,转膜、封闭后加入一抗和β–actin,4 ℃孵育过夜;第2天加入相应二抗,再室温孵育2 h,用TBST缓冲液漂洗3次后用ECL检测系统显影免疫反应蛋白;最后用View Smart系统对蛋白显影的X–光片进行灰度扫描。
1.4 数据处理
所有试验均平行操作3次。数据运用Graph Pad Prism 8进行统计学分析,采用ANOVA进行显著性分析。正交试验结果运用Minitab 17进行分析。
2 结果与分析
2.1 大蒜提取物和二胜肽及六胜肽对B16F10细胞活力的影响
从图1可知,在0.00~20.00 µg/mL剂量范围内,大蒜提取物对B16F10细胞呈剂量依赖性抑制其细胞活力;大蒜提取物质量浓度为1.25、2.50 µg/mL时的细胞活力与空白对照组间的差异无统计学意义;当大蒜提取物质量浓度大于等于5.00 µg/mL时,细胞活力极显著(<0.001)低于对照组的。可见,当大蒜提取物质量浓度小于等于2.50 µg/mL时,其对B16F10细胞无毒性,质量浓度大于等于5.00 µg/mL时,则具有明显的细胞毒性。质量浓度小于等于4.00 µg/mL的二胜肽或六胜肽对B16F10细胞活力均没有显著性影响。综合上述结果,并结合常用添加量,选择大蒜提取物质量浓度小于等于2.50 µg/mL,二胜肽和六胜肽的质量浓度小于等于4.00 µg/mL进行后续试验。

“***”示与对照组间差异有统计学意义(P<0.001)。
2.2 大蒜提取物和二胜肽及六胜肽对B16F10细胞形态的影响
从图2可知,对照组的B16F10细胞呈梭形贴壁生长,有树突,紧密连接形成单层细胞;经非毒剂量的大蒜提取物、二胜肽和六胜肽处理后,B16F10细胞形态、数量与空白对照组相比没有明显差别。可见,大蒜提取物、二胜肽和六胜肽分别在非毒剂量下对B16F10细胞的形态没有明显影响。

1~6分别示0.00、0.50、1.00、1.50、2.00、2.50 µg/mL大蒜提取物处理的细胞形态;7~12分别示0.00、0.25、0.50、1.00、2.00、4.00 µg/mL二胜肽处理的细胞形态;13~18分别示0.00、0.25、0.50、1.00、2.00、4.00 µg/mL六胜肽处理的细胞形态。
2.3 大蒜提取物和二胜肽及六胜肽对B16F10细胞黑色素生成的影响
从图3可知,3种物质在一定的质量浓度范围内均能明显地抑制细胞内黑色素的生成,且呈剂量依赖性;其中,除0.50 µg/mL大蒜提取物对细胞内黑色素的生成没有显著影响外,其余质量浓度的大蒜提取物对黑色素生成均具有显著抑制作用,且在质量浓度为2.50 µg/mL时效果最佳;二胜肽和六胜肽抑制黑色素生成的作用大于大蒜提取物的,考虑到二胜肽和六胜肽在实际应用中的添加量,且在1.00 µg/mL时已极显著(<0.001)降低了细胞内黑色素的生成量,后续试验中,二胜肽和六胜肽的最高质量浓度均选择1.00 µg/mL。

“*”“**”“***”分别示与对照组间差异有统计学意义(P<0.05、P<0.01、P<0.001)。
2.4 正交试验结果
通过正交试验结果的极差分析与方差分析结果(表2和表3)可得,大蒜提取物(A)、二胜肽(B)、六胜肽(C)对B16F10细胞黑色素生成抑制作用的大小依次减小,且因素A和B对黑色素生成具有显著性影响。再根据值的大小,确定大蒜提取物、二胜肽及六胜肽最佳质量浓度组合为332,即大蒜提取物最佳添加质量浓度为2.50 µg/mL、二胜肽最佳质量浓度为1.00 µg/mL及六胜肽最佳质量浓度为0.50 µg/mL。

表2 大蒜提取物和二胜肽及六胜肽组合物正交试验结果

表3 大蒜提取物和二胜肽及六胜肽组合物方差分析结果
2.5 大蒜提取物和二胜肽及六胜肽组合物对细胞黑色素合成相关蛋白的影响
从图4可知,最佳组合物可极显著(<0.01或<0.001)抑制B16F10细胞的TYR、TRP–1和TRP–2蛋白的表达。
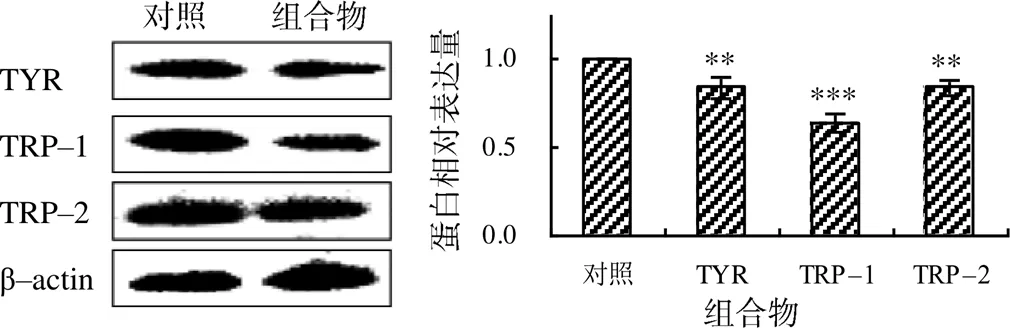
“**”“***”分别示与对照组间差异有统计学意义(P<0.01、P<0.001)。
3 结论
本研究中,发现大蒜具有一定的抑制黑色素生成作用;同时也证实了在0.25~4.00 µg/mL范围内,二胜肽和六胜肽具有剂量依赖性的抑制黑色素生成的作用。通过正交试验发现,当大蒜提取物质量浓度为2.50 µg/mL、二胜肽质量浓度为1.00 µg/mL及六胜肽质量浓度为0.50 µg/mL时,该组合物抑制黑色素生成作用效果最佳。
黑色素的生物合成受到复杂信号通路的调节,TYR、TRP–1和TRP–2是黑色素合成的关键酶,在哺乳动物体内的黑色素合成中发挥了重要作用[27]。本研究中,与空白对照组相比,该最佳组合物极显著(<0.01)降低了TYR、TRP–1、TRP–2的表达。表明组合物抑制黑色素的生成与TYR、TRP–1和TRP–2蛋白水平的降低有关。
[1] 冯冬茹,杨水军,谢衡,等.马尾松树皮提取物对小鼠B16黑色素瘤细胞中黑色素生成抑制效果及其机制的初步研究[J].时珍国医国药,2012,23(1):148–151.
[2] KIM B H,HONG S N,YE S K,et al.Evaluation and optimization of the anti-melanogenic activity of 1-(2- cyclohexylmethoxy-6-hydroxy-phenyl)-3-(4-hydroxymethyl-phenyl)-propenone derivatives[J].Molecules,2019,24(7):1372.
[3] 陈艳梅,胡昱,黄玲珑,等.曲酸衍生物KAD3的合成及其抑制黑色素形成的作用机制[J].厦门大学学报(自然科学版),2020,59(6):929–938.
[4] 沙焱,杨震宇,周伟,等.氢醌引起TK6细胞毒性的差异蛋白组学研究[J].中国职业医学,2018,45(6):675–680.
[5] 陈易彬,徐锦,王敏,等.黑木耳甲醇提取物抑制黑色素的研究[J].食品工业科技,2015,36(21):111–114.
[6] 王勇恒,梁彦会,孙培冬.川芎提取物美白双靶点活性研究[J].日用化学工业,2020,50(4):249–254.
[7] 李娜.大蒜的功效成分及其应用的研究进展[J].中国食物与营养,2007,13(11):25–27.
[8] 张百俊,杨和连,刘爱琴.大蒜功能研究现状[J].河南科技学院学报(自然科学版),2007,35(4):33–35.
[9] 闫淼淼,许真,徐蝉,等.大蒜功能成分研究进展[J].食品科学,2010,31(5):312–318.
[10] EIDI A,EIDI M,ESMAEILI E.Antidiabetic effect of garlic(L.) in normal and streptozotocin- induced diabetic rats[J].Phytomedicine,2006,13(9/10):624–629.
[11] THOMSON M,ALI M.Garlic[]:a review of its potential use as an anti-cancer agent[J].Current Cancer Drug Targets,2003,3(1):67–81.
[12] PEREZ-ORTIZ J M,GALAN-MOYA E M,DE LA CRUZ-MORCILLO M A,et al.Cost effective use of a thiosulfinate-enrichedextract in combination with chemotherapy in colon cancer[J]. International Journal of Molecular Sciences,2020,21(8):2766.
[13] CHAND S K,NANDA S,MISHRA R,et al.Multiple garlic(L.) microRNAs regulate the immunity against the basal rot fungusf.sp.[J].Plant Science,2017,257:9–21.
[14] BOZIN B,MIMICA-DUKIC N,SAMOJLIK I,et al. Phenolics as antioxidants in garlic(L.,Alliaceae)[J].Food Chemistry,2008,111(4):925–929.
[15] GOMAA A M S,ABDELHAFEZ A T,AAMER H A. Garlic() exhibits a cardioprotective effect in experimental chronic renal failure rat model by reducing oxidative stress and controlling cardiac Na+/K+- ATPase activity and Ca2+levels[J].Cell Stress and Chaperones,2018,23(5):913–920.
[16] 张晓林,刘萍.大蒜有机硫化物的研究进展[J].医学综述,2011,17(3):432–434.
[17] 李新霞,赵东升,耿晶,等.大蒜活性成分与硫化氢的关系研究[J].新疆医科大学学报,2014,37(1):12–15.
[18] 汪宝树.天然美容佳品大蒜液[J].辽宁体育,1989(11):44–45.
[19] 陈雷,赵瑞芳,吕彩虹,等.生物活性美容多肽的研究进展综述[J].中西医结合心血管病电子杂志,2019,7(7):38.
[20] LEYTON P,PAIPA C,BERRIOS A,et al.Structural study and characterization of the dipeptide 2-[[5-amino- 5-oxo-2-(phenylmethoxycarbonylamino) pentanoyl] amino] acetic acid by vibrational spectroscopy and DFT calcula- tions[J].Journal of Molecular Structure,2013,1031:110–118.
[21] HOPPEL M,REZNICEK G,KÄHLIG H,et al.Topical delivery of acetyl hexapeptide-8 from different emulsions:influence of emulsion composition and internal structure[J]. European Journal of Pharmaceutical Sciences,2015,68:27–35.
[22] 刘辉,沈衡平,李淑怡,等.大蒜提取物化妆品对豚鼠皮肤刺激性实验研究[J].香料香精化妆品,2021,2:65–67.
[23] 张瑞雪,马勇,刘宇,等.果蔬酵素对黑色素生成的影响[J].食品工业,2019,40(5):220–223.
[24] 张向娜,林勇,黄建安,等.茶叶提取物EGCG和GCG及ECG对B16细胞内黑色素生成的抑制作用[J].湖南农业大学学报(自然科学版),2017,43(4):405–410.
[25] 于海鑫,张秀玲,高诗涵,等.紫苏叶花色苷微波辅助提取工艺优化及其抗氧化活性[J].食品工业,2019,40(10):51–55.
[26] LIU H,LIAO W,FAN L,et al.Ethanol extract ofsuppresses liver cancer cell proliferation and migration[J].Chinese Medicine,2020,15(1):1–11.
[27] YANG Y,SUN X,NI H,et al.Identification and characterization of the tyrosinase inhibitory activity of caffeine from[J].Journal of Agricultural and Food Chemistry,2019,67(46):12741–12751.
Inhibitory effects of the extracts ofon the melanogenesis in B16F10 melanoma cells
YAO Xin1,ZENG Jielin1,SHEN Hengping2,LIU Zhen1,FAN Lixia1,YANG Anping1,LIU Hui1*
(1.School of Medicine, Foshan University, Foshan, Guangdong 528000, China; 2.Oululian Biotechnology(Guangdong) Co. Ltd, Foshan, Guangdong 528051, China)
The effects of extracts of, dipeptide-2 and acetyl hexapeptide-8 on B16F10 cells viability were determined using MTT method. And the effects of these three substances on the melanin synthesis and morphology of B16F10 cells were evaluated with the nontoxic dose. With the single factor experiment, orthogonal experiments were used to explore the concentration of extracts of, dipeptide-2 and acetyl hexapeptide-8 on the inhibitory effects of the melanin synthesis. The expression of proteins of TYR、TRP-1 and TRP-2 in B16F10 cells were detected using western blot. The results showed that the extracts of(0.00-2.50 µg/mL), dipeptide-2 and acetyl hexapeptide-8 (0.00-4.00 µg/mL) had no effect on the cell viability and morphology of B16F10 cells. The extracts of(0.00-2.50 µg/mL), dipeptide-2 and acetyl hexapeptide-8(0.00-4.00 µg/mL) could inhibit the melanogenesis in B16F10 cells with a dose-dependent manner. The optimal inhibition effect on melanogenesis was extracts of2.50 µg/mL, dipeptide-2 1.00 µg/mL, and acetyl hexapeptide-8 0.50 µg/mL. The optimal composition could significantly inhibit the expression of TYR, TRP-1 and TRP-2 proteins, indicating that the inhibition of melanogenesis by the composition was linked to the reduction of TYR, TRP-1 and TRP-2 protein levels.
B16F10 cell; extract of; dipeptide-2; acetyl hexapeptide-8; melanogenesis; cell viability; cell morphology; inhibition effect
S633.4
A
1007-1032(2022)06-0666-06
姚欣,曾洁琳,沈衡平,刘朕,范丽霞,杨安平,刘辉.大蒜提取物对B16F10细胞内黑色素生成的抑制作用[J].湖南农业大学学报(自然科学版),2022,48(6):666–671.
YAO X,ZENG J L,SHEN H P,LIU Z,FAN L X,YANG A P,LIU H.Inhibitory effects of the extracts ofon the melanogenesis in B16F10 melanoma cells[J].Journal of Hunan Agricultural University(Natural Sciences),2022,48(6):666–671.
http://xb.hunau.edu.cn

2021–06–02
2022–11–20
广东省基础与应用基础研究项目(2019A1515110696);广东省教育厅项目(2019KQNCX171)
姚欣(1995—),女,河南商丘人,硕士研究生,主要从事食品活性成分研究,2821185388@qq.com;*通信作者,刘辉,博士,讲师,主要从事药食同源活性成分研究,tianmahui2011@163.com
10.13331/j.cnki.jhau.2022.06.006
责任编辑:邹慧玲
英文编辑:柳正
