单、双脂肪酸甘油酯(亚麻酸)乳液的制备及特性研究
2023-01-12张盈铢李文博李艳周航
张盈铢,李文博,李艳*,周航
(1.华中农业大学食品科学技术学院,湖北武汉 430070)(2.辽宁科海食品化学工程有限公司,辽宁丹东 118000)
α-亚麻酸,为ω-3 系不饱和脂肪酸,是维持人体生命活动必不可少,但自身不能合成,必须通过食物来提供的必需脂肪酸之一,在体内可转化为二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),对人体有诸多生理功能,如降血脂、降血压,预防心脑血管疾病,抑制肿瘤的生长等[1-4]。α-亚麻酸最常见的食物来源是植物油,如亚麻籽油、紫苏油和牡丹籽油,其中亚麻籽油的α-亚麻酸含量最高,是补充α-亚麻酸的极佳来源[5]。然而甘油三酯的过多摄入会导致肥胖的发生,有研究证明不同形式的油脂在人体内具有不同的新陈代谢率[6],因此在关注脂质摄入量的同时,还需要关注脂质的摄入形式。
单、双脂肪酸甘油酯是单甘酯与甘油二酯的混合物,由于甘油二酯独特的代谢方式,使其具有多种生理功能,如降低血脂、抑制肝脏脂肪积累、预防心血管疾病等[7-9]。与甘油三酯相比,单、双脂肪酸甘油酯与其结构差异较小,化学性质稳定,营养价值较高,常被用作甘油三酯的替代品[7,10],因此,可以将富含α-亚麻酸的甘油二酯作为补充α-亚麻酸的极佳来源,而不会造成脂肪堆积的负担[11]。在日本和美国,甘油二酯已经被允许作为烹调用油进行食用[10]。此外,由于单、双脂肪酸甘油酯的两亲性和表面活性,使其具有更高的溶解能力和更好的分散性[12]。有研究表明单、双脂肪酸甘油酯有利于提高疏水性营养素的溶解度和口服生物利用率[13,14]。然而,单、双脂肪酸甘油酯在替代相应油脂的潜力方面还有待深入研究。
由于食用油脂具有极强的疏水性,且在空气中容易氧化,产生不良的风味和有害物质,限制了其在食品领域的应用。为了解决油脂极易氧化和水溶性差的问题,开发有效的递送系统具有重要的意义。水包油乳液已被证明是用于递送功能性油脂的有效载体,许多研究表明水包油乳液能够延缓油脂的氧化,并提高其稳定性[15-18],还能提高不饱和脂肪酸的生物利用率[19,20]。
为此,本文选用常见的天然蛋白乳化剂(乳清蛋白Whey Protein Concentrate-WPC,大豆分离蛋白Soybean Protein Isolate-SPI,酪蛋白酸钠 Sodium Caseinate-SC)及非离子型乳化剂(吐温80-T80),以生物发酵来源的单、双脂肪酸甘油酯(亚麻酸)为油相制备乳液,通过粒径电位、微观形态等乳液表征方法探究乳化剂类型对乳液形成的影响,对比不同乳液的物理稳定性和氧化稳定性,并利用体外消化模型研究不同乳化剂对乳液脂质消化速率和消化程度的影响,及亚麻籽油和单、双脂肪酸甘油酯(亚麻酸)水解程度的差异,为单、双脂肪酸甘油酯(亚麻酸)用于替代亚麻籽油的应用提供参考依据。
1 材料与方法
1.1 原料
乳清浓缩蛋白:约为85%,Hilmar 8010,美国希尔玛配料公司;大豆分离蛋白:≥90%,西宝生物科技(上海)股份有限公司;酪蛋白酸钠:90%,上海源叶生物技术有限公司;吐温80:国药集团化学试剂有限公司;单、双甘油脂肪酸酯(亚麻酸):单酯含量61.5%,双酯含量24%,亚麻酸含量60.2%,辽宁科海食品化学工程有限公司;亚麻籽油:益海嘉里食品营销有限公司;其他所用试剂均为分析纯。
1.2 主要仪器设备
Ultra-TurraxT25 型高速剪切机,德国IKA 公司;M-110L 型高压微射流均质机,美国Microfluidics 公司;TI-S 倒置荧光显微镜,日本尼康公司;UV-1700 型紫外-可见分光光度计,日本岛津公司;902 Titrando 全自动电位滴定仪,瑞士万通公司;Malvern 2000 型激光粒度分析仪,英国Malvern 公司;Zetasizer Nano ZS 型纳米粒度测定仪,英国Malvern 公司。
1.3 试验方法
1.3.1 乳液制备
将1%(m/m)WPC、SPI、SC 和T80 分别溶解在缓冲溶液(5 mmol/L 磷酸盐缓冲液PBS,pH 值7.0)中制备水相,其中WPC、SPI 和SC 溶液置于4 ℃冰箱中冷藏过夜以充分水合。以单、双脂肪酸甘油酯(亚麻酸)为油相,将油相(5%,m/m)与水相(95%,m/m)搅拌混合,用高速分散均质机以12 000 r/min 的速度持续剪切1.5 min 形成粗乳液,粗乳液在62 MPa的压力下通过高压均质机进行5 次循环,制得的乳液于4 ℃保存备用。由T80、SC、SPI 和WPC 制得的乳液分别标记为:T-GLE、C-GLE、S-GLE、W-GLE。
1.3.2 体外消化模型的构建
1.3.2.1 口腔
参考Sarkar 等[21]的方法并稍作修改。将6 mL 的乳液和1.5 mL PBS(pH 值7.0,5 mmol/L)混合,再与7.5 mL 模拟口腔液混合,将混合液的pH 值调至6.8,在37 ℃的恒温水浴锅中孵育10 min,模拟口腔消化。模拟口腔液由粘蛋白和不同种类的盐组成,其配方为:蒸馏水,NaCl(1.594 g/L),NH4NO3(0.328 g/L),KH2PO4(0.636 g/L),KCl(0.202 g/L),K3C6H5O7·H2O(0.308 g/L),H2NCONH2(0.198 g/L),粘蛋白(5 g/L)。
1.3.2.2 胃
取15 mL经口腔消化样品与15 mL模拟胃液混合,用NaOH 调节pH 值至2.5。最终混合物以100 r/min 连续搅拌,于37 ℃下孵育1 h。模拟胃液的配方为:蒸馏水,NaCl(2 g/L),胃蛋白酶(3.2 g/L)和HCl(0.084 mol/L),将pH 值调为1.2 即得模拟胃液[22]。
1.3.2.3 小肠
将30 mL 胃消化样品加入100 mL 玻璃烧杯中,在37 ℃水浴中孵育,然后将pH 值调至7.0。将1.5 mL的模拟小肠液和3.5 mL 的胆汁盐溶液(53.57 mg/mL)添加到烧杯中,不断搅拌,并将混合物的pH 值调至7.0。随后加入2.5 mL 新鲜制备的胰酶悬浮液(24 mg/mL),采用pH-stat 滴定仪使体系pH 值维持在7.0,保持2 h,监测消耗的NaOH 体积。模拟小肠液的配方为:蒸馏水,CaCl2(125 mmol/L)和NaCl(3.75 mol/L)[23]。
通过公式(1)可由消化过程中NaOH 消耗量计算出游离脂肪酸的释放量,反应出油脂的消化速率和最终消化程度。
游离脂肪酸的释放率用下式表示:

式中:
FFA——游离脂肪酸的释放率,%;
VNaOH(t)——在t时刻消耗NaOH 的体积,L;
MNaOH——NaOH 的摩尔浓度,mol/L;
Mlipid——油脂的摩尔质量,g/mol;
wlipid——消化前乳液中油的质量,g。
1.3.3 乳液粒径与Zeta 电位测量
采用激光粒度分析仪和纳米粒度测定仪测定乳液及各消化阶段的平均粒径、粒径分布及Zeta 电位,测量温度为25 ℃。分析前用磷酸盐缓冲液(5 mmol/L,pH 值7.0)稀释初始样品、口腔样品、小肠样品,胃样品用蒸馏水稀释至pH 值2.5。
1.3.4 微观结构观察
1.3.4.1 光学显微镜
利用光学显微镜观察初始乳液的微观结构。取10 μL 样品滴于载玻片中央,通过100 倍油镜对乳液的微观结构进行观察,拍照记录并根据标尺判断乳滴大小。
1.3.4.2 荧光显微镜
采用荧光显微镜观察乳液和消化液液滴分布情况。染色方法为:1.5 mL 样品加10 μL 尼罗红(0.01%),荧光染色后,于荧光显微镜下观察各阶段乳液的微观结构。
1.3.5 稳定性监测
1.3.5.1 贮藏稳定性
将制备好的乳液进行分装,置于4 ℃环境下保存14 d,分别在第0、3、5、7、14 天记录乳液的宏观和微观变化,并测定其粒径的大小,评价外部环境对乳液贮藏稳定性的影响。
1.3.5.2 氧化稳定性
将乳液样品置于50 ℃恒温培养箱中进行加速氧化,比较由不同乳化剂稳定的乳液中油脂氢过氧化物及次级氧化产物丙二醛的含量随时间的变化趋势,研究乳液的抗氧化机制与性能。
氢过氧化值(Peroxide Value,POV)参考Julio等[24]的方法并稍作修改。取0.2 mL 乳液或取与乳液中油相含量相当的单、双脂肪酸甘油酯(亚麻酸)和亚麻籽油与1 mL 异辛烷/异丙醇(3:1,V/V)混合,涡旋震荡20 s,然后在3 400 g 下离心2 min,取0.2 mL 有机相,溶于甲醇/正丁醇(2:1,V/V)溶液中,加入20 μL 3.94 mol/L 硫氰酸铵溶液和20 μL 二价铁离子溶液(由0.132 mol/L氯化钡和0.144 mol/L 硫酸亚铁混合制成),用甲醇/正丁醇(2:1,V/V)溶液定容至8 mL,置于暗处反应20 min 后于510 nm 处测定溶液的吸光度。以过氧化氢为标准绘制曲线,计算样品的POV 值。每个样品平行测定3 次。
硫代巴比妥酸值(Thiobarbituric Acid Value,TBARS)参考Nasrabadi 等[15]的方法并稍作修改。取乳液0.2 mL,用水稀释至2 mL,加入4 mL 硫代巴比妥酸(TBA)溶液(由0.375 g TBA、15 g 三氯乙酸和100 mL 0.25 mol/L HCl 混合而成),沸水浴15 min,在自来水下冷却5 min,于10 000 r/min 离心10 min 后,收集上清液并于532 nm 处测定吸光度。以1,1,3,3-四乙氧基丙烷绘制标准曲线,计算样品的TBARS 值。每个样品平行测量3 次,记录平均值及标准偏差。
1.3.6 数据分析
每个样品至少进行三次重复实验,数据用平均值±标准差表示,使用SPSS 25.0 软件进行统计分析,p<0.05 认为有统计学差异。
2 结果与讨论
2.1 初始乳液的性质
不同乳液的粒径电位如图1 所示,初始乳液均具有较小的平均粒径(131.97~224.87 nm)(图1a)。T80由于其较高的表面活性,所稳定的乳液粒径最小(~131.97 nm)。初始液滴尺寸的差异通常是由均质化过程中乳化剂表面活性和吸附动力学的差异所引起[25]。对乳液的Zeta 电位进行测量(图1b),结果表明所有乳液的表面电位均为负值,其中,由蛋白质稳定的乳液具有较强的静电斥力(电势绝对值大于3 0 mV),T80 稳定的乳液的电位值相对较小(14.20 mV),这可能是因为由蛋白稳定乳液的pH 值远高于蛋白的等电点(pI≈4~5),因此吸附的蛋白质会带强烈的负电荷,从而赋予乳滴间较强的静电排斥力。
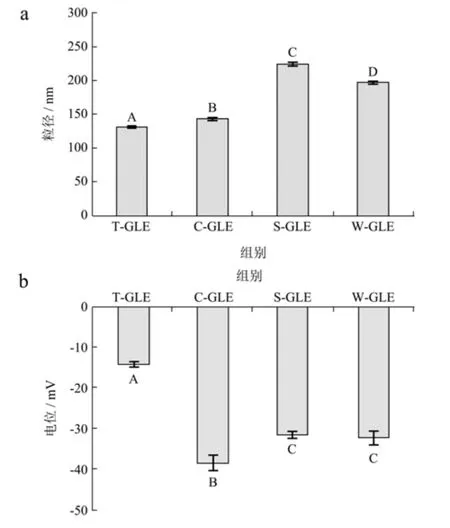
图1 不同乳化剂稳定乳液的初始粒径(a)和电位(b)Fig.1 Particle size (a) and zeta-potential (b) of the emulsions stabilized by different emulsifier
2.2 乳液稳定性
2.2.1 贮藏稳定性
乳液的粒径大小和微观形态对乳液的稳定性(乳析、絮凝和聚结)有重要影响。将新鲜制备的乳液置于4 ℃下贮藏14 d,观察乳液平均粒径、宏观和微观结构的变化(图2)。从结果可以看出,四种乳液在外观上相似,为颜色均一的乳白色,无分层、乳析现象。在4 ℃贮藏两周后乳液的外观、微观结构及粒径大小变化不大,表明乳液具备良好的贮藏稳定性。


图2 乳液在14 d 贮藏期的外观(a)、微观结构(b)及粒径(c)的变化Fig.2 Appearance (a),microstructure (b) and particle size (c) of emulsions during 14 days storage
2.2.2 氧化稳定性
油脂的氧化是影响食品品质和货架期的主要原因。多不饱和脂肪酸极易被氧化,产生不良的风味和气味,甚至产生有毒化合物,损害人体健康[26]。可以通过测定乳液在加速氧化储存期所产生的初级氧化产物和次级氧化产物来评估乳液的氧化稳定性。
如图3a 所示,储藏14 d 后,纯亚麻籽油具有最高的过氧化物含量(628.16 mmol/kg)。与纯油和酯相比,乳液界面的组成和厚度能有效减缓脂质氧化的发生[27]。在氧化初期,乳液中的过氧化物含量较高,可能与乳液的高界面面积、乳化过程引入的氧气、剪切应力产生的过热等因素有关[28]。此外,由于单、双脂肪酸甘油酯(亚麻酸)中不饱和脂肪酸的含量较多,对氧的敏感性更大,故在氧化初期其过氧化值迅速增加。在储藏14 d 后,由WPC、SPI 和SC 稳定的乳液氢过氧化物含量分别为217.45、197.73、235.95 mmol/kg,显著少于由T80 稳定的乳液(377.40 mmol/kg)(p<0.05)。这是由于T80 乳液具有较小的平均粒径,更大的界面面积有利于脂质与氧气的接触,加快了脂质的氧化速度,而蛋白质可作为金属螯合剂和自由基清除剂,有利于延缓脂质氧化的发生[29]。
TBARS 是表征脂质次级氧化程度的指标之一,一般与氢过氧化物相结合共同解释油脂氧化过程。如图3b 所示,TBARS 与脂质过氧化物的结果具有类似的趋势。储存14 d 后,亚麻籽油具有最高的TBARS值,为1.30 mmol/kg,Nasrabadi 等[15]的实验结果也表明散装亚麻籽油在50 ℃的储存下具有更高的POV 和TBARS 值,这是多不饱和脂肪酸在高温下更快氧化的结果。四种乳液的 TBAR S 值均较低(0.26~0.37 mmol/kg),由于乳液的界面层充当了油滴的物理屏障,油脂液滴与具有促进油脂氧化的离子相互作用减弱,使其氧化速率减慢[15]。氧化稳定性实验结果表明乳液能够提高亚麻籽油及其甘油酯的氧化稳定性,并且相比T80,蛋白质对油脂的氧化保护效果更好。
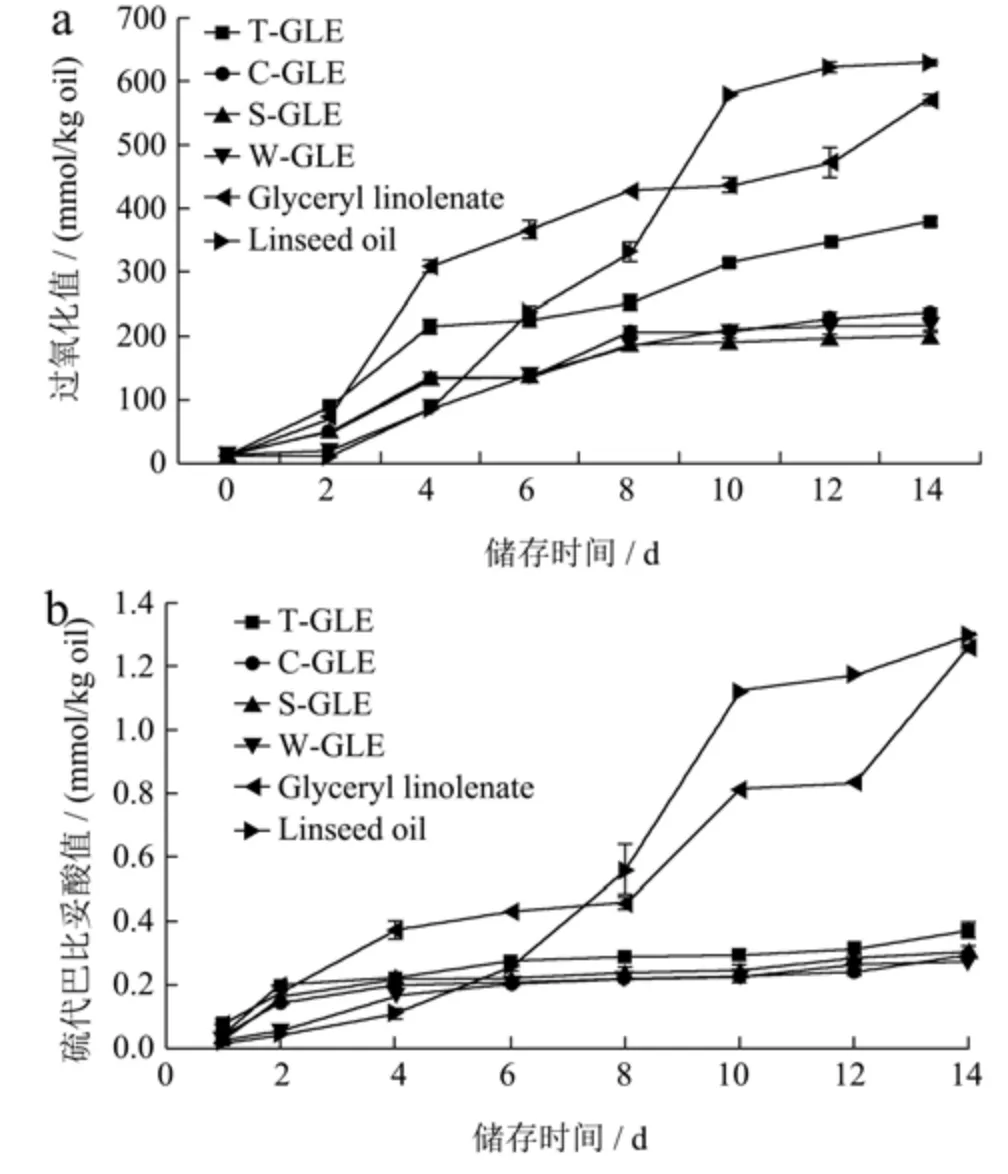
图3 乳液在50 ℃下贮藏14 d氢过氧化物浓度(a)和TBARS浓度(b)Fig.3 Lipid hydroperoxide concentration (a) and TBARS concentration (b) of emulsions stored at 50 °C for 14 days
2.3 体外模拟消化过程中乳液的结构变化
乳液经模拟口腔消化后,所有样品的平均粒径较初始粒径都略微增加(图4a),但仍保持初始乳液的粒径分布(图5)。荧光显微图(图6)显示模拟口腔消化后脂滴发生了轻微的絮凝,脂滴絮凝可归因于模拟唾液中黏蛋白分子的桥接作用[30],这与Yuan 等[31]的研究结果一致。在电位方面(图4b),经口腔消化后各乳液的电位与初始样品具有相似的趋势,T80 稳定乳液的电位值较初始值显著升高(p<0.05)。
模拟胃相消化后,可以观察到所有样品的平均粒径显著增加(p<0.05)(图4a),且粒径分布中大颗粒的数量增多(图5),尤其以蛋白稳定的乳液最为明显。从荧光显微镜图像可以看出经过胃相消化后出现了大量液滴絮凝(图6),其中,T80 稳定的乳液的液滴聚集水平要比蛋白质乳液小得多,胃内脂滴聚集可归因于蛋白质被胃液中的蛋白酶水解,使得蛋白包被液滴之间的静电斥力降低[31]。通过模拟胃相消化后,所有样品的电位相当相似,接近于零(0.35~4.19 mV)(图4b),这可能是因为脂滴表面的蛋白质被蛋白酶部分消化,蛋白质分子在低于其等电点的低pH 值下带正电荷,使阴离子被吸收到阳离子液滴表面,从而实现电荷中和,这与之前的研究报道一致[31]。
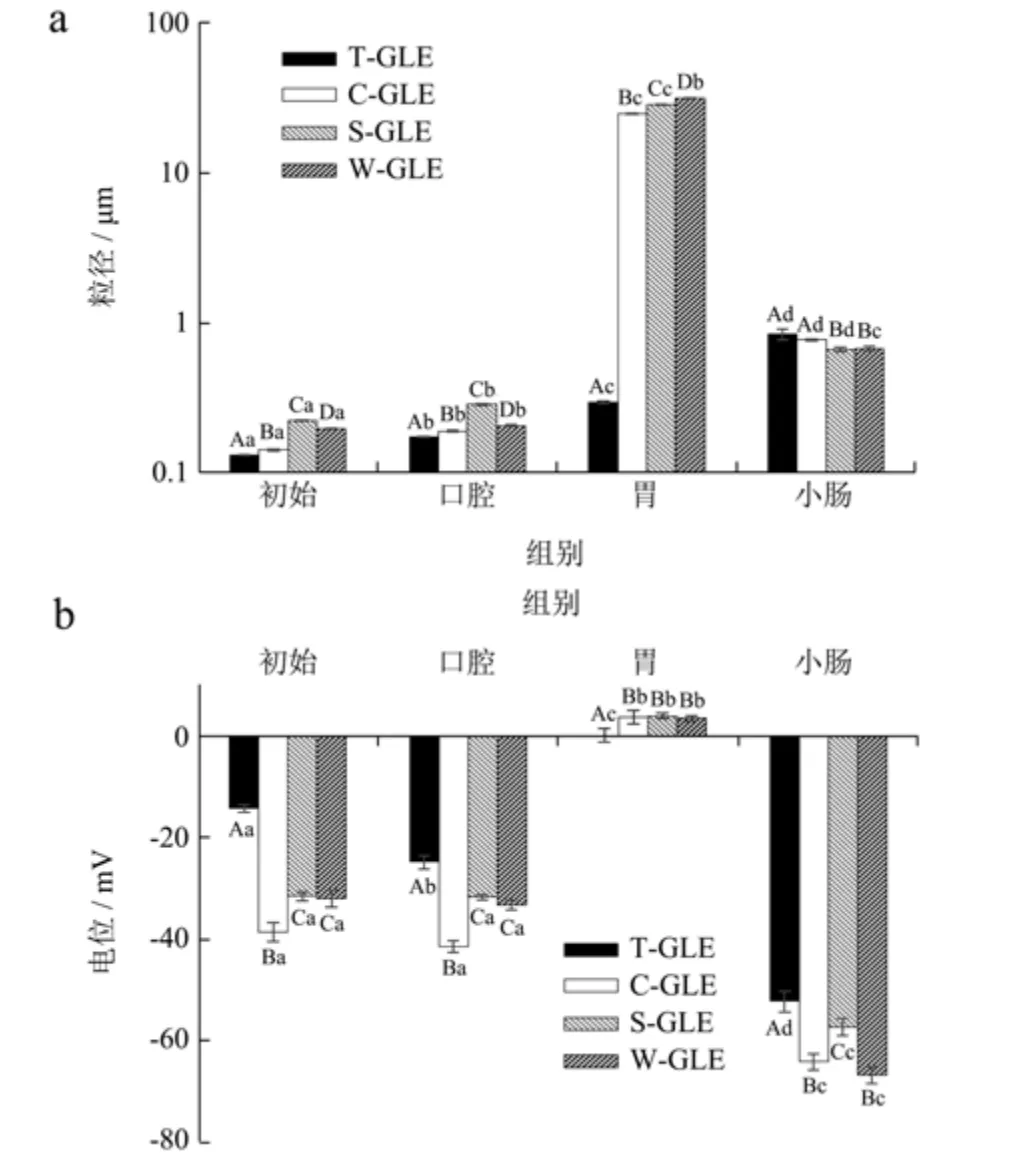
图4 不同模拟消化阶段乳液的粒径(a)和电位(b)Fig.4 Particle size (a) and zeta-potential (b) of emulsions at different simulative digestion stages
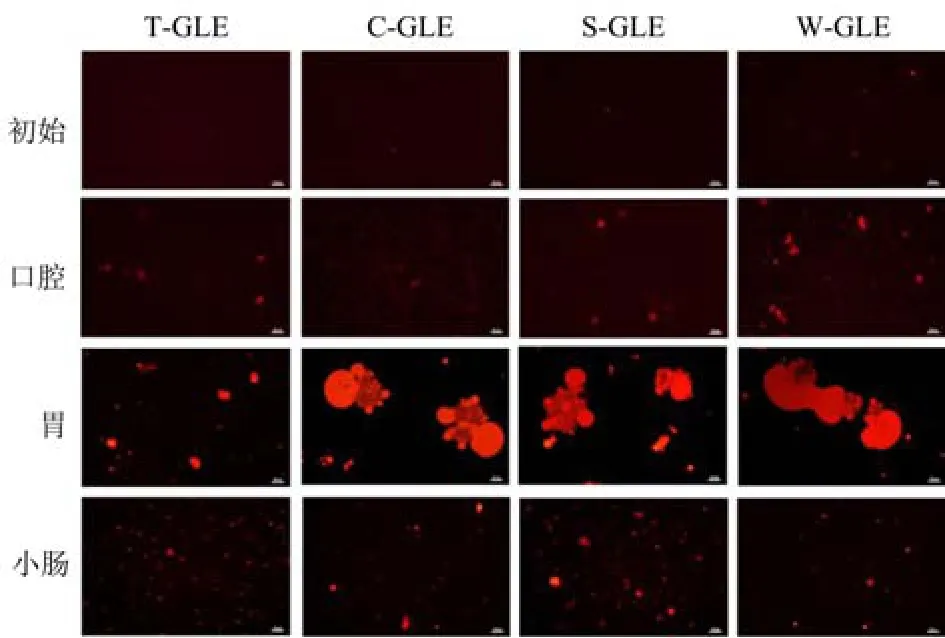
图6 不同模拟消化阶段乳液的荧光显微图像Fig.6 Fluorescence microscopic images of emulsions at different simulative digestion stages
模拟小肠消化后,可以观察到所有样品的平均粒径(d32<1 μm)显著降低(p<0.05)(图4a),平均粒径的减小主要是由于脂滴被脂肪酶消化所致。此外,部分乳液粒径分布呈多峰分布(图5),这可能是由于食糜中存在不同类型的胶体颗粒,如混合胶束、不溶性钙盐等[31]。所有样品经过模拟小肠阶段后,负电荷均高于胃阶段,这可以归因于模拟小肠相中存在阴离子胶体粒子。乳化剂的类型对模拟小肠阶段后混合物的电势有一定的影响,WPC、SPI 和SC 比T80 具有更高的负电荷,这可能是由于蛋白质更容易在颗粒表面聚集,从而导致负电荷更低。

图5 不同模拟消化阶段乳液的粒径分布Fig.5 Particle size distribution of emulsions at different simulative digestion stages
2.4 脂质消化
通过pH-stat 方法研究了乳化剂类型对脂质消化的影响,以单、双脂肪酸甘油酯(亚麻酸)和亚麻籽油为对照,体外模拟消化模型中的脂肪酸释放率如图7所示。与纯油和酯相比,乳液因其较小的液滴尺寸和更大的比表面积有利于脂质的消化,且表面活性剂和蛋白质易于被胆汁盐置换,从而提高脂质的消化速率[15]。对乳液的消化速率分析表明,乳化剂类型对游离脂肪酸的释放影响不大,表现为SPI(68.03%)>SC(64.03%)≈T80(63.22%)≈WPC(61.67%)。不同乳液之间脂解程度存在的差异可能是因为乳化剂的性质会影响模拟消化液中的胆汁盐、脂肪酶和其他反应物吸附到脂滴表面的能力,此外,乳化剂与胃肠道中成分的相互作用、乳液液滴的大小和比表面积也会对脂质消化产生影响[32,33]。有研究表明,尽管小分子表面活性剂(T20)稳定乳液在胃部消化过程中聚集程度较小,但由于T20 较高的表面活性,限制了脂肪酶/共脂肪酶复合物在脂滴表面的吸附,从而降低了乳液的消化速率[33]。与亚麻籽油(23.93%)相比,单、双脂肪酸甘油酯(亚麻酸)的初始消化速度更快,最终消化率更高(46.33%)。此前有文献报道,富含α-亚麻酸的甘油二酯比亚麻籽油具有更高的消化率[11]。Golding 等[34]的实验结果也表明,在消化吸收特性实验中,与甘油三酯相比,甘油二酯产生的乳糜微粒更容易被脂肪酶水解,从而释放更多的脂肪酸。
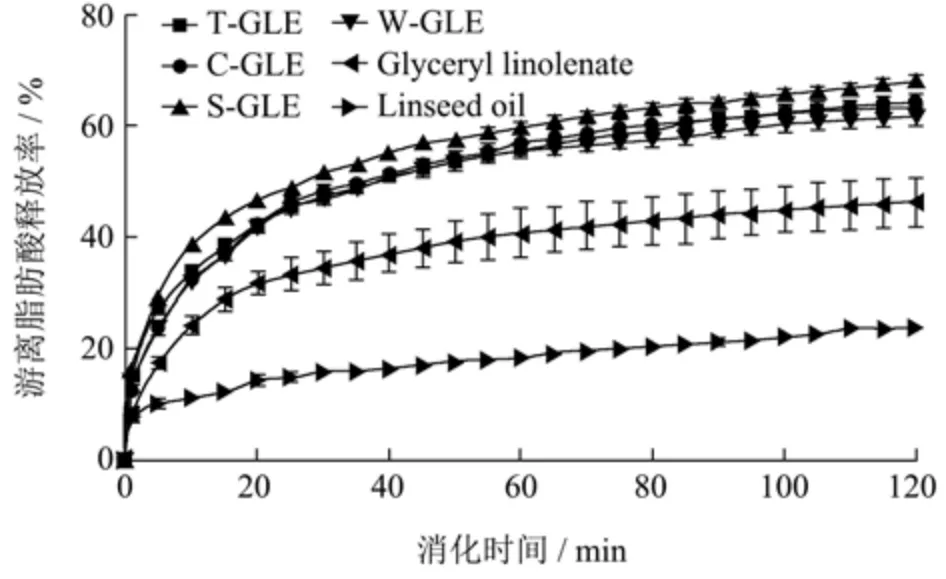
图7 小肠消化阶段乳液中游离脂肪酸的释放曲线Fig.7 Released profile of free fatty acid from emulsions during small intestine digestion phase
3 结论
以单、双脂肪酸甘油酯(亚麻酸)为油相,以乳清浓缩蛋白、大豆分离蛋白、酪蛋白酸钠和吐温80 为乳化剂制备乳液。结果表明,不同乳化剂所制备的乳液均具有较小的粒径和均一的粒径分布,且在14 d 的储藏期内保持相对稳定。脂质氧化实验结果表明,相比T80,蛋白质作为乳化剂在抑制油脂氧化方面更加有效。在体外消化试验中,蛋白质稳定的乳液在胃消化阶段出现大量颗粒聚集,但所选乳化剂对乳液中脂质的最终水解程度影响不大,同时与亚麻籽油相比,单、双脂肪酸甘油酯(亚麻酸)的初始消化速度更快,最终消化率更高。因此,为了延长富含不饱和脂肪酸脂质的货架期并改善其消化能力,在乳液递送体系的构建过程中,选择合适的乳化剂具有重要的意义。
