百里香酚纳米复合诱导大豆蛋白自组装凝胶及机制
2023-01-12陈飞平戴凡炜陈于陇叶明强王玲戚英伟罗政吴继军
陈飞平,戴凡炜,陈于陇,叶明强,王玲,戚英伟,罗政,吴继军
(广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)
百里香酚(Thymol,C10H14O)已被欧盟(EU)和美国食品药品管理局(FDA)列入食品添加剂GRAS(一般公认安全)名单,也是我国允许使用的食品添加剂。它是一种疏水性酚类物质,可导致病原菌细胞膜损伤,产生抑菌作用[1],且抑菌活性优于香芹酚、丁香酚等其他植物精油[2]。然而,疏水特性使它难以在食品体系中均匀分散,当使用浓度高于溶解度(0.074%[3])时,百里香酚会导致溶液浑浊、沉淀而损害食品的外观品质,并且其强烈的芳香气味也会对食品香气产生负影响。事实上,在牛奶、胡萝卜汁等食品中百里香酚的质量分数往往高于0.1%才能对食物源致病菌产生有效的抑制作用[4,5],因此百里香酚的溶解性差问题是其产业化应用亟待解决的问题。
蛋白质是天然高分子,以蛋白质作为基料构建活性物质输送载体是当前的研究热点,主要形式包括乳液、胶囊、分子复合物、凝胶、核心-外壳颗粒、胶束等,其中凝胶基输送载体是蛋白分子经物理或化学交联后形成的三维空间网络结构,是生物活性物质包埋缓释的良好输送载体[6,7]。大豆蛋白是豆油加工的副产物,具有降胆固醇等功效,在结构上含有极性和非极性基团并且氨基酸组成合理,具有优越的与小分子活性物质结合的能力,是近年来活性物质输送载体的研究热点[8,9]。大豆蛋白凝胶的形成往往需要热变性及交联剂或凝固剂的辅助[10],基于小分子活性物质复合直接诱导大豆蛋白凝胶的研究还鲜见报道。前期研究发现,在pH 偏移处理条件下,百里香酚复合在非热条件下可促进大豆蛋白形成凝胶结构,但两者共组装凝胶的调控手段及机制仍不明确。
pH 偏移处理已被证明是一种有效的蛋白质功能修饰方法,该处理可提高蛋白质的凝胶特性及其对多酚的结合能力[11,12]。另外,在pH 偏移处理条件下,多酚复合可诱导蛋白质成胶。例如,添加茶多酚可促进碱诱导的蛋白质三维网络结构的形成,促进蛋清蛋白钙离子交联凝胶[13]和热致凝胶的形成[14];添加没食子酸或芦丁可改善明胶水凝胶的理化特性[15]。但这些研究主要针对动物蛋白,而对pH 偏移处理协同疏水性多酚复合诱导植物蛋白凝胶的研究还较少。Guo 等[16]研究发现,亲水性多酚单宁酸通过共价结合可诱导大豆蛋白在碱性条件下形成凝胶。
前期研究发现,百里香酚与大豆蛋白形成纳米复合物后,其抑菌活性提高[17],而且对百香果具有防腐保鲜作用[18]。鉴于此我们推断由百里香酚复合诱导的大豆蛋白凝胶具有抑菌功能活性,可作为基料应用于功能性食品生产中。因此,本文的研究目的是探索百里香酚纳米复合诱导大豆蛋白自组装凝胶的途径及其机制,同时探索百里香酚在食品工业中应用能否同时发挥抑菌剂和胶凝剂双重功能。
1 材料与方法
1.1 试验材料与试剂
百里香酚(纯度>98%,分析纯),上海阿拉丁公司;大豆分离蛋白(干基蛋白含量为91.5%),实验室自制;硫黄素T(ThT)、尿素(分析纯),美国Sigma公司;DL-二硫苏糖醇(DTT,分析纯),江苏绿叶生物有限公司;其他试剂均为分析纯。
1.2 仪器设备
UV-1900i 紫外分光光度计,日本SHIMADZU 公司;Nano ZS90 纳米粒度分析仪,英国Malver 公司;5810R 高速离心机,德国Eppendorf 公司;Millrock 冷冻干燥机,德国Millrock 公司;Cary Eclipse 荧光光谱仪,美国Varian 公司;TH2-82A 数显恒温震荡仪,常州澳华仪器公司。
1.3 试验方法
1.3.1 大豆蛋白-百里香酚纳米复合物制备
称取一定量的大豆分离蛋白粉末溶解于去离子水中,配置成质量浓度为50~100 mg/mL 的大豆蛋白溶液,磁力搅拌2 h 后,置于4 ℃冰箱中水化过夜,之后取出恢复至室温后,用1 mol/L NaOH 溶液调节pH 值至9.0~12.0,加入质量为0.033~0.40 g/g 蛋白的百里香酚晶体,在40 ℃条件下磁力搅拌3 h,并用1 mol/L NaOH 溶液维持体系pH 值为初始值,5 000 r/min 离心10 min,取上清即为大豆蛋白-百里香酚纳米复合物溶液。
1.3.2 大豆蛋白-百里香酚纳米复合物凝胶制备
大豆蛋白-百里香酚纳米复合物冷致凝胶的制备参考Zhang 等[19]的方法,并有所调整。大豆蛋白-百里香酚纳米复合物溶液制备之后,使用1 mol/L HCl 溶液将其pH 调节至中性,之后放置于4 ℃、18 h 使之形成凝胶。
1.3.2.1 蛋白浓度的影响
在固定百里香酚添加量0.04 g/g 蛋白、初始pH 值11.0、终止pH 值7.0 条件下,研究不同蛋白浓度(50、75 和100 mg/mL)对大豆蛋白-百里香酚纳米复合物自组装凝胶的影响。
1.3.2.2 百里香酚添加量的影响
在固定蛋白浓度75 mg/mL、初始pH 值11.0、终止pH 值7.0 条件下,研究不同百里香酚添加量(0.033、0.067、0.08、0.10、0.133、0.20 和0.40 g/g 蛋白)对大豆蛋白-百里香酚纳米复合物自组装凝胶的影响。
1.3.2.3 反应初始pH 值的影响
在固定蛋白浓度75 mg/mL、百里香酚添加量为0.133 g/g 蛋白、终止pH 值7.0 条件下,研究了反应初始pH 值(9.0、10.0、11.0 和12.0)对大豆蛋白-百里香酚纳米复合物自组装凝胶的影响。
1.3.2.4 反应终止pH 值的影响
在固定蛋白浓度75 mg/mL、百里香酚添加量为0.133 g/g 蛋白、初始pH 值11.0 条件下,研究了不同终止pH 值(6.0、7.0 和8.0)对大豆蛋白-百里香酚纳米复合物自组装凝胶的影响。
1.3.3 复合物表征
1.3.3.1 荷载效率
将制备的纳米复合物溶液用去离子水稀释100 倍后,取1 mL 加入4 mL 乙酸乙酯中,涡旋混匀萃取,室内避光放置30 min 分层后,取上清液测定276 nm 处的吸光值,根据标准曲线计算百里香酚的浓度,然后按照以下公式计算荷载率(Encapsulation Efficiency,EE,%)和荷载量(Load Amount,LA,mg/mg 蛋白)。

式中:
m1——复合物中百里香酚含量,mg;
mt——总加入百里香酚含量,mg;
mp——总大豆蛋白质量,mg。
1.3.3.2 颗粒分布和平均粒径
大豆蛋白溶液及复合物溶液中颗粒的分布和平均粒径测定采用动态光散射(DLS)技术,溶液样品用经0.22 μm 膜过滤的、与样品pH 相同的磷酸盐缓冲液(PBS、10 mmol/L)稀释至蛋白质浓度为0.5 mg/mL,之后用Malvern Nano ZS 仪器分析,设备参数为:激光器He-Ne(633 nm)、散射角173 °、测试温度25 ℃。
1.3.4 复合物自组装凝胶机制
1.3.4.1 浊度分析
复合物溶液浊度(τ)分析采用分光光度法,参考陈楠楠的方法,并有所调整[20]。复合物溶液用pH 值相同的磷酸盐缓冲液(10 mmol/L)稀释至3 mg/mL 后,取3.0 mL 的样品溶液置于宽度为1 cm 的比色皿中。样品池温度使用恒温仪控制在(20±0.2)℃。用分光光度计测量在500 nm,溶液的浊度随时间的变化。用以下公式计算:

式中:
A——500 nm 处的吸光度(×稀释倍数);
L——光程长度(1 cm)。
1.3.4.2 Th T 荧光
蛋白质淀粉样纤维化采用Th T 荧光法分析,参考Koscielska 等[21]的方法。取8 mg Th T 溶于10 mL 磷酸缓冲液(10 mmol/L、pH 值7.0)中制得Th T 浓缩液,待其充分溶解后用0.22 μm 滤膜去除不溶性颗粒。Th T储液用金属箔密封避光保存,置于4 ℃的冰箱中保存。每次使用前用上述磷酸缓冲液将浓缩液以1:50 比例稀释后制得Th T 工作液。取50 μL 待测样品(预先稀释至蛋白浓度10 mg/mL)加入5 mL Th T 工作液,震荡混匀至少1 min 以保证测量结果准确性。使用荧光分光光谱仪进行Th T 荧光测量。仪器参数设置如下:激发波长和发射波长分别是460 nm 和490 nm,激发波长的狭缝间隙10 nm,发射波长的狭缝间隙5 nm,扫描速率240 nm/min,扫描波长范围为470~600 nm,电压700 V。实验中记录在488 nm 左右出现最大吸收峰的高度值(Height)。
1.3.4.3 凝胶作用力分析
凝胶网络形成的分子间作用力通过分析凝胶在不同溶剂中的浊度来确定,参考Tang 等[22]以及Zhao 等[23]的方法,并有所调整。取0.2 g 凝胶样品加入3 mL 变性剂中,磁力搅拌1 h 后,1 000 r/min 离心15 min,上清液测定500 nm 下的吸光值,之后根据1.3.3.1 计算浊度。浊度降低,表明该变性剂代表的作用力较强。选用的变性剂为:6 mol/L 尿素-10 mmol/L 磷酸缓冲液(分析氢键作用力和疏水相互作用力)、10 mmol/L DTT-10 mmol/L 磷酸缓冲液(分析二硫键作用力)、0.6 mol/L NaCl-10 mmol/L 磷酸缓冲液(分析静电作用力),对照为10 mmol/L 磷酸缓冲液(PBS),所选用的缓冲液pH 值与样品的pH 值保持一致。
1.4 数据处理与分析
每个实验重复3 次,采用Excel 2010 处理数据和Origin软件作图,采用SPSS软件对数据进行显著性分析。
2 结果与讨论
2.1 不同蛋白浓度的影响
蛋白浓度是影响蛋白质凝胶的重要因素,通常认为大豆蛋白凝胶所需的蛋白质量浓度为10%(m/V)[24]以上。如表1 所示,在百里香酚添加量较低情况下,大豆蛋白能将其完全荷载,荷载率均达到100%左右,荷载量为0.04 mg/mg 蛋白左右。与前人的研究相符,在低百里香酚结合条件下,大豆蛋白-百里香酚纳米复合物自组装凝胶的临界蛋白质量浓度为10%(100 mg/mL)[24],该质量浓度明显低于单宁酸诱导大豆蛋白凝胶所需蛋白质量浓度(12%)[16],表明百里香酚是一种较好的大豆蛋白胶凝剂。
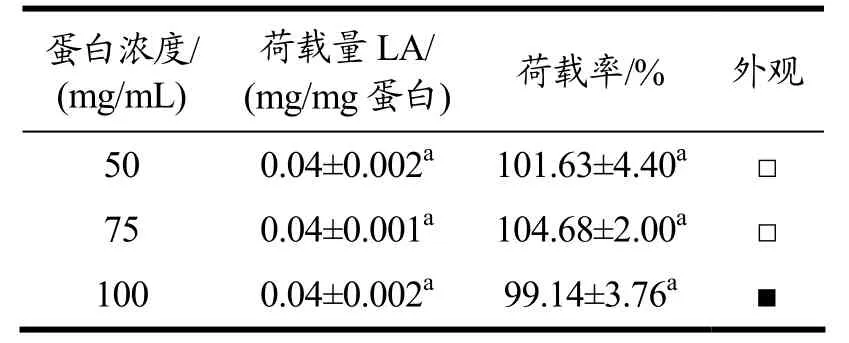
表1 蛋白质量浓度对大豆蛋白-百里香酚纳米复合物的荷载效果及形态的影响Table 1 Effects of protein concentration on the loading efficiency and appearance of soy protein-thymol nanocomplexes
2.2 不同百里香酚添加量的影响
大豆蛋白构象中含有疏水位点和疏水区域,主要通过疏水相互作用结合生物活性物质,如百里香酚、姜黄素等,在一定的构象条件下,随着活性物质增加,大豆蛋白的结合位点会趋于饱和[17,25,26]。如表2 所示,随着百里香酚添加量增加,大豆蛋白对百里香酚的荷载量增加,在百里香酚添加量不超过0.20 g/g 蛋白时,大豆蛋白的荷载率达到100%(表2),当添加量继续增加时,荷载率降低,说明此时大豆蛋白的结合位点已经饱和,大豆蛋白对百里香酚的最高荷载量达到0.33 mg/mg(33%)。将复合物溶液置于4 ℃条件下18 h,发现百里香酚添加量大于0.08 g/g 蛋白时,复合物开始凝胶化,从溶胶逐渐形成凝胶,但添加量大于0.20 g/g 蛋白之后,复合物不能形成凝胶,说明在蛋白浓度75 mg/mL、反应初始pH 值11.0、反应终止pH 值为7.0 条件下,大豆蛋白-百里香酚纳米复合物自组装凝胶的临界百里香酚浓度为0.08 g/g 蛋白,在0.08~0.20 g/g 蛋白添加量范围内,百里香酚浓度增加有利于大豆蛋白的胶凝特性,这结果与单宁酸诱导大豆蛋白自组装凝胶类似,随着单宁酸浓度增加,所形成大豆蛋白凝胶的硬度增加[16]。但百里香酚荷载量过高可能会诱导蛋白分子间相互作用,产生聚集体,从而影响凝胶的形成。
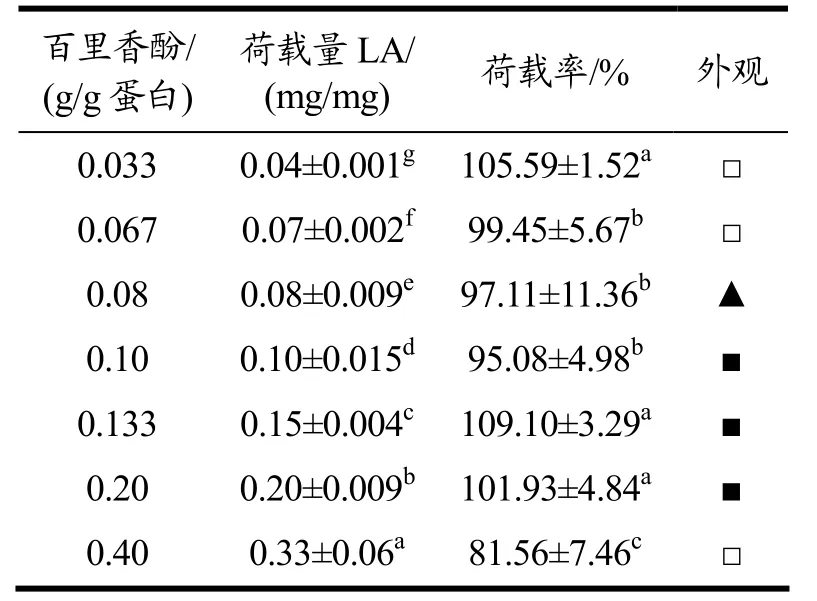
表2 百里香酚添加量对大豆蛋白-百里香酚纳米复合物的荷载效果及形态的影响Table 2 Effects of thymol adding amount on the loading efficiency and appearance of soy protein-thymol nanocomplexes
另外,很有趣的是,当复合物中百里香酚荷载量增加时,大豆蛋白冷致凝胶所需的蛋白浓度降低(75 mg/mL),表明百里香酚复合具有促进大豆蛋白自组装凝胶作用。该结果与Zhong 等[27]的研究报道相符,该研究发现高浓度葛根素结合会促进乳清蛋白热致凝胶的形成,随着葛根素添加量增加,乳清蛋白凝胶的强度提高。
2.3 不同反应初始pH 值的影响
pH 值偏移处理是一种可改善蛋白质的功能特性的技术[28],已被证实可提高大豆蛋白热致凝胶性能[11]。考虑到百里香酚在碱性条件下溶解性较好,本研究选择远高于等电点的pH 值环境处理大豆蛋白。如表3 所示,随着pH 值增加,大豆蛋白对百里香酚的荷载量提高,表明pH 值偏移处理可提高大豆蛋白对百里香酚的结合能力。该结果与前人研究结果相符[12,29],可能与pH 值偏移处理诱导蛋白结构解离和重组装有关[30]。然而当体系pH 值达到12.0 时,荷载量反而下降(表3),可能是因为在极端pH 值条件下,大豆蛋白结构展开,构象和表面特性发生严重变化,不利于百里香酚的结合。在四种pH 值条件下制备的大豆蛋白-百里香酚纳米复合物均能凝胶化,且随着pH 值提高,复合物溶液从溶胶逐渐转变成凝胶,且凝胶的形变逐渐减少(图1)。pH 值大于10.5 可诱导蛋清蛋白溶液形成凝胶[13],而本文大豆蛋白在pH 值大于9 即可自组装形成冷致凝胶,表明百里香酚复合对pH 值偏移处理诱导大豆蛋白自组装凝胶有促进作用。考虑到pH 值12.0 时大豆蛋白严重变性产生异味,故选择pH 值11.0 作为最适宜的反应初始pH 值。

表3 反应初始pH 对大豆蛋白-百里香酚纳米复合物的荷载效果及形态的影响Table 3 Effects of initial reaction pH on the loading efficiency and appearance of soy protein-thymol nanocomplexes
2.4 不同反应终止pH 值的影响
蛋白质凝胶是分子间相互作用形成网络结构的结果,在碱性条件下,由于蛋白质的羧基(COOH)去质子化成COO-,产生高度负电荷结构,分子间静电排斥力大,不利于凝胶的形成,因此在反应结束后需要调低体系的pH。如图1 所示,最终体系为弱酸性或弱碱性均不利于大豆蛋白-百里香酚纳米复合物自组装凝胶的形成,在pH 值为7.0 和8.0 时,复合物能自组装成凝胶和溶胶,在pH 值为6.0 时,复合物保持溶液状态,甚至在贮藏半个月之后有分层现象。

图1 反应初始pH 值(左)和终止pH 值(右)对大豆蛋白-百里香酚纳米复合物自组装凝胶的影响Fig.1 Effects of initial reaction pH and reaction ending pH on the self-assembly gelation of soy protein-thymol nanocomplexes
2.5 大豆蛋白-百里香酚纳米复合物自组装凝胶机制
以不同反应终止pH 制备的复合物为对象研究大豆蛋白-百里香酚纳米复合物自组装凝胶机制。从外观分析可知,在pH 值8.0~6.0 条件下,没有百里香酚的纯蛋白溶液均保持溶液状态,而复合百里香酚后,pH值8.0 和7.0 体系的蛋白能形成溶胶和凝胶(表4)。
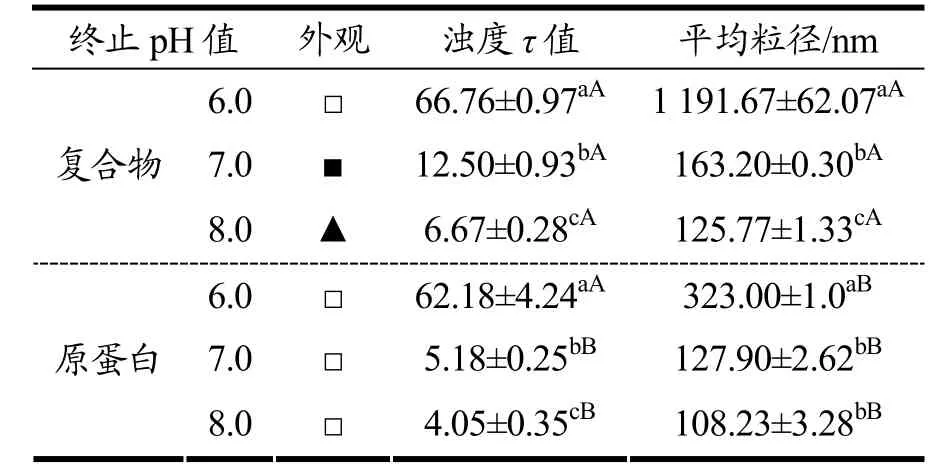
表4 不同终止pH 值条件下制备的大豆蛋白-百里香酚纳米复合物的形态、浊度和Th T 荧光强度Table 4 Effects of reaction ending pH on the appearance,turbidity and Th T fluorescence intensity of soy protein-thymol nanocomplexes
从溶液粒径分布和平均粒径分析可知,随着pH 值降低,大豆蛋白的平均粒径增加,颗粒的粒径逐渐趋势大颗粒范围分布(表4、图2)。在没有百里香酚存在的纯蛋白体系中,在pH 值8.0~6.0 环境下,蛋白分子主要以纳米颗粒形式存在,pH 值降低会诱导部分蛋白分子发生局部聚集,形成较大的聚集体。在大豆蛋白-百里香酚复合物体系中,百里香酚的结合会进一步诱导蛋白分子聚集,平均粒径增加16.21%~268.94%,并且在pH 值6.0 条件下,绝大部分复合物以微米级别大小颗粒存在。很有趣的是,在没有百里香酚的体系,蛋白适度聚集并不能诱导自组装凝胶的发生,但在百里香酚存在的体系,pH 值和百里香酚协同诱导大豆蛋白聚集化,并且适度聚集可进一步诱导自组装凝胶的发生,过低或过度聚集都会破坏复合物的自组装凝胶特性。在pH 值7.0 条件下制备的复合物以粒径小于1 000 nm 的颗粒存在,因此由大豆蛋白-百里香酚纳米复合物自组装制备的凝胶为纳米凝胶。
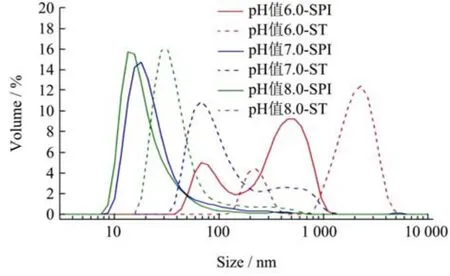
图2 不同反应终止pH 值条件下制备的大豆蛋白-百里香酚纳米复合物溶液的粒径分布图Fig.2 Typical particle size distribution profiles of soy protein-thymol nanocomplexes prepared with different reaction ending pH
球蛋白自组装纤维化的显著特点之一就是形成了具有β-折叠结构的淀粉样纤维,硫黄素T(Th T)是一种阳离子苯并噻唑染料,能与淀粉样纤维结合后使荧光强度显著增强[31],因此可通过Th T 荧光强度的变化来表征大豆蛋白自组装纤维化情况。从图3 可知在弱酸性和弱碱性条件下,大豆蛋白(7.5%,m/m)能够自组装纤维化,形成一定程度的纤维结构。通常认为大豆蛋白纤维化是蛋白先水解成多肽,之后多肽自组装成有序的纤维结构的过程,一般在远离等电点的pH值、加热及低浓度蛋白条件下进行,水解反应是蛋白纤维化的主要限速条件,而高浓度蛋白(7.5%~8.0%,m/m)可增加初始蛋白的聚集速率[32]。这可能就是本研究大豆蛋白在弱酸和弱碱条件下纤维化的原因,大豆蛋白适度水解后自组装形成“蠕虫状”的聚集体。在中性条件下,蛋白自身纤维化程度最低,但百里香酚结合可促进大豆蛋白纤维化,Th T 的荧光强度提高93.78%,且纤维化程度与pH 值6.0 弱酸诱导大豆蛋白纤维化程度相当。另外,在弱酸和弱碱条件下,百里香酚结合对大豆蛋白纤维化的促进作用不明显。结合大豆蛋白-百里香酚纳米复合物凝胶化结果(图1),可推断百里香酚结合诱导的大豆蛋白纤维性能可能与酸诱导的大豆蛋白纤维性能不同。Xu 等[33]报道,没食子儿茶素没食子酸酯(EGCG)复合可裂解大豆蛋白纤维的刚性结构,形成柔韧性的纤维,从而诱导大豆蛋白纤维自组装成凝胶结构。

图3 不同反应终止pH 值条件下制备的大豆蛋白-百里香酚纳米复合物溶液的Th T 荧光强度Fig.3 Th T fluorescence intensity of soy protein-thymol nanocomplexes prepared with different reaction ending pH
动态光散射度检测蛋白质溶液中的微小聚集颗粒十分灵敏,一旦溶液中出现大于单体分子的颗粒,扫描光波就会发生很大的变化,因此可使用动态光散射测量溶液中的光散射强度的变化来表征蛋白自组装纤维化过程[34]。从图4 可知,大豆蛋白在弱酸性条件下光散射强度明显高于中性和弱碱性,说明其酸性条件可诱导大豆蛋白自组装纤维,在中性和碱性条件下,大豆蛋白自组装纤维能力较弱。然而,在中性条件下,百里香酚结合能显著增加大豆蛋白的光散射强度(154.67%),表明百里香酚结合可诱导大豆蛋白自组装纤维。

图4 不同反应终止pH 值条件下制备的大豆蛋白-百里香酚纳米复合物溶液的光散射强度Fig.4 Light scattering intensity of soy protein-thymol nanocomplexes prepared with different reaction ending pH
综上所述,百里香酚结合可诱导大豆蛋白纤维化聚集,继而诱导凝胶的形成,但复合物的纤维化程度要保持在适度范围,过高或过低都不利于大豆蛋白自组装凝胶的发生。
2.6 大豆蛋白-百里香酚纳米复合物凝胶网络分子间作用力分析
典型的蛋白质凝胶是由非共价和共价作用力稳定的。Tang 等[22]认为可通过不同化学变性剂对相互作用力的破坏来推断凝胶形成的分子间作用力。Jiang 等[35]认为在蛋白质凝胶中添加一定化学变性剂,可以溶解凝胶网络结构中的结合蛋白,因此可通过蛋白质溶解性的改变来推断凝胶网络的分子作用力。
尿素是一种中性变性剂,可以弱化疏水相互作用和抑制氢键作用。如图5 所示,所有大豆蛋白-百里香酚纳米复合物凝胶在尿素中的浊度均显著低于对照,表明尿素处理增加了凝胶中大豆蛋白的溶解性,因此氢键作用和疏水相互作用是大豆蛋白-百里香酚纳米复合物凝胶网络结构形成的主要作用力。这与Gulseren 等[36]的研究结果相符,该研究表明尽管大豆蛋白功能的影响因素众多,氢键和疏水相互作用在强化其凝胶特性中发挥重要作用,从而使大豆蛋白凝胶结构致密性增加。
DTT 也是一种变性剂,可通过还原蛋白质的二硫键从而阻止半胱氨酸残基之间相互作用形成蛋白质分子内或分子间二硫键。如图5 所示,大豆蛋白-百里香酚纳米复合物凝胶在DTT 溶液中的溶解度高于对照,但显著低于尿素溶液。DTT 可以破坏二硫键从而使原本连接这些共价键的蛋白溶解,因此可推断二硫键对于大豆蛋白-百里香酚纳米复合物凝胶网络形成发挥一定的作用,但贡献率低于氢键和疏水相互作用。该结果与大豆蛋白热致凝胶不一致,Zhao 等[23]报道形成大豆蛋白热致凝胶网络的分子作用力主要为二硫键、氢键和疏水相互作用,表明百里香酚结合诱导大豆蛋白凝胶机制与热变性诱导大豆蛋白凝胶机制不同,百里香酚结合后会阻止蛋白分子间二硫键的形成,但会通过自身分子间形成氢键或促进蛋白分子间氢键的形成。
尽管KCl 不是一种变性剂,但通常被用于研究凝胶网络结构的静电相互作用。如图5 所示,所有大豆蛋白-百里香酚纳米复合物凝胶在KCl 溶液中的溶解度显著低于对照,表明静电相互作用并不是大豆蛋白-百里香酚纳米复合物凝胶网络形成的主要作用力。

图5 不同反应体系pH 值条件下制备的大豆蛋白-百里香酚纳米复合物凝胶的分子间相互作用力分析Fig.5 Intermolecular interaction forces of soy protein-thymol nanocomplexes hydrogels prepared with different reaction pH
从上述分析,可推断大豆蛋白-百里香酚纳米复合物凝胶网络的形成主要依赖氢键和疏水相互作用力,其次是二硫键作用力,静电相互作用力不参与该过程。
考虑到在碱性条件下,蛋白三级结构展开,疏水位点暴露[11],百里香酚质子化在水中溶解性提高[37],百里香酚分子结合到蛋白疏水位点,较高荷载的百里香酚分子间相互作用形成桥联,促进蛋白分子间纤维化聚集,形成适度尺度的聚集体[26]。结合以上分析,可推断大豆蛋白-百里香酚纳米复合物自组装凝胶的机制为:在碱性条件下,百里香酚分子结合到大豆蛋白疏水区域,之后体系pH 值调节至中性,蛋白结构重叠,蛋白分子间、百里香酚分子间相互作用增加,诱导纤维化聚集体发生,聚集体之间通过氢键、疏水相互作用和二硫键等作用力形成网络结构,呈现出凝胶状态。
3 结论
本研究分析了蛋白浓度、百里香酚添加量、反应初始pH 值和反应终止pH 值对大豆蛋白与百里香酚相互作用及其自组装凝胶的影响,结果发现,四者协同影响复合物自组装凝胶进程,一个较佳的条件是:蛋白浓度75 mg/mL、百里香酚添加量为0.133 g/g 蛋白、反应体系初始和终止pH 值分别为11.0 和7.0。高载量的百里香酚复合可诱导大豆蛋白产生适度的纤维化聚集,聚集体之间通过氢键、疏水相互作用和二硫键等作用力形成网络结构。因此,百里香酚可作为抑菌剂和胶凝剂在食品工业中应用,发挥双重作用,所构筑的大豆蛋白冷致凝胶可作为生物活性物质递送载体,应用于功能食品开发中。
