岩藻多糖及其降解物在小鼠肠道中的代谢及对肠道代谢产物的影响
2023-01-12张玉姣孙晓娜田伟功王松涛沈才洪艾春青宋爽
张玉姣,孙晓娜,田伟功,王松涛,沈才洪,艾春青,宋爽*
(1.大连工业大学食品学院,辽宁大连 116034) (2.泸州品创科技有限公司国家固态酿造工程技术研究中心,四川泸州 646000)
岩藻多糖是一种含有大量岩藻糖和硫酸基团的硫酸多糖,主要来自于褐藻[1]。岩藻多糖具有多种生物活性如抗凝血[2]、抗病毒[3]、抗氧化[4]、抗肿瘤和免疫活性[5]等。然而,岩藻多糖作为一种天然的高分子化合物,通常无法被人体的消化系统降解[6],仅少量可被吸收入血[7],绝大部分是以原型到达宿主肠腔内影响肠道微生物及其代谢产物[8],这可能是岩藻多糖发挥健康功效的最重要途径[9]。但是岩藻多糖在体内被肠道菌群代谢情况及其对肠道代谢物的影响仍不清楚,这阻碍了对岩藻多糖功效机制的了解。
肠道微生物群产生的代谢物对宿主的生理状态有重要影响[10,11],因此阐明岩藻多糖对肠道代谢的影响对揭示岩藻多糖功效机制具有重要意义。非靶向代谢组学采用液相色谱-质谱检测(LC-MS)等技术,无偏向性的检测生物体内受到刺激前后所有小分子代谢物的动态变化,并通过生信分析筛选差异代谢物,对差异代谢物进行通路分析,揭示其变化的生理机制[12-14]。因此,在本研究中,非靶向代谢组学被应用于检测岩藻多糖及其降解产物对肠道代谢物的调控作用,以探究岩藻多糖及其降解产物的作用机制。
本研究通过分析岩藻多糖(FUC)、岩藻多糖弱酸降解产物(AFUC)和氧化降解产物(OFUC)在小鼠肠道代谢情况、主要参与岩藻多糖及其降解产物在肠道内代谢的肠道微生物以及其对肠道代谢物的影响,揭示岩藻多糖通过肠道菌群发挥功效的机制及结构因素(硫酸基和相对分子质量)对作用效果的影响。
1 材料与方法
1.1 材料与试剂
岩藻多糖(FUC),青岛明月海琳岩藻多糖生物科技有限公司提供,岩藻多糖弱酸降解产物(AFUC)和氧化降解产物(OFUC)由实验室前期制得,FUC、AFUC和OFUC 的相对分子质量分别为188.6、7.4、19.6 ku,硫酸基含量分别为 28.3%±4.4%、3.1%±0.7%、28.2%±3.1%。1-苯基-3-甲基-5-吡唑啉酮(分析纯),国药集团化学试剂有限公司;氨水(分析纯),天津石英钟厂;乙酸(分析纯),大茂化学试剂有限公司;氯仿(分析纯),武汉化学试剂厂;乙腈(色谱纯),甲醇(色谱纯),Spectrum 公司;甲醇(色谱纯);1-Methylnicotinamide-d3Iodide(标准品),Acetyl-L-carnitine-(N-methyl-d3)(标准品),Dl-glutamic acid(标准品),剑桥同位素;12-[(Cyclohexylcarbamoyl)amino]dodecanoic acid(标准品),Sigma 公司;岩藻糖(标准品),Fluka 公司;乳糖(分析纯),天津光复精密化工研究所。AB SCIEX 4000 QTRAP 质谱仪,美国AB SCIEX;LXQ 液相色谱-线性离子阱质谱仪,赛默飞世尔科技有限公司;CF16RX II 高速冷冻离心机,日本日立公司;XW-80A 漩涡混合器,上海精科有限公司;干燥箱,上海-恒科学仪器有限公司。
1.2 方法
1.2.1 动物实验
动物实验研究方法:本研究方案和实验均得到动物实验伦理委员会的批准(批准方案 I D SYXK2017-0005)。10 只BALB/c 雄性小鼠(SPF 级4周龄),购买于辽宁长生生物技术股份有限公司。小鼠生活环境温度维持在(23±2)℃,相对湿度为55%±5%,明/暗循环12 h 的条件下,自由进食和饮水。小鼠饲养于洁净的标准实验动物饲养笼适应两周。实验前,称量实验小鼠质量,收集实验小鼠的新鲜粪便记为空白组(BLK),冻存于-80 ℃冰箱中。对小鼠灌胃200 μL FUC(每天300 mg/kg),并将小鼠放进代谢笼中,收集24 h 粪便。一天后,再灌胃200 μL AFUC(每天300 mg/kg),并收集24 h 粪便。间隔24 h 以后,再次灌胃200 μL OFUC(每天300 mg/kg),收集24 h 粪便,将粪便样品置于-80 ℃冰箱冻存。
1.2.2 岩藻多糖及其降解产物在粪便中的含量测定
1.2.2.1 混合标准工作液的配制
称取岩藻多糖FUC 或其降解产物(AFUC,OFUC)10 mg,用水溶解并定容至10 mL,制得岩藻多糖标准储备液。分别移取适量岩藻多糖标准储备液,用水逐级稀释成质量浓度为1 000、500、200、100、50、20、10 μg/mL 的混合标准工作液,现用现配。
1.2.2.2 标准溶液的水解
量取0.5 mL 上述标准工作液于5 mL 具螺口和胶垫片的水解管中,再加入0.5 mL 的4 mol/L 的三氟乙酸溶液,密封,放入恒温干燥箱中,设定温度120 ℃,水解3 h,取出水解管,室温冷却。氮吹除去溶剂,再加入0.5 mL 甲醇,氮吹至完全干燥以除去残余的三氟乙酸。
1.2.2.3 样品前处理与水解
准确称取冻干后的粪便样品0.1 g,加入2 mL 纯净水溶解,离心(8 000 r/min,10 min,4 ℃),取1 mL上清溶液加入4 mL 乙醇,在4 ℃条件下静置 4 h 以上,离心(4 000 r/min,10 min,4 ℃),得到沉淀样品。
向离心管中加入0.5 mL 2 mol/L 的三氟乙酸,旋涡混匀,再转移至5 mL 具螺口和胶垫片的水解管中,该操作重复2 次,以保证离心管中沉淀全部转移至水解管中。将水解管密封,放入恒温干燥箱中,设定温度120 ℃,水解3 h。取出水解管,室温冷却。氮吹除去溶剂,再加入0.5 mL 甲醇,氮吹至完全干燥以除去残余三氟乙酸。
1.2.2.4 1-苯基-3-甲基-5-吡唑啉酮(PMP)衍生化
向样品水解物或标准品水解物中加入400 μL 的氨水,使水解管中的残渣充分溶解,然后加入100 μL 10 μg/mL 乳糖内标工作液,再加入400 μL 的PMP 甲醇溶液(0.5 mol/L),混匀,密封后在70 ℃水浴条件下加热反应30 min,氮吹除去溶剂。再加入0.5 mL 甲醇,氮吹除去溶剂,重复2 次,以除去氨水。然后加入1%的乙酸溶液1 mL,再加入1 mL 三氯甲烷,充分涡旋混匀,静置后去除有机相。重复该操作三次,以保证萃取效果。将萃取后水相溶液过0.22 μm 有机系滤膜,得到待测样品供液相色谱-质谱/质谱检测。衍生后的试样应在48 h 内完成检测,否则需冻存(-18 ℃,6 个月内)。
液相色谱-质谱/质谱检测条件:
色谱柱:Thermo scientific Hyperisil Gold(150 mm×2.1 mm,5 μm);进样量:2 μL;柱温:30 ℃;流动相:20 mmol/L 乙酸铵-乙腈(85:15,V/V),等度洗脱;流速:0.5 mL/min。离子化模式:电喷雾离子源(ESI),正离子模式;喷雾电压:5 500 V;辅助加热气温度:600 ℃;扫描模式:多重反应监测(MRM)模式。
1.2.3 小鼠的肠道微生物群分析
16S 扩增子测序采用SDS 方法提取小鼠粪便菌群基因组的DNA,然后通过琼脂糖凝胶电泳检测DNA的纯度和浓度。对基因组DNA 中的16S rRNA 基因V3-4 区扩增,引物选用806R 和515F。根据TruSeq®DNA 无PCR 样品制备试剂盒(Illumina,美国)的说明生成测序文库,并在Qubit@2.0 荧光计(Thermo Scientific)上进行了评估。动物粪便样品测序由诺禾致源生物信息科技有限公司完成。小鼠肠道菌群主成分分析、花瓣图、聚类分析、菌群的相对丰度和热图等在网站上操作得出(https://magic.novogene.com)。
根据Caporaso 等[15]的分析方法,采用QIIME V1.7.0 对Alpha 多样性、Rarefaction 曲线进行分析,使用R 软件V3.0.3 显示计算得出的样本中的辛普森指数和香农指数等。测序深度指数用Good's coverage 来展现,菌群丰富度采用Chao1 指数和Ace 来评估确定,并采用辛普森指数和香农指数来分析菌群多样性[15]。Venn 图采用R 软件包V3.0.3 进行构建,用来比较分析不同组间肠道菌群里OTUs 的组成差异[16]。主坐标分析PCoA和β多样性使用QIIME 软件V1.7.0 进行计算,使用R 软件V2.15.3 中的Stat、Ggplot2 和WGCNA 软件包进行展示。在PCoA 分析基础上进一步做聚类分析,采用R 软件V2.15.3 中的Ggplot2 和FactoMineR程序包来降低原始变量的维度。Wilcoxon 秩和检验用来分析各个组之间在门和属上存在的统计差异。对每个样本中相对丰度前35 的属,采用R 软件包V2.15.3制成热图。采用线性判别分析(LDA)和LEfSe(LDA Effect Size)分析来确定各个组之间存在的统计差异[16]。
1.2.4 非靶向代谢组学测定
1.2.4.1 样品处理
称取粪便样品100 mg,加入500 μL 乙腈-甲醇-水(2:2:1,V/V/V)溶液,再加入10 μL 内标(20 ng/mL 12-[(cyclohexylcarbamoyl) amino] dodecanoic acid,210 ng/mL 1-methylnicotinamide-d3iodide,51 ng/mL acetyl-L-carnitine-(N-methyl-d3)和3 500 ng/mL DL-glutamic acid(2,4,4-d3,98%),放在冰浴中涡旋振荡30 s 直至形成完全分散的匀浆,将其放置于-20 ℃冰箱保持30 min。在4 ℃的温度条件下,12 000 r/min离心12 min。取上清液置于干净离心管中,低温保存。再于4 ℃的温度条件下,12 000 r/min 离心5 min 后留取上清,并用0.22 μm 的有机滤膜进行过滤。取上清液到进样瓶中用于代谢分析。
1.2.4.2 AB TripleTOF 5600 液质测定
(1)色谱条件
色谱柱:Waters Xselect @HSS T3(2.5 μm,100×2.1 mm);柱温30 ℃;流速0.4 mL/min;正离子模式下使用的流动相:A 相采用水-乙腈(95:5,V/V)并向其中添加体积分数0.1%甲酸,B 相采用水-乙腈(5:95,V/V)并向其中添加体积分数0.1%甲酸;负离子模式使用的流动相为C 相:将5 mmol 的CH3COONH4溶解在1 L 的纯净水中,并加入5%的乙腈;D 相:5 mmol 的CH3COONH4溶解在1 L 的95%乙腈中。
(2)质谱条件
AB TripleTOF 5600 质谱仪使用离子源气体1(GS1):55 arb;离子源气体2(GS2):55 arb;幕气(CUR):35 arb;温度(TEM);550 ℃;离子喷雾电压浮动(ISVF):5 500 V 为正离子模式,-4 500 V 为负离子模式。为了确保系统的准确性,所有样品各取10 μL混合在一起得到QC,每8 个检测样品之间增加一个QC 样品,通过QC 样品对系统一致性进行验证。
1.2.4.3 非靶向代谢组学数据分析
将采集出来的原始数据转换成“abf”格式,转换的文件导入到MSDIAL 中进行原始峰的提取,去卷积,峰对齐,峰识别,再将数据导出,然后用SIMCA 14.1软件来进行主成分分析(PCA)和正交偏最小二乘-判别分析(OPLS-DA),再利用MSDIAL 中的资料库来鉴别VIP 值大于1 的代谢产物。
1.3 统计学分析
多元线性回归分析用于研究岩藻多糖及其降解产物的利用率与细菌OTUs 之间的关系。至少一个样本中丰度大于1%的细菌OUTs 才会被纳入到回归模型中。采用SPSS 20.0 软件进行数据分析,GraphPad Prism 8.3 进行作图。所有数据均表示为平均值±标准误差。两组或两个样本间的比较使用Student's t-test 检验。检验三组之间的差异使用单因素方差分析(ANOVA)中Duncan's range 检验。p<0.05 被认为具有统计学意义。
2 结果与讨论
2.1 肠道菌群对岩藻多糖及其降解物的利用作用分析
岩藻多糖(FUC)主要由硫酸化的(1-3)-α-L-岩藻糖为重复单元构成,结构如图1 所示。氧化降解通常不会破坏硫酸基团[17],所以氧化降解产物(OFUC)与FUC 重复结构单元相同,只是分子量降低。而酸降解会使硫酸基团严重脱落,生成脱硫酸化的降解产物[18]
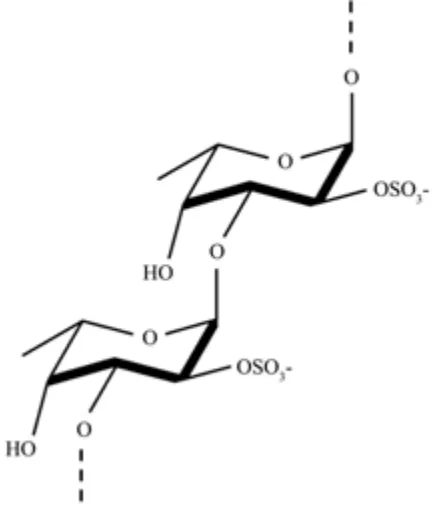
图1 岩藻多糖结构[19]Fig.1 Structure of fucoidan
对实验小鼠定量灌胃FUC、AFUC 和OFUC,收集0~24 h 内粪便,通过HPLC-MS/MS 定量分析FUC、AFUC 和OFUC 的排出率。结果表明FUC 的排出率为48.85%±23.43%,OFUC 的排出率为40.99%±13.86%,AFUC 的排出率为40.78%±19.66%,但是AFUC、OFUC与FUC 的排出率没有显著差异,这可能是由于小鼠个体之间存在较大的代谢差异。该结果说明相对分子质量对FUC、AFUC 和OFUC 在肠道内代谢情况无显著影响。
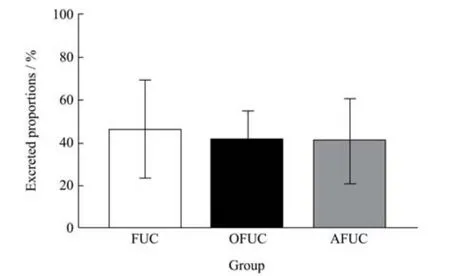
图2 FUC、AFUC 和OFUC 24 h 内随粪便排出率Fig.2 The excreted proportions of FUC,AFUC and OFUC through feces within 24 h
2.2 利用岩藻多糖及其降解物的关键肠道微生物分析
为了分析利用岩藻多糖及其降解物的关键肠道微生物,采用16S rRNA 菌群测序分析小鼠肠道菌群,并分析FUC、AFUC 和OFUC 的利用率与肠道菌群之间的关系。首先分析了肠道菌群在门水平上的相对丰度,可以看出不同小鼠的肠道菌群组成存在着很大差异。如图3 拟杆菌门和厚壁菌门占总体细菌的80%以上,是最具优势的肠道菌门。

图3 不同大鼠的肠道菌群在在门水平的相对丰度图Fig.3 The intestinal flora of different mice at the relative abundance at the phylum level
为了更进一步分析肠道菌群与岩藻多糖及其降解产物的相互作用关系,找出能够利用岩藻多糖及其降解产物的关键细菌,我们对肠道细菌与FUC、AFUC和OFUC 的肠道代谢率做多元线性回归分析,得到与FUC、AFUC 和OFUC 的在肠道内的代谢率呈正向相关的肠道细菌如表1 所示。FUC 在肠道中的代谢与Bacteroides 菌属,Muribaculaceae 菌科的未知菌属以及Lachnospiraceae_NK4A136_group菌属呈正向相关;AFUC在肠道中的代谢与Muribaculaceae菌科呈正向相关;OFUC 在肠道中的代谢与Muribaculaceae 菌科、Lachnospiraceae 菌科和Lachnospiraceae_NK4A136_group菌属呈正向相关。其中,FUC、AFUC 和OFUC在肠道中的代谢均与Muribaculaceae 菌科呈正向相关。据报道Muribaculaceae 菌科确实存在与糖类降解有关的酶,分析结果进一步证实了Muribaculaceae 菌科在糖类消化吸收方面的重要作用[20,21]。然而,FUC和OFUC在肠道中的代谢均与Lachnospiraceae_NK4A136_group菌属呈正向相关。Lachnospiraceae_NK4A136_group菌属虽然没有降解多糖的报道,但是有研究表明给高脂模型小鼠灌胃硫酸化多糖以后,会增加Lachnospiraceae_NK4A136_group菌属的丰度[22],因此推测Lachnospiraceae_NK4A136_group菌属同样参与FUC 和OFUC 在肠道内的消化降解过程。从FUC、AFUC 和OFUC 的结构差异来看,硫酸基团含量高的复杂多糖在肠道内的代谢需要更复杂的菌群合作代谢,且Muribaculaceae 菌科,Lachnospiraceae 菌科和Bacteroidaceae 拟杆菌科等是对FUC、AFUC 和OFUC在肠道内代谢的关键菌群。
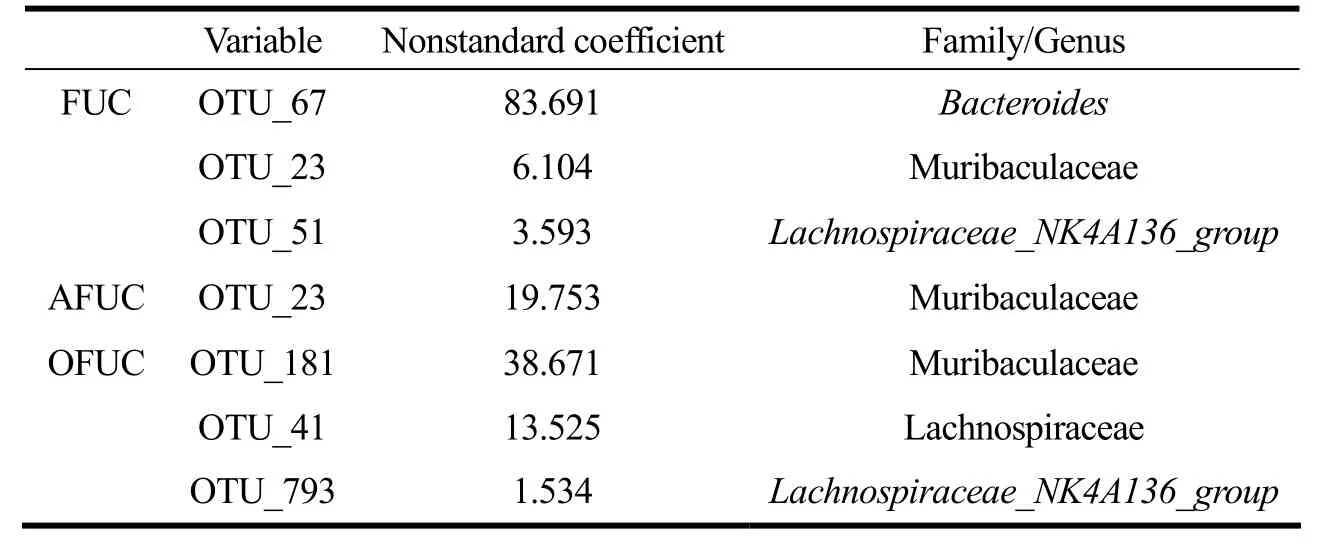
表1 与FUC、AFUC 和OFUC 在肠道内利用存在相关性的肠道细菌Table 1 Gut microbiota correlated with FUC,AFUC and OFUC utilization in vivo
2.3 岩藻多糖及其降解物对肠道代谢产物的影响
为了研究AFUC、OFUC 和FUC 对肠道代谢产生的影响,对小鼠粪便进行了基于LC-MS 的非靶向代谢组学分析。从图4 中可以看出,与空白组(BLK)相比,AFUC、OFUC 和FUC 均对肠道代谢产生了显著的影响,而且三者之间没有明显分离,但有一定的差异性。
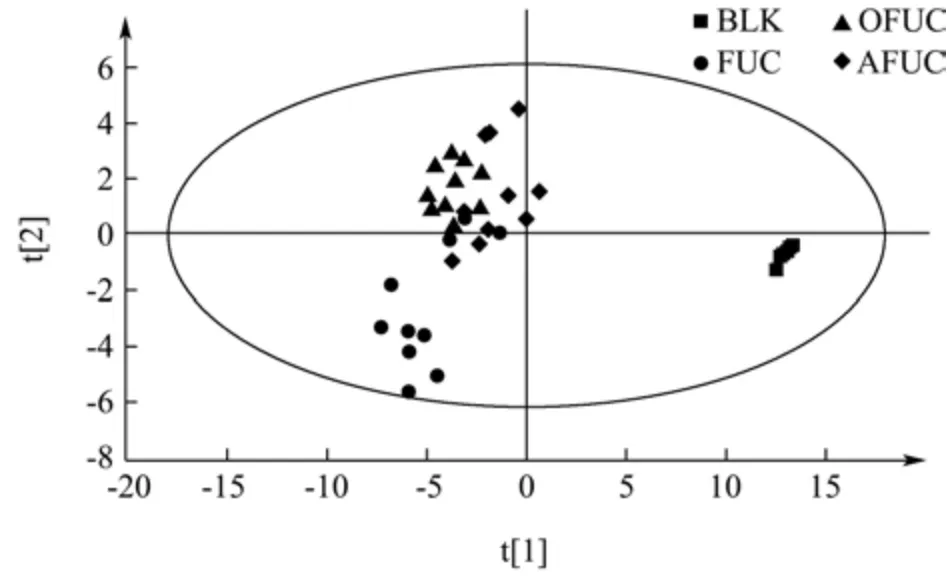
图4 粪便中代谢物的PLS-DAFig.4 PCA analysis of the feces metabolites
根据OPLS-DA 模型的VIP(Variable Importance in the Projection)值对变量进行筛选,通过比较VIP 的值,来确定不同离子模式下FUC 组与空白组之间VIP 大于1 的差异代谢物,并通过t-test 检验筛选出p<0.05 的差异性代谢产物,初步鉴定出92 个差异性代谢物。对筛选出的差异代谢物进行代谢通路研究(Pathway Analysis),以-log10 (p)和impact 分别为横坐标和纵坐标,得到分析结果如图5 所示。Y 轴基于p 值(来自通路富集分析),X 轴基于pathway impact value(来自通路拓扑分析)。FUC 组与空白组相比主要影响了泛酸和辅酶 A 生物合成(Pantothenate and CoA Biosynthesis)、氨酰-tRNA 合成(Aminoacyl-tRNA Biosynthesis)、苯丙氨酸代谢(Phenylalanine Metabolism)、精氨酸生物合成(Arginine Biosynthesis)、烟酸和烟酰胺代谢(Nicotinate and Nicotinamide Metabolism)、苯丙氨酸、酪氨酸和色氨酸生物合成(Phenylalanine,Tyrosine and Tryptophan Biosynthesis)、D-谷氨酰胺和 D-谷氨酸代谢(D-Glutamine and D-Glutamate Metabolism)、胺基代丙酸、天冬氨酸和谷氨酸代谢(Alanine,Aspartate and Glutamate Metabolism)和维生素B6代谢(Vitamin B6 Metabolism)等27 个代谢通路。以上代谢通路主要与机体内氨基酸代谢有关,有研究表明部分氨基酸水平的变化会影响机体的血脂水平[24],苯丙氨酸能够被苯丙氨酸羟化酶催化为酪氨酸,酪氨酸水平的升高进一步对机体的糖脂代谢产生影响[30],这可能是岩藻多糖发挥降血脂[32]作用的重要原因之一。除此之外,FUC 还显著调节了泛酸和辅酶A(CoA)生物合成途径。CoA 是许多代谢反应中必不可少的辅助因子,例如脂肪酸的合成和氧化、复杂脂质的合成和柠檬酸循环中丙酮酸的氧化等,CoA 来源于泛酸(维生素B5),泛酸可以从饮食中和肠道细菌中获得[31]。张彤彤等[33]研究发现海参多糖可以影响肠道内泛酸和辅酶A(CoA)生物合成途径,增加不饱和脂肪酸排泄从而影响脂质代谢。本研究说明FUC 可能被肠道细菌代谢产生代谢产物激活氨基酸代谢、以及泛酸和辅酶A(CoA)生物合成等多条代谢途径发挥降脂抗肥胖等生理作用。

图5 FUC 代谢通路分析图Fig.5 Pathway analysis of FUC
OFUC 组筛选得到83 个差异代谢物,分析代谢通路结果如图6 所示。OFUC 主要影响了不饱和脂肪酸的生物合成(Biosynthesis of Unsaturated Fatty Acids)、生物素合成(Biotin Metabolism)、苯丙氨酸、酪氨酸、色氨酸的生物合成(Phenylalanine,Tyrosine and Tryptophan Biosynthesis )、氨 酰-tRNA合成(Aminoacyl-tRNA Biosynthesis)、D-谷氨酰胺和D-谷氨酸代谢(D-Glutamine and D-Glutamate Metabolism)、牛磺酸和低牛磺酸代谢(Taurine and Hypotaurine Metabolism)等28 个代谢通路。OFUC 与FUC 相比,除了影响氨基酸代谢途径以外还显著影响了不饱和脂肪酸的合成。肠道内不饱和脂肪酸的合成与多种生理功能相关。有研究表明低分子量麦冬寡糖通过调节肠道中不饱和脂肪酸的生物合成、亚油酸代谢、α-亚麻酸代谢、花四烯酸代谢等代谢途径来缓解糖尿病[34];硫酸化修饰的凉粉草多糖通过影响肠道中不饱和脂肪酸的合成、苯丙氨酸、酪氨酸和色氨酸的生物合成等代谢途径来发挥肝保护作用[35]。本研究发现OFUC 经体内消化可以调节机体肠道中的脂肪酸代谢和氨基酸代谢等代谢途径,这为OFUC 发挥多种生理功能提供了数据支持。
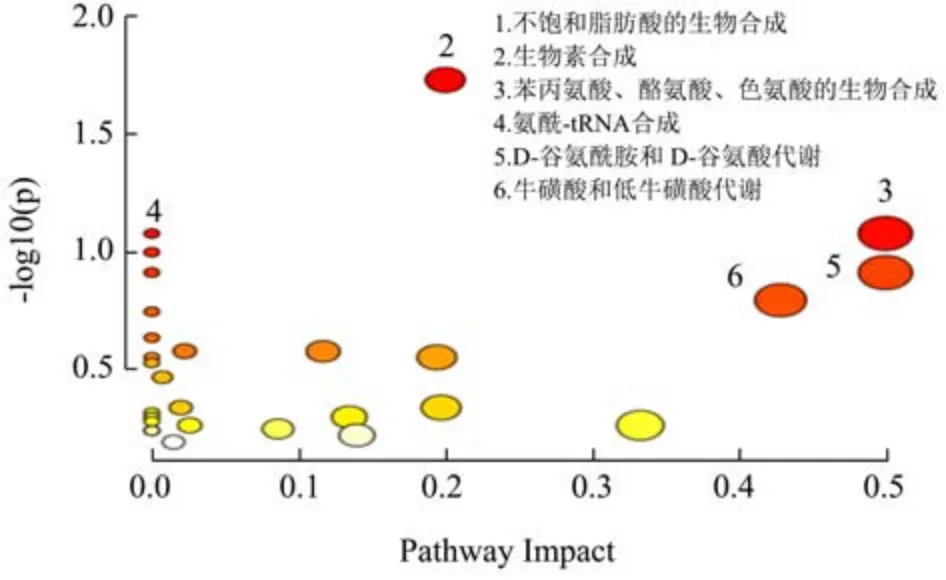
图6 OFUC 代谢通路分析图Fig.6 Pathway analysis of OFUC
AFUC 组筛选出76 个差异代谢物,分析代谢通路结果如图7 所示。AFUC 主要影响了不饱和脂肪酸的生物合成(Biosynthesis of Unsaturated Fatty Acids)、谷胱甘肽代谢(Glutathione Metabolism)、D-谷氨酰胺和D-谷氨酸代谢(D-Glutamine and D-Glutamate Metabolism)、氮代谢(Nitrogen Metabolism)、二羧酸代谢(Glyoxylate and Dicarboxylate Metabolism)、维生素B6 代谢(Vitamin B6 Metabolism)、生物素合成(Biotin Metabolism)等24 个代谢通路。结果发现AFUC 与FUC 相比,还显著影响不饱和脂肪酸的合成,与OFUC 的作用效果相似,说明AFUC 与OFUC 影响体内区别于FUC 的多种代谢通路可能与分子量有关,低分子量的AFUC 与OFUC 更容易被肠道微生物代谢产生代谢产物激活多种代谢通路从而发挥益生功效。
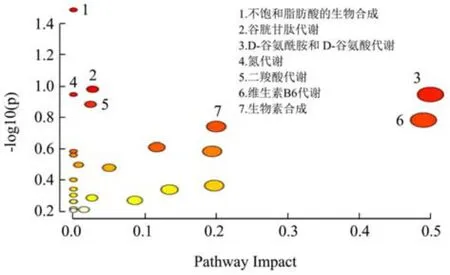
图7 AFUC 代谢通路分析图Fig.7 Pathway analysis of AFUC
通过比较FUC 与AFUC、OFUC 的代谢差异,发现FUC、AFUC 和OFUC 共同影响了D-谷氨酰胺和D-谷氨酸代谢(D-Glutamine and D-Glutamate Metabolism)途径。谷氨酸代谢在蛋白质和核酸生物合成的调节中起重要作用。谷氨酰胺是一种非必需氨基酸,作为三羧酸循环的底物参与中枢代谢过程[23]。Petrus 等[24]研究发现,谷氨酰胺可以减少大鼠脂肪组织的炎症,并与脂肪量成反比。Hu 等[25]研究发现,饮食补充植物乳杆菌FZU3013发酵海带能影响D-谷氨酰胺和D-谷氨酸代谢途径来改善高脂血症大鼠的血脂紊乱。因此,这可能是FUC 与AFUC、OFUC 发挥降血脂的功效的重要代谢途径。降解后的OFUC、AFUC 与FUC 相比,显著调控了生物素代谢(Biotin Metabolism)的代谢通路。有研究表明,生物素(维生素H)是一种含硫的酶辅因子[26],是生命三个领域所必需的微量营养素,它与中枢代谢有关,如羧化、脱羧化和反式羧化反应等[27],且由大多数细菌合成[28],在人体内,生物素可以被大肠杆菌以pimeloyl-ACP 为前体开始合成[29]。因此我们推测降解后的岩藻多糖更容易被肠道微生物利用,产生的代谢产物参与机体代谢途径从而发挥的益生效果。
3 结论
通过对粪便中FUC、AFUC 和OFUC 的定量分析,发现相对分子质量对AFUC、OFUC 与FUC 在肠道内的代谢无显著影响。通过分析FUC、AFUC 和OFUC与肠道菌群的相互作用关系发现,AFUC 在肠道内的代谢主要与肠道中的Muribaculaceae 菌科存在相关性;FUC 和OFUC 在肠道内的代谢主要与肠道中毛螺菌科(Lachnospiraceae),Muribaculaceae 菌科和拟杆菌科(Bacteroidaceae)等存在相关性。FUC、AFUC 和OFUC在宿主体内通过影响肠道菌群代谢,共同影响了D-谷氨酰胺和D-谷氨酸代谢(D-Glutamine and D-Glutamate Metabolism)途径,降解产物OFUC 和AFUC 均显著影响生物素代谢(Biotin Metabolism)的代谢途径,说明岩藻多糖及其降解产物对肠道菌群相互作用的效果存在差异。本研究为岩藻多糖在体内吸收研究以及岩藻多糖衍生化产品的开发提供数据支持。
