一株Triton X-100降解菌的分离鉴定及降解条件优化
2023-01-12王宝任苏婷婷王战勇
王宝任,苏婷婷,王战勇
(1.辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001;2.沈阳农业大学 生物科学技术学院,辽宁 沈阳 110866)
表面活性剂是一种在低浓度下能够显著降低界面张力的物质,具有增溶、分散、乳化的作用,由于其独特的性质和多样的功能,广泛应用于工农业、医药、食品、日化等领域[1-2]。但是,若大量使用表面活性剂,则会在环境中积累,造成一定的生态问题。例如,水体中的表面活性剂在鱼的内脏和鳃积累,可导致鱼类窒息死亡[1];土壤中的表面活性剂会损伤植物根系,抑制植物的光合作用[3-5];过量的表面活性剂对人体也有害,可能会导致皮炎和口腔溃疡等疾病[6-7]。因此,有效清除环境中的表面活性剂,维持生态环境的平衡,保护人体健康,已成为环境工程领域亟待解决的重要任务。治理表面活性剂废水的方法众多,但生物降解法是最为高效和安全环保的处理方法[8-9]。
本研究从某化工厂污水处理车间好氧曝气池的活性污泥中筛选了对非离子表面活性剂TritonX-100具有降解能力的菌株ISB5,对其降解Triton X-100的能力进行了考察。研究结果对表面活性剂造成的环境污染问题的修复和处理具有重要的实际意义。
1 实验部分
1.1 实验材料、仪器及设备
1.1.1 实验材料 Triton X-100非离子表面活性剂,福州飞净生物科技有限公司;六水硝酸钴、硫氰酸铵,上海阿拉丁生化科技股份有限公司;胰蛋白胨、酵母提取物,英国OXOID公司;核酸提取纯化试剂盒,江苏达伯药业有限公司;硫氰酸钴铵溶 液、三 氯 甲 烷、NaCl、(NH4)2SO4、MgSO4·7H2O、CaCl2·2H2O、FeSO4·7H2O、Na2HPO4·12H2O、KH2PO4,分析纯,国药集团化学试剂有限公司。
1.1.2 实验仪器及设备 AR124CN电子天平,上海奥豪斯仪器有限公司;XL30 ESEM-FEG扫描电子显微镜,荷兰FEI公司;SHP-1500生化培养箱、TSQ-280恒温培养振荡器,上海精宏实验设备有限公司;Mikro 200R高速冷冻离心机,德国Hettich公司;Model 680酶标仪,美国Bio-Rad公司;LDZX-50KB立式压力蒸汽灭菌器,上海申安医疗器械厂;HZQ-QX全温振荡器,哈尔滨东联电子技术开发公司。
1.2 培养基的制备
MSM培养基:向500 mL烧杯中加入(NH4)2SO4(2.00 g)、MgSO4·7H2O(0.20 g)、CaCl2·2H2O(0.01 g)、FeSO4·7H2O(0.001 g)、Na2HPO4·12H2O(1.50 g)、KH2PO4(1.50 g)并混合,加适量去离子水溶解,用玻璃棒搅拌促溶,倒入1 000 mL容量瓶中并用去离子水定容至刻度,置1 000 mL肖特瓶中保存。
富集培养基:在MSM培养基中加入质量分数为0.5%的酵母提取物,用玻璃棒搅拌促溶。
LB培养基:向500 mL烧杯中加入蛋白胨(10.00 g)、酵母提取物(5.00 g)、NaCl(5.00 g)并混合,加适量去离子水溶解,用玻璃棒搅拌促溶,倒入1 000 mL容量瓶中并用去离子水定容至刻度(现用现配)。
1.3 菌株的分离与筛选
取适量某化工厂污水处理车间的活性污泥,接入100.00 mL富集培养基中,在30℃、150 r/min的条件下振荡培养4 d后,取1 mL菌液再次加入100.00 mL富集培养基中,在30℃、150 r/min的条件下再次振荡培养4 d,重复3次。
将上述经过多次富集培养的菌液适当稀释后,接种于以Triton X-100为唯一碳源的MSM平板上,涂布均匀,在30℃的温度下培养3~4 d。选取生长状况较好的单菌落再次接种于Triton X-100/MSM平板进行复筛,划线培养。
观察复筛平板上菌落的颜色和形状等特征,选取生长状况良好的单菌落继续于平板上划线培养。经过多次培养后,根据菌落颜色和形状等特征确定纯培养菌株。
1.4 菌株的形态特征观察
将纯培养菌株在LB培养基平板上划线培养(30℃)2 d后,使用扫描电镜观察菌体形态。
1.5 菌株的16S r DNA鉴定
使用16S rDNA测序对菌株进行鉴定[10]。16S rDNA扩增引物为通用引物:27F(AGAGTTTGATCCTGGCTCAG)和1492R(TACGGTTACCTTACGACTT)。将聚合酶链式反应(PCR)产物送至生工生物工程(上海)股份有限公司进行测序,在NCBI数据库中进行比对分析,利用MEGA5软件构建系统发育树。
1.6 降解条件的考察
1.6.1 培养温度对菌株ISB5降解Triton X-100的影响 将菌株ISB5按1.00%(菌株ISB5与培养基的体积比,下同)的接种量接种于含Triton X-100(质量浓度为2 g/L)的100.00 mL MSM培养基中,在不同培养温度、150 r/min下振荡培养48 h,在12 000 r/min的条件下对培养物离心15 min后,取上清液测定Triton X-100的质量浓度。
1.6.2 振荡速率对菌株ISB5降解Triton X-100的影响 将菌株ISB5按1.00%的接种量接种于含Triton X-100(质量浓度为2 g/L)的100.00 mL MSM培养基中,在不同振荡速率、30℃的温度下振荡培养48 h后,测定培养物上清液中Triton X-100的质量浓度。
1.6.3 装液体积(装液量,下同)对菌株ISB5降解Triton X-100的影响 将菌株ISB5按1.00%的接种量接种于含Triton X-100(质量浓度为2 g/L)的不同体积的MSM培养基中,在30℃、150 r/min的条件下振荡培养48 h后,测定培养物上清液中Triton X-100的质量浓度。
1.6.4 培养时间对菌株ISB5降解Triton X-100的影响 将菌株ISB5按1.00%的接种量接种于含Triton X-100(质量浓度为2 g/L)的100.00 mL MSM培养基中,在30℃、150 r/min的条件下振荡培养不同时间后,测定培养物上清液Triton X-100的质量浓度。
1.6.5培养基Triton X-100初始质量浓度对菌株ISB5降解Triton X-100的影响 将菌 株ISB5按1.00%的接种量接种于含不同质量浓度Triton X-100的100.00 mL MSM培 养 基 中,在30℃、150 r/min的条件下振荡培养48 h后,测定培养物上清液中Triton X-100的质量浓度。
1.6.6 接种量对菌株ISB5降解Triton X-100的影响将菌株ISB5按不同的接种量接种于含Triton X-100(质量浓度为2 g/L)的100.00 mL MSM培养基中,在30℃、150 r/min的条件下振荡培养48 h后,测定培养物上清中Triton X-100的质量浓度。
1.7 非离子表面活性剂的测定方法
通过硫氰酸钴法(CTAS法)[11]测定Triton X-100的质量浓度。1.00 mL上清液中加入1.25 mL硫氰酸钴铵溶液和1.50 mL氯仿,充分混匀将硫氰酸钴-乙氧基钴络合物萃取到氯仿层中,进一步离心分层后,使用酶标仪在630 nm下测量氯仿提取物的吸光度,根据标准曲线计算Triton X-100的质量浓度,并计算降解率。
2 结果与讨论
2.1 菌株的筛选
经数次分离纯化,得到了一株对Triton X-100具有降解能力的菌株,命名为ISB5。对菌株ISB5菌落的生长状态进行观察,发现菌落较小,呈淡黄色,中间微微隆起,黏滑透明。
2.2 菌株的扫描电镜形态分析
菌株ISB5的扫描电镜显微照片如图1所示。由图1可以看出,菌株ISB5个体呈杆状或略弯曲的杆状,两端尖锐,无芽孢,无荚膜,菌体尺寸为(1.3~2.1)μm×(0.38~0.52)μm。
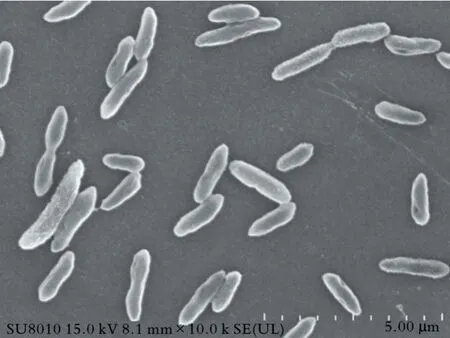
图1 菌株ISB5的扫描电镜显微照片
2.3 16S rDNA扩增结果
把菌株ISB5的16S rDNA序列上传至GenBank数据库中,登录号为MW741885。根据菌株ISB5的系统发育进化树(见图2),结合细菌的形态特征,将菌株初步鉴定为Pseudomonassp.(假单胞菌属)。

图2 菌株ISB5的系统发育进化树
2.4 降解条件的优化
2.4.1 培养温度对菌株ISB5降解Triton X-100的影响 培养温度对菌株ISB5降解Triton X-100的影响如图3所示。由图3可以看出,随着培养温度的升高,Triton X-100的降解率呈现先上升后下降的趋势;当培养温度为30℃时,Triton X-100的降解率最高;当培养温度大于30℃时,Triton X-100降解率呈下降趋势,尤其是当培养温度达到35℃后,下降趋势非常明显;当降解温度为45℃时,Triton X-100的降解率仅为10.6%,说明菌株ISB5不适应偏高温的生长环境。
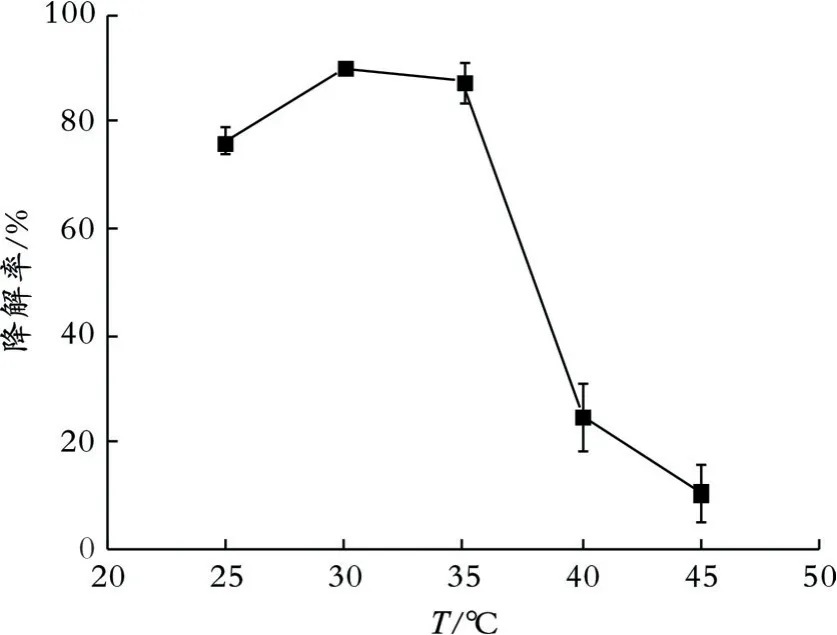
图3 培养温度对菌株ISB5降解Triton X-100的影响
2.4.2 溶解氧含量对菌株降解Triton X-100的影响 溶解氧含量是影响需氧微生物生长的重要条件,摇床培养过程中影响溶解氧含量的主要因素有摇床振荡速率(振荡速率,下同)和装液量。
(1)振荡速率对菌株ISB5降解Triton X-100的影响。振荡速率对菌株ISB5降解Triton X-100的影响如图4所示。
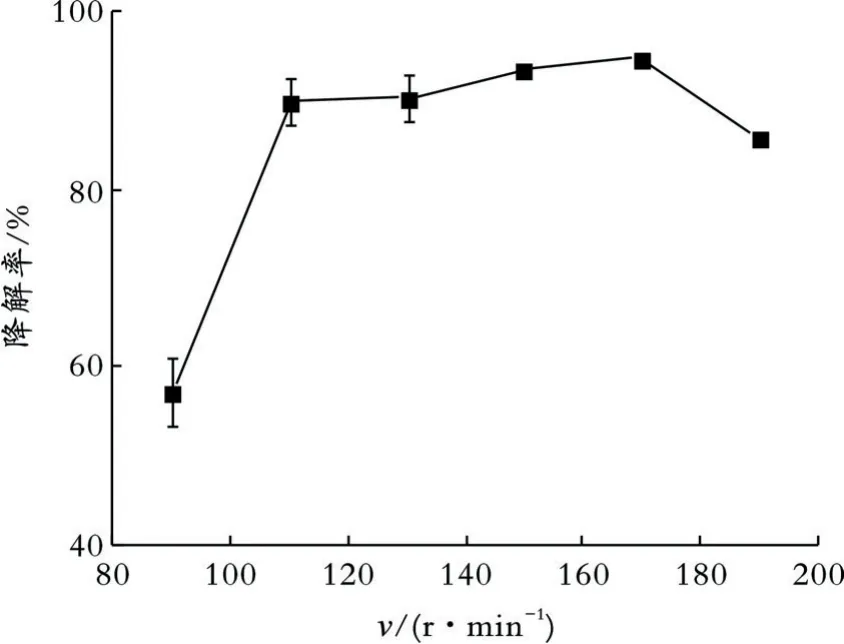
图4 振荡速率对菌株ISB5降解Triton X-100的影响
由图4可以看出,随着振荡速率的增加,Triton X-100降解率呈先上升后下降的趋势;当振荡速率为110~170 r/min时,Triton X-100的降解率较高;当振荡速率大于170 r/min时,随着振荡速率的增加,Triton X-100的降解率反而下降。其原因是:虽然振荡速率的增加有助于液体培养基内溶解氧含量升高,但液体培养基内的剪切应力也会变大,而菌株所能承受的剪切应力是有限的,当剪切应力高于菌株承受能力的上限时,会抑制菌株生长甚至破坏菌株,使菌株的降解能力降低[12]。综合考虑,选取150 r/min作为最适振荡速率。
(2)装液量对菌株ISB5降解Triton X-100的影响。装液量是液体微生物培养的重要影响因素,通过调整装液量可控制培养基中的溶解氧和氧气的传递效率。装液量对菌株ISB5降解Triton X-100的影响如图5所示。由图5可以看出,当装液量为60.00~100.00 mL时,随着装液量的增加,Triton X-100的降解率呈增长趋势;当装液量为100.00 mL时,Triton X-100的降解率最高;继续增加装液量,Triton X-100的降解率不再提高。
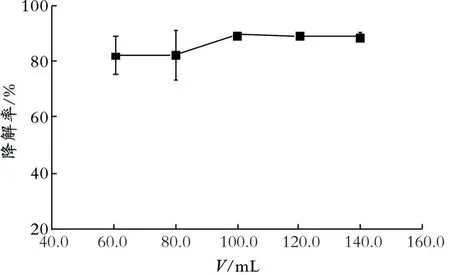
图5 装液量对菌株ISB5降解Triton X-100的影响
2.4.3 培养时间对菌株ISB5降解Triton X-100的影响 适宜的培养时间可使微生物有效地利用培养基中的营养物质,发挥其降解作用。培养时间对菌株ISB5降解Triton X-100的影响如图6所示。
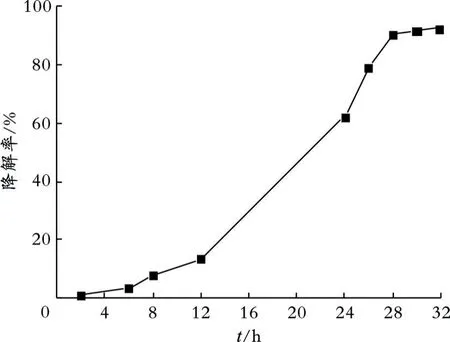
图6 培养时间对菌株ISB5降解Triton X-100的影响
由图6可以看出,随着培养时间的增加,Triton X-100的降解率呈上升趋势;培养时间为0~12 h时,Triton X-100的降解速度增加缓慢,这与菌株ISB5在此阶段处于生长延滞期有关,此时菌株ISB5需要适应高质量浓度Triton X-100的存在;此后,随着培养时间的增加,Triton X-100的降解率明显提高,在32 h时降解率达到最大。但是,培养时间为28~32 h时,Triton X-100的降解率效变化不大。因此,从经济角度考虑,选择28 h为最适培养时间。
2.4.4 培养基Triton X-100初始质量浓度对菌株ISB5降解Triton X-100的影响 培养基Triton X-100初始质量浓度对菌株ISB5降解Triton X-100的影响如图7所示。
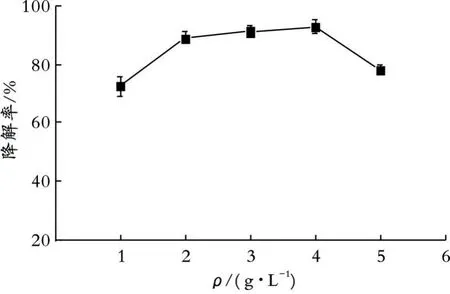
图7 培养基Triton X-100初始质量浓度对菌株ISB5降解Triton X-100的影响
由图7可知,当Triton X-100初始质量浓度为1~4 g/L时,降解率呈现增长趋势;当Triton X-100初始质量浓度为4 g/L时,Triton X-100的降解率最高,降解率达到93.0%;当Triton X-100初始质量浓度大于4 g/L时,Triton X-100的降解率随着Triton X-100初始质量浓度的增加而降低,这可能是高质量浓度Triton X-100在一定程度上抑制菌体生长有关。2.4.5接种量对菌株ISB5降解Triton X-100的影响 接种量对菌株ISB5降解Triton X-100的影响如图8所示。由图8可以看出,当接种量小于1.00%时,Triton X-100的降解率随着接种量的增加呈上升趋势;当接种量大于1.00%时,菌株ISB5的降解率并无明显的增加。
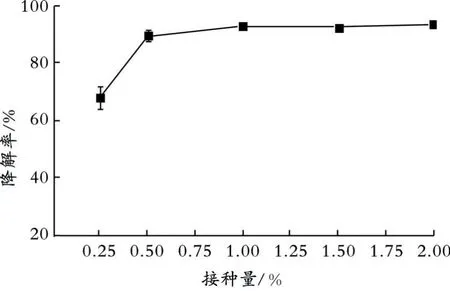
图8 接种量对菌株ISB5降解Triton X-100的影响
3 结论
从某化工厂污水处理车间好氧曝气池的活性污泥中筛选了一株对Triton X-100具有降解能力的菌株,对菌株ISB5的16S rDNA进行了测序和比对分析,将菌株ISB5鉴定为假单胞菌属(Pseudomonassp.)。对菌株ISB5降解Triton X-100的条件进行了考察,确定了菌株ISB5的适宜降解条件:培养温度为30℃,培养基Triton X-100的初始质量浓度为4 g/L,培养时间为28 h,摇床的振荡速率为150 r/min,装液量为100.00 mL,接种量为1.00%。在此条件下,菌株ISB5对TritonX-100的降解率可达93.0%以上。
