石斛添加量对小曲微生物及风味的影响
2023-01-12陈小琴母应春苏伟姜丽赵驰
陈小琴,母应春,苏伟,姜丽,赵驰
(贵州大学酿酒与食品工程学院 贵阳 550025)
酒曲是中国白酒酿造的糖化、发酵和生香剂,含多种微生物和风味物质,对酒的产率和品质有重要影响,有“曲是酒之骨”之称[1]。铁皮石斛(Dendrobium officinale Kimura et Migo)具有独特药用价值,含石斛多糖、生物碱等多种活性成分,具有抗癌、降血糖、增强免疫力等功效[2]。制作酒曲时添加药食同源物质能抑制杂菌生长,促进有益微生物繁殖,还能丰富产品风味[3]。吴志等[4]在制曲时添加3%的石菖蒲、生地黄和白术等醇提液,提高了曲发酵力和糖化力。禹晓婷等[5]添加12 味药食同源物质入曲,发现新基质曲糖化力和液化力是传统曲的1.3 倍和2.8 倍。目前,还未见将石斛茎作为小曲发酵基质的研究报道。
近年来,高通量测序技术(high-throughput sequencing,HTS)在酒曲中广泛应用,增强了人们对酒曲微生物群落结构及多样性的了解[6]。同时,常结合代谢组学技术研究食品中挥发性风味物质(volatile flavor components,VFCs)。如Zhao 等[7]采用宏基因组学和GC-TOF-MS 研究了贵州3 种小曲微生物群落和风味物质,结果显示乳酸杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、曲霉属(Aspergillus)、酿酒酵母属(Saccharomyces)等为小曲中优势菌属,并筛选出39 种显著差异代谢物。Tang 等[8]利用Illumina MiSeq 平台和气相色谱质谱联用仪(Gas Chromatography-Mass Spectrometer,GC-MS),检测4 种小曲微生物群落和VCFs,发现葡萄球菌属(Staphylococcus)、魏氏细菌属(Weissella)、根霉菌属(Rhizopus)和念珠菌属(Candida)为优势菌属,同时鉴定出68 种显著差异的VCFs。目前还没有关于石斛小曲品质的研究报道。
本研究以传统小曲和石斛小曲为研究对象,采用HTS 和顶空固相微萃取结合气相色谱-质谱联用技术(Headspace Solid Phase Microextraction-GC-MS,HS-SPME-GC-MS)分析石斛添加量对小曲微生物群落、挥发性风味物质及理化特性的影响,为石斛小曲工艺优化和生产应用提供理论参考。
1 材料和方法
1.1 材料与试剂
石斛小曲原料为市售铁皮石斛茎,产自贵州;种曲为根霉菌Q303,贵州轻工研究所;传统小曲未添加石斛,编号为DZ;石斛小曲按石斛添加量30%,40%和50%分别编号为A,B 和C。
Power Soil DNA 提取试剂盒,美国MP Bio公司;2%琼脂糖凝胶,西班牙Biowest 公司;DNA聚合酶,大连宝生物工程有限公司;正、反引物,深圳市英俊生物技术有限公司;MinElute PCR 纯化试剂盒,德国Qiagen 公司;正构烷烃(色谱纯),美国Sigma 公司;环己酮(>99.5%,GC),上海阿拉丁生物科技股份有限公司。
1.2 仪器
ABI VeritiTM99012PCR 仪,美国ABI 公司;Gel Doc 2000 型凝胶成像仪,美国Bio-Rad 公司;Illumina Hiseq 测序仪,美国Illumina 公司;GCMS TSQ8000 与TRACE1300 气-质谱联用,美国赛默飞世尔科技公司;50/30 μm/CAR/PDMS/DVB萃取头,美国安捷伦公司。
1.3 方法
1.3.1 样品制备与采集 参照禹晓婷等[5]的方法并稍作修改制备小曲。所有样品装入无菌袋中,密封,置于-80 ℃超低温冰箱,用于理化特性、VFCs和微生物检测。
工艺流程:

1.3.2 理化指标检测 小曲水分、酸度、液化力、糖化力、发酵力和酯化力等检测参考文献[9]。
1.3.3 挥发性风味检测
1.3.3.1 GC-MS 条件 进样口温度:240°C;升温程序:40 °C(5 min),5 °C/min 上升到150 °C(3 min),最后以5°C/min 上升到240°C(5 min)。以高纯氦气(99.999%)为载气,载气流速1.00 mL/min,不分流进样。
质谱条件:EI 离子源,离子源温度250°C,电离电压70 eV,传输线温度240°C,色谱扫描范围35~550 amu。
1.3.3.2 定性及定量方法 与质谱NIST 光谱数据库比对并鉴定,仅保留正、反匹配度大于700 的化合物。通过内标法计算得到各挥发性组分的质量浓度。计算公式如下:

式中:Ci——待测挥发性组分质量浓度,μg/kg;Cis——内标质量浓度,μg/mL;Ai——待测挥发性组分的色谱峰面积,mAU·min;Ais——内标的色谱峰面积,mAU·min。
1.4 数据分析
用SPSS Statistics 26.0 软件统计分析数据;SIMCA14.1 软件绘制用于正交偏最小二乘判别得分图,Origin 2018 软件用于绘制微生物群落组成图和主成分分析图、层级聚类图,R 语言软件用于绘制VFCs 热图、微生物与VFCs 相关性热图,Canoco 5 软件绘制冗余分析图。
2 结果与分析
2.1 小曲理化性质
由表1 可知,4 种小曲水分含量在11.42%~12.52%之间,差异不显著(P>0.05),均小于国家标准的13%,利于长期储存[10]。添加30%石斛茎时,糖化力、液化力和发酵力最大值分别为(122.40±0.61),(51.87±8.67)U/g 和(13.97±2.00)g/100 g;然而,酯化力在40%添加量时最大值(169.38 ±6.71)mg/g。糖化力和发酵力分别反映微生物将原料中的淀粉转化为可发酵性糖的能力及将其转化成乙醇的能力[11-12];酯化力与白酒发酵过程中酯类物质的形成密切相关[13]。此外,酸度是评价酒曲成熟度的一个重要指标[14],且随石斛添加量的增加而增大,在添加量为50%时最大值(0.82±0.03)mmol/10 g。综上所述,较DZ 而言,添加30%石斛茎时小曲的理化品质最佳。

表1 小曲样品理化性质分析Table 1 Analysis of physicochemical propertie in Xiaoqu sanples
2.2 挥发性风味物质分析
从4 种小曲中共鉴定出41 种可靠挥发性组分,主要为醇类12 种、酚类7 种、烃类6 种、醛酮类6 种、酸类3 种、酯类3 种和其它类4 种(表2)。其中,从A、B、C 和DZ 分别检测出24,29,21种和7 种。醇类和酚类是构成A、B、C 和DZ 中风味特征的重要物质,其在A、B 和C 中的组成和含量明显高于DZ。此外,烃类和其它类仅存在于A、B 和C 中,并随石斛茎添加量的增加而增加,这可能来自石斛原料[15]。由此可见,在小曲制备中添加石后,提高了VFCs 组成及含量。当添加量为40%时,小曲VFCs 种类及含量均为最大值。

表2 小曲挥发性风味物质分析Table 2 Analysis of volatile flavor compounds in Xiaoqu samples
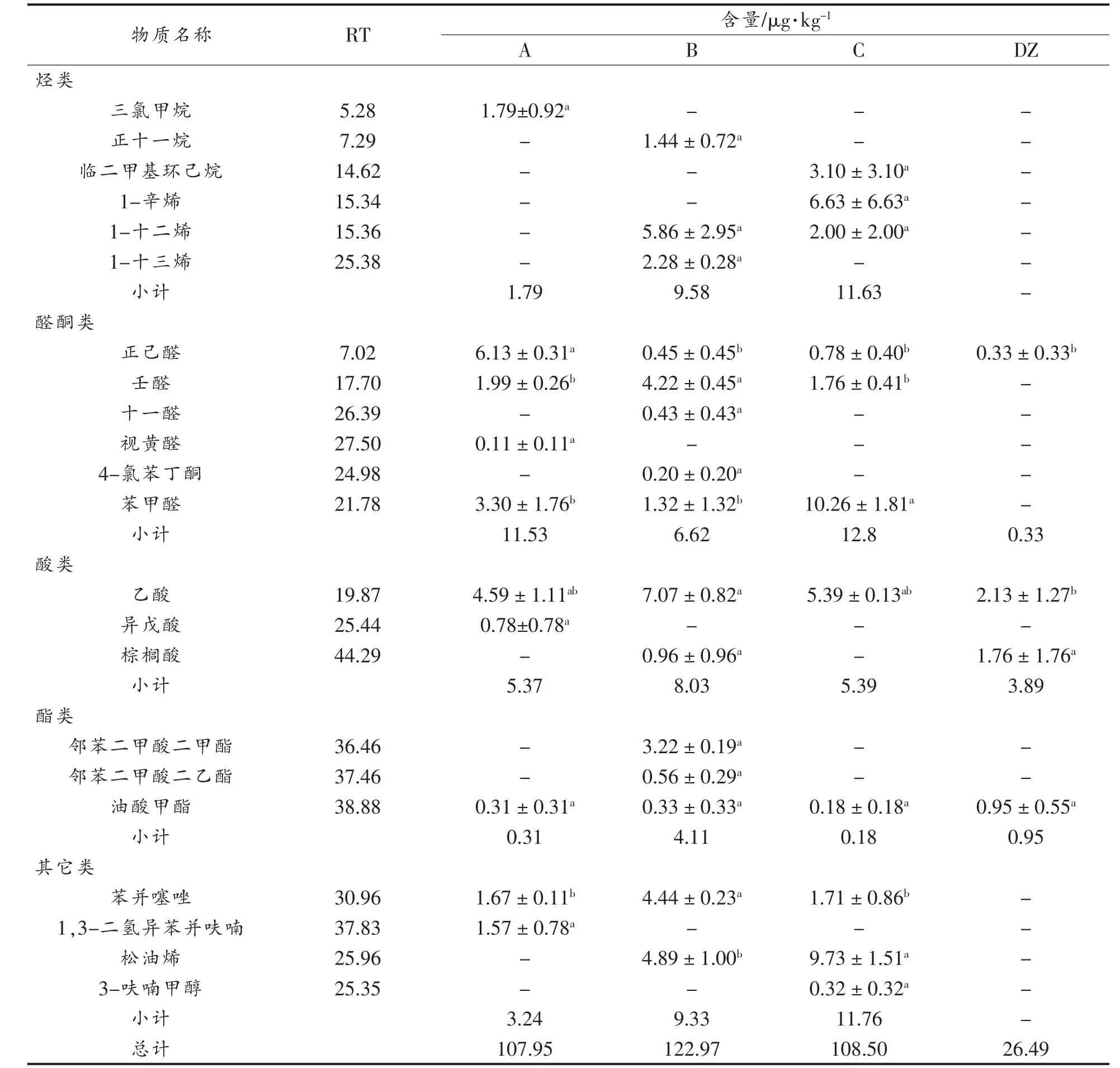
(续表2)
为更好地说明样品小曲间VFCs 含量的差异,利用正交偏最小二乘判别法(Orthogonal Partial Least Squares Discriminant Analysis,OPLS-DA)进行分析。如图1a 所示,R2X 为0.675,Q2Y 为0.93,说明该模型在分析样品时不存在异常值[16]。4种小曲分别位于不同象限,表明各样品间VFCs 存在差异。此外,基于VIP >1.0 和P <0.05,共筛选出16 种显著差异代谢物(Important Significantly Different Metabolites,ISDMs),对其热图统计分析。如图1b 所示,A、B 和C 的风味特征仍明显优于DZ。A、B 和C 中的ISDMs 以醇类、醛酮类和酚类为主,如芳樟醇、正己醇、苯甲醇、苯乙醇、苯甲醛、壬醛、愈创木酚等,而DZ 中主要为苯乙醇。这是因为铁皮石斛茎中多糖、苯丙氨酸等可在微生物作用下产生醇类和醛酮类物质[17]。芳樟醇呈现铃兰香气和木香,有镇痛、抗炎症的功效[18];苯乙醇呈现玫瑰花香味和桃子果香味,是大曲VFCs 中优势醇类[19];苯甲醛具有杏仁和焦糖气味[20];壬醛稀释时散发玫瑰和橘子的香气[21];正己醇有青草香气和树叶气味,能影响白酒香气[22];松油烯呈现柑橘香和木香,可用于调配柠檬和薄荷香精[23];愈创木酚有木香及香荚兰的隐香,被证实为白酒中重要挥发性组分[24]。同时,4 个小曲聚类为两大支,A和B 聚为一类,C 和DZ 聚为另一类。这与OPLS-DA 得分图在t1 上的结果一致。
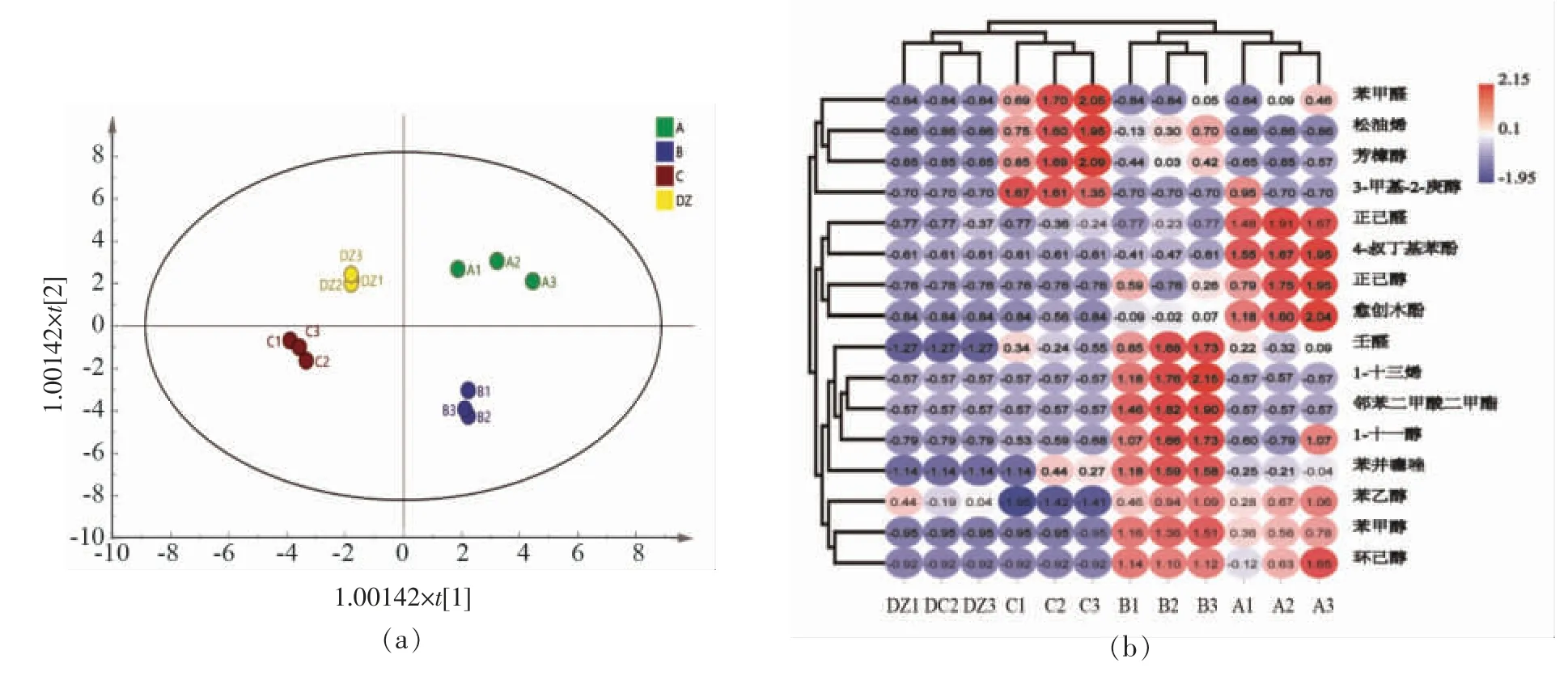
图1 小曲样品挥发性物质的OPLS-DA 得分图(a)和重要显著差异物质的聚类热图(b)分析Fig.1 Opls-da score chart of VFCs(a)and hierarchical clustering heat map of ISDMs(b)in Xiaoqu samples
2.3 样品中细菌的分析
2.3.1 细菌α-多样性 分析 A、B、C 和DZ 在97%相似度水平下进行聚类,共获得OTUs 平均数分别为214,393,582 和339(表3)。由表3 可知,覆盖率在98.44%~99.81%间,表明未被检出序列的概率较小[25]。本研究测序结果能真实反映小曲样品中细菌微生物真实情况。此外,Chao1 指数和Shannon 指数被用来描述物种丰度和多样性。C 的Chao1 和Shannon 指数最大(619.12 和7.87),而A的Chao1 和Shannon 指数最小(341.88 和0.40)。添加50%石斛茎时,小曲细菌群落组成和结构最复杂。
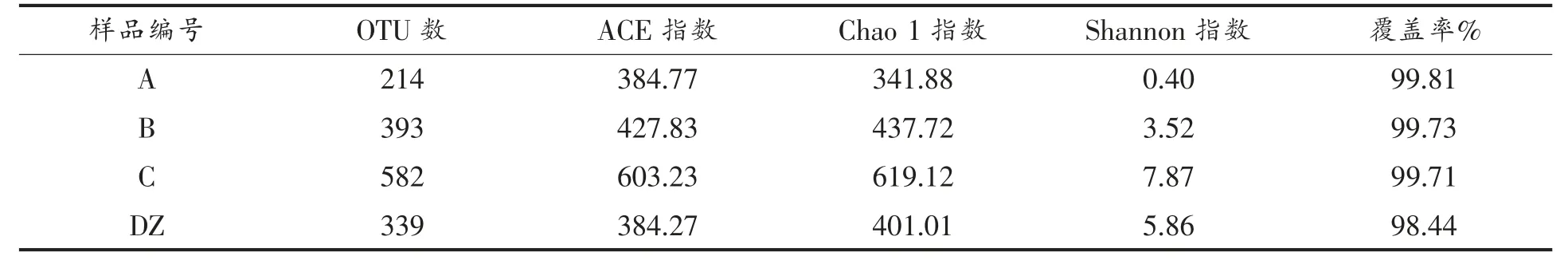
表3 小曲细菌微生物α-多样性分析Table 3 α-Diversity index of bacterial microorganism in Xiaoqu
2.3.2 细菌群落结构分析 在门水平上,从4 个小曲中共检测到22 个细菌门,图2a 显示丰度前10 的物种,其余物种合并为其它。A 和B 以厚壁菌门(Firmicutes)为绝对优势细菌门,分别占比96.96%和75.40%。此外,B 中变形菌门(Proteobacteria,13.59%)同样占优势。C 以厚壁菌门(32.36%)、变形菌门(26.13%)和拟杆菌门(Bacteroidetes,23.98%)为优势细菌门。同时,B 和C 中还含有少量酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)。DZ 以厚壁菌门(12.91%)、变形菌门(29.99%)、酸杆菌门(16.47%)和蓝细菌门(Cyanobacteria,12.63%)为优势细菌门。据报道,厚壁菌门、变形菌门、酸杆菌门和拟杆菌门是小曲中主要优势细菌门[26-28]。A、B 和C 中厚壁菌门与拟杆菌门含量比DZ 中高,可能是石斛多糖促进其生长,这与张俊楠等[29]研究结果相似。

图2 小曲在细菌门水平(a)和属水平(b)的群落组成Fig.2 Community composition of Xiaoqu at phylum level(a)and genus level(b)
在属水平上,共检测到342 个细菌属。图2b显示丰度前10 的物种,其余物种归类为其它。如图2b 所示,A、B 和C 与DZ 细菌群落存在较大差异,且无规律可言。芽孢杆菌属(Bacillus)是A(96.13%)和B(71.89%)中的优势细菌属。C 以2.75%的乳酸杆菌属(Lactobacillus)、5.26%的uncultured_bacterium_f_Muribaculaceae、5.15%的葡萄球菌属(Staphylococcus)和4.05%的uncultured_bacterium_f_Lachnospiraceae 为优势细菌属。DZ 以uncultured_bacterium_o_Chloroplast、uncultured_ bacterium_f_Mitochondria、乳酸杆菌和uncultured_bacterium_k_Bacteria 为优势细菌属,分别占比12.63%,12.04%,5.51%和7.83%。
uncultured_bacterium_f_Muribaculaceae 属于拟杆菌门细菌,于2002 年首次被发现,可产生维生素B12,能治疗恶性贫血症[31]。uncultured_bacterium_f_Muribaculaceae、uncultured_bacterium_f_Enterobacteriaceae 和uncultured_bacterium_f_Lachnospiraceae 分别属于拟杆菌门、变形菌门和厚壁菌门,其为水稻秸秆和糖浆废水共发酵过程中的产酸优势菌门[32]。芽孢杆菌属在A 和B 中占优势,是因为石斛能促进其繁殖[33]。芽孢杆菌属通过分泌蛋白酶和淀粉酶赋予小曲糖化力、液化力和发酵力[34],并与吡嗪类、酯类、醇类和有机酸类物质密切相关[35]。乳酸杆菌属能产生丰富有机酸,还能产生细菌素抑制致病菌[36]。由此可见,当添加30%石斛时,小曲有益细菌比例最高,添加量为50%时不利于有益细菌繁殖。
2.4 样品中真菌的分析
2.4.1 真菌α-多样性分析 由表4 可知,基于97%相似度,分别获得OTUs 数为80(A)、444(B)、510(C)、121(DZ)。覆盖率均大于99.0%,表明测序结果基本反映样品小曲中真菌群落结构的多样性。C 的Chao1 和Shannon 指数最大(577.80 和5.83),而DZ 的Chao1 和Shannon 指数最小(140.88 和1.24)。这表明C 的真菌群落丰富度和多样性最高,DZ 最低,即添加50%石斛茎时,小曲真菌群落组成及结构最复杂。

表4 小曲真菌微生物α-多样性分析Table 4 α-Diversity index of fungus microorganism in Xiaoqu
2.4.2 真菌群落结构分析 在门水平上,共检出7 个真菌物种。如图3a 所示,A、B、C、DZ 优势真菌门均为子囊菌门(Acomycota)和毛霉菌门(Mucoromycota),分别占比54.53%、46.56%、50.27%、82.42%和42.92%、47.25%、33.38%、17.45%。据报道,子囊菌门和毛霉菌门在不同酒曲中占主导[37-38]。值得注意的是担子菌门(Basidiomycota)仅存在于A、B 和C 中,且与石斛茎添加量呈正比关系。毛霉菌门和担子菌门在A、B 和C 中明显增加,说明石斛茎中某些活性成分能促进毛霉菌门与担子菌门生长。

图3 小曲在门水平(a)和属水平(b)真菌群落组成Fig.3 The fungus composition of Xiaoqu at phylum level(a)and genus level(b)
在属水平上,共检测到226 个真菌属。图3b显示相对丰度前10 的物种,其余物种分别归类为其它和未分类。DZ 与A、B 和C 间真菌群落存在差异,同时,A、B 和C 间也存在差异。A 中优势真菌属为根霉菌属(Rhizopus,42.89%)、曲霉菌属(Aspergillus,26.97%)和威克汉姆酵母属(Wickerhamomyces,22.59%)。B 中优势真菌属为根霉菌属(47.25%)和威克汉姆酵母属(24.06%);C 中优势真菌属为根霉菌属(33.37%)。同时,A、B 和C 中还有少量酿酒酵母属(Saccharomyces)、棒孢酵母属(Clavispora)、古根菌属(Archaeorhizomyces)和镰刀菌属(Fusarium)。DZ 中真菌物种组成较为简单,优势真菌属为根霉菌属(17.42%)和曲霉菌属(81.60%)。
研究表明,石斛能促进根霉菌属和酿酒酵母属繁殖,相反抑制曲霉菌属生长[38-39],这解释了为何石斛小曲中根霉菌属和酿酒酵母属增多,而曲霉菌属明显减少的变化趋势。根霉菌属和曲霉菌属作为小曲中核心真菌属,能产生多种水解酶,用于淀粉糖化和蛋白质水解生成还原糖及氨基酸[40-41],且曲霉属与吡嗪类、酯类和芳香族化合物的形成有密切联系[33]。威克汉姆酵母属是常见的非酿酒酵母,能促进酚类及芳香类物质形成[42]。酿酒酵母属是乙醇的主要生产者,同时也能产生酯类和高级醇[43]。古根菌属、镰刀菌属、芽枝霉属和被孢霉属主要存在于A、B 和C 中,且与石斛茎添加量存在正比关系,因此推测其来自石斛原料。镰刀菌属与芽孢杆菌属存在拮抗作用[44],因此C 中芽孢菌属含量较少。综上,当添加30%石斛茎时,小曲中有益真菌种类及含量最大,利于发酵;相反,添加50%石斛茎时不利于有益真菌生长,这与细菌群落结构分析一致。
2.5 小曲群落相似性聚类分析
为更好地说明样品小曲中微生物群落的差异,分别对细菌和真菌组成进行主成分分析(Principal Component Analysis,PCA)及层级聚类分析(Hierarchical Cluster Analysis,HCA)。如图4a 所示,PC1 和PC2 对细菌群落差异的贡献率之和高达94.2%,能较好地反映样品小曲间细菌群落差异。A 和B 与C 和DZ 分别位于主坐标轴左、右两侧,说明A 和B 与C 和DZ 之间差异较大。图4b显示,4 个小曲聚两大支,A 和B 聚为一类,C 和DZ 聚为另一类,这与PCA 结果一致。如图4c 所示,PC1 和PC2 对真菌群落差异贡献率之和高达97.4%。A、B 和C 与DZ 分别位于主坐标轴左、右两侧,表明A、B 和C 与DZ 间差异较大。图4d 显示,A、B 和C 聚为一类,DZ 聚为另一类,这与PCA结果一致。

图4 小曲细菌群落主成分(a)和层级聚类(b),真菌群落主成分(c)和层级聚类(d)分析图Fig.4 PCA(a)and HCA(b)of bacterial community,PCA(c)and HCA(d)of fungal community in Xiaoqu samples
2.6 关联性分析
2.6.1 小曲微生物与理化性质的冗余分析 冗余分析(Redundancy Analysis,RDA)分析了小曲微生物与理化性质间的相关性。如图5a 所示,芽孢杆菌属与发酵力、糖化力、液化力及酯化力呈正相关,A 和B 细菌群落结构相似,因此与这4 个理化指标相关性高。葡萄球菌属和乳酸杆菌属与酸度呈正相关,酸度主要与小曲C 有较高相关性;葡萄球菌属在白酒生产中起何作用至今未见报道,但葡萄球菌属中的腐生葡萄球菌属可通过产生酸性蛋白酶降低环境酸度[45-46]。如图5b 所示,根霉菌属、威克汉姆酵母和曲霉菌与液化力、发酵力、糖化力和酯化力呈正相关,其中A 和B 与液化酶活力、糖化酶活力、发酵力和酯化力相关性较高。镰刀菌属、红菇属、古根菌属、芽枝霉属、被孢霉属和棒孢酵母属则与酸度呈较强正相关,C 与酸度相关性最高。综上所述,真菌对小曲理化特性形成的影响较大。
2.6.2 小曲微生物与挥发性组分相关性分析 基于Spearman 算法分别剖析细菌和真菌在属水平前10 的物种与16 种ISDMs 间的相关性,借助R语言软件进行热图可视化分析。如图6a 所示,芽孢杆菌属与环己醇、苯甲醇、正己醇、4-叔丁基苯酚和正己醛呈显著正相关,这与Azokpota 等[47]研究一致。葡萄球菌属与松油烯和芳樟醇呈显著正相关。如图6b 所示,根霉菌属和威克汉姆酵母属与醛酮类、醇类和酚类物质呈正相关,如环己醇、苯甲醇、正己醇、1-十一醇和愈创木酚等,这与Chen 等[48]和刘晓柱等[49]的研究结果一致。酿酒酵母菌属与1-十一醇、壬醛、芳樟醇、松油烯、苯甲醛和苯并噻唑呈正相关;酿酒酵母属在白酒酿造过程中的主要作用是产生醇类物质,同时也与醛类物质的形成有关[50]。苯并噻唑、1-十一醇、壬醛、芳樟醇、松油烯、3-甲基-2-庚醇和苯甲醛与红菇菌属、棒孢酵母菌、古根菌属、镰刀菌属、芽枝霉属和被孢霉属呈正相关。根据重要显著差异挥发性风味热图(图2b)和真菌群落组成图(图5b)可知,芳樟醇、松油烯等7 种风味组分和古根菌属、镰刀菌属等6 个真菌属在A、B 和C 中含量较高,推测其与石斛原料存在密切关联,而彼此间具体联系还需进一步研究。

图5 细菌(a)和真菌(b)群落与环境因子的冗余分析Fig.5 Redundancy analysis of bacterial(a)and fungal(b)community and environmental factors
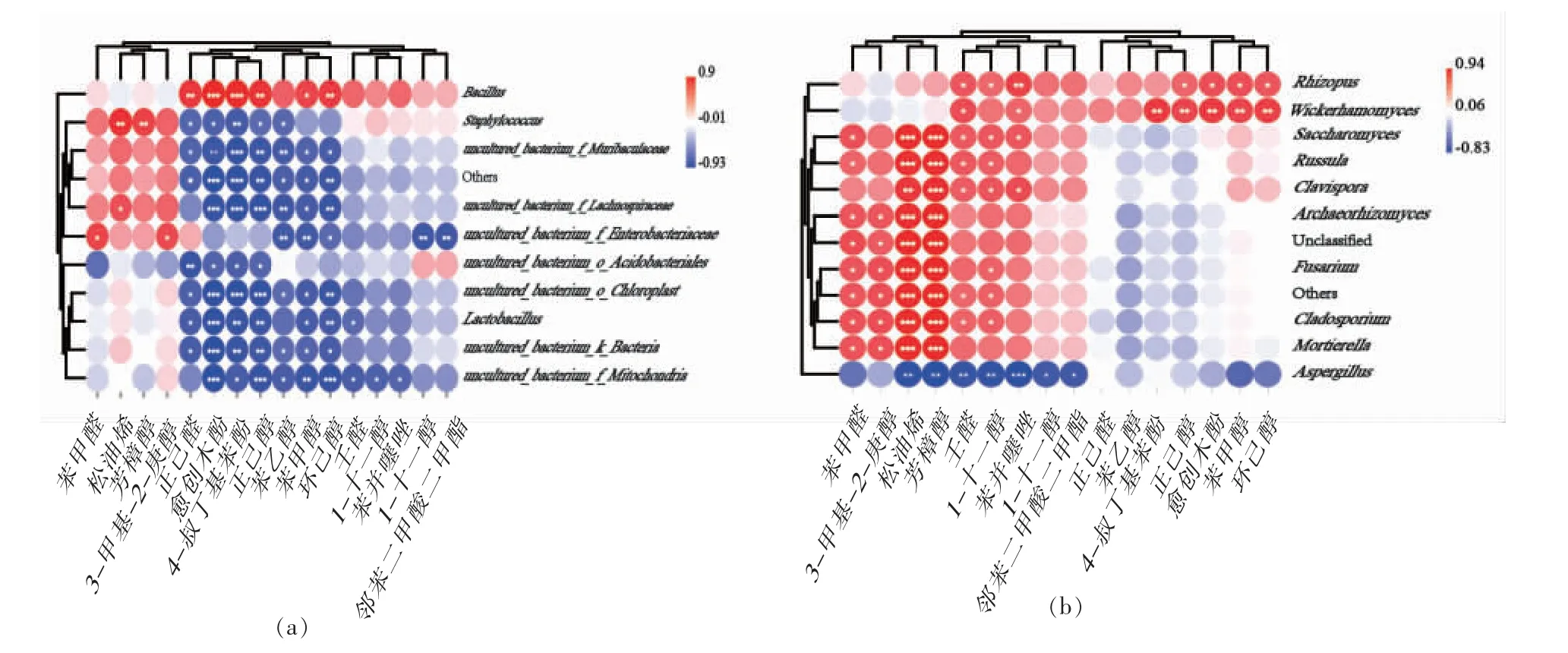
图6 细菌(a)和真菌(b)群落与重要显著差异风味物质相关性分析Fig.6 Correlation analysis between bacterial(a)and fungal(b)communities and important significantly different metabolites
3 结论
采用高通量测序技术结合HS-SPME/GC-MS分析石斛添加量对小曲微生物群落、理化特性和挥发性风味物质的影响。结果发现:DZ 优势细菌属 为 uncultured_bacterium_o_Chloroplast、uncultured_bacterium_f_Mitochondria 和乳酸杆菌属,优势真菌属为根霉菌属和曲霉菌属。A、B 和C 中优势细菌属为芽孢杆菌,优势真菌属存在差异,主要为根霉菌属、曲霉菌属和威克汉姆酵母属。添加石斛茎增大了小曲中芽孢杆菌和根霉菌等有益微生物含量。当添加量为30%时,小曲有益细菌和真菌物种占比最大。与DZ 相比,石斛茎明显增加了烃类、醇类、酚类和醛酮类化合物的种类和含量。小曲样品不同理化特性间存在差异,添加30%石斛茎时提高了小曲糖化力、液化力、发酵力和酯化力等。相关性分析显示,芽孢杆菌属、根霉菌属和威克汉姆酵母属与糖化力、液化力、发酵力和酯化力,醇类、酚类和醛酮类物质呈正相关。综上,最终确定添加30%石斛茎时小曲品质最好。同时要注意制曲过程的卫生状况,降低不可培养的细菌含量。
