黑果腺肋花楸汁对便秘小鼠肠道功能的改善作用
2023-01-12唐晓姝陈雪梅胡博张白曦
唐晓姝,陈雪梅,胡博,张白曦
(1 江南大学国家功能食品工程技术研究中心 江苏无锡214000 2 江南大学食品学院 江苏无锡 214000)
黑果腺肋花楸(aronia melanocarpa)又称野樱莓,富含大量的多酚、花青素、绿原酸、槲皮素等,具有较高的抗氧化性,是植物活性物质的主要来源之一。Jamar 等[1]研究了花青素通过改善肠道微生物组成来控制肥胖。也有文献[2-3]发现,在肠道微生物代谢过程中,多酚可分解为具有生物活性的代谢物,进而调节肠道菌群的组成和活性,改善肠道菌群失调,增加有益菌群和有害菌群的比例,如乳酸菌、变形菌等,从而对人体产生潜在的生理影响。此外,多酚可以改变肠道菌群的组成,使其朝着对某些慢性疾病有益的特定微生物种类发展[4-5]。Yu 等[6]发现黑果腺肋花楸的花青素可以显著增加拟杆菌属的相对丰度,对肠道菌群有正向调节作用。Pei 等[7-8]通过动物实验发现,食用黑果腺肋花楸后可通过抑制炎症因子来改善胃肠道健康。Kong 等[9]研究黑果腺肋花楸的多酚对脂多糖诱导大鼠肝脏疾病的肠道菌的调节作用,发现黑果腺肋花楸多酚提取物组通过调节肠道菌群降低大鼠的体重和肝脏指数。
本文研究黑果腺肋花楸汁对小鼠便秘和肠道菌群的改善作用,包括首粒黑便排出时间、小肠推进率和小肠蠕动功能等指标的改善效果。采用ELASA 试剂盒测定黑果腺肋花楸汁对便秘小鼠血清中兴奋性递质和抑制性递质分泌量的影响,同时引入16S r RNA 技术评价其对便秘前、后小鼠肠道菌群的调节作用,从肠道激素含量和肠道菌群角度探明黑果腺肋花楸汁改善小鼠便秘的机制。
1 材料与方法
1.1 材料与试剂
样品及药品:黑果腺肋花楸,吉林辽源市;盐酸洛哌丁胺≥98.0%、活性炭粉10~100 目,上海百灵威化学技术有限公司;阿拉伯树胶,国药集团化学试剂有限公司;胃动素测试盒、胃泌素试剂盒、P物质试剂盒、内皮素-1 测试盒、血管活性肠肽试剂盒、生长抑素测试盒,南京森贝伽生物科技有限公司。
实验动物:无特定病原体(Specific Pathogen Free,SPF)级BALB/c 的雄性小鼠,18~22 g,北京维通利华实验动物技术有限公司。
环境及饲料:实验动物在江南大学实验动物中心屏障设施中饲养;维持饲料、垫料,江苏协同医药生物工程有限责任公司。
1.2 仪器与设备
ME3002E 电子天平,梅特勒-托利多公司;DYCP-31DN 型琼脂糖水平电泳仪,北京六一生物科技有限公司;ND2000 光度计,赛默飞世尔科技公司;ABI GeneAmp9700 型PCR 仪,爱普拜斯应用生物系统公司;Quantus TM 高灵敏荧光计,美国普洛麦格(Promega)公司;NovaSeq 6000 测序平台,美国Illumina 公司;5424R 高速离心机,德国艾本德公司。
1.3 试验方法
1.3.1 样品制备 黑果腺肋花楸,弃腐烂、破损的果实,用纯水洗净、晾干。将其用胶体磨破碎制成果浆,包裹在纱布中,挤压,过200 目筛,离心(3 200 g/min,5 min)得到黑果腺肋花楸汁,4 ℃储存。
1.3.2 动物分组与实验周期 实验设为空白对照组、模型对照组、黑果腺肋花楸汁低、中、高剂量组,每组10 只动物。黑果腺肋花楸汁低、中、高剂量组小鼠分别给予剂量为5,10 mL/kg BW 和20 mL/kg BW,换算成60 kg 成人服用量约为60 mL/d 的5,10 倍和20 倍。受试样品、饮用水均经口灌胃,连续14 d。
本实验28 d,前7 d 为适应期,后21 d 为干预期。第7 天随机收集未干预的小鼠粪便10 份(灌胃前空白组BBL);第21 天分别收集干预后造便秘模型前的小鼠粪便(灌胃后空白组ABL,灌胃后低剂量组AL,灌胃后中剂量组AM,灌胃后高剂量组AH)及造便秘模型模后的小鼠粪便(灌胃后模型空白组AMBL,灌胃后模型中剂量组AMM,灌胃后模型高剂量组AMH),每组粪便5 份,快速放入-80℃冰箱保存。第21 天做排便实验;第28 天做小肠运动实验。
1.3.3 排便和小肠运动实验 参照本实验室发表的文献[10]中小肠运动实验、排便实验方法。
1.3.4 便秘小鼠血清中胃肠调节肽的测定 取小鼠眼球血1.5 mL,4 ℃、3 500 r/min 离心10 min,取血清,用ELISA 试剂盒测定血清中胃肠调节肽的含量,按照说明书中的操作步骤操作。对小鼠血清中Gas、MTL、SP、ET-1、SS 和VIP 的线性回归方程R2均大于0.99。
1.3.5 便秘前、后小鼠粪便菌群的测定 采集小鼠粪便后封存于干燥、无菌的收集管中,在干冰冷冻条件下送至上海唯那生物科技有限公司进行微生物总DNA 的抽提、质检。取适量质控合格的总DNA,使用 338F(5' -ACTCCTACGGGAGGCAGCAG -3')引物和 806R(5' -GGACTACHVGGGTWTCTAAT-3')引物进行16S rDNA V3~V4 区域目标片段的PCR 扩增。根据Illumina NovaSeq 6000 平台标准操作规程,将纯化后的扩增片段构建PE 250 文库并进行双末端测序。下机的fastq 数据经fastp 软件(version 0.21.0)质控后,使用QIIME 软件流程进行OTU 聚类、α 多样性分析、β 多样性分析以及菌群变化差异分析等。测序数据双末端拼接后,根据分类置信度为0.7 的阈值进行聚类,序列相似度大于等于97%的被认为是同一种OTU,从中挑选出最长的序列,作为OTU 的代表序列。核酸处理、文库构建、测序工作由上海唯那生物科技公司完成。
1.3.6 数据分析 测序部分数据通过LEfSe 分析对样品的物种组成做差异显著性检验,并用STAMP 软件比较组间的功能差异。其它数据统计学分析采用SPSS(statistics 20)软件做方差齐性检验,P<0.05 具有统计学意义。各类统计图的绘制使用R 语言(version 4.0.3)、Origin8.0 和Excel 完成。除特别说明外,结果均以平均值±标准偏差表示。
2 结果与分析
2.1 黑果腺肋花楸汁对便秘小鼠排便参数的影响
用盐酸洛哌丁胺进行便秘小鼠造模,盐酸洛哌丁胺会抑制肠道平滑肌收缩,减少肠蠕动,模拟胃肠动力障碍,从而引起便秘[11]。由表1 可知,与ABL 组比较,AMBL 组小鼠给予洛哌丁胺后,首粒黑便排便时间明显延长,5 h 内排黑便粒数明显减少,黑便质量降低,表明小鼠便秘模型建立成功。
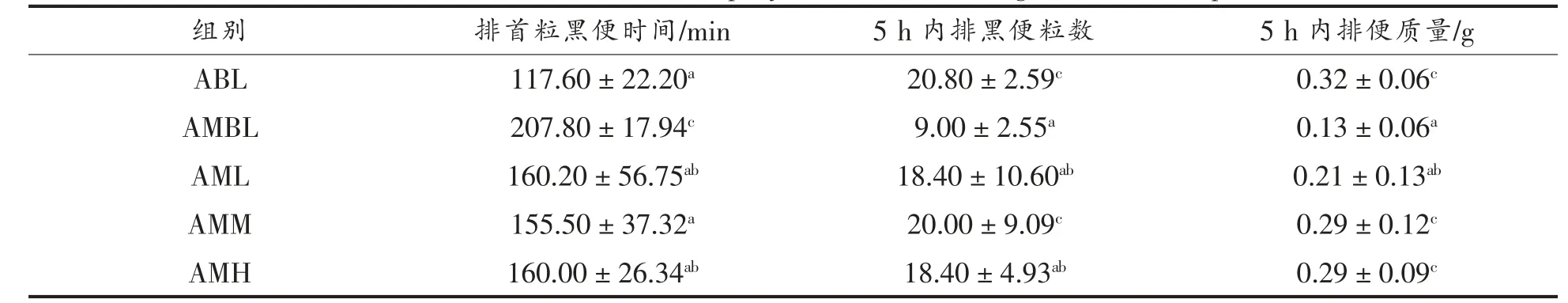
表1 黑果腺肋花楸汁对小鼠排便实验的影响Table 1 Effect of aronia melanocarpa juice on the relaxing the bowels experiment
与AMBL 组相比,黑果腺肋花楸汁的AML、AMM、AMH 3 个剂量组均不同程度地缩短便秘小鼠的首粒黑便排便时间,增加5 h 内排黑便粒数。除AML 组外,AMM、AMH 组5 h 内排便质量也显著增加。黑果腺肋花楸剂量组的粪便软硬度适中,成形性良好,表明其较好地改善便秘小鼠的润肠通便情况,小鼠状态与空白对照组无明显差异。
2.2 黑果腺肋花楸汁对便秘小鼠小肠推进率的影响
测量和计算小鼠的小肠推进率,如表2 所示。与ABL 组比较,AMBL 组小鼠给予洛哌丁胺后,小肠的墨汁推进率显著降低,提示小鼠便秘模型建模成功。与AMBL 组比较,黑果腺肋花楸汁剂量组小鼠的小肠推进率均有不同程度地提高,其中AML、AMH 组小肠推进率提高了40%以上,差异性达极显著水平,说明黑果腺肋花楸汁通过促进便秘小鼠小肠蠕动,缓解便秘症状。

表2 黑果腺肋花楸汁对小鼠小肠推进率的影响Table 2 Effect of aronia melanocarpa juice on the intestine pushing rate experiment
2.3 黑果腺肋花楸汁对调节便秘小鼠血清胃肠激素的影响
便秘相关的胃肠激素分布在胃肠黏膜细胞之间,是胃肠道黏膜层和胰腺的内分泌细胞分泌的活性物质,可调控胃肠道运动,具有兴奋和抑制两种作用[12]。其中MTL、Gas、SP 为兴奋性递质,它们能促进胃的收缩,加速肠道传输时间,促进胃肠内容物运行,对胃肠道运动起兴奋作用;ET-1、SS、VIP 为抑制性递质,可以抑制胃肠激素的释放,减缓小肠通过时间,抑制胃肠排空等[13-14]。
图1 中,便秘小鼠AMBL 组的血清兴奋性递质(GAS、MTL 和SP)的分泌量显著低于ABL 组,给予黑果腺肋花楸汁的AML、AMM、AMH 3 个剂量组便秘小鼠的兴奋性递质分泌量均有一定的回升,MTL中的AMM 组,GAS中的AMM 和AMH组和SP 中的AMH 组,与便秘模型组AMBL 比较,均有显著性差异。便秘小鼠AMBL 血清抑制性递质(SS、ET-1 和VIP)的分泌量显著高于BBL组,给予黑果腺肋花楸汁的AML、AMM、AMH 3个剂量组便秘小鼠的抑制性递质分泌量均有显著的回落,说明黑果腺肋花楸汁能显著促进小鼠兴奋性递质的分泌量,降低抑制性递质的分泌量,并具有一定的剂量相关性。

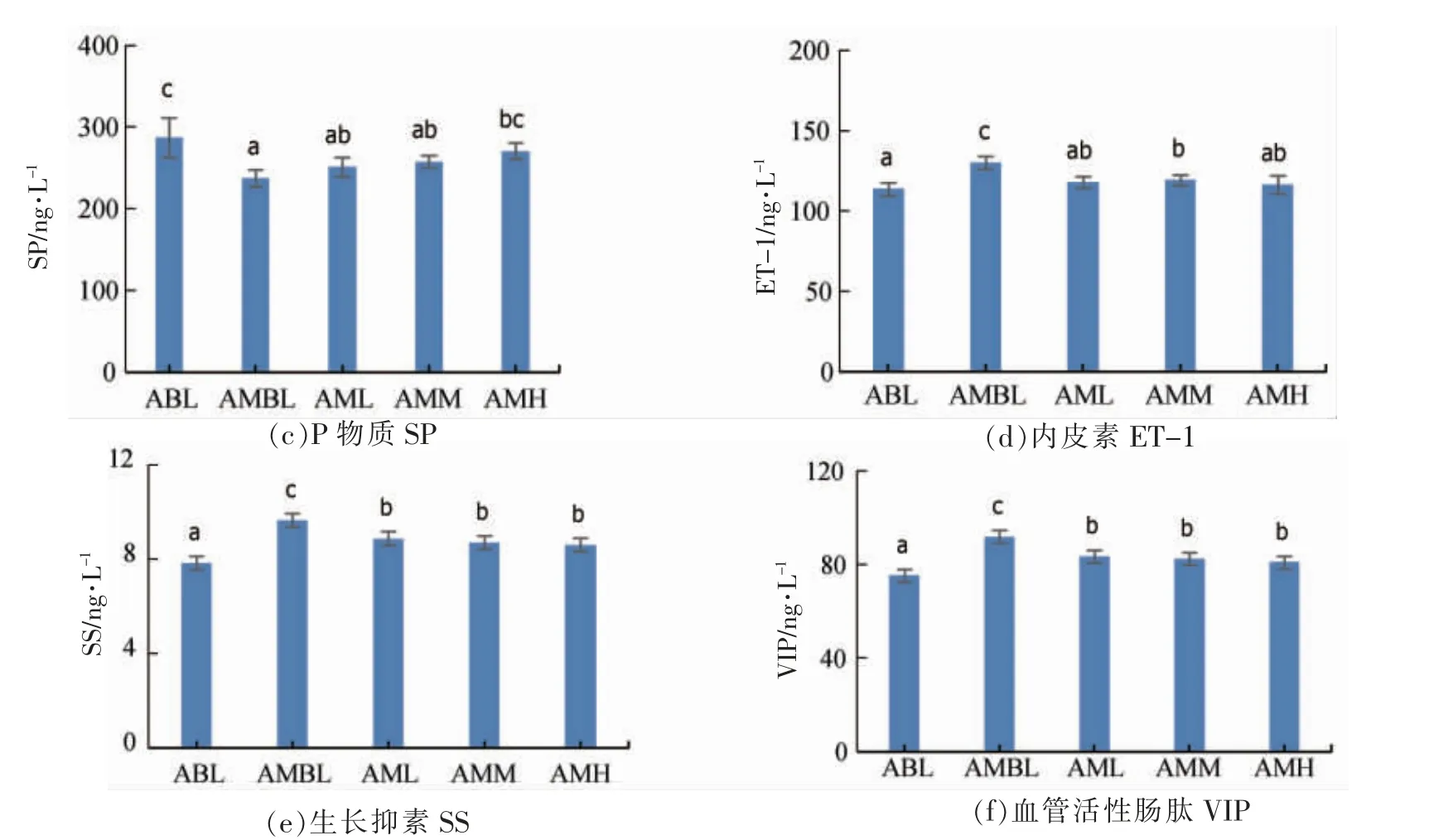
图1 黑果腺肋花楸汁对调节便秘小鼠血清中胃肠肽含量的影响Fig.1 Effect of aronia melanocarpa juice on the content of gastrointestinal hormones in serum of constipated mice
2.4 黑果腺肋花楸汁对便秘前、后小鼠肠道菌群结构的影响
2.4.1 对便秘前、后小鼠肠道菌群多样性的影响
物种多样性(Alpha diversity)指单个样品中物种多样性,包括Chao 指数、Shannon 指数、Simpson指数等。Chao 指数反映样品中菌落的丰富度,即简单指群落中物种的数量,而不考虑群落中每个物种的丰富情况,它能够估计样品群落包含的物种总数,同时反映群落中低丰度物种的存在情况,是常用的计算菌群丰富的指数之一[15]。图2a 所示,与BBL 组和ABL 组比较,黑果腺肋花楸汁组(AM 组和AH 组)的Chao 指数显著升高,推测黑果腺肋花楸汁增加了小鼠肠道菌群的物种总数。
Shannon 和Simpson 指数反映群落的多样性。通常群落多样性越高,物种分布越均匀,Shannon指数越大;若一个群落中优势菌种占得多,其它非优势菌种占比减少,则该物质的Simpson 指数数值越大[15]。图2b、2c 中,与BBL 组和ABL 组比较,黑果腺肋花楸汁组(AM 组和AH 组)的Shannon和Simpson 指数分别显著上升和下降,表明黑果腺肋花楸汁可以增加小鼠肠道群落的多样性,使菌群种类分布得更均匀。

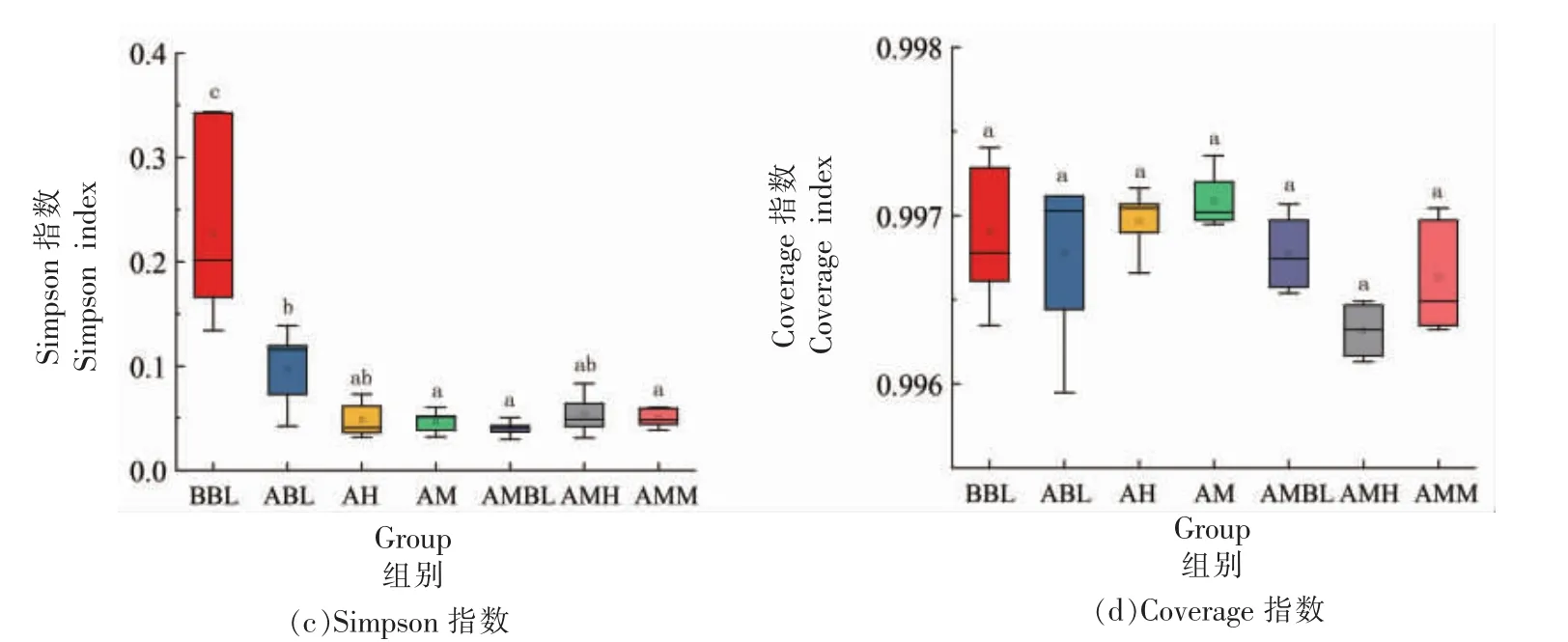
图2 各组肠道菌群的Alpha 多样性指数Fig.2 Alpha-diversity indexes of gut microbiotas in each group
Coverage 指数反映测序深度,数值越高,样本中序列越易被测出。由图2d 可知,各组的Coverage 指数均大于0.99,表明此次测序深度基本达到样品中的所有物种。
基于QIIME 软件计算Beta 多样性,通过Beta多样性指数比较各组微生物组成的差异。基于样本中物种的组成结构和丰度信息在OTU 水平上,进行主坐标分析(Principal Co-ordinates Analysis,PCoA)。采用unweightedUniFrac 距离算法,选取贡献率最大的主坐标组合作图(图3),图中各点距离越近,样品的物种组成越相似。在OUT 分类水平上,各组中的组内平行样本都能较好地聚在一起,说明组内样本间具有较高的一致性。给予受试物后的6 个组与BBL 组距离较远,说明经14 d的喂养,小鼠肠道菌群的结构分布有明显改变;与ABL 组相比,AM、AH 组微生物群落沿第2 主坐标(PC2)正向偏移,说明受试黑果腺肋花楸汁的小鼠肠道菌群的物种组成结构有显著变化;与AMBL组相比,AMM、AMH 组微生物群落沿第1 主坐标(PC1)远离模型AMBL 组,更接近AM、AH 组,推测中、高剂量的便秘小鼠能够通过受试黑果腺肋花楸汁改变肠道菌群的分布,改善肠道菌群失调,缓解便秘。
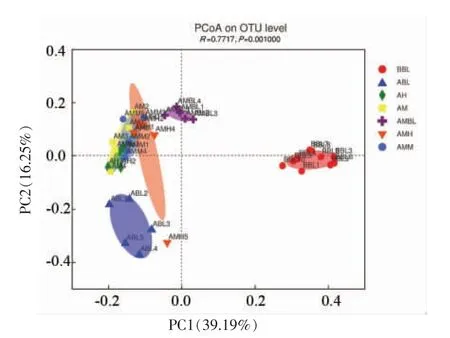
图3 各组肠道菌群结构PCoA 分析Fig.3 PCoA analysis of intestinal flora structure in in each group
2.4.2 门水平分类下各组物种组成情况 在门分类水平下,分析各组肠道菌群群落组成的相对丰度,由图4a 所示:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)均为优势菌门,是各组小鼠肠道菌群的主要组成部分,平均占比在90%以上。其次为脱硫杆菌门(Desulfobacterota)、变形菌门(Proteobacteria)、脱铁乳杆菌(Deferribacterota)、疣 微菌门(Verrucomicroblota)等。
厚壁菌门与拟杆菌门相对丰度比值(F/B)可在一定程度上作为反映肠道菌群紊乱的重要指标[16]。高脂饮食会使F/B 的比值增加[17]。肥胖个体中F/B 的比值较高,体重减轻与F/B 降低有关[18-19]。在肥胖模型中,F/B 改变可能与肠道微生物的代谢潜力相关,F/B 降低可能会提高微生物从膳食中获取能量的能力,有利于控制肥胖[20-21]。
分析黑果腺肋花楸汁受试前、后小鼠肠道中F/B(图4b),与ABL 组比较,给予14 d 黑果腺肋花楸汁的AH、AM 组的F/B 平均值均显著减小,说明饮用富含大量多酚类活性物质的黑果腺肋花楸,对改善肠道微生物,调节体重等有一定的帮助,具体机制需进一步验证。
大多数变形菌门是致病性革兰氏阴性菌,细菌中最大的一门,包括很多病原菌,当它们超过正常水平时,与炎症疾病有关。通常,变形菌门作为肠道菌群紊乱和潜在疾病的鉴定标准,当数量处于较低水平时,表示肠道环境健康良好[15,22]。本试验数据显示(图4c),经14 d 的喂养,ABL 组的变形菌门丰度显著增加;与ABL 组比,AH、AM 组的丰度显著降低;造便秘模型后,AMBL 组、AMH 组和AMM 组的变形菌门富集程度大幅度提升,然而,与AMBL 组比较,受试物AMH、AMM 组的丰度显著降低,说明黑果腺肋花楸汁可以降低便秘前、后小鼠肠道中的变形菌门丰度,使小鼠的肠道环境向更健康的方向发展。
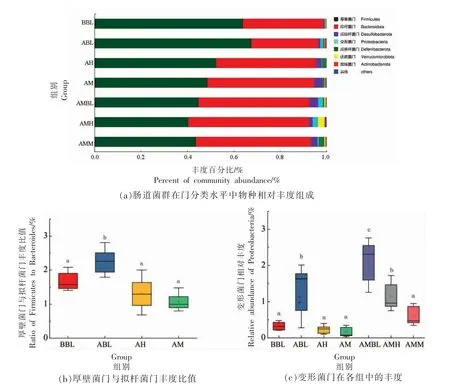
图4 “门”水平下黑果腺肋花楸汁对小鼠肠道菌群群落的影响Fig.4 Effects of aroniamelanocarpa juiceon intestinal flora of mice at portal level
2.4.3 属水平分类下各组物种组成情况 基于注释出来的物种组成信息表,使用R 语言程序包绘制不同组别的小鼠粪便样品属水平菌群组成分布图(图5a)。乳杆菌属(Lactobacillus)是一种存在于体内的乳杆菌属益生菌,可将碳水化合物发酵成乳酸,有助于人体肠道健康。图5b 可看出,与BBL组比较,14 d 后ABL、AM 和AH 组中乳杆菌属丰度显著性增加。其中ABL 组中的乳杆菌属占40.8%,而AM 和AH 组的乳杆菌属虽仅占12.8%,16.5%,但其它菌属丰度均变得丰富。造便秘模型后AMBL 组中乳杆菌属丰度显著下降,AMM 和AMH 组对比AM 和AH 组略有下降,未有显著性。推测黑果腺肋花楸汁可以调节便秘小鼠肠道中有益菌乳杆菌属的含量,缓解便秘症状。
在革兰氏阳性菌中,葡萄球菌属(Staphylococcus)是最常见的化脓性球菌,是导致医院交叉感染的主要致病菌[23]。图5c 中,BBL 组的葡萄球菌属占近50%,经14 d 的喂养,葡萄球菌属丰度显著降低(ABL、AM、AH 组),造便秘模型后的AMBL 组中葡萄球菌属丰度又显著增加,而造便秘模型后一直给予黑果腺肋花楸汁受试物的AMM、AMH 组中葡萄球菌属丰度相比AMBL 组显著降低,且呈量效关系。表明经过一段时间的喂养,原肠道菌群中葡萄球菌属得以改善,推测便秘会导致小鼠肠道菌群中葡萄球菌属的丰度会增加,而受试黑果腺肋花楸汁样品后可改善葡萄球菌属的丰度。

图5 “属”水平下黑果腺肋花楸汁对小鼠肠道菌群群落的影响Fig.5 Effects of aroniamelanocarpa juice on intestinal flora of mice at genera level
3 结论
用盐酸洛哌丁胺进行便秘小鼠造模成功,通过小肠推进率、首粒黑便排出时间、小肠蠕动功能等指标评价小鼠的通便功能。为探究黑果腺肋花楸汁改善便秘的原因,对小鼠血液中的胃肠激素含量进行检测,发现黑果腺肋花楸汁通过增加兴奋性递质,降低抑制性递质而促进小鼠通便。高通量测序结果表明,黑果腺肋花楸汁可以增加小鼠肠道菌群的多样性,使肠道菌更加丰富、均匀,并可改善菌群分布,改善肠道菌群失调。在门水平上,黑果腺肋花楸汁可使厚壁菌门与拟杆菌门丰度比值显著下降,并改善便秘前、后变形菌门的丰度。在属水平上,黑果腺肋花楸汁可显著增加便秘后小鼠乳酸杆菌属的丰度,降低便秘前、后小鼠的葡萄球菌属丰度。
综上所述,黑果腺肋花楸汁对便秘小鼠具有较好的通便功能。推测每日饮用60 mL 的黑果腺肋花楸汁,可以调节胃肠激素含量,改善肠道菌群结构,增加肠道中的有益菌,降低致病菌。黑果腺肋花楸汁在改善便秘、调节肠道微生态方面具有一定潜力,本研究结果为黑果腺肋花楸汁制备相关的功能性食品提供了理论依据。
