水稻垩白相关基因及其功能的研究进展
2023-01-11唐先宇萧浪涛夏石头
唐先宇,萧浪涛,夏石头*
(湖南农业大学 a.植物激素与生长发育湖南省重点实验室;b.生物科学技术学院,长沙 410128)
垩白(chalkiness)是水稻(OryzasativaL.)稻米在成熟过程中因淀粉填充不充分而产生的未填充的微小间隙,导致大米宏观上呈现出一种不透光的白色。高垩白稻米在机械强度上显著劣于正常稻米,在加工过程中极易断裂破碎,从而严重影响稻米的品质,增加了生产成本,降低了市场竞争力[1]。另外,高垩白稻米与正常稻米烹饪后的口感存在明显差异,多为黏度与弹性降低。也有部分研究认为,稻米的垩白性状与其口感无显著相关性[1]。这可能是由于不同原因导致的垩白所引起的差异。
在早期研究中,人们认为垩白是典型的数量性状,受遗传因子和环境共同影响[2-4],这导致早期水稻垩白研究进展缓慢,且大量基因水平上有关垩白性状的研究工作难以全面诠释垩白性状的调控网络。随着近年来生物学研究技术的不断革新进步,越来越多的垩白性状相关突变体不断被发现与研究,使得人们对调控垩白性状的分子机理有了新的认识与理解。本文综述了近年来水稻垩白相关基因的数量性状基因座(quantitative trait locus,QTL)定位、克隆及其功能的研究进展。
1 垩白性状的形成
在水稻籽粒的发育过程中,胚乳灌浆时伴随有大量淀粉与蛋白质的积累与合成,而胚乳中淀粉组分的填充水平既影响产量还影响稻米品质[3],在填充不完全的情况下,过多空隙使光线透过籽粒时被大量散射,形成白斑。垩白性状是由于淀粉组分的不充分填充导致的,故其研究需要基于对稻米胚乳发育过程的了解。已有学者将水稻胚乳的发育分为4个阶段:共细胞、细胞化、储藏产物积累和成熟[5]。淀粉的积累主要集中在储藏产物积累阶段。在胚乳的发育过程中,淀粉的积累主要是先从胚乳中心区域开始,后逐步向外侧扩散。其细胞程序性死亡(programmed cell death,PCD)试验也得出了类似的结论[5],即胚乳中心细胞膜完整性首先受到影响,然后向外围扩散,且胚乳背部细胞中的淀粉粒通常大于侧部细胞。淀粉和蛋白质的大量积累完成后,胚乳开始逐渐脱水,在储藏产物积累和成熟的过程中,淀粉与蛋白质结晶,使得水稻籽粒形成半透明状。因此,发育过程中因淀粉填充不完全所导致的垩白表型与储藏产物的积累、淀粉合成代谢、能量物质运输、胚乳与胚的能量物质竞争等途径密切相关。
除遗传因素外,灌浆时期的温度、湿度、光照、水肥条件等许多因素都会显著影响垩白的产生。其中,高温及较低的直链淀粉的含量等往往正向调控垩白的产生[2-4],水稻叶片的光合速率与其籽粒的垩白水平相关[6],过高的灌浆速率也会导致较高的垩白水平[7-10]。此外,脱落酸(abscisic acid,ABA)在水稻灌浆期间起到了重要的调控作用,其含量的时空变化与水稻的垩白水平相关。在水稻灌浆的前中期,ABA能够促进水稻灌浆,后期则抑制灌浆;而进一步的研究表明,赤霉素(gibberellin,GA)、ABA在胚乳与胚的养分竞争分配中起到了重要的调节作用[11-15]。
2 垩白性状的QTL定位
在众多影响因素中,研究者们发现,尽管粒长与粒宽的增加都可增加稻米千粒重、提高产量,但是粒宽与粒长同垩白性状的相关性却是相反的。粒宽的增加往往伴随垩白率的增加[16],粒长的增加则结果相反[17]。遗传学规律表明,部分正向调控水稻垩白性状的相关基因,即增加水稻垩白率的基因,与正向调控粒宽的基因高度连锁,而部分反向调控水稻垩白性状的相关基因与正向调控粒长的基因高度连锁。为了利用该遗传规律兼顾水稻的高产与品质,更多的育种工作者选择培育长粒型而非宽粒型品种。这是因为正向调控垩白的基因与正向调控粒宽的基因高度连锁,分离这两类高度连锁基因显然很困难且效率低,反之,培育高粒长品种就能得到部分连锁的反向调控垩白性状的基因。
近年来测序技术的成熟,使得通过全基因组关联研究(genome-wide association studies,GWAS)策略高效分析得到引起水稻垩白性状的QTL位点成为可能。2003年,Li等[18]定位到4个影响稻米垩白水平的QTL,其中,qET-3与qET-8位点被证明能够显著调控垩白水平。2006年,沈圣泉等[19]再次鉴定到5个调控垩白水平的QTL,且qTR6-1对垩白的调控与环境因素存在显著相关性。2014年,第一个控制稻米垩白的主效QTLChalk5基因被克隆[20]。2020年,国际水稻所通过多个不同垩白品种的比对,得到了746个与垩白性状密切相关的QTL位点,除涵盖了早年已发现的大量相关QTL位点外,许多未被发掘的QTL位点也已被发现[21]。分析与部分基因验证结果表明,其涵盖的Myb转录因子、脂质代谢、蜡质代谢、直链淀粉代谢、米粒尺寸等途径相关基因与预测的调控水稻垩白性状的单核苷酸多态性(single nucleotide polymorphism,SNP)位点存在重叠,且部分垩白调控相关基因存在上位作用。然而,针对米粒尺寸调控相关基因与预测位点重叠的基因精细定位与分析验证结果表明,水稻粒宽与垩白之间的关系或许并不是由水稻粒宽相关基因引起的,因为仅有3个QTL区域与已知的粒宽QTL区域重合,且其中部分影响粒宽的关键基因与垩白的产生不存在较强的因果关系[21]。
3 垩白性状相关基因及其功能
随着研究的不断深入,越来越多的证据表明,水稻可能通过影响能量产生、能量物质分配、淀粉合成与淀粉结构4类机制来调控稻米垩白性状(图1)。与之相应的是,垩白性状相关基因可分为能量产生相关基因、能量物质分配相关基因、淀粉合成相关基因、淀粉体堆积结构相关基因和其他途径相关基因。
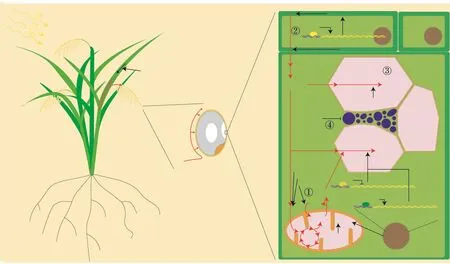
图1 水稻垩白的产生机制示意图Fig.1 Schematic diagram of chalkiness mechanisms in rice
3.1 能量产生相关基因
由于稻谷依靠自身光合作用得到的能量相当有限,其主要能量与物质主要由其他营养生长器官提供,这使得稻米在发育过程中,其籽粒的呼吸作用相对光合作用对供能更为重要。倘若呼吸作用的能量产生受到限制,就会导致稻米发育时期干物质积累受阻,从而产生垩白表型。在近年发现的众多垩白突变体中,FLO4(flouryendosperm4)[22],FLO10(flouryendosperm10)[23]、FLO12(flouryendosperm12)[24]、FLO13(flouryendosperm13)[25]、FLO14(flouryendosperm14)[26]、FLO16(flouryendosperm16)[27]、FLO18(flouryendosperm18)[28]和FLO19(flouryendosperm19)[29]可通过影响水稻能量产生而导致垩白性状,其中,FLO13与FLO16可直接影响能量的产生。FLO13编码了呼吸链复合体1上的一个亚基OsNDUFA9,从而直接影响到能量的产生;而FLO16编码了一个烟酰胺腺嘌呤二核苷酸依赖的细胞质苹果酸脱氢酶,其突变导致苹果酸穿梭系统无法正常运行,线粒体基质中质子浓度受到影响,从而影响到能量的产生。因FLO13与FLO16均参与线粒体的产能过程,导致flo13与flo16突变体表型也极其相似,相对于野生型,其米粒均扁平、发黄,同时伴随有非常严重的几乎覆盖全横截面的心白表型。FLO10、FLO14和FLO18虽也影响线粒体的产能过程,但是与FLO13和FLO16的直接影响不同的是,他们编码了一类三角状五肽重复(pentatricopeptide repeat,PPR)蛋白,FLO10与FLO18定位于线粒体,FLO14则定位于细胞核,FLO10、FLO14和FLO18可对线粒体NADH脱氢酶亚基编码基因(NADHdehydrogenasesubunit,NAD)进行RNA编辑,调控其NADH脱氢酶活性,从而间接影响线粒体呼吸作用产能,产生垩白表型。由于FLO10、FLO14和FLO18也能影响线粒体的产能过程,flo10、flo14和flo18突变体米粒的表型也与flo13和flo16相似。FLO12与FLO19分别编码了一个丙氨酸转氨酶和一个丙酮酸脱氢酶复合体的E1-α亚基,能够影响丙酮酸与乙酰辅酶A的积累,从而影响到下游线粒体的产能过程。flo12与flo19突变体米粒相对野生型米粒较扁,略微发黄,伴有严重的大面积心白表型。然而,相对于线粒体产能过程同样受影响的flo10、flo13、flo14、flo16和flo18突变体而言,flo12与flo19突变体米粒心白面积较小,外层仍有较厚的正常无垩白组织,这或许可通过FLO12与FLO19所影响的丙氨酸转氨与丙酮酸脱氢步骤存在更多更强的代偿反应来解释[29]。
水稻籽粒中,糖类是最丰富的物质。然而有趣的是,flo12突变是通过影响丙氨酸转氨过程而抑制线粒体的产能过程的,这似乎暗示了氨基酸代谢在水稻籽粒发育过程中提供了相当一部分的能量[24]。2005年,Kang等[22]筛选到了一株带有垩白性状的T-DNA突变体,并命名为flo4。该研究发现,FLO4编码了一个胞质丙酮酸磷酸双激酶(C-type pyruvate orthophosphate dikinase,PPDK),该酶参与CO2的固定过程,同时为氨基酸合成提供碳骨架,在碳氮代谢过程中起到了重要的作用。目前,国内外一致认为,水稻籽粒中的蛋白含量与氮肥施用量成正相关[30-31],同时,后期增施穗氮肥会增加水稻垩白粒率[32-33]。熊丹[34]发现,水稻在籽粒发育期间,其氨基酸含量呈现双峰曲线变化,约在抽穗后15 d内丙氨酸相对含量呈现明显的下降趋势,随后小幅上涨,20~25 d后出现第二个相对弱于第一次的下降趋势后逐渐稳定。也有研究表明,垩白部分的醇溶谷蛋白和球蛋白明显低于非垩白部分[35]。这些证据表明,在水稻籽粒发育期间,氨基酸也提供了相当一部分的能量。先前的研究认为,FLO12在植物中扮演了一个调控碳氮平衡的角色,然而flo4与flo12突变表型似乎暗示,在水稻籽粒发育过程中,动态涨幅的氨基酸不仅作为碳氮平衡的角色,而且在平衡和补偿部分能量代谢中也起到重要的作用。
3.2 能量物质分配相关基因
水稻籽粒需要足够多的能量与物质维持发育与保证淀粉的填充储存,因此,保证能量物质对籽粒的充分供给十分重要。在水稻中,蔗糖转运蛋白1(sucrose transport protein 1,SUT1)、蔗糖转运蛋白2(sucrose transport protein 2,SUT2)、蔗糖转运蛋白3(sucrose transport protein 3,SUT3)和蔗糖转运蛋白4(sucrose transport protein 4,SUT4)承担了蔗糖的转运功能。其中,sut1突变体的籽粒粒重相比野生型明显下降[36]。2008年,Wang等[37]研究发现,gif1(grainincompletefilling1)突变体存在严重的垩白表型,而GIF1编码了细胞壁蔗糖转化酶,该酶能够控制植物蔗糖的运载,调控糖类运输。2015年,nfyb1(nuclearfactoryb1)突变体被发现其稻米存在严重的垩白表型,其在水稻籽粒背侧糊粉层中特异性表达。进一步研究发现,NFYB1可直接调控SUT1、SUT3、SUT4蔗糖转运蛋白基因的表达,通过调控蔗糖到胚乳的转运而调控垩白的形成[38-39]。
3.3 淀粉合成相关基因
淀粉作为水稻籽粒的主要成分主要承担了储能功能。在保证能量与物质供给的条件下,在水稻籽粒灌浆期间,淀粉大量合成,形成主要的干物质积累。因此,该时期淀粉的正常合成受到限制,会影响籽粒淀粉的积累,从而引起垩白表型。在水稻的淀粉合成过程中需要大量的酶参与。在淀粉生物合成的第一步,AGPase(ADP-Glc pyrophosphorylase)催化葡萄糖-1-磷酸转化为ADP-葡萄糖,随后的合成过程中GBSSI/Wx(granule bound starch synthase)负责直链淀粉的合成。支链淀粉的合成受到SS(starch synthases)、SBE(starch branching enzymes)、DBE(starch debranching enzymes)等一系列淀粉生物合成酶的控制。在参与水稻淀粉合成的基因中,AGPase(OsAGPL3、OsAGPS2b、OsAGPL2)、PHO(OsPHOL/OsPHO1)、GBSS(OsGBSSI/Wx)、SS(OsSSI、OsSSIIa、OsSSIIIa、OsSSIVb)、SBE(OsBEI/SBE1、OsBEIIb)、DEB(OsISA1、OsISA2、OsPUL)被认为与水稻籽粒淀粉合成与积累密切相关[40-42]。其中,AGPL2基因突变后产生了严重的心白表型,籽粒发黄,但最外层仍有较厚的非垩白组织。AGPL2基因编码了一个葡萄糖焦磷酸化酶,该酶的功能缺失会导致淀粉合成关键步骤受到抑制[43]。淀粉磷酸化酶1(plastidial phosphorylase 1,PHO1)在淀粉代谢过程中同时具有合成与分解两个方向的功能。PHO1能够与大多数的淀粉合成酶形成复合体,在淀粉的代谢过程中起到重要的调控作用,其活性缺失使稻米籽粒中淀粉粒变小,从而产生垩白表型[44]。Wx(Waxy)基因编码一个颗粒结合淀粉合酶,在直链淀粉合成过程中行使功能,其突变体籽粒内直链淀粉含量受到严重的影响,相比野生型显著降低,存在垩白表型[45]。2007年,有研究报道了T-DNA插入突变体flo5(flouryendosperm5),确定其突变基因编码了淀粉合成酶(starch synthase 3a,SSIIIa),并通过参与支链合成与淀粉组装过程而影响水稻的垩白性状[46-47]。Yano等[48]发现,水稻淀粉分支酶sbe突变体存在垩白表型,其支链淀粉含量减少,淀粉体不规则。胞内淀粉合成中,SBE能在淀粉上引入一个分支点,在支链淀粉合成过程中行使功能,SBEIIb(starch branching enzymes IIb)活性受到影响,导致淀粉粒相比野生型变小,直链淀粉含量增加,支链淀粉长链水平上升,淀粉合成受到抑制,产生垩白表型[49]。2014年,flo6(flouryendosperm6)突变体被发现其稻米存在严重的心白性状,FLO6编码了一个含有CBM48结构域的蛋白,该结构域能与淀粉发生互作而结合到淀粉上,同时FLO6蛋白还能够与ISA1(isoamylases1)互作结合。进一步研究表明,FLO6能帮助ISA1与淀粉结合,从而调控淀粉的合成,形成垩白表型[50]。2017年,flo8(floury endosperm8)突变体被筛选获得,其株型略矮于野生型,但稻米带有严重心白表型。FLO8编码UDP葡萄糖焦磷酸化酶1(UDP-glucose pyrophosphorylase 1,UGP1),该酶直接参与淀粉的生化合成过程,表明flo8的心白表型是因直接影响淀粉合成所致[51]。
除直接调控相关淀粉合成酶系基因外,水稻还可通过转录因子调控这类酶编码基因的表达水平而调控垩白。2010年,RSR1(rice starch regulator 1)被发现能调控水稻的垩白性状。RSR1是一个AP2/EREBP家族转录因子,其负调控SSI基因的表达,rsr1突变体被发现存在严重的心白表型。生殖生长阶段中,rsr1突变体种子中直链淀粉含量相比野生型显著增加,过表达植株则与野生型无显著差异。有趣的是,尽管突变体中直链淀粉含量升高,但其突变体与过表达植株中总淀粉含量相较于野生型均无显著差异。同时,rsr1突变体种子千粒重显著增加,RSR1过表达千粒重则减少。值得注意的是,与其他垩白突变体不同,rsr1突变体尽管有较高的垩白率,但其千粒重相比野生型显著提升,且淀粉含量未发生改变[52]。2013年,水稻bzip58突变体被发现产生了严重的腹白表型,且千粒重减少。进一步研究表明,bZIP58能够识别水稻可溶性淀粉合酶IIa(starch synthase 2a,SSIIa)、可溶性淀粉合酶IIIb(starch synthase 3b,SSIIIb)、可溶性淀粉合酶IVb(starch synthase 4b,SSIVb)、腺苷二磷酸葡萄糖焦磷酸化酶3(ADP-glucose pyrophosphorylase large subunit,AGPL3)、淀粉分支酶1(starch branching enzyme 1,SBE1)、淀粉分支酶IIb(starch branching enzyme 2b,SBEIIb)、颗粒结合淀粉合酶(granule-bound starch synthase,GBSS)和淀粉脱支酶2(isoamylase 2,ISA2)的编码基因的启动子部分,并调节它们的表达。同时,该基因突变体中淀粉含量减少、可溶性糖水平升高,进一步表明bzip58突变体能通过调控淀粉合成影响垩白表型,从而调控水稻灌浆时期的淀粉的填充与垩白性状的产生[53]。
3.4 淀粉体堆积结构相关基因
Li等[20]基于高垩白品种珍汕97与低垩白品种H94的GWAS分析,发现珍汕97的CHALK5等位基因能够显著调控稻米的垩白水平。虽然CHALK5存在两个开放阅读框(open reading frame,ORF),但根据该基因转入中花11中的结果来看,其中只有一个ORF对垩白起主效调控作用,转入该ORF的中花11水稻籽粒垩白水平显著提升,这表明珍汕97的CHALK5基因是一个获得功能性天然突变。CHALK5的表达模式表明,CHALK5在胚乳中表达水平远高于其他组织,且定位在液泡上。CHALK5编码一个液泡质子泵焦磷酸水解酶(vacuolar H+-translocating pyrophosphatase,V-PPase),可调控液泡的pH水平。随后的试验发现,高垩白品种的焦磷酸(pyrophosphoric acid,PPi)水解活性提高了19%,进一步证实了CHALK5的高表达或过高的活性与垩白的产生存在正相关性[20]。为进一步解释CHALK5引起垩白的原因,通过对两种水稻品种的胚乳组织电镜结果分析,发现与低垩白品种相比,高垩白品种除淀粉颗粒堆积松散、不成紧密多面体而成球形外,其胚乳细胞的蛋白体I和蛋白体II数量显著减少,蛋白体平均面积下降,且带有垩白的细胞中,淀粉颗粒和蛋白体中积累了大量的小多边形环或囊泡状或液泡状结构,导致淀粉体之间出现松散的结构层次,使得淀粉体间不能被正常填充。值得注意的是,尽管蛋白体结构如此异常,淀粉体的数量和大小却无显著性差异。Li等[20]认为,这是因为CHALK5定位于液泡,过多的CHALK5或其更高的活性导致pH降低,异常的pH水平干扰了囊泡运输系统的正常运转,使得胞内囊泡结构大量增加,蛋白体数量下降,体积减少,导致淀粉颗粒和蛋白体之间形成空隙而产生垩白。
2009年,Wakasa等[54]与Yasuda等[55]发现,bip(bindingprotein)突变体存在严重的垩白表型,bip突变体籽粒糊粉层细胞结构异常,BiP过表达植株中,淀粉粒堆积疏松。BiP能够参与内质网蛋白质的折叠过程,其突变体导致细胞中出现大量的异常蛋白体,影响淀粉的正常填充与堆积,从而产生垩白表型。Han等[56]发现,pdil1-1(proteindisulphide isomerase-likeenzyme)突变体也存在严重的垩白表型。与BiP类似,PDIL1-1能够参与蛋白质的折叠过程,同时,pdil1-1突变中淀粉合成酶系的活性也受到影响,相较野生型难以正常填充淀粉。Kim等[57]发现, 与bip类似,pdil1-1的胞内出现大量的异常蛋白体,影响到淀粉的正常填充与堆积,从而产生垩白。Wang等[58]则发现rab5a突变体存在严重的垩白表型。Rab5a在贮藏蛋白进入蛋白酶体II的运输过程中发挥了重要作用,其突变体胚乳细胞内存在大量的谷蛋白前体,淀粉体无法紧密填充。电镜照片显示,其淀粉体相比野生型几乎无棱角,存在大量孔隙,进而呈现垩白表型。Wen等[59]研究发现,VPS9A能够与RAB5A互作,在谷蛋白前体经高尔基体转运至蛋白体过程中发挥作用,其淀粉体类似bip和rab5a,即淀粉体疏松排列且呈球形,导致vps9a突变体出现垩白表型。Ren等[60]发现,gpa3突变体也存在垩白表型。GPA3能够与VPS9a、Rab5a互作形成复合体,该复合体调控蛋白体等的运输过程。gpa3突变体淀粉体类似rab5a、vps9a突变体,其淀粉体排列疏松,呈现球形。
3.5 其他途径相关基因
尽管近年来大量的垩白突变体与相关研究的进展揭示了大量可能的垩白产生途径与机制,然而,目前仍有多个突变体的垩白表型的产生机制不明。
研究者通过化学诱变筛选得到了一些存在水稻垩白性状的突变体[61],其中一个突变被命名为flo2(flouryendosperm2),但由于早期分子生物学技术的限制,使得该基因的研究陷入停滞。直至2010年,日本理工大学团队才完成了该基因的定位。该研究发现,FLO2编码了一个三角四肽重复序列(tetratricopeptide repeat,TPR),flo2突变体中淀粉和蛋白合成相关基因的表达受到不同程度的影响,且在一定程度上调控了高温条件下水稻垩白的产生[62]。然而,FLO2的具体分子机制仍然未知。
flo7(flouryendosperm7)突变体被发现存在严重的垩白表型,且仅出现在外胚乳中。FLO7基因仅存在于水稻中,在其他已测序植物中未发现其同源基因。亚细胞定位表明,其位于淀粉体与淀粉体之间,暗示其在淀粉代谢过程中或许承担了某些重要的功能。然而,遗憾的是,FLO7的功能及其调控垩白的具体机制至今仍未被揭示[63]。2018年,flo11(flouryendosperm11)突变体被发现存在较弱的垩白表型,且仅存在于最内层胚乳与最外层胚乳上。克隆后分析发现,FLO11编码一个质体定位的热激蛋白(heat shock protein 70 cp-2, Hsp70cp-2),其通过影响Tic110与Tic40在胚乳中的积累水平而调控垩白性状[64]。根据先前垩白突变体中BiP等蛋白的结构,FLO11可能影响了胞内蛋白体的结构与分布,导致淀粉体的异常填充堆积,然而该推论缺少试验数据支持,FLO11引起垩白表型的具体机制仍然不明。
同年,FLO15被发现编码了一个质体定位的乙二醛酶1,该酶在谷胱甘肽代谢中行使功能,其突变体产生心白的同时,flo15突变体中淀粉聚合度水平相比野生型显著下降,表明FLO15似乎影响了淀粉合成的延长过程[65]。尽管FLO15可能与籽粒发育过程中的缺氧胁迫有关,且flo15突变体中活性氧水平显著高于野生型植株,但因缺少直接证据,目前引起flo15垩白表型的具体机制尚且不明。
4 总结与展望
已发现的flo系列突变体主要存在以下几种不同的表型:胚乳中心垩白;胚乳中心垩白直至全胚乳垩白且全米略微发黄,同时粒重相对降低;全胚乳垩白。此外,少数突变体能够产生一些非经典的垩白表型,包括胚乳中层垩白、胚乳两端垩白。有趣的是,绝大多数相同类型的垩白表型突变基因都被定位在相近甚至是相同的代谢过程中,而这些代谢过程主要为能量产生、能量物质分配、淀粉合成与淀粉结构形成(图1)。如FLO4[22]、FLO10[23]、FLO12[24]、FLO13[25]、FLO14[26]、FLO16[27]、FLO18[28]、FLO19[29]等能直接或间接地影响到籽粒内能量的正常产生,GIF1[37]、NFYB1[38-39]等能够直接或间接影响养分转运调控源库关系,表明能量与养分供给能力在成熟籽粒垩白水平的调控过程中起到了关键作用。
淀粉生物合成是一个复杂的过程,需要依赖大量的关键合酶与相关蛋白的参与,其中AGPL2[43]、PHO1[44]、Wx[45]、FLO5[46-47]、SBE[48]、SBEIIb[49]、FLO6[50]、FLO8[51]、RSR1[52]、bZIP58[53]等能直接或间接地影响到籽粒内淀粉的正常合成。考虑到近年来非酶蛋白的发现增加了淀粉代谢的复杂程度[66],水稻不仅通过直接调控淀粉合成关键合酶的活性而影响垩白水平,还存在调控相关合酶与淀粉结合能力的途径,暗示其他类似的调控方式亟待挖掘。
此外,近年来新发现的一类突变体(包括chalk5[20]、bip[54-55]、pdil1-1[56-57]、rab5a[58]、vps9a[59]、gpa3[60]等)能通过影响蛋白体与囊泡系统导致胞内淀粉体无法正常填充堆积,从而产生垩白表型。这类突变体所产生的垩白表型类似agpl2、pho1、wx、flo5、sbe、sbeIIb、flo6、flo8、rsr1、bzip58等能直接或间接地影响到籽粒内淀粉正常合成的突变体,但相比之下,这类突变体少有粒重显著下降的情况发生。
然而,部分突变体垩白形成具体机制仍未被完全揭示,如flo2[61-62]、flo7[63]、flo11[64]、flo15[65]等。尽管部分证据暗示FLO7或许与淀粉合成有关,FLO11或许与淀粉体堆积结构有关,但都缺乏直接的证据支持,这需要后续更多的研究工作与试验数据的支撑。幸运的是,近年来,大量垩白基因被发掘,使得水稻的垩白性状形成的一些新规律逐步浮现。如Lin等[67]确定了一个腹部缺口突变体,其垩白仅出现在胚乳基部。基于该突变体开发的一种新型的比较系统可用以稻米垩白机理的研究。随着垩白产生分子机制的不断解析,对水稻等植物中能量代谢物质合成机制与调配策略的认识有望加深,将为其应用于分子育种培养低垩白的水稻品种提供新的思路。
