非小细胞肺癌奥希替尼获得性耐药细胞株的建立及其耐药机制的探讨
2023-01-11刘怡婷张秀伟张允雷
刘怡婷,王 喆,冯 静,高 敏,张秀伟*,张允雷,4*
(1.南京医科大学附属江宁医院呼吸与危重症医学科,南京 211100;2.南京医科大学生物医学工程与信息学院,南京 211100;3.南京医科大学第一附属医院急诊医学中心,南京 210029;4.南京医科大学附属江宁医院中心实验室,南京 211100)
肺癌的发病率和死亡率近年来已上升至全球第一位,年均患病人数超过200万人,而每年因肺癌死亡的人数占癌症死亡总人数的20%。在中国,肺癌患者的比例已上升至癌症病人的30%,其中,80%~85%的肺癌病人患有非小细胞肺癌(nonsmall cell lung cancer cell,NSCLC),患者的5年平均存活率低于20%[1-2]。这给人们带来了沉重的生活和经济负担。前瞻性的临床研究表明,不同基因突变类型的肺癌发病率存在显著的地区差异。例如,表皮生长因子受体(epidermal growth factor receptor,EGFR)在亚洲的突变率明显高于欧洲、美洲和非洲等其他地区[3]。这类具有T790M耐药突变和致敏EGFR突变的患者,其主要特征是存在外显子19缺失(del19)和外显子21L858R点突变[4]。国际肺癌研究协会(The International Association for the Study of Lung Cancer,IASLC)、美国临床肿瘤学会(American Society of Clinal Oncology,ASCO)和欧洲医学肿瘤学会(European Society of Medical Oncology,ESMO)提出,根据患者分子亚型制定治疗策略可以有效提高患者的总生存期(overall survival,OS)[5]。EGFR突变是NSCLC中最常见的突变类型。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)的肿瘤学临床实践指南推荐,将奥希替尼作为转移性NSCLC和EGFR敏感突变患者的首选一线治疗药物[6]。奥希替尼是第三代口服表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI),具有双重抑制突变的能力,能够在EGFR的TK结构域内的第797位点不可逆地共价结合半胱氨酸残基[7],可将患者的无进展生存率(progression-free survival,PFS)提高至19个月,同时有效克服第一、二代EGFRTKI因T790M阳性突变产生的获得性耐药问题。但由于肿瘤自身的适应性和高度的异质性,在进行临床用药时发生的二次耐药突变加速了奥希替尼获得性耐药问题的出现[8-9]。因此,如何降低奥希替尼获得性耐药的发生率并解决NSCLC耐药性的问题,对于提高临床NSCLC的治疗效率具有重要意义。本研究选用具有EGFR突变的NSCLC细胞系HCC827,通过间歇性大剂量冲击和梯度递增相结合的方式建立奥希替尼耐药细胞株HCC827OR,为研究奥希替尼的耐药机制提供可靠的细胞模型;通过观察和分析耐药细胞株的生物学特性初步探索奥希替尼的耐药机制,可以辅助临床用药方案的制定,降低和延缓肿瘤耐药。同时,奥希替尼耐药细胞株的建立为新的分子靶向药物的筛选及耐药机制的研究提供了重要的体外细胞模型。
1 材料与方法
1.1 主要材料
NSCLC HCC827细胞购于美国典型培养物保藏中心(American Type Culture Collection);Quick BlockTMWestern封闭液、二抗稀释液、CCK8试剂购于上海碧云天生物技术有限公司;RPMI1640培养基购于武汉塞维尔生物科技有限公司;青霉素和链霉素购于兰杰柯科技有限公司;细胞冻存液、胰酶和小牛血清购于南京生航生物技术有限公司;Hoechst33342购于Sigma;鬼笔环肽(phalloidin)荧光染料购于苏州宇恒生物科技有限公司;EGFR、p-EGFR、AKT、p-AKT和GADPH抗体购于Abcam;甲磺奥希替尼(泰瑞沙)由阿斯利康公司提供。
1.2 试验方法
1.2.1 细胞培养
将HCC827细胞培养于含有10%小牛血清和1%青霉素-链霉素的RPMI1640培养基中,并置于37℃、5% CO2的细胞培养箱。在显微镜下观察细胞形态,收集生长状态良好、处于对数生长期的细胞进行相关试验。
1.2.2 耐药细胞株的建立
通过间歇性大剂量冲击和梯度递增相结合的方法诱导NSCLC细胞株HCC827,按每孔5×105个细胞将对数生长期收集的细胞铺于6孔细胞培养板上,培养24 h。先通过CCK8法测得细胞株的半数抑制浓度(half inhibition concentration,IC50),将无药培养基换成含有100 nmol/L奥希替尼的培养基,作用12~24 h,观察细胞状态。如初期有大量漂浮的死细胞,则及时更换浓度为IC50(45 nmol/L)的培养基继续培养,直到存活的细胞重新恢复正常增殖。当细胞在含有45 nmol/L奥希替尼的培养基中生长良好并连续传代3次以上时,再用含有100 nmol/L奥希替尼的培养基冲击培养12~24 h,之后更换为含有45 nmol/L奥希替尼的培养基(上述为一个培养循环)。当细胞经历3个循环且处于较为稳定的状态后,可按50 nmol/L的药物浓度差提升药物浓度,作用12~24 h,观察细胞状态,并更换为含有45 nmol/L奥希替尼的培养基再培养24~72 h。当贴壁细胞在含药培养基中的密度低于20%~30%或出现大量漂浮的死细胞时,及时采取撤药处理,给药多次后,细胞即可在含药环境中稳定增殖。当药物筛选浓度达到IC50的5倍时,按100 nmol/L的浓度差提升,根据细胞状态调整培养基的药量,直至细胞能够在设置的浓度下正常生长。试验总计历时7个月,建立的耐药细胞株被命名为HCC827OR。
1.2.3 细胞核及骨架染色
取对数期细胞铺于6孔细胞培养板中(每孔5×105个细胞),待孔内的细胞密度达到60%时,用磷酸盐缓冲液(phosphate buffer saline,PBS)清洗2~3次,之后置于相差显微镜下放大100倍,对比观察两种细胞形态的差异并拍照记录。拍照后,用PBS再次清洗细胞,并用3.75%甲醛在冰上固定细胞15 min。用PBS清洗3次,去除甲醛残留液,加入0.5%Triton X-100,在室温下透化处理10 min。用PBS清洗细胞,每孔加入100 μL 0.5%~4.0%的鬼笔环肽染色液,室温下避光孵育20 min。用PBS清洗细胞,吸弃残液,加入10 μg/mL的Hoechst33342染液,室温避光染色5 min,通过荧光显微镜观察并记录细胞形态。Hoechst33342与细胞核中的双链DNA选择性地结合,细胞核发出蓝色荧光,鬼笔环肽与细胞内肌动蛋白特异性结合,发出红色荧光。
1.2.4 EGFR的基因突变检测
细胞经胰酶消化后离心,弃上清液,用PBS清洗2次后用1 mL PBS重悬细胞,置于4℃冰箱保存,并送上海生工生物工程有限公司检测肺癌EGFR的基因突变情况。
1.2.5 CCK8法检测细胞增殖
取对数生长期的HCC827和HCC827OR细胞制成单细胞悬液接种于96孔板中(每孔5×103个细胞)。培养18~24 h后加入不同浓度的奥希替尼(0、5、10、100和1 000 nmol/L),每个药物浓度设置3个复孔,同时设空白组(培养基中未接种细胞)和无药对照组(接种细胞但未加入药物)。培养72 h后,小心的移除培养液,每孔加入100 μL的细胞培养基和10 μL CCK8试剂,37℃避光孵育1 h后,使用酶标仪(TECAN INFINITE,M200 pro)在450 nm波长上检测溶液的光密度值,采用Graphpad Prism 9.0软件计算IC50,再按照此公式计算细胞耐药指数(resistance index,RI)。计算公式为 :RI=IC50(HCC827OR)/IC50(HCC827)。
1.2.6 Western blot分析细胞中EGFR及相关蛋白的表达
将HCC827和HCC827OR分别接种于6孔板中,于24 h后加入奥希替尼,浓度分别为0、1、10和100 nmol/L。作用48 h后,用预冷的PBS洗2遍,加入含磷酸酶抑制剂的RIPA(radio immunoprecipitation assay)裂解液,置于冰上裂解后提取细胞总蛋白,并用BCA(bicinchoninic acid assay)法测定蛋白浓度。利用4%~12%的聚丙烯酰胺梯度胶分离总蛋白,将蛋白转膜至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,用Quick BlockTMWestern封闭液封闭1 h,用含有0.5% Tween-20的Tris-HCl缓冲液(Tris-Buffered Saline and Tween 20,TBST)漂洗后,加入对应的抗体溶液(EGFR、p-EGFR、AKT、p-AKT和GAPDH),于4℃孵育过夜。TBST洗涤3次后与二抗溶液反应,室温孵育1 h,用TBST漂洗3次,加入发光液后于全自动成像分析系统(protein simple,USA)中显影拍照。
1.2.7 细胞周期分析
在HCC827和HCC827OR的细胞对数生长期用0.25%的胰酶消化细胞,离心收集沉淀,用500 μL预冷的PBS重悬细胞,使细胞分散为单细胞悬液,快速加入到-20℃预冷的1.5 mL无水乙醇溶液中,冰上放置15 min。1 000 r/min离心5 min,收集细胞,用PBS洗涤2次,加入200 μL 1 mg/mL的RNase A酶,于37℃孵育30 min,去除细胞中的RNA酶。上机前加入300 μL 100 μg/mL的碘化丙啶(propidium iodide,PI)染液,室温放置30 min。用流式细胞仪检测(CytoFLEX Flow cytometer, Beckman Coulter Inc.,Miami,FL,USA)细胞周期,使用Flowjo10软件进行数据分析。
1.2.8 划痕试验
取对数生长期的HCC827和HCC827OR细胞制成单细胞悬液,接种于6孔板中(每孔5×105个细胞)。待细胞密度生长至85%时即可用于划痕试验。用10 μL的一次性枪头划过直尺标记的区域制造伤痕,用PBS重复漂洗3次,洗去漂浮的细胞后,加入无血清的RMPI1640培养基,再放入细胞培养箱继续培养。分别于48和96 h通过光学显微镜拍摄图片,并记录划伤区域的面积变化情况。
1.3 统计学方法
采用Graphpad Prism 9.0统计学软件对数据进行分析和作图。数据以平均值±标准差(±s)表示。采用t检验比较两样本间的均数,使用单因素方差分析法分析多组间的数据。P<0.05为差异具有统计学意义。以上试验所得数据均重复3次。
2 结果与分析
2.1 奥希替尼耐药细胞株HCC827OR的建立及形态学变化
本研究通过间歇性大剂量冲击和梯度递增的方法,历时7个月,成功将HCC827诱导成获得性耐药细胞株HCC827OR。在倒置显微镜下,HCC827和HCC827OR两种细胞均贴壁生长。其中,HCC827生长无规则,细胞外观以梭形为主(图1a),而HCC827OR则呈现出团簇状生长的状态,细胞间互相镶嵌,部分细胞伪足拉长,边缘出现不规则变化。根据鬼笔环肽和Hoechst荧光标记后的结果可知,与HCC827细胞相比,在HCC827OR细胞中呈红色荧光的细胞骨架部分,虽然其局部骨架的延展性增加,但总体积明显减小。同时,对比两者在同一拍摄区域面积内的细胞核大小,HCC827OR的细胞核仁大小明显不一,核浆比增大(图1b)。这表明,HCC827细胞在耐药后出现了明显的细胞形态变化,也意味着其胞内的蛋白表达和细胞代谢等微观生命活动发生了显著的变化。
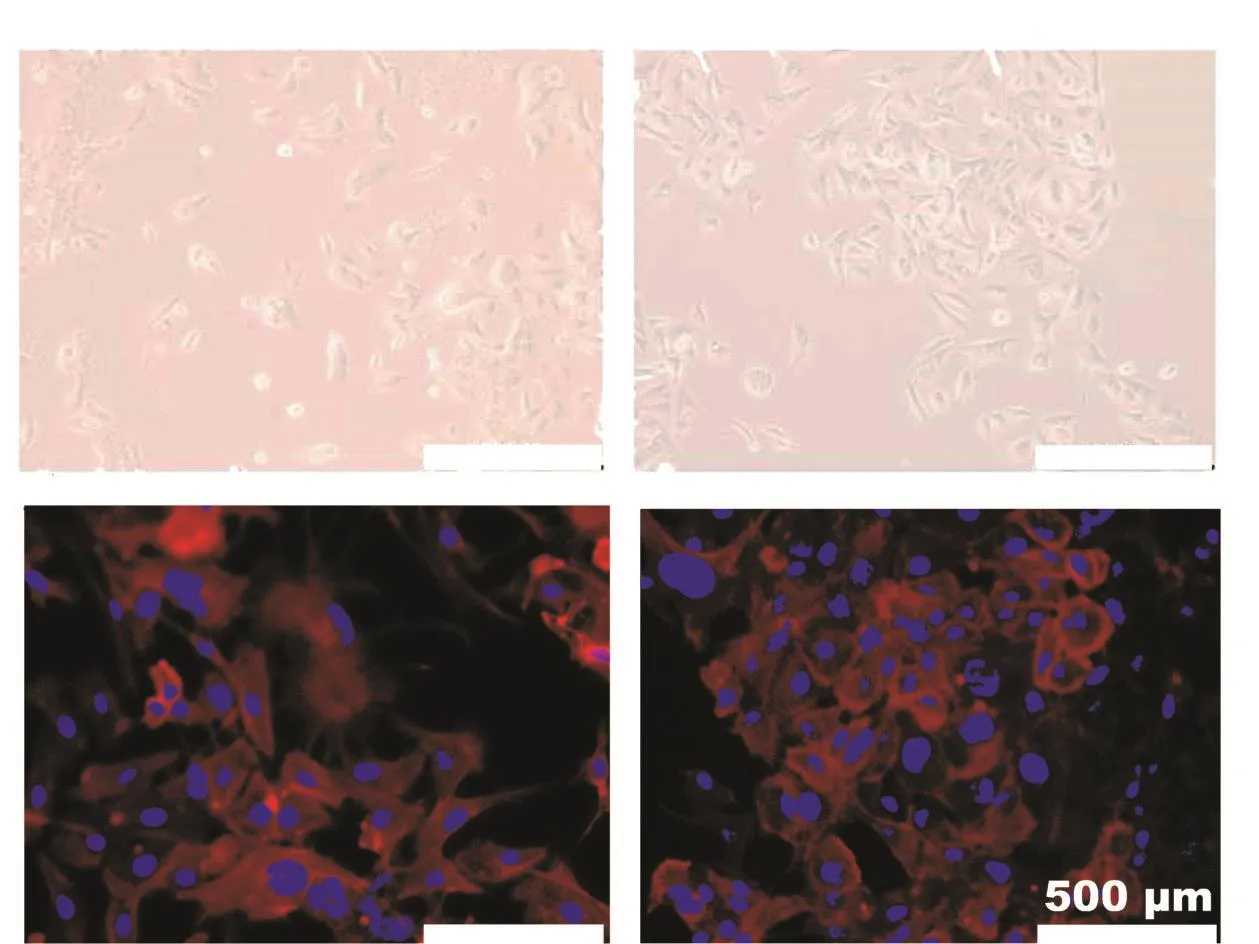
图1 HCC827和HCC827OR细胞的形态差异(200×)Fig.1 The morphological difference between HCC827 and HCC827OR cells (200×)
2.2 细胞耐药性检测
IC50是指对细胞生长抑制率达到50%效果时的药物浓度,用于衡量药物对药物的耐受能力。根据测定的亲本细胞和耐药细胞的IC50,计算RI,RI>5则认为耐药细胞系的耐药性符合耐药株的要求。根据上述评估标准,我们进行了细胞增殖的检测[10]。CCK8细胞增殖的检测结果显示,HCC827的IC50为(40.11±0.366 5)nmol/L,而HCC827OR的IC50为(747.90±0.453 8)nmol/L,RI为18.65,符合耐药株的建立要求。药物浓度与细胞抑制率曲线见图2。
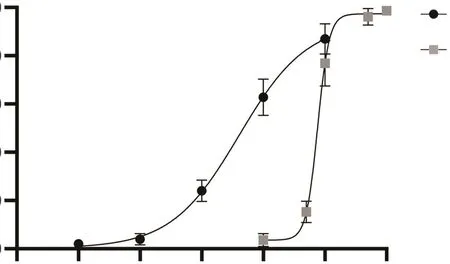
图2 HCC827和HCC827OR的奥希替尼浓度-细胞抑制率曲线(48 h)Fig.2 Cytotoxicity of Osimertinib against HCC827 and HCC827OR (48 h)
2.3 耐药细胞株EGFR基因的变化
第二代测序(next generation sequencing,NGS)检测结果表明,HCC827存在EGFR19外显子缺失,HCC827OR细胞保留了该突变特性,但两者EGFR的表达丰度不同,后者仅是前者的约二分之一(表1)。与此同时,在本次测序结果中未发现EGFR耐药机制中常见区域的继发突变位点,如C797S、C797G、G798R、G796S、L718Q和L718V等[11-15]。这表明HCC827OR可能通过非EGFR途径产生了耐药。
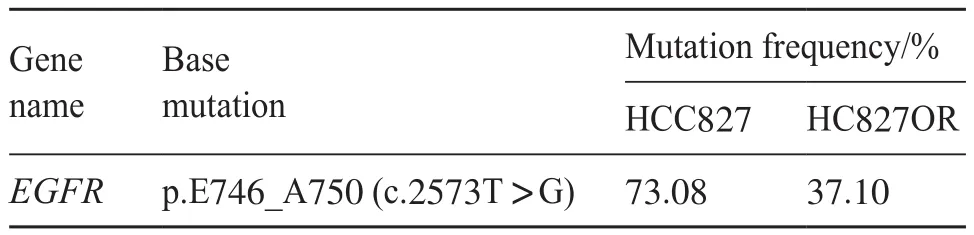
表1 HCC827及HCC827OR相关基因测序结果Tab.1 The gene sequence result of HCC827 and HCC827OR
2.4 耐药细胞株中p-AKT通路异常激活
Western blot检测结果表明,在HCC827和HCC827OR细胞中,奥希替尼对细胞的抑制程度与p-EGFR和p-AKT的表达水平存在明显的量效关系。与HCC827相比,HCC827OR细胞中的p-EGFR表达显著下调,而p-AKT随着奥希替尼的增高显著上调,但HCC827细胞因无耐药性,在100 nmol/L奥希替尼的条件下完全死亡(图3)。在细胞增殖过程中,EGFR信号通路主要控制细胞的生长、增殖和凋亡,AKT通路则调控细胞的生长增殖、周期长短和存活能力[16-17]。因此,当持续增加给药浓度直至奥希替尼浓度大于IC50(100 nmol/L)时,HCC827的EGFR及下游的AKT磷酸化水平明显下降,大量细胞失去增殖能力,并逐渐凋亡。而耐药细胞株HCC827OR在在同一给药浓度下,即使EGFR通路磷酸化水平较低无法调控细胞的增殖,通过p-AKT通路的激活,也能从旁路促进耐药细胞的生长增殖,使得HCC827OR在100 nmol/L的奥希替尼给药环境中保持良好的增殖活力。
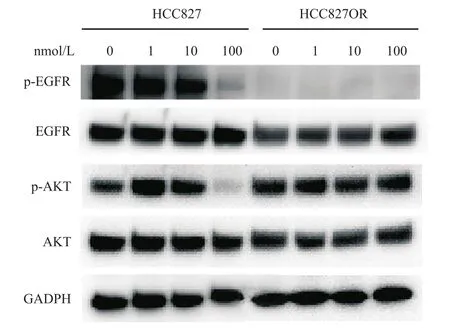
图3 在奥希替尼(0、1、10、100 nmol/L)作用48 h后,HCC827和HCC827OR细胞的关键信号通路蛋白的表达变化情况Fig.3 The effects of Osimertinib (0, 1, 10, 100 nmol/L) on the protein expression of HCC827 and HCC827OR cells after 48 h
2.5 细胞耐药后增殖能力显著增强
细胞周期是一个受到调控后发生有序活动的过程。流式细胞术检测结果表明,野生型HCC827细胞中G1期细胞的比例高达(55.07±4.71)%,S和M期的比例为(44.93±3.56)%。而奥希替尼耐药的HCC827OR的G1期细胞的比例[(37.70±3.56)%]明显减少,更多的细胞出现在S和M期,比例为(62.30±5.42)%。这说明HCC827细胞耐药后出现了明显的G2/M周期阻滞的特征,进而表明其拥有了更强的增殖能力(图4)。
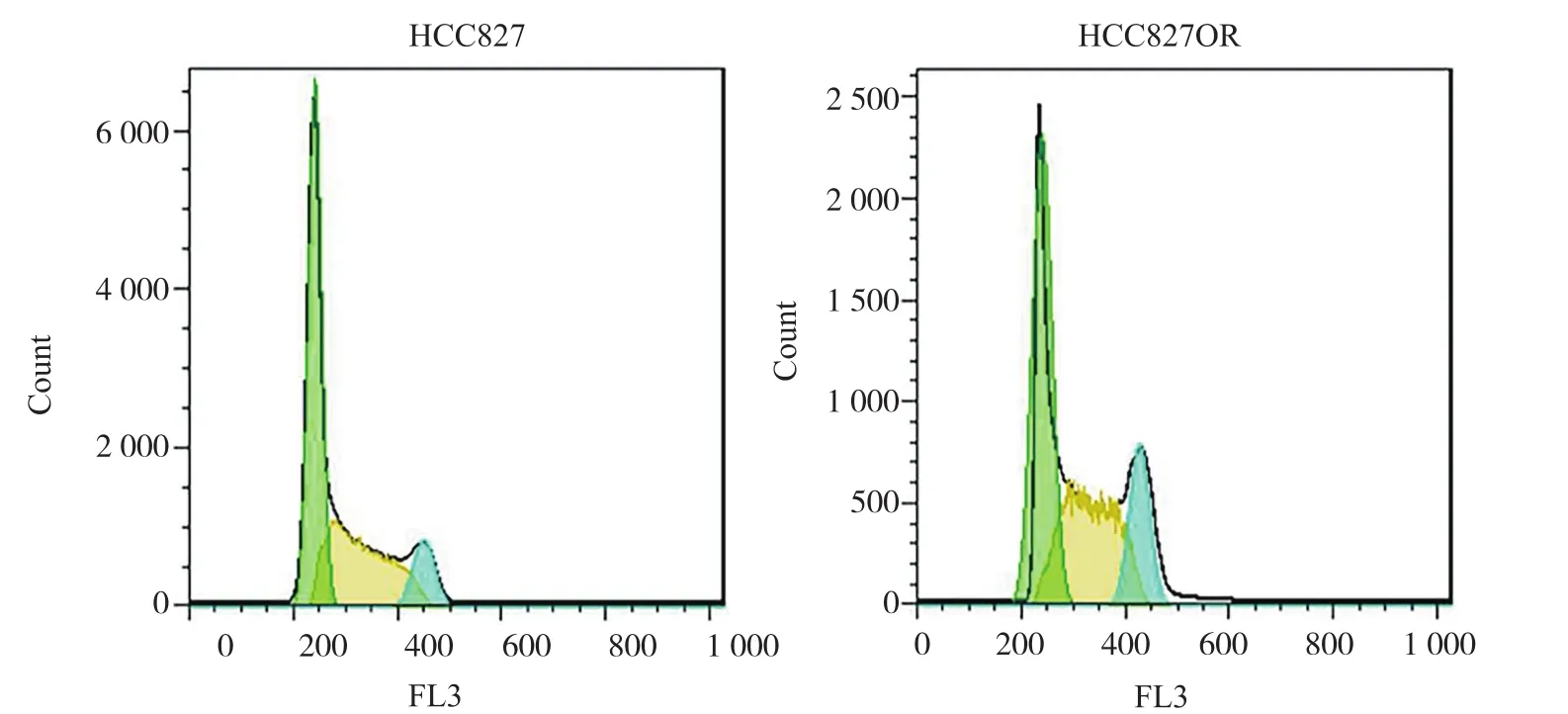
图4 HCC827和HCC827OR细胞的周期分布Fig.4 Cell cycle distribution of HCC827 and HCC827OR cells
2.6 细胞耐药后迁移能力显著增强
划痕试验结果表明,与HCCC827细胞相比,HCC827OR在48和96 h后展示了更强的细胞迁移能力。我们推测,HCC827OR的这种高迁移能力与p-AKT的显著上调密切相关(图5)。NGS结果显示,HCC827耐药前后EGFR的基因丰度的降幅达到35.98%,导致HCC827OR的EGFR磷酸化通路的活化水平下降,对其调控的下游信号通路产生影响。Western blot试验发现,EGFR下游p-AKT通路在HCC827OR中异常激活,而AKT是EGFR下游主要的信号通路之一。该通路不仅调节细胞增殖,其磷酸化水平的增高还会显著促进肿瘤细胞的迁移[18-19],同时也是肿瘤细胞获得性耐药的机制之一,具备调节细胞侵袭、转移的能力。AKT通路磷酸化水平的显著增加促使耐药细胞获得更强的迁移能力。

图5 细胞划痕试验比较亲本细胞HCC827和耐药株HCC827OR侵袭能力的差异(100×)Fig.5 Comparison of migration ability of HCC827 and HCC827OR cells in wound healing (100×)
3 讨论
奥希替尼作为第三代EGFR-TKI抑制剂,给NSCLC患者特别是二代耐药患者带来了希望。但是,第三代耐药细胞的出现警醒我们肿瘤细胞是复杂多变的。目前,市场上尚未有稳定的奥希替尼耐药细胞株出售。本研究通过筛选建立奥希替尼耐药细胞株,为广大科研工作者提供基因和表型稳定的第三代EGFR-TKI抑制剂耐药NSCLC细胞株。这对于探究肿瘤耐药机制和寻找新的分子靶向治疗药物具有重要的意义。本研究选取NSCLC HCC827细胞株,通过间歇性大剂量冲击和梯度递增结合的方式诱导构建奥希替尼获得性耐药株HCC827OR,在停止加药诱导6个月后,细胞耐药性未丢失[20]。与传统的梯度递增方法相比(10个月),本方法可以显著缩短耐药细胞株的筛选时间(7个月),所得细胞系具有稳定耐药的特点。本研究通过NGS测序分析了HCC827OR的EGFR基因突变情况,并通过Western blot检测EGFR、AKT及其相应磷酸化通路的蛋白表达情况。试验结果表明,与HCC827相比,HCC827OR的EGFR基因突变的丰度下降,进一步抑制了EGFR磷酸化通路。但是,其下游p-AKT通路被异常激活,使得在相同药物浓度下,奥希替尼对耐药细胞株的生长抑制程度显著降低。同时,耐药细胞株的G2/M期阻滞以及细胞迁移能力的增加表明,HCC827OR耐药细胞株具有更强的增值能力和侵袭性。
一代和二代EGFR-TKI抑制剂的耐药性机制主要归因于EGFR20外显子T790M突变,而第三代EGFR分子靶向药奥希替尼的耐药机制复杂多样。现有的研究将奥希替尼细胞耐药机制分为依赖EGFR的和非依赖EGFR的耐药机制。依赖EGFR突变的耐药途径主要涉及EGFR的突变,扩增和缺失,突变位点主要包括C797S、C797G、G798R、G796S、G796D、L718Q和L718V等区域的继发性突变[11-15],进而降低药物对肿瘤细胞的靶向性。非EGFR依赖的耐药机制主要涉及旁路基因突变和表型转变等,通过改变其他上下游肺癌驱动基因的信号通路,如MET扩增以及HER2、KARS、BRAF和P13K等基因突变[21-25],借助其他通路的激活对细胞的生长增殖起补偿作用。本研究结果支持奥希替尼耐药的HCC827是通过非EGFR依赖的旁路基因促进细胞的增殖和迁移的。
综上所述,本研究通过间歇性大剂量冲击和梯度递增结合的方式筛选得到了奥希替尼耐药细胞株HCC827OR,经基因测序、关键蛋白检测、细胞周期和细胞迁移等方法鉴定,所得耐药细胞株具有临床奥希替尼耐药的特点,这为后期耐药机制的深度研究提供了有效的体外研究模型,为筛选和鉴定新的抗耐药肿瘤分子靶向药物提供了理想的靶标。
