应用高通量成像技术检测猪流行性腹泻病毒中和抗体
2023-01-11谷长维胡博刘微
谷长维,胡博,2*,刘微
[1.中国农业科学院特产研究所,吉林 长春 130112;2.农业农村部经济动物疫病重点实验室,吉林 长春 130112;3.吉林省维民知识产权代理事务所(普通合伙),吉林 长春 130000]
猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV) 是一种α-冠状病毒,可导致各年龄段猪暴发高度接触性肠道疾病[1]。PEDV 自2013 年在美国中西部出现以来,已在美洲大部分地区流行,使养猪业出现了重大的经济损失[2]。流行区的控制措施是针对建立PEDV 母猪免疫力和控制PEDV感染。母源免疫在保护新生仔猪抵抗PEDV感染中起关键作用。商业性疫苗、肌内注射给药,只有在口服暴露于活的PEDV(反馈)后,才能够增强PEDV 的免疫力,这是实现强烈、快速、持久刺激肠道黏膜免疫的唯一途径[3]。多项PEDV 抗体试验,包括免疫荧光试验(immunological fluorescence assay,IFA)、酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)、病毒中和(virus neutralization,VN) 和荧光聚焦中和(fluorescence focus neutralization,FFN)[4],特别是评估PEDV 中和抗体水平(VN、FFN) 为评估和预测猪群免疫力提供了有价值的工具[5]。VN 检测试剂盒在常规使用中存在固有的弱点:检测结果具有主观性,因为反应是由人评价的,检测的重复性受到细胞增殖和病毒复制的运行间变异的影响,并且涉及的生物过程通量较慢。PEDV FFN 试验是VN 试验的改良版,由试验人员读取结果,并根据相对于对照样本的荧光减少解释响应。具体而言,抗体滴度报告为最高稀释度的倒数,导致荧光聚焦单位(fluorescence focus units,FFU)相对于病毒对照孔减少超过90%。FFN 不依赖于检测病毒致细胞病变效应(cytopathic effect,CPE) 的事实意味着该检测具有更短的周转时间[6](即,可在20~24 h 内读取平板,而VN 为3 d)。尽管如此,FFN 保留了VN的一些缺点,包括直接观察荧光染色的感染细胞是主观的、劳动密集型的和耗时的[6]。与其他方法相比,据报道成像细胞计数是检测中和抗体(如水泡性口炎病毒和腺病毒)的一种客观、快速、可重复、特异性和半自动的方法。我们评估了基于成像细胞术的PEDV 高通量中和试验(high-throughput neutralization assay,HTNT)的性能。
1 材料和方法
1.1 材料
Vero 81 细胞(ATCC CCL-81;美国典型培养物保藏中心),Dulbecco 改良Eagle 培养基(DMEM 培养基;美国MilliporeSigma 公司),10%热灭活胎牛血清[(fetal bovine serum,FBS);美国Atlas 生物制品公司]和1%青霉素-链霉素(美国Grand Island 生物制品集团公司)。
1.2 方法
用从感染PEDV 的仔猪上采集的材料接种20 头9 周龄猪,随时间采集样本,获得已知PEDV 抗体状态的血清样本(n=159)。为验证其PEDV 阴性状态,在接种后第4 天(days post inoculation,DPI) 采集所有猪的血清和口腔液体标本,通过PEDV IgG ELISA 和逆转录实时PCR(realtime-reverse transcription polymerase chain reaction,RT-rtPCR)进行检测。将约15 g 切碎的PEDV RT-rtPCR 阳性肠道组织(田间样本)与500 mL 磷酸盐缓冲液(PBS,pH 7.4;美国Grand Island 生物制品集团公司) 混合,制备注射猪的PEDV 接种物。DPI 0 时,使用喷雾器(美国Chapin公司)将接种物喷入每头猪的鼻孔中5 s。通过PEDV RT-rtPCR 检 测DPI -7、DPI 0 和DPI 7 采集的个体猪的粪便样本,以确认生产性感染。
在第-4、0、7、14、21、28、35 和42天,从颈静脉或颅腔静脉采集用于抗体检测的血液样本,并将血清储存在-80 ℃的2 mL低温试管(德国Greiner Bio-One 公司) 中直至检测。从接种PEDV 的猪上采集血清样本(n=159),随机排序,随后通过HTNT 和FFN检测PEDV 中和抗体。
在含2 µg/mL 甲苯磺酰基L-苯丙氨酸氯甲基酮(tosyl-L-phenylalanine chloromethyl ketone,TPCK)处理的胰蛋白酶的病毒接种培养基(Dulbecco's modified eagle medium,DMEM 培养基) 中10 倍连续稀释(10-1~10-8) 病毒贮备液,然后向含融合Vero 81 细胞的96 孔板的5 个孔中加入100 µL 各稀释液,进行病毒滴定。不含病毒的病毒接种培养基用作阴性对照。将平板置于37 ℃、5% CO2的加湿培养箱中孵育5 d,或直至观察到细胞病变效应(cytopathic effect,CPE)。使用Spearman+Kärber 方法计算病毒滴度,并表示为50%组织培养感染剂量(TCID50)/mL[7]。
在PEDV HTNT 中使用透明平底、黑色聚苯乙烯、组织培养处理的96 孔板(美国Corning 生命科学公司),以避免使用成像细胞仪(配备MiniMax 300 成像细胞仪的Spectra Max i3 多模式酶标仪平台;美国Molecular Devices 公 司) 用SoftMax Pro软件(v.6.5,Molecular Devices)操作。在100 μL 细胞增殖培养基中,用Vero 81 细胞(5×104个/ 孔) 接种微孔,制备平板。将平板孵育48 h 或直至Vero 81 细胞≥90%融合。使用成像细胞仪估计融合率(%),透射光暴露时间为5 ms,焦点调整为60 µm。拒绝孔不符合融合要求的平板。
每个试验平板(即阳性对照、PEDV 抗体阳性血清;阴性对照、PEDV 抗体阴性血清;病毒对照和细胞对照、病毒接种培养基)中均包括内部对照(一式四份检测;100 µL/孔)。PEDV 抗体阳性和阴性血清对照来自PEDV 接种或阴性对照猪,检测前,将所有血清样本(包括阳性和阴性对照)在56 ℃下灭活30 min。将病毒接种培养基以1 ∶20 稀释,然后用1 ∶10 稀释的PEDV 贮备病毒(3.16×105TCID50/mL)以1 ∶1稀释,以1 ∶40 稀释样本。
样本在37 ℃下孵育1 h,然后将150 µL血清-病毒混合物转移至96 孔HTNT 板中,该板含有已用清洗培养基(含1%青霉素-链霉素的DMEM 培养基)预清洗3 次的融合Vero 81 细胞。将平板在37 ℃下孵育1.5 h,然后用清洗培养基清洗一次,并用病毒接种培养基清洗一次。
向各孔加入150 µL 病毒接种培养基,并将平板在37 ℃下孵育20~24 h。然后移除培养基,用100 µL 80%丙酮(4 ℃)固定细胞15 min,并风干(22~25 ℃)。
用PBS(pH 7.4;美国Grand Island 生物制品集团公司)清洗平板一次,并用1 ∶100稀释的PEDV 核蛋白(N) 异硫氰酸荧光素(fluorescein isothiocyanate,FITC) 标记的腹水(SD6-29 克隆;美国Medgene Labs公司) 在37 ℃下染色1 h。用PBS 清洗平板4 次。在成像细胞仪上以541 nm 波长读取HTNT 板,单部位读数,15~30 ms 曝光时间,20 µm 焦点。将响应读取为总荧光强度(total fluorescence intensity,TFI),然后将其标准化为:
总荧光值(total fluorescence ratio,TFR)=100-样本TFI 平均值×100÷阴性对照TFI 平均值
HTNT 平板需满足特定的质量标准:抗体阳性血清对照TFI=0.1~7.0,抗体阴性血清对照TFI ≥70,病毒对照TFI ≥100,病毒对照孔染色阳性,细胞对照孔无阳性染色。不符合这些标准的平板的结果舍弃。
HTNT 检测的样本(一式两份) 使用FFN 程序检测PEDV 中和抗体。简言之,热灭活血清样本在含TPCK 处理胰蛋白酶(1.5 µg/mL)的MEM中稀释2 倍(1 ∶10~1 ∶1 280)。将血清样本与细胞培养适应的PEDV(100 FFU/100 µL)以1 ∶1 混合,37 ℃下孵育1 h。将混合物加入含Vero 81 细胞汇合单层的96 孔板中,37 ℃下孵育2 h。孵育后,用含有TPCK 处理的胰蛋白酶(1.5 µg/mL)的MEM 再次洗涤平板,孵育20~24 h。用80%丙酮(22~25 ℃)固定平板,用FITC 结合的单克隆抗体SD6-29 染色,并用荧光显微镜观察。中和终点滴度定义为相对于对照组荧光聚焦减少90%的最高血清稀释度。认为中和终点滴度≥1 ∶20 的血清样本为PEDV中和抗体阳性。
2 结果
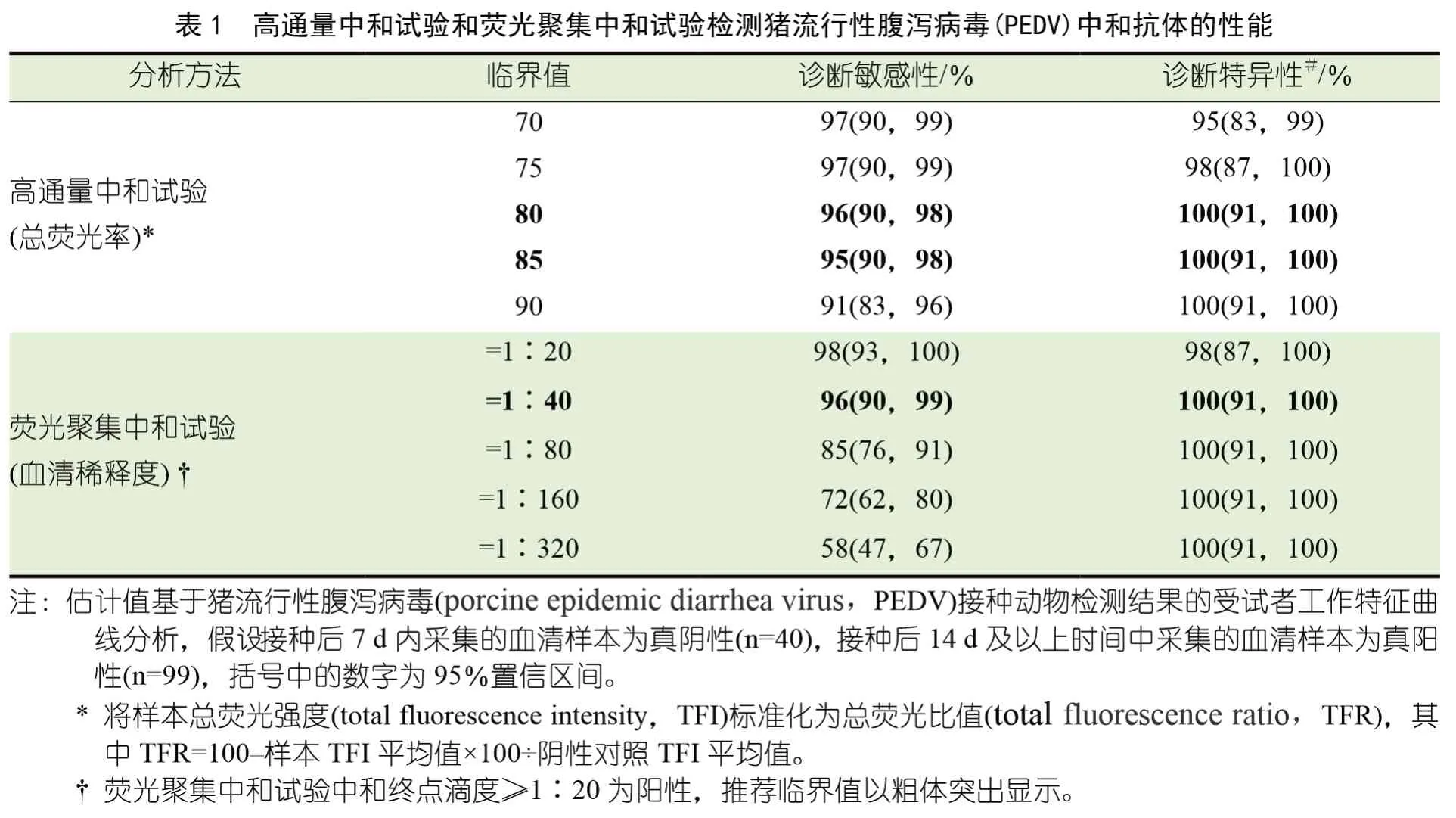
使用Fisher 精确检验比较PEDV HTNT与FFN 阳性血清的比例。FFN 和HTNT 检测试剂的诊断灵敏度和特异性估计值是根据每种检测试剂的一系列临界值的受试者工作特征(receiver operating characteristic,ROC)曲线分析(SAS V.9.4)得出的,假设<7 DPI 采集的血清样本为阴性,≥14 DPI 采集的样本为阳性。
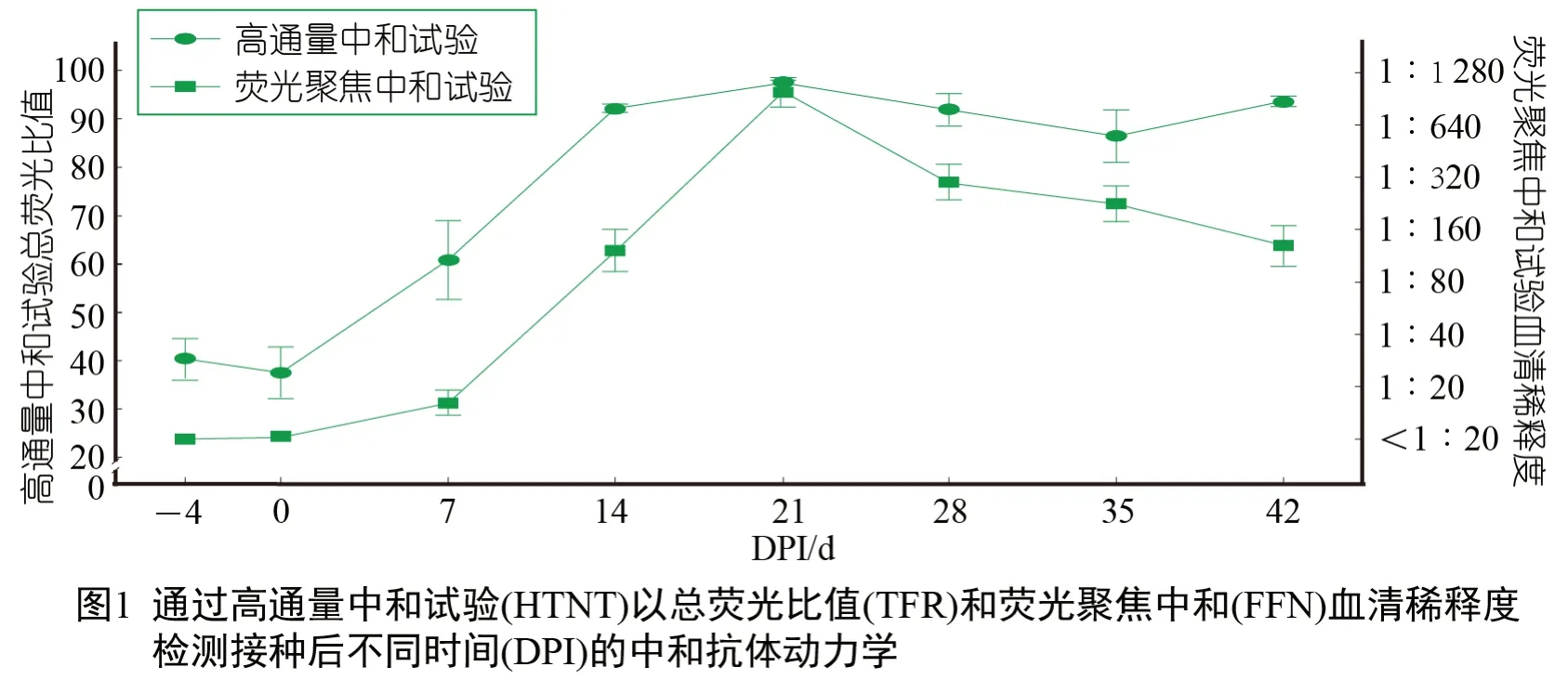
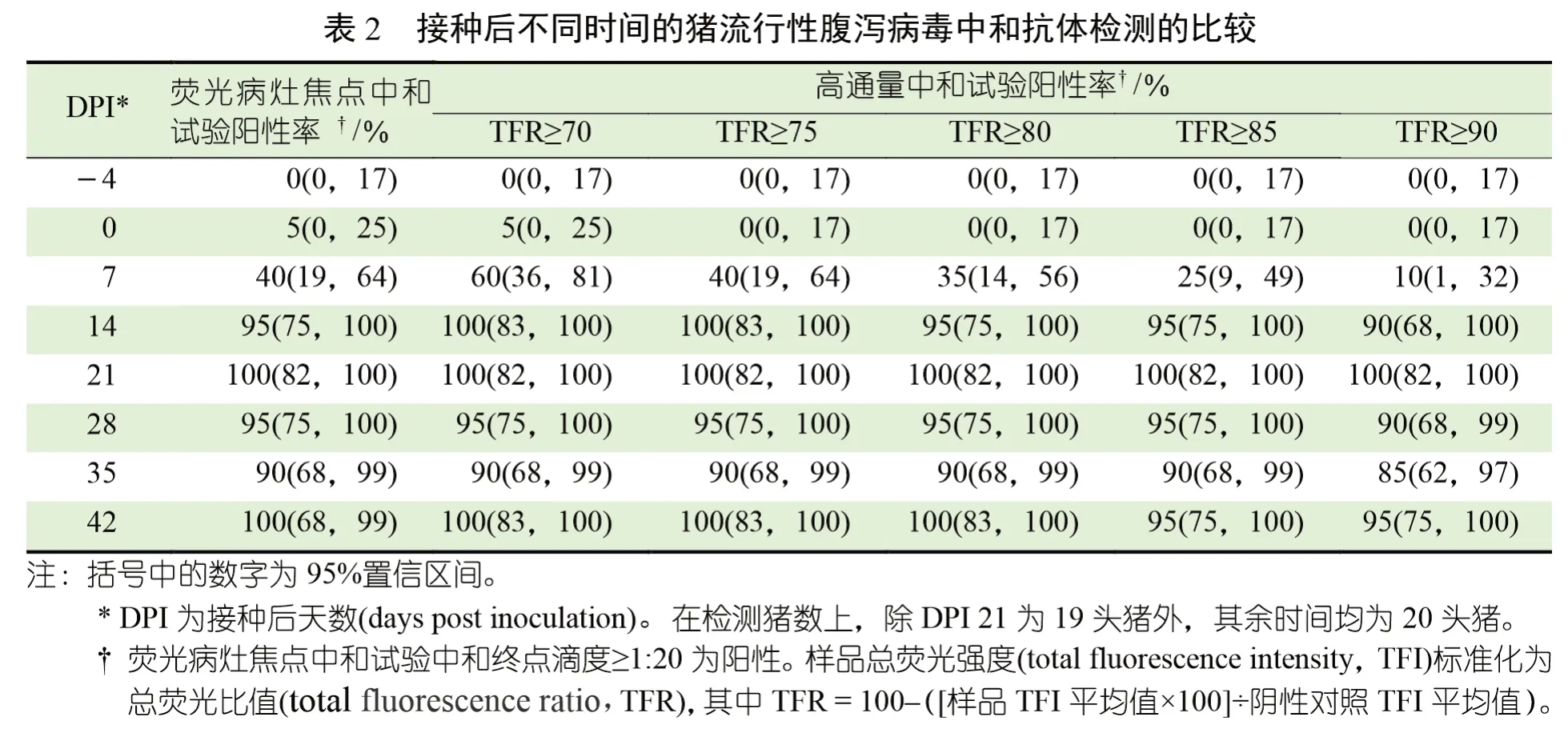
DPI -7 和DPI 0 采集的个体猪粪便样本(n=20) 经RT-rtPCR 检测为PEDV阴性,而DPI 7 采集的接种物和猪粪便样本(n=20) 为RT-rtPCR 阳性。PEDV IgG ELISA 结果显示,到DPI 14 时,所有猪均发生血清转化。接种后几天,在猪中观察到水样腹泻,但未观察到其他临床体征,所有猪均顺利恢复。DPI 4~42之间采集的159 份血清样本均经HTNT 和FFN检测(图1)。在DPI 7 检测到首次中和抗体应答(HTNT 和FFN)。在DPI 21(HTNT 和FFN)达到峰值后,中和抗体浓度下降(HTNT)或保持稳定(HTNT)至DPI 42。在一系列临界值内估计FFN 和HTNT 诊断灵敏度和特异性(表1)
使用≥1 ∶20,10 的FFN 临界值,在DPI 0 观察到1 个假阳性结果(表2)。此后,8/20头(40%) 猪在DPI 7 时为FFN 阳性,19/20头(95%)在DPI 14 时为FFN 阳性,20/20 头(95%)在DPI 21 时为FFN 阳性(表2)。总体而言,如估计值和重叠的95%置信区间所示,在观察期间,试验性能几乎相同(表1)。
3 讨论
用于检测中和抗体的基于成像细胞计数的系统能够可视化和测量细胞、定量反应以及捕获和存储数据或图像。在HTNT PEDV 试验中,使用高通量成像细胞仪标准化细胞融合、读取反应和评价平板对照。基于客观测量的标准化读取方案和计算消除了试验过程中的人体主观性和变异性,并将96 孔板的读取时间缩短至<4 min。因此,成像细胞计数可为检测多种病原体的中和抗体提供更客观、快速和半自动的方法。
