pH条件对肌原纤维蛋白乳液微凝胶性质的影响
2023-01-10陈佳诗张利平王旭峰林可情缪松郑宝东张龙涛
陈佳诗,张利平,王旭峰,林可情,缪松,郑宝东,张龙涛*
(1.福建农林大学食品科学学院,福建 福州 350002;2.中国-爱尔兰国际合作食品物质学与结构设计研究中心,福建 福州 350002;3.福州大学生物科学与工程学院,福建 福州 350108;4.Teagasc 食品研究中心,爱尔兰科克 P61C 996)
乳液微凝胶(emulsion microgels)是一个或多个乳状液滴被软固体包裹形成的微米级软颗粒,特殊的物理形态使其兼具乳液的脂肪包埋功能[1]和微凝胶软颗粒的机械性能,能提供类似于脂肪的边界润滑作用[2]。现有制备方法包括乳液凝胶破碎法、乳液挤出外部凝胶化法、多步骤乳液模板化法及流体凝胶法[3]。以蛋白质为乳化、凝胶材料,采用流体凝胶技术,可以通过调整工艺参数对微凝胶的粒度、形貌和模量等进行控制,近年来得到较多关注[4-5],Moakes 等采用该技术,制成尺寸在微米级(25 μm)、乳液封装效率达99%的乳清分离蛋白乳液微凝胶颗粒[5]。形成和维持蛋白质结构及其凝胶网状结构的作用力主要有静电相互作用、疏水相互作用、氢键、二硫键等[6]。肌原纤维蛋白是动物蛋白凝胶形成的主要成分,pH 通过影响肌原纤维蛋白氨基酸侧链电荷分布,改变蛋白质分子间的相互作用,影响蛋白质及其热诱导凝胶的非共价键作用力和结构[7]。研究pH 对肌原纤维蛋白乳液微凝胶性质的影响,对于其制备过程及应用研究具有十分重要的意义。
以蛋白质乳液为原料制备的凝胶,其凝胶层主体来自水相中的蛋白质,pH 变化导致氨基酸侧链基团的电离或质子化状态发生改变,改变了蛋白质分子的电荷分布,蛋白质分子间的静电相互作用也因此改变[8]。肌原纤维蛋白凝胶非共价键作用力、二级结构和微观结构与pH 密切相关,pH 从7.0 降到5.0,会导致静电排斥力降低,而疏水相互作用、氢键等吸引力基本不变;另外α-螺旋含量降低,β-折叠含量增多,凝胶微观结构变得无序,孔径减小[7]。以乳清分离蛋白和蛋清蛋白为原料制备微凝胶颗粒的研究表明,可通过制备时改变pH 条件,调控其颗粒粒径和结构,进而对流变特性产生影响。蛋清蛋白流体凝胶(pH 7.5)与乳清分离蛋白流体凝胶(pH 3.5 和pH 8.0)显示出高黏度和良好的润滑性能,而在各自的等电点附近,流体凝胶润滑性能均降低,可能与颗粒聚集导致流体凝胶在等电点时的粒径增大有关[9]。由此推测,在不同的pH 条件下制备乳液微凝胶,可能会对乳液微凝胶颗粒的结构产生影响,进而影响其机械性能和功能特性。然而,迄今为止未见制备时改变pH 条件对乳液微凝胶性质影响的报道。作者以肌原纤维蛋白为原料,采用流体凝胶法制备乳液微凝胶颗粒,探究不同pH 条件对乳液微凝胶颗粒性质的影响。
1 材料与方法
1.1 材料与试剂
金线鱼鱼糜:福建海欣食品股份有限公司提供;大豆油:泉州福海粮油工业有限公司产品;牛血清白蛋白、乙二醇双(2-氨基乙基醚)四乙酸:上海Solarbio 生物科技有限公司产品;十二水磷酸二氢钠、二水磷酸二氢钠、氯化钠、五水硫酸铜、六水氯化镁、酒石酸钾钠:国药集团化学试剂有限公司产品;尼罗红:Acros Organics 公司产品;尼罗蓝:Alfa Aesar 化学有限公司产品。
1.2 仪器与设备
Avanti J-E 冷冻离心机:美国Beckman 公司产品;SCIENTZ-950E 超声波细胞破碎仪:宁波新芝生物科技有限公司产品;FDU-1200 冷冻干燥机:上海爱朗仪器有限公司产品;T18 Basic 高速分散机:德国IKA 公司产品;pH 700 测量仪:美国Eutech 公司产品;BAS 系列电子天平:德国Sartorius 公司产品;Zeiss LSM 700 激光共聚焦显微镜:德国Leica 公司产品;UV/V-1800 紫外/可见分光光度计:上海美谱达仪器有限公司产品;MCR 301 高级旋转流变仪:奥地利Anton Paar 公司产品;Mastersizer3000 激光粒度仪:英国Malvern 公司产品。
1.3 实验方法
1.3.1 肌原纤维蛋白的提取称取适量的金线鱼鱼糜,加入4 倍体积磷酸盐缓冲液(0.1 mol/L NaCl、10 mmol/L 磷酸钠、2 mmol/L MgCl2、1 mmol/L EGTA,pH 7)匀浆60 s,4 ℃、3 000g离心15 min,得到沉淀,重复以上步骤2 次;向沉淀中加入4 倍体积0.1 mol/L NaCl 溶液,匀浆60 s 后,4 ℃、3 000g离心15 min,得到沉淀,调节pH 至6.25 后,重复一次,得到的沉淀即为肌原纤维蛋白。将蛋白质分散于磷酸盐缓冲液(50 mmol/L 磷酸钠、0.6 mol/L NaCl,pH 6.25),调节蛋白质质量浓度为15 mg/mL,备用。蛋白质质量浓度采用双缩脲法测定。
1.3.2 不同pH 条件下肌原纤维蛋白乳液微凝胶的制备将15 mg/mL 肌原纤维蛋白溶液超声处理(300 W,6 min)后,加入油相,使最终质量分数为10%,在13 000 r/min 下高速分散3 min,得到稳定的肌原纤维蛋白乳液。使用0.1 mol/L NaOH 溶液或HCl 溶液,以每分钟20 滴的滴加速率和100 r/min的搅拌速率,将乳液pH 分别调至3、4、5、6、7、8、9,将不同pH 的乳液在40 ℃平衡5 min 后,以2 ℃/min的加热速率将乳液加热至80 ℃,保温15 min 后,冰浴冷却,整个过程施加剪切。
1.3.3 粒度测定采用静态光散射技术,通过Mastersizer 3000 激光粒度仪测定颗粒的平均粒径和粒度分布。颗粒采用蛋白质的相对折射率1.46,颗粒吸收率0.001,水相折射率1.330,样品池中搅拌的转速控制在2 000 r/min 用于分散样品,加入样品直至遮光度为10%,每个样品重复测定3 次取平均值。
1.3.4 ζ 电位使用Zetasizer nano series 粒度仪测定不同pH 条件下肌原纤维蛋白的ζ 电位,测量样品的蛋白质质量浓度为2 mg/mL。
1.3.5 微观结构将样品与等份的尼罗蓝(0.1 g/L)和尼罗红(0.1 g/L)溶液充分混合。染色后的样品使用Zeiss LSM 880 激光共聚焦显微镜观察,在488 nm 和633 nm 激发波长收集图像,物镜倍数40 倍。
1.3.6 流变性质测定使用Anton Parr MCR 301旋转流变仪对微凝胶流变特性进行测试,使用PP25平行板,板间距设定为1 mm。为了消除颗粒相体积对流变特性的影响,凝胶在10 000g下离心10 min,去除游离水。样品在4 ℃储存24 h 后进行测定。测定时用硅油密封,防止溶剂损失或大气水分的吸附。所有的乳液微凝胶样品均在20 ℃下进行分析,所有样品均采用相同的程序标准。
1)温度扫描 量取19 mL 不同pH 的乳液倒入同心圆筒中,在40 ℃平衡5 min 后,以2 ℃/min 速率升至80 ℃后保温10 min,后降至40 ℃,整段过程中持续施加剪切,记录过程中黏度的变化。
2)振幅扫描 频率设为1 Hz,应变范围为0.1%~100%,记录储存模量(G′)和损耗模量(G″)随应变的变化,测出样品的线性黏弹区域。
3)频率扫描 在角频率变化范围为0.1~100 rad/s 时,施加0.1%恒定应变进行频率扫描,记录G′、G″随频率的变化,并对曲线进行幂率拟合,公式如下:

式中:G′为储存模量,Pa;k为幂律常数;ω 为角频率,rad/s;n为频率指数。
4)黏度测定 采用对数取点方式,剪切速率从0.01 s-1到600 s-1再到0.01 s-1进行稳态速率扫描,记录黏度变化,并计算两次扫描形成的滞后环面积。剪切黏度随速率变化采用Power-Law 模型进行流动曲线拟合,方程如下:
式中:η 为黏度,Pa·s;γ 为剪切速率,s-1;a为一致性指数,Pa·sn;n为流动行为指数。
5)恢复力测试 三阶剪切流动测量如下:首先对样品施加1 s-1的剪切速率,持续120 s;之后对样品施加300 s-1的剪切速率,持续120 s;最后对样品施加1 s-1的剪切速率,持续120 s;记录过程中黏度变化,计算恢复率。
6)时间扫描 对样品施加1 s-1和200 s-1的剪切速率,剪切时间为600 s。
1.3.7 数据分析所有数据使用Origin Pro8.6 绘图。使用SPSS 做数据分析,并进行ANOVA 差异显著性分析。
2 结果与分析
2.1 ζ 电位
蛋白质含有可电离基团,许多功能受到电荷水平的影响[10],蛋白质的聚集或分散是表面电荷相互作用的结果。ζ 电位是表征胶体体系稳定性的重要指标,通过吸引力或排斥力诱导短程粒子间的相互作用[11]。蛋白质电荷的pH 依赖性主要归因于羧基和氨基对蛋白质分子电离状态的影响。pH 通过影响肌原纤维蛋白氨基酸侧链电荷分布,改变蛋白质分子间的相互作用,影响蛋白质及其热诱导凝胶的非共价键作用力和结构[12]。由图1可知,pH 为3、4时蛋白质带正电荷,pH 大于5 时,蛋白质带负电荷,等电点约为5,与张兴等研究结果相同[7]。
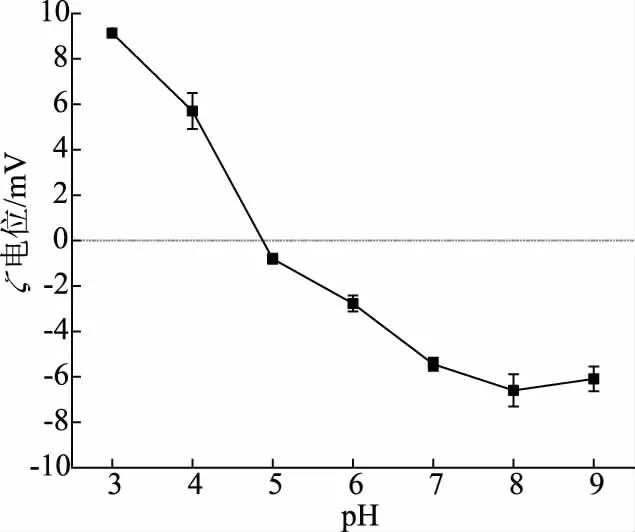
图1 肌原纤维蛋白ζ 电位随pH 的变化Fig.1 Effect of pH on the ζ potencial of myofibrillar protein
2.2 粒度分布
如图2所示,不同pH 条件制备的乳液微凝胶的粒径主要分布在10~1 000 μm,pH 3~9 时平均粒径分别为156、164、158、57.7、54.9、54.2、50.7 μm。不同pH 条件对乳化油滴的大小有影响,在低pH 及等电点附近,由于静电相互作用的影响,形成的油滴较大[13],进一步影响到以油滴为核的乳液微凝胶的粒径大小。pH 的改变引起蛋白质电荷的变化,从而影响蛋白质分子的交联和聚集。
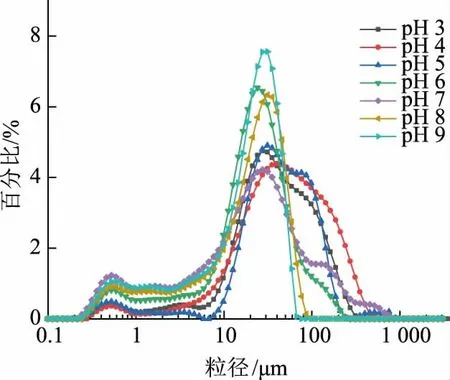
图2 不同pH 条件制备的肌原纤维蛋白乳液微凝胶的粒径分布Fig.2 Particle size distribution of myofibrillar protein emulsion microgels prepared under different pH values
由图可知,pH 3~5 时粒径较大,分布较宽,粒径分布图形成宽峰,向右偏移,由于以大油滴作为凝胶成核的点,并且在等电点附近时,表面静电荷较小,静电相互作用较小,疏水基团暴露等,在形成凝胶的过程中,蛋白质的聚集速度较快,同时低pH 条件下油滴也较大,易形成较大粒径的微凝胶。而pH大于等电点时,作为凝胶成核点的油滴较小,同时由于静电相互作用,蛋白质之间斥力较大,蛋白质聚集速度慢且聚集受到抑制,易形成较小粒径的微凝胶。因此,pH 在3~5 时粒径较大,分布于150 μm附近,pH 6~9 时,粒径较小,分布于50~60 μm。
2.3 微观结构分析
油相呈现绿色荧光,蛋白质呈现红色荧光。由图3可知,pH 为5、6、7 时,油滴周围形成相对致密的壳层,球形油滴被肌原纤维蛋白凝胶包封。可推测微凝胶的形成遵循成核和生长模型,以油滴作为成核和生长的点,在油滴周围乳化形成膜的蛋白质经加热诱导变性充分展开,与水相中变性的蛋白质相遇后聚集,形成一个蛋白质壳层,将油滴包裹住。同时,在高于等电点的环境中,使带电的蛋白质颗粒呈现短距离静电作用。因此,在此亚稳态的乳液微滴,处于静电作用、剪切作用和由加热导致的化学键合作用的平衡中。在pH 为5、6、7 时,剪切作用、化学键合作用强于静电作用所导致的颗粒间的斥力,因此,形成了以油滴为核心的微凝胶的成长。在pH 为8、9 时,静电斥力较强,蛋白质颗粒之间的聚集受到抑制,因此,油滴与带电的蛋白质颗粒以相对松散的形态存在,通过空间阻隔作用,形成油滴与蛋白质颗粒之间的亚稳态平衡。
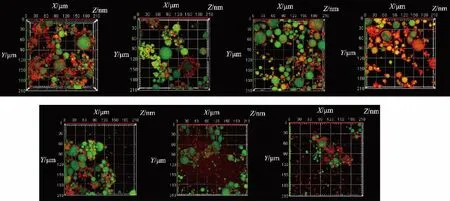
图3 肌原纤维蛋白乳液微凝胶颗粒的微观结构图Fig.3 Microstructure of myofibrillar protein emulsion microgels
2.4 流变测试分析
2.4.1 温度扫描图4显示了不同pH 条件下制备肌原纤维蛋白乳液微凝胶过程中的黏度变化。初始阶段,pH>6 时微凝胶的黏度显著增加,pH 3~5 的微凝胶黏度趋于平稳,之后系统的表观黏度缓慢下降。到达80 ℃时黏度保持相对稳定,在降温过程中,黏度持续上升。
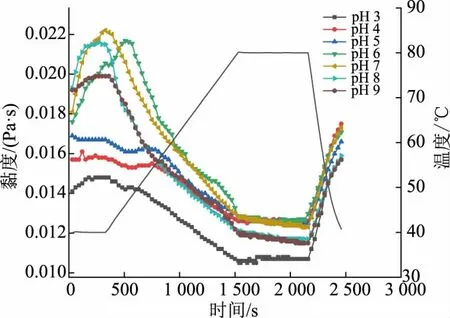
图4 肌原纤维蛋白乳液微凝胶形成过程中黏度变化Fig.4 Viscosity change during the formation of myofibrillar protein emulsion microgels
pH>6 的微凝胶在初始阶段,以乳液的油滴为核,富集周围展开的蛋白质,形成初级粒子。初级粒子的数量和体积分数增加是导致黏度增加的主要原因[4,14],然后在凝胶温度附近,多个初级粒子聚集形成凝胶核[15],微粒体积分数下降,导致黏度下降。
而对于pH 3~5 的微凝胶,低pH 的环境已经使蛋白质变性,蛋白质结构展开,疏水基团暴露,导致疏水性增加,蛋白质已经聚集,所以前期黏度没有明显变化。加热时弱凝胶开始形成,此时肌球蛋白头部相互交联,蛋白质网络结构初步形成,而后在加热过程中,凝胶黏度随温度升高而降低。加热至凝胶温度以上时,水和蛋白质之间的作用被破坏,蛋白质发生进一步变性,促进了蛋白质之间的相互作用,微粒开始聚集,形成较大颗粒,导致蛋白质凝胶黏度降低[9],同时在剪切的作用下,蛋白质三维网状结构难以形成,最终形成分散的粒子,在降温冷却时,通过疏水作用、氢键等非共价键来加强微凝胶特性,形成稳定的微凝胶颗粒[16]。
2.4.2 振幅扫描不同pH 下乳液微凝胶颗粒样品的振幅扫描见图5。所有乳液微凝胶样品都表现出一定程度的黏弹性,并且在测试区域内G′大于G″,呈现出固体样行为,这是颗粒本身的性质及不同颗粒之间的相互作用引起的。弹性网络是通过吸附在油滴上的蛋白质凝胶层的重叠而产生的,由于空间约束迫使液滴相互接触[17]。在临界应变下,微凝胶的网络结构开始分解,pH 为5 的样品临界应变最小,为0.3%,此时pH 接近等电点,颗粒的网络结构稀疏,结构空隙大,刚性较小,颗粒容易变形,形成的凝胶较弱[18],且在应变为70%时,材料响应发生了变化,由伪固体变为流体。pH 为3、4 时临界应变在1%附近,pH 6~9 的线性黏弹区域比pH 3~5 大,这是由于颗粒具有可变性,即当颗粒接触紧密时,颗粒间相互作用大,它们会被压缩变形,因此有着更大的接触面积、更大的摩擦力[19],此时需要更大的应力来破坏结构。pH 3~5 时凝胶结构更大、更松散,在较小应变下就可以破坏结构,同时G′也较低。
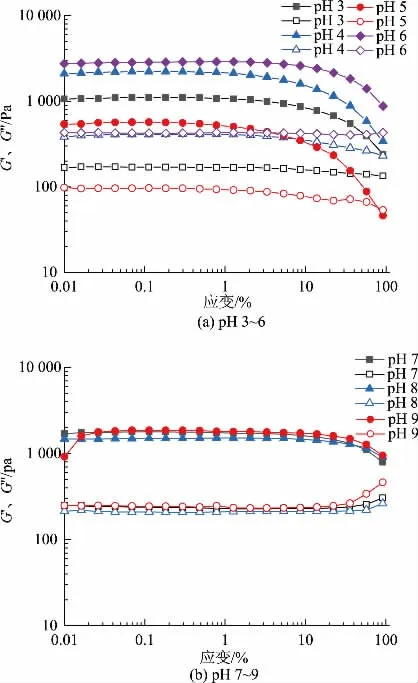
图5 不同pH 的肌原纤维蛋白乳液微凝胶线性黏弹区域Fig.5 Linear viscoelastic region of myofibrillar protein emulsion microgels prepared at different pH values
2.4.3 频率扫描为了进一步探究乳液微凝胶颗粒的力学性能,在小变形流变学下对肌原纤维蛋白乳液微凝胶颗粒进行了表征。图6为不同pH 的乳液微凝胶模量随角频率的变化。随着角频率的增加,模量也随之上升,G′和G″均表现出弱频率依赖性。所有pH 的乳液微凝胶颗粒的G′恒大于G″,并且在频率扫描范围内G′与G″变化曲线没有交点,说明加热过程中形成了凝胶网络。
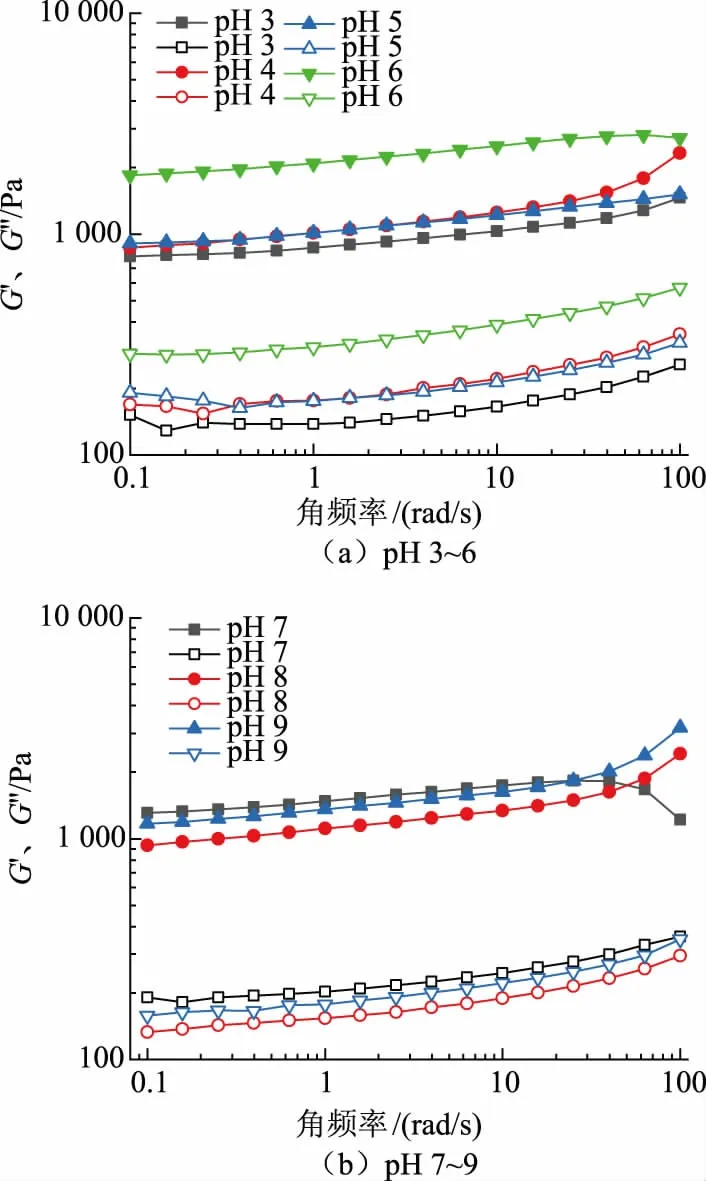
图6 不同pH 的肌原纤维蛋白乳液微凝胶频率扫描图Fig.6 Frequency dependency of G′ and G″ for myofibrillar protein emulsion microgels prepared at different pH values
蛋白质凝胶可以分为3 类:生物聚合物、交联凝胶以及非共价连接凝胶[20]。生物聚合物的频率依赖性很强,并且在频率扫描中,G′和G″有交点,这类软凝胶在低频率和高频率下均显示为流体状。交联凝胶具有永久的共价交联网络,几乎没有频率依赖性。非共价连接凝胶的频率依赖性较小,G′和G″扫描曲线没有交点。
根据频率扫描幂律拟合结果,可以判断出凝胶的类型[21]。对G′曲线进行幂律拟合,得出不同pH 的乳液微凝胶颗粒的n为0.06~0.11。当n为正数时,可以判定凝胶为非共价连接的物理凝胶[22-23]。因此,不同pH 下的乳液微凝胶均为非共价连接的物理凝胶。
从整体来看,pH 为6 的微凝胶,G′大于其他pH的微凝胶;而随着角频率的增加,pH 为8、9 的微凝胶模量也随之上升;在pH 为3~5 时,颗粒的G′与G″较低。pH 为3、4 时蛋白质带正电,且电势值大,强烈的静电相互作用削弱了凝胶强度。pH 为5 时处于等电点附近,形成的粒径较大,多孔结构松散,与水的结合能力较弱,形成的凝胶较软。在pH 6~9时,其模量相对于其他pH 凝胶的模量更高,因为pH 大于pI,静电斥力增加,初级粒子聚集的速度下降,蛋白质有序成链,蛋白质形成的结构比较细致,由此形成刚性更强的微凝胶颗粒,而随着pH 增加,凝胶模量均低于pH 为6 的凝胶,可能是由于pH 增加,蛋白质分子负净电荷量提高,分子之间的静电排斥力增加,限制了蛋白质的聚集,导致凝胶强度降低。
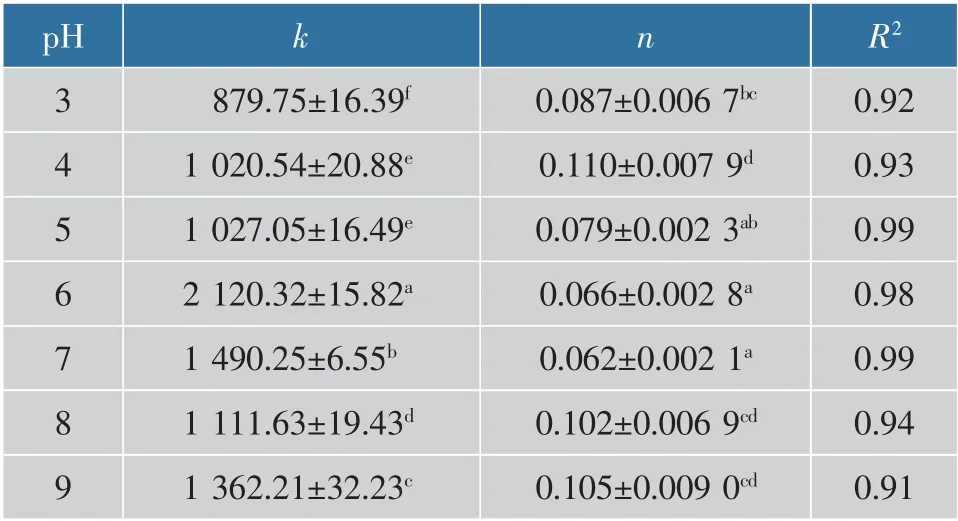
表1 不同pH 条件下肌原纤维蛋白乳液微凝胶频率扫描的幂律参数Table 1 Power-Law parameters for frequency sweep of myofibrillar protein emulsion microgels at different pH values
2.4.4 黏度测定所有pH 条件下的微凝胶都显示出剪切稀化的特征(见图7),这是微凝胶颗粒典型的特征。在低剪切速率时,会出现剪切增厚的现象,直至出现第一个峰值,这可能是由于刚开始测量时产生的瞬态效应[24],也可能是低剪切速率时,粒子几乎不发生流动,粒子间相互作用导致的。而后,随着剪切速率增加,微凝胶的黏度降低,可能因为在剪切作用下,粒子产生流动,微凝胶颗粒的结构被破坏,网络结构弱化,导致这些分子在一定程度上被分离出来[25],最初的团簇被分解成单个更小的絮凝体,从而降低其流动阻力,分子不再具有与以前相同的紧密接触,最终形成单个粒子,因此几乎独立地运动。也可能是悬浮粒子沿着剪切流动方向进行排列[26]。
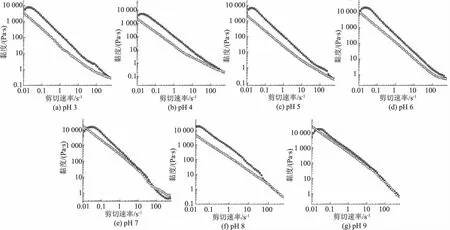
图7 不同pH 条件下肌原纤维蛋白乳液微凝胶黏度随剪切速率变化Fig.7 Viscosity of myofibrillar protein emulsion microgels varies with the shearing rate at different pH values
对比不同pH 乳液微凝胶的第一个峰值,pH 为6 时黏度最大,为18 400 Pa·s,pH 为3~5 时黏度明显比其他低,这与频率扫描结果一致。高浓度体系在微尺度上的黏度表现为粒子相互“挤压”。对于相同程度的空间填充,聚合粒子越多产生的黏度越高,在这种情况下,黏度更多是由颗粒的变形性和形态学驱动的[27]。而整体的黏度还是随着pH 的增加而增加。在pI 附近,凝胶化过程分子排斥力减小,在蛋白质开始排序之前,就已经形成了较弱的凝胶结构,更软的颗粒比更硬的颗粒更易变形、流动,所以整体的黏度更低,这种快速聚集使蛋白质与水结合受限。
两次扫描中的迟滞现象说明样品存在触变性,触变行为表示在剪切力作用下,结构强度减弱,在随后的静置过程中,结构或快或慢地恢复,最终会完全恢复。触变性是由于粒子间的相互作用或者结构的分解破坏引起的。迟滞现象的存在表明了剪切导致相体积的变化,从而致使黏度降低。所有凝胶都存在迟滞现象,迟滞环面积越小,结构损伤就越小。pH 为6 时滞后面积最大,这与频率扫描pH 为6 时模量最大的结果相符合。
对剪切稀化部分进行幂律拟合,k为黏度系数,n为流动指数,k与持水能力成正比,n对应于凝胶的假塑性程度。对比不同pH 凝胶的k得知,pH 3~5时持水能力明显低于pH 6~9,其中pH 为5 的持水能力最差,可能是由于处于等电点,疏水作用增强,形成了失水颗粒。不同pH 乳液微凝胶水结合能力的差异与凝胶强度的不同有关,所有微凝胶的n均较小(n<0.2),体现出非牛顿流体的特征。
2.4.5 剪切恢复力测试剪切恢复力测试用于评估样品结构变形以及回收程度。第一阶段,在处理步骤之前,在低剪切速率下,测量样品静止时的流变特性;第二阶段,样品随高剪切速率而变形;第三阶段,在与第一阶段相同的低剪切速率下,测量样品的流变特性,根据间隔时间确定样品的结构恢复率[28]。第三段体现出样品结构恢复的速度和样品结构恢复程度,当剪切速率突然上升或下降时,随后的黏度瞬变反映了受控流动条件下凝胶结构的变化,在剪切恢复力测试下,微凝胶颗粒的流动行为符合其微观结构和黏弹性[29]。
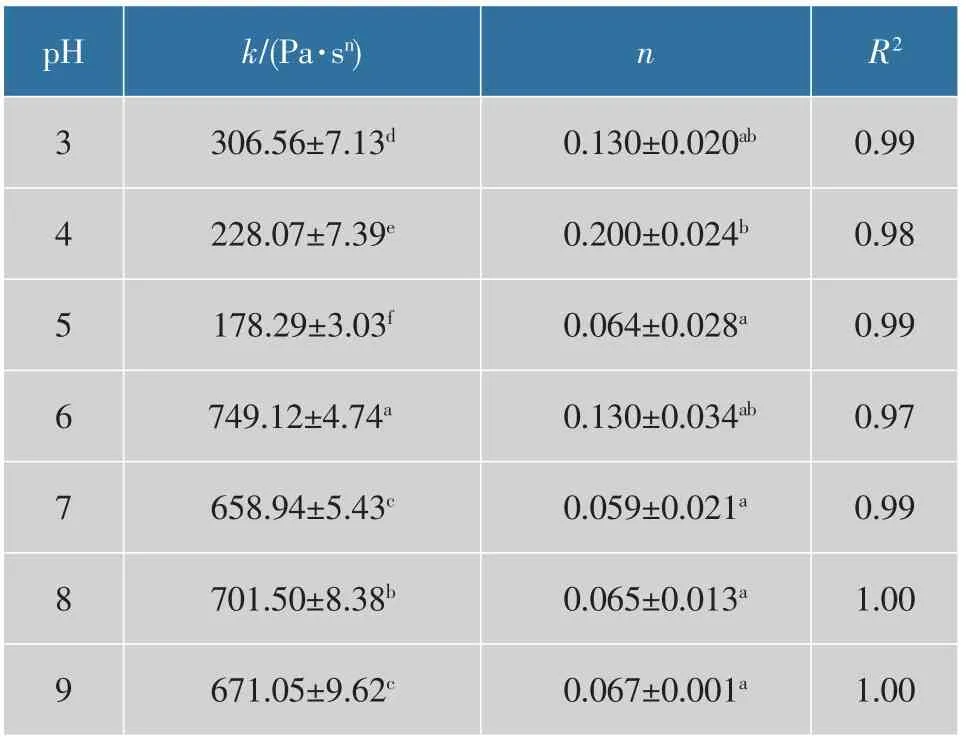
表2 不同pH 下肌原纤维蛋白乳液微凝胶黏度曲线的幂律参数Table 2 Power-Law parameters for viscosity of myofibrillar protein emulsion microgels at different pH values
第三个阶段中,所有pH 乳液微凝胶的黏度与第一步剪切时的黏度相比都明显降低。结构的恢复有两个过程:蛋白质分子黏度快速提升,后逐渐趋于平衡,此时构象重新排列。在一定的时间内,pH为5 时恢复能力最好,可能是pH 最接近蛋白质的等电点,颗粒结构相对来说更大、更松散,颗粒间相互作用弱,在施加剪切的时候,结构被破坏的少,等剪切撤去时,未被破坏的结构会随时间而重建,被破坏的结构多,恢复时间较长,恢复的程度和速率与微凝胶的黏弹性有关。
2.4.6 时间扫描由图9可以得出,不论是高剪切速率还是低剪切速率,不同pH 的乳液微凝胶黏度的变化趋势一致。在低剪切速率下,受到的剪切力对凝胶结构影响不大,蛋白质分子能够快速重组排列,所以黏度达到平衡所需的时间少。在高剪切速率下,凝胶受到的剪切力大,凝胶结构一定程度上被破坏,凝胶重新排列需要一定时间,故黏度趋于平衡的时间比低剪切速率长。
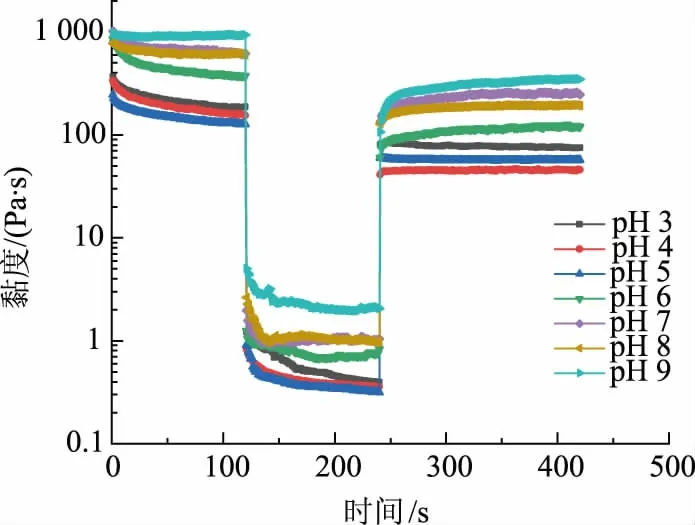
图8 不同pH 下肌原纤维蛋白乳液微凝胶的剪切恢复力Fig.8 Shear recovery of myofibrillar protein emulsion microgels at different pH values
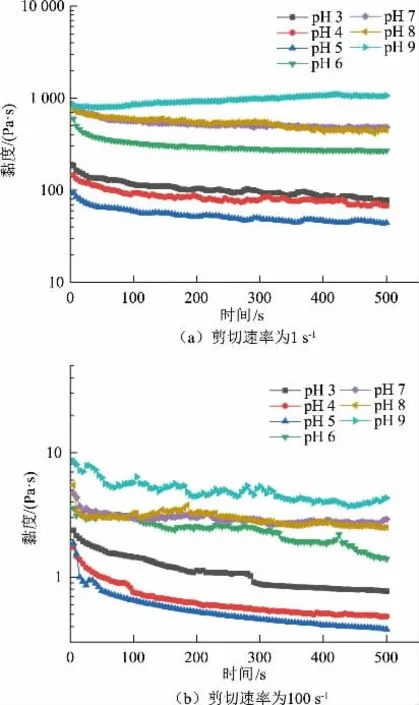
图9 不同pH 下肌原纤维蛋白乳液微凝胶在两种剪切速率下黏度随时间的变化Fig.9 Time dependency of viscosity for myofibrillar protein emulsion microgels at different pH values under two different shear rates
3 结 语
不同pH 条件下加热处理乳液所形成的乳液微凝胶均为非共价连接的物理凝胶,呈假塑性流体特征,pH 条件不会改变乳液微凝胶的流体类型。在酸性条件下及等电点附近,粒径明显大于其他pH 下的乳液微凝胶颗粒。pH 为6 时球形油滴被肌原纤维蛋白凝胶包封的最好。在低频率扫描时,pH 为6时肌原纤维蛋白乳液微凝胶呈现最高的黏弹性。黏度随pH 的升高呈现出先减小后增大的趋势,pH 为6 时最高黏度最大,触变性也最好。在剪切恢复力测试中,微凝胶颗粒的结构均有一定程度被破坏,其中pH 为5 时被破坏程度最小,具有更高的结构恢复率。
