戊二醛添加顺序对胶原蛋白肠衣膜品质的影响
2023-01-10徐菲菲陈茂深夏熠珣
徐菲菲,许 健,刘 飞*,陈茂深,夏熠珣,钟 芳
(1.江南大学未来食品科学中心,江苏 无锡 214122;2.江南大学江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122;3.嘉兴未来食品研究院,浙江 嘉兴 314015)
胶原蛋白肠衣是一种蛋白质类可食用膜,为提升其适用性,很多研究采用化学或物理交联的方式来改善胶原蛋白肠衣的性能。通过交联处理后,蛋白质分子内或蛋白质分子间可以通过交联键形成更致密的空间网络结构,从而改善肠衣的机械特性及阻隔特性[1-2]。交联剂种类繁多,选择合适的交联剂及其使用量至关重要。Wang 等通过紫外照射、热交联对胶原蛋白肠衣进行交联处理,使膜的力学性能与热稳定性得到了改善[3]。Bigi 等通过加入京尼平对蛋白质膜进行交联[1]。Casanova 等用京尼平交联酪蛋白胶束[4]。朱雪珂等借助京尼平,实现了多肽在丝素蛋白表面的接枝[5]。但京尼平价格十分昂贵,通常应用在医学领域中。国内外研究中,醛类、离子类和酶是最常用的交联剂。在胶原蛋白肠衣生产工业中,醛类是使用最广泛的交联剂,效果也最优异。
在欧洲、美国、中国等地戊二醛被允许使用在胶原蛋白肠衣工业中。戊二醛以抗酸能力强、交联效率高、反应迅速、价格低廉等特点,成为胶原蛋白肠衣工业中使用最广泛的交联剂[6-8]。
作者采用戊二醛对胶原蛋白肠衣膜进行交联。分别探讨制胶时、成胶后以及成膜后3 种戊二醛的添加方式对胶原蛋白肠衣膜品质的影响,以期获得戊二醛的最佳添加方式,提高牛皮的利用率和利用价值,提高食品行业包装材料的质量,减少白色污染,创造更大的社会价值和经济效益。
1 材料与方法
1.1 材料与试剂
牛二层皮:内蒙古秋实生物有限公司提供;甘油、硫酸铵、盐酸、戊二醛、柠檬酸、柠檬酸钠:国药集团化学试剂有限公司产品。
1.2 仪器与设备
均质机:德国GEA 公司产品;真空反应器:上海弗鲁克设备有限公司产品;物性分析仪:英国SMS 公司产品;傅里叶红外光谱仪:美国Thermo Fisher 公司产品;高精度分光测色仪:美国Hunterlab公司产品;差式扫描量热仪:德国Netzsch 公司产品。
1.3 实验方法
1.3.1 牛二层皮洗涤将牛二层皮用去离子水多次清洗,去除灰分,至水洗液电导率降至4 500 μm/s以下。加入质量分数3%(以牛皮干质量计)的硫酸铵继续清洗,去除钙离子。加入质量分数1%柠檬酸钠(以牛皮干质量计),缓慢滴入质量分数1%柠檬酸(以牛皮干质量计),将水洗液pH 调至4.6,继续清洗。最后用去离子水清洗,使水洗液电导率降至500 μm/s 以下,至此,洗涤工作完毕。
1.3.2 胶原团的制备将牛二层皮裁成块状,与碎冰一起放入高速粉碎机,粉碎制得皮浆。再将皮浆与盐酸溶液 (质量分数0.96%) 按照体积比1∶1 混合,搅拌至均匀。在4 ℃下,进行酸化膨胀20 h,间隙搅动后,使用均质机(27.5 MPa)均质1 次,再在真空反应器中进行搅拌脱气,制得胶原团。操作参数为:搅拌速度200 r/min,真空度0.8 MPa。
1.3.3 胶原蛋白肠衣膜的制备将胶原团压制成片,在质量分数3% NaOH 溶液中浸泡,中和盐酸后,再用去离子水清洗至中性,最后在25 ℃下干燥24 h,置于干燥箱(相对湿度53%,25 ℃)回湿72 h,制得胶原蛋白肠衣膜。
1.3.4 交联剂的添加顺序实验
1)制胶时加入 将戊二醛与盐酸溶液一同与皮浆混合。控制胶原团内戊二醛质量浓度为0、50、100、200、400 mg/L。
2)成胶后加入 当盐酸溶液与皮浆混合后再采用与胶原团滚揉的方法加入戊二醛。控制胶原团内戊二醛质量浓度为0、50、100、200、400 mg/L。
3)成膜后加入 当盐酸溶液与皮浆混合成为胶原团后,将制备好的胶原团压板成膜。将干燥后的肠衣膜浸入质量浓度为0、50、100、200、400 mg/L的500 mL 戊二醛溶液中15 min 后,于干燥箱(相对湿度53%,25 ℃)内平衡72 h。
1.3.5 干态下胶原蛋白肠衣膜抗拉强度和断裂延伸率测定将肠衣膜裁成1 cm×5 cm,用物性分析仪测定其抗拉强度、断裂延伸率[9-10],重复3 次取平均值。计算公式如下:

式中:T为抗拉强度,MPa;F为断裂力,g;S为横截面积,mm2;B为断裂延伸率,%;d1为断裂伸长长度,mm;d0为原长度,以夹具之间的间隙距离计,为30 mm;膜厚度作为测试参数输入。
1.3.6 湿态下胶原蛋白肠衣膜抗拉强度和断裂延伸率的测定将裁好的肠衣膜于25 ℃水中浸泡1 min 取出,用滤纸吸干水分,其他方法同1.3.5。
1.3.7 煮态下胶原蛋白肠衣膜抗拉强度和煮断裂延伸率的测定将裁好的肠衣膜于沸水中煮1 min取出,用滤纸吸干水分,其他方法同1.3.5。
1.3.8 胶原蛋白肠衣膜热收缩率测定将肠衣膜裁成1 cm×5 cm,于沸水中浸泡1 min 后取出测定长度变化,重复3 次取平均值。计算公式如下:

式中:H为热收缩率,%;d0为原长度,5 cm;d2为煮后肠衣膜长度,cm。
1.3.9 胶原蛋白肠衣膜溶胀率的测定取一定量肠衣膜,置25 ℃水中浸泡24 h 取出,用滤纸吸干水分后称量,测定肠衣膜的吸水溶胀率[11-12],重复3 次取平均值。计算公式如下:
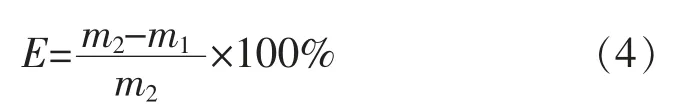
式中:E为吸水溶胀率,%;m1为肠衣膜质量,g;m2为吸干水分后肠衣膜质量,g。
1.3.10 胶原蛋白肠衣膜的色泽及透光率的测定将肠衣膜裁成5 cm× 5 cm,用测色仪测定其色泽,结果用L*、a*、b*值表示[11,13]。将肠衣膜裁成2 cm×5 cm,用紫外分光光度计测定其透光率,计算公式如下[11,14]:

式中:T为透光率,%;T530为样品在530 nm 条件下的透光率,%;L为膜的厚度,μm。
1.3.11 胶原蛋白肠衣膜的红外光谱将肠衣膜裁成2 cm×2 cm,置于干燥箱 (相对湿度0,25 ℃)72 h,再用傅里叶红外光谱仪在衰减全反射模式下进行分析,记录从4 000~400 cm-1的红外谱图[11,15]。
1.3.12 胶原蛋白肠衣膜的变性温度测定将胶原蛋白肠衣膜剪成2 cm× 2 cm,置于干燥箱(相对湿度53%,25 ℃)72 h,用差式扫描量热仪(differential scanning calorimetry,DSC)进行测定。测试条件为:温度扫描范围25~180 ℃,升温速率5 ℃/min[11,16]。
1.4 数据处理
对实验数据进行统计学分析,实验结果用平均值±标准差的形式表示。采用SPSS 23.0 分析,用t检验进行两样本比较,用ANOVA 进行单因素方差分析,用Duncan 多重比较法(P<0.05)进行差异显著性分析。
2 结果与分析
2.1 在制胶时加入交联剂
2.1.1 干、湿、煮态下胶原蛋白肠衣膜的抗拉强度变化如图1(a)所示,干态下,随着戊二醛质量浓度的升高,肠衣膜的抗拉强度有所升高,但不显著(P>0.05);当戊二醛质量浓度达到100 mg/L 时,肠衣膜的抗拉强度不再增加。如图1(b)所示,湿态下,当戊二醛质量浓度达到100 mg/L 时,肠衣膜的抗拉强度还在继续增加,但不显著(P>0.05)。如图1(c)所示,随着戊二醛质量浓度的增加,煮态下肠衣膜的抗拉强度继续增加,当达到400 mg/L 时,肠衣膜的抗拉强度显著增强到约1 MPa(P<0.05)。
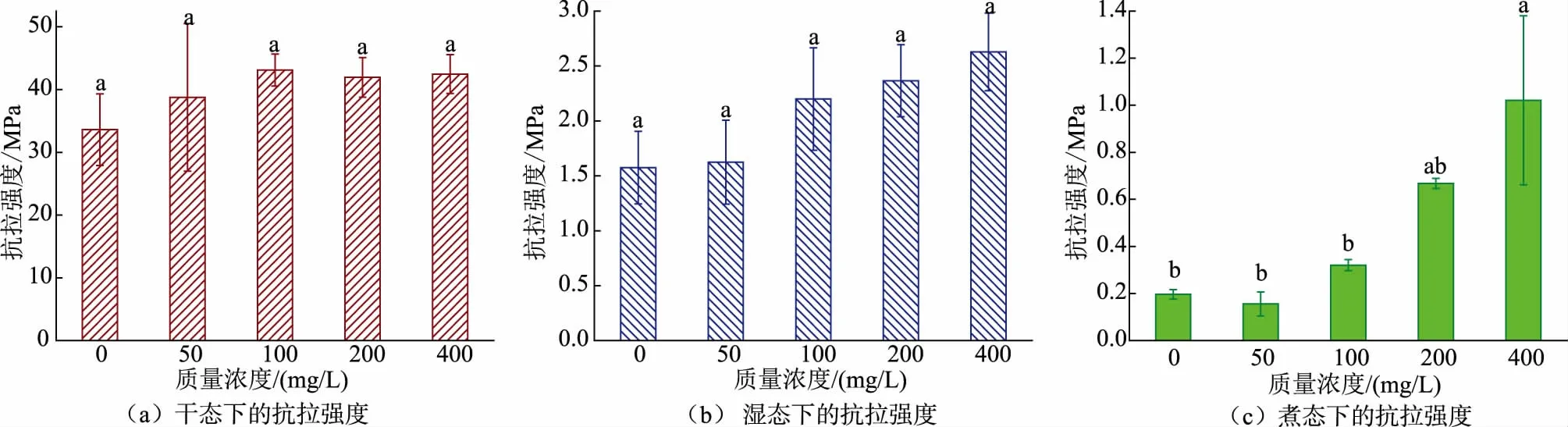
图1 不同质量浓度戊二醛交联肠衣膜的抗拉强度(制胶时加入交联剂)Fig.1 Tensile strength of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added during the process of paste making)
2.1.2 干、湿、煮态下胶原蛋白肠衣膜的断裂延伸率变化如图2所示,加入交联剂提高胶原蛋白肠衣膜抗拉强度的同时,不会降低其断裂延伸率,这说明胶原蛋白的交联反应不会对肠衣膜的断裂延伸率起负面作用。当戊二醛质量浓度为200 mg/L时,干态下肠衣膜的断裂延伸率有所增加,而湿态下肠衣膜的断裂延伸率随戊二醛质量浓度增加并未发生太大变化,但在煮态下肠衣膜的断裂延伸率随戊二醛质量浓度增加略有增加。由此可知,在制胶时加入戊二醛,对胶原蛋白肠衣膜的断裂延伸率没有显著影响。
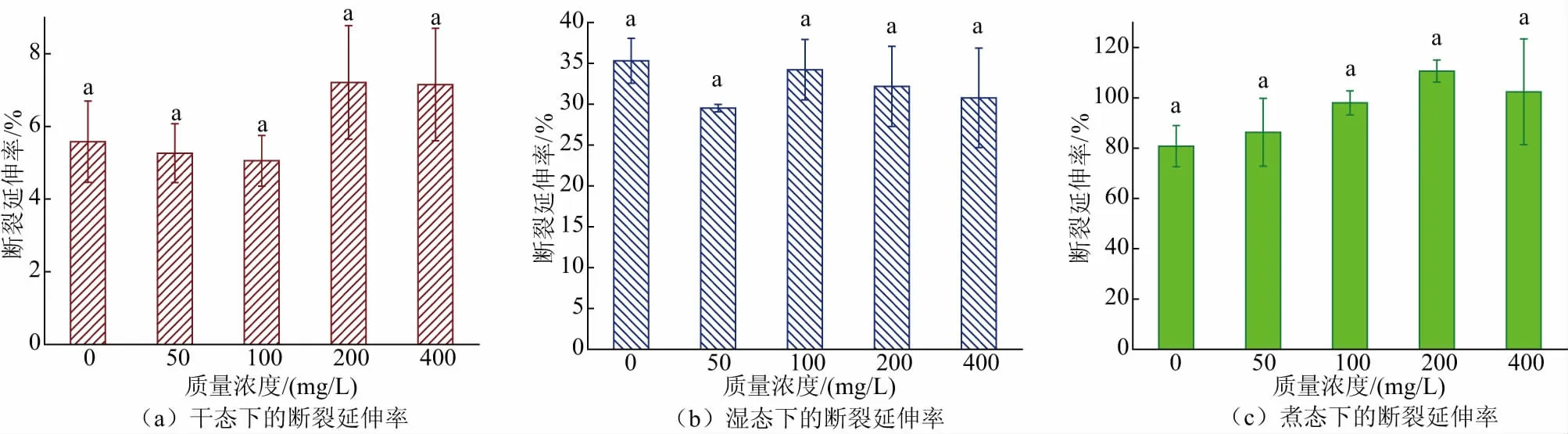
图2 不同质量浓度戊二醛交联肠衣膜的断裂延伸率(制胶时加入交联剂)Fig.2 Elongation of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added during the process of paste making)
2.1.3 胶原蛋白肠衣膜的溶胀率、热收缩率戊二醛的加入使胶原纤维网络结构变得更加致密,导致可以容纳水分子的空间不断减少,肠衣膜的溶胀率与戊二醛的质量浓度呈负相关(见图3(a)),尤其当戊二醛质量浓度为200 mg/L 和400 mg/L 时,肠衣膜的溶胀率显著降低(P<0.05)。如图3(b)所示,随着戊二醛质量浓度增加,肠衣膜的热收缩率也呈下降趋势,即其抗热缩能力增强。戊二醛质量浓度为400 mg/L 的胶原团所制肠衣膜的热收缩率约为33%,相较于对照组下降了约10%。由此说明,加入戊二醛后,胶原蛋白肠衣膜的溶胀率与热收缩率都得到明显改善。
图3 不同质量浓度戊二醛交联肠衣膜溶胀率、热收缩率的变化(制胶时加入交联剂)Fig.3 Swelling rate and heat shrinkage rate of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added during the process of paste making)
2.1.4 胶原蛋白肠衣膜的色泽用高精度分光测色仪测定膜的色泽[17],结果用L*、a*、b*值表示。根据叶勇的结果[18],在胶原蛋肠衣膜中加入戊二醛,会使肠衣膜的颜色发生变化,即b*值增加(变黄)。如表1所示,随着戊二醛质量浓度提高,肠衣膜的b*值明显增加,当戊二醛质量浓度为400 mg/L 时,肠衣膜的b* 值为13.39,发生了十分明显地变黄。肠衣膜变色的原因主要是戊二醛中醛基和胶原中的氨基发生了交联反应[19]。由于新双键的生成,与肽链上的肽键等其他双键体系形成超共轭系统,从而显示出一定的颜色。
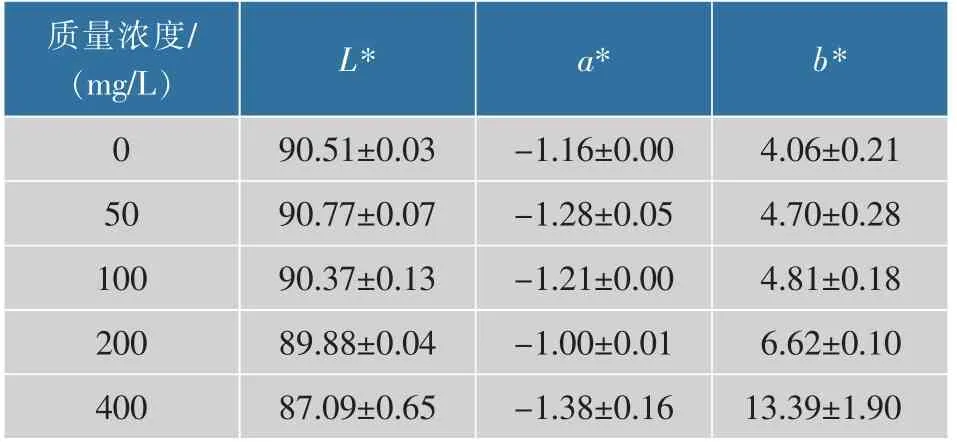
表1 不同质量浓度戊二醛交联肠衣膜的色泽 (制胶时加入交联剂)Table 1 Color of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added during the process of paste making)
2.1.5 胶原蛋白肠衣膜的FTIR 光谱FTIR 可用来分析加入交联剂后胶原蛋白肠衣膜内官能团及键的变化[20-21]。交联可以使—OH 发生明显地伸缩振动,向更高的波长发生位移,即蓝移[19]。如图4所示,对照组—OH 峰的位置在3 280.55 cm-1,当戊二醛质量浓度为50、100、200、400 mg/L 时,—OH 峰的位置分别在3 286.41、3 281.40、3 281.73、3 281.89 cm-1,发生了一定的蓝移。而加入戊二醛后,胶原蛋白肠衣膜的酰胺I、II、III、IV 和V 带都没有发生明显位移,说明胶原蛋白肠衣膜本身的结构并未遭到破坏,加入适量的戊二醛并不会对肠衣膜的化学键产生明显影响。
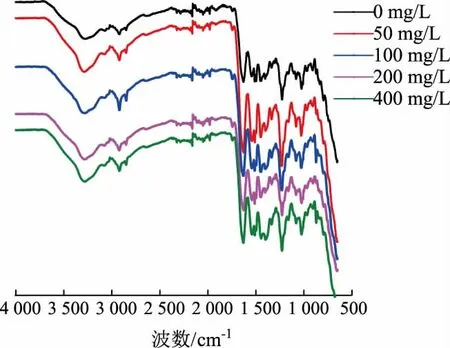
图4 不同质量浓度戊二醛交联肠衣膜的红外光谱 (制胶时加入交联剂)Fig.4 FTIR spectrum of casing films crosslinked by glutaraldehyde with different mass concentrations(crosslinking agent added during the process of paste making)
2.1.6 胶原蛋白肠衣膜的变性温度如图5所示,用DSC 对制备的肠衣膜进行热分析[22]。加入戊二醛后,胶原蛋白肠衣膜的热稳定性有了较大改善。不加入戊二醛的肠衣膜,变性温度为75.9 ℃。当戊二醛质量浓度为50、100、200、400 mg/L 时,肠衣膜的变性温度分别为81.4、79.4、76.6、75.6 ℃。根据结果可知,当戊二醛质量浓度为50、100 mg/L 时,肠衣膜的热稳定性显著增强。而当戊二醛质量浓度为400 mg/L 时,胶原蛋白肠衣膜的热稳定性反而有所下降,这说明戊二醛不宜添加过多。
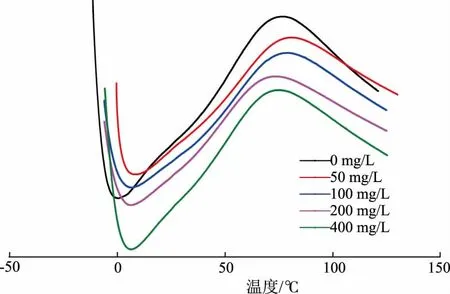
图5 不同质量浓度戊二醛交联肠衣膜的变性温度 (制胶时加入交联剂)Fig.5 Denaturation temperature of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added during the process of paste making)
2.2 成胶后加入交联剂
2.2.1 干、湿、煮态下胶原蛋白肠衣膜的抗拉强度变化通过滚揉的方法加入戊二醛并测定肠衣膜的抗拉强度。如图6所示,当戊二醛质量浓度为100 mg/L 时,干态下胶原蛋白肠衣膜的抗拉强度不再继续增加;而戊二醛交联对湿态下胶原蛋白肠衣膜的抗拉强度稍有提升,但没有显著差异(P>0.05);煮态下,对照组的抗拉强度仅为0.2 MPa,但当戊二醛质量浓度达到400 mg/L 时,胶原蛋白肠衣膜的抗拉强度增加到1.2 MPa。
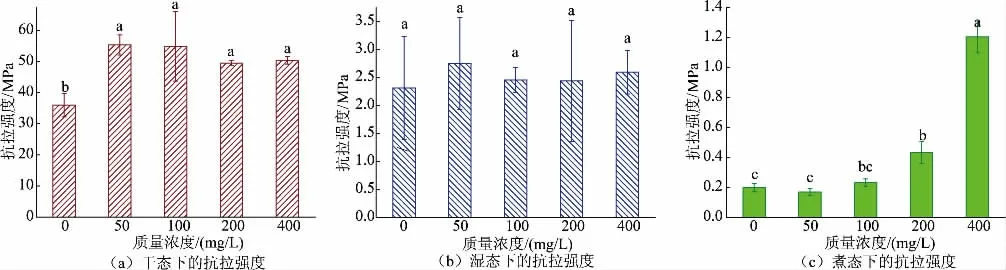
图6 不同质量浓度戊二醛交联肠衣膜的抗拉强度(成胶后加入交联剂)Fig.6 Tensile strength of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added after the process of paste making)
2.2.2 干、湿、煮态下胶原蛋白肠衣膜断裂延伸率的变化如图7所示,干态下胶原蛋白肠衣膜的断裂延伸率呈波动趋势,当戊二醛质量浓度为100 mg/L时肠衣膜的断裂延伸率最大,为10%,高于戊二醛质量浓度为400 mg/L 的样品。这可能是因为滚揉法并不能使戊二醛溶液与胶原团充分接触,从而导致了这样的波动趋势。湿态下肠衣膜的断裂延伸率变化不大,这说明戊二醛交联对湿态下肠衣膜的断裂延伸率没有显著影响。但当戊二醛质量浓度为100 mg/L 和400 mg/L 时,煮态下肠衣膜的断裂延伸率显著增大(P<0.05)。
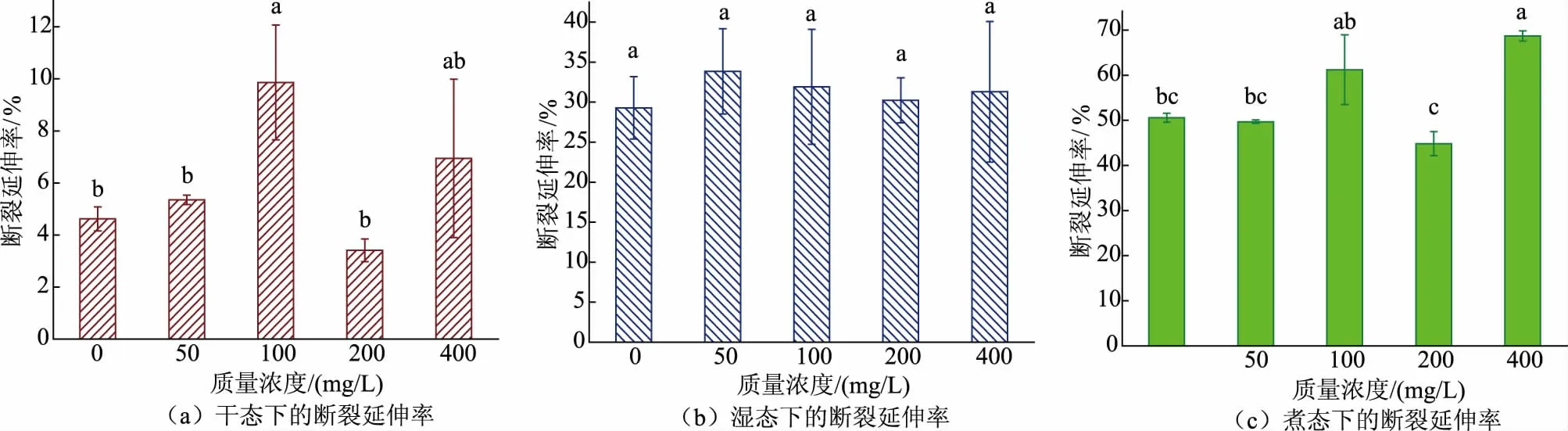
图7 不同质量浓度戊二醛交联肠衣膜的断裂延伸率(成胶后加入交联剂)Fig.7 Elongation of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added after the process of paste making)
2.2.3 胶原蛋白肠衣膜的溶胀率、热收缩率的变化与未加入戊二醛的对照组相比,加入戊二醛后肠衣膜的溶胀率有所升高(见图8),这与预期的结果不符,说明加入了戊二醛后肠衣膜的内部结构并未变致密。从侧面说明了在成胶后加入戊二醛并不是一种较为有效的方法。肠衣膜的热收缩率略有下降,说明在成胶后加入戊二醛,对改善肠衣膜的热收缩率有一定帮助。
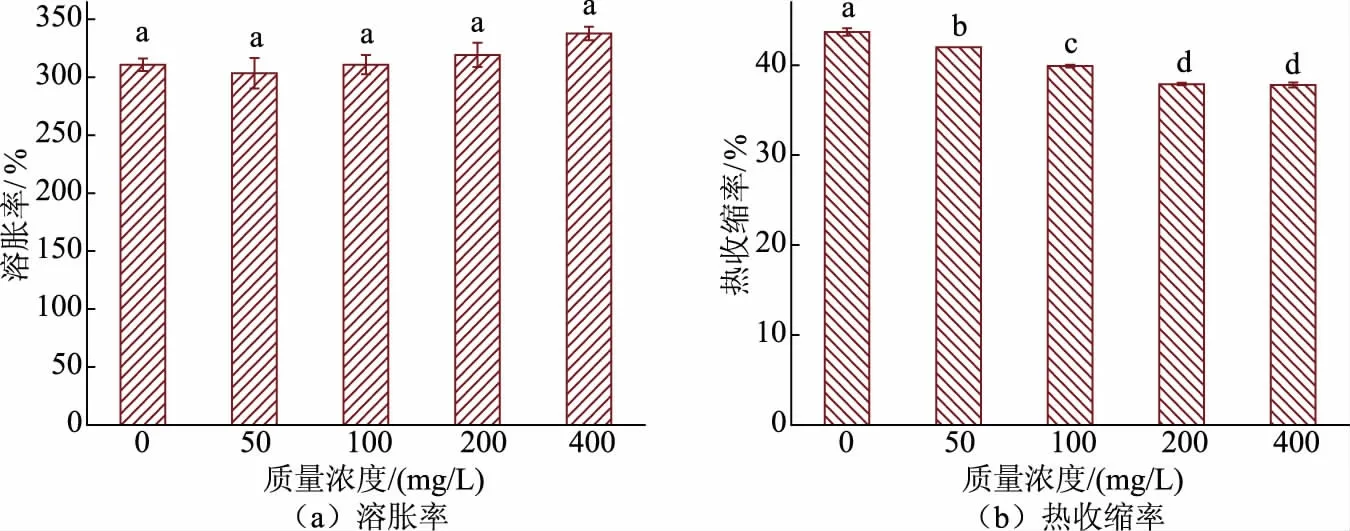
图8 不同质量浓度戊二醛交联肠衣膜溶胀率、热收缩率的变化(成胶后加入交联剂)Fig.8 Swelling rate and heat shrinkage rate of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added after the process of paste making)
2.2.4 胶原蛋白肠衣膜的色泽加入戊二醛后,胶原蛋白肠衣膜会因其超共轭系统而导致b* 值增加,即变黄,这也是工业生产中胶原蛋白肠衣膜变黄的主要原因。但4 种质量浓度的戊二醛溶液都未明显改变肠衣膜的b* 值(见表2),这也证明了在成胶后用混揉法加入戊二醛并非一种有效的交联方法。原因是胶原团本身就是结合较紧密的多孔网络结构,因此在成胶后加入戊二醛无法使其均匀渗透在肠衣膜内。
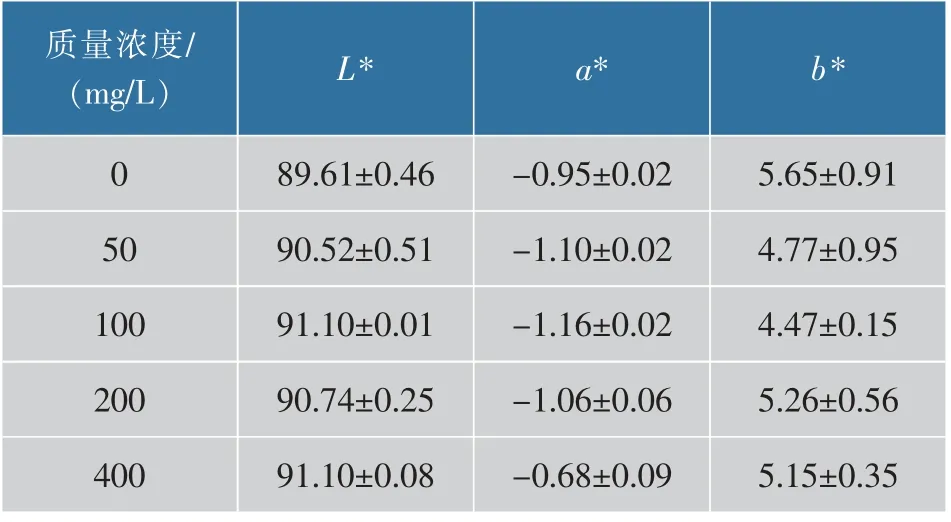
表2 不同质量浓度戊二醛交联肠衣膜的色泽 (成胶后加入交联剂)Table 2 Color of casing films crosslinked by gluta -raldehyde with different concentrations (crosslinking agent added after the process of paste making)
2.2.5 胶原蛋白肠衣膜的FTIR 光谱成胶后添加不同质量浓度戊二醛的肠衣膜—OH 峰的位置分别为3 279.56、3 283.68、3 280.34、3 282.69 cm-1,而对照组肠衣膜—OH 峰的位置为3 282.69 cm-1,并未发生明显的蓝移(见图9)。这与文献中报道的情况不符,也从侧面说明了交联反应的不充分。由此说明,相对于在制胶时加入戊二醛,在成胶后加入戊二醛不能充分交联肠衣膜。
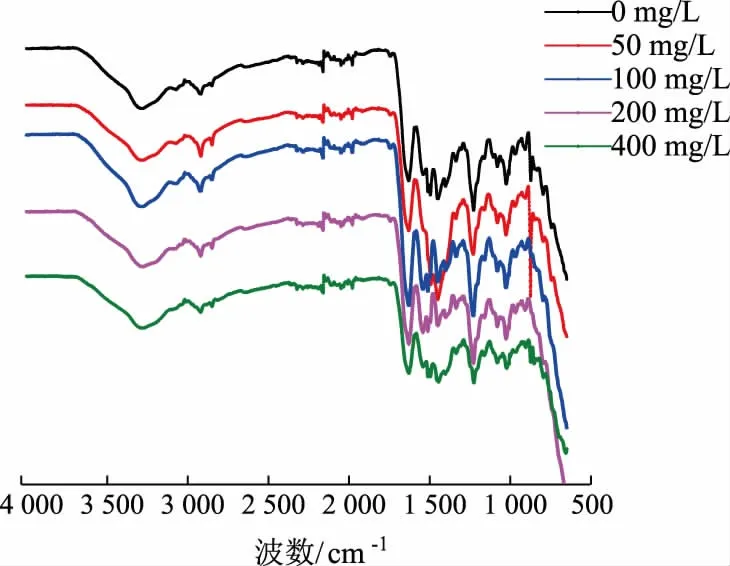
图9 不同质量浓度戊二醛交联肠衣膜的红外光谱 (成胶后加入交联剂)Fig.9 FTIR spectrum of casing films crosslinked by glutaraldehyde with different mass concentrations(crosslinking agent added after the process of paste making)
2.2.6 胶原蛋白肠衣膜的变性温度成胶后加入戊二醛,肠衣膜的热稳定性并没有明显改善,对照组胶原蛋白肠衣膜的变性温度为77.6 ℃,当戊二醛质量浓度为50、100、200、400 mg/L 时,肠衣膜的变性温度分别为79.9、77.1、78.0、77.2 ℃(见图10)。当戊二醛质量浓度为50 mg/L 时,肠衣膜的热稳定性最好。相较于在制胶时加入戊二醛,成胶后加入戊二醛对肠衣膜的热稳定性没有明显改善,这也反映了在成胶后用滚揉的方法加入戊二醛存在难度,不是一种好的交联方法。
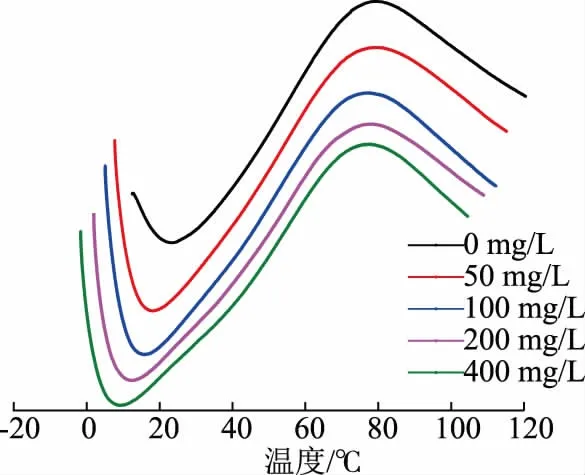
图10 不同质量浓度戊二醛交联肠衣膜的变性温度(成胶后加入交联剂)Fig.10 Denaturation temperature of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added after the process of paste making)
2.3 成膜后加入交联剂
2.3.1 干、湿、煮态下胶原蛋白肠衣膜的抗拉强度变化将制备好的胶原蛋白肠衣膜浸泡在戊二醛溶液中交联并测定肠衣膜的抗拉强度。结果见图11,虽然戊二醛质量浓度为100 mg/L 时,干态下胶原蛋白肠衣膜的抗拉强度不再增加。但不同于前两种方法的结果,随着戊二醛质量浓度增加,湿、煮态下,肠衣膜的抗拉强度持续显著增加(P<0.05),这说明成膜后浸泡法是一种极高效的交联方法。特别地,湿态下对照组抗拉强度仅为2.4 MPa,当戊二醛质量浓度为400 mg/L 时,肠衣膜的抗拉强度提升到10 MPa,提升了约300%,说明成膜后浸泡法可在保持胶原蛋白肠衣膜紧密程度的基础上,显著提升交联强度。
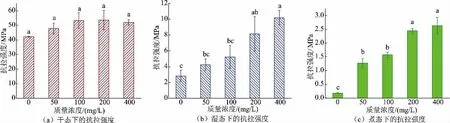
图11 不同质量浓度戊二醛交联肠衣膜的抗拉强度(成膜后加入交联剂)Fig.11 Tensile strength of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added after paste film formation)
2.3.2 干、湿、煮态下胶原蛋白肠衣膜断裂延伸率的变化如图12所示,干态下肠衣膜断裂延伸率的增加较为显著,但当戊二醛质量浓度为100 mg/L时,肠衣膜的断裂延伸率不再增加。随着戊二醛质量浓度增加,湿态下肠衣膜的断裂延伸率有所下降,但无显著差异。此外,虽然煮态下肠衣膜的断裂延伸率在戊二醛加入后有所增加,但并无规律,当戊二醛质量浓度为50 mg/L 时,肠衣膜的断裂延伸率最大。
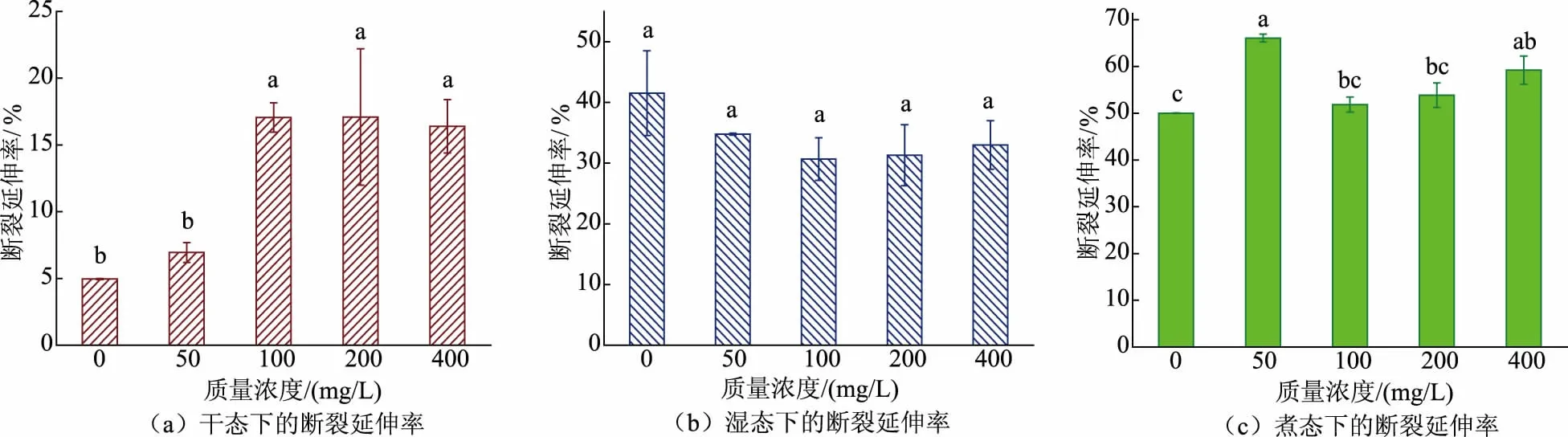
图12 不同质量浓度戊二醛交联肠衣膜的断裂延伸率(成膜后加入交联剂)Fig.12 Elongation of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added after paste film formation)
2.3.3 胶原蛋白肠衣膜的溶胀率、热收缩率如图13所示,胶原蛋白肠衣膜经过浸泡法处理后其溶胀率、热收缩率都明显降低,原因是交联反应使肠衣膜内部可以容纳水分子的空间减少,同时胶原纤维结合更加紧密,使胶原蛋白肠衣膜的抗热缩能力增强。

图13 不同质量浓度戊二醛交联肠衣膜溶胀率、热收缩率的变化(成膜后加入交联剂)Fig.13 Swelling rate and heat shrinkage rate of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added after paste film formation)
2.3.4 胶原蛋白肠衣膜的色泽在成膜后,将胶原蛋白肠衣膜浸入戊二醛中的方法交联效率极高。如表3所示,在浸入不同质量浓度的戊二醛溶液后,肠衣膜的b*值明显增加。当戊二醛质量浓度为400 mg/L 时,肠衣膜的b*值达到17.99,高过其他两种方法,说明其交联效果明显优于其他两种。
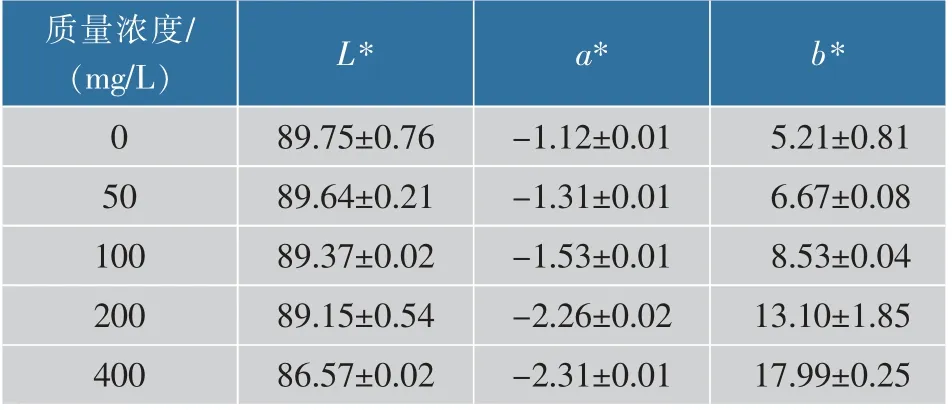
表3 不同质量浓度戊二醛交联肠衣膜的色泽 (成膜后加入交联剂)Table 3 Color of casing films crosslinked by glutaraldehyde with different mass concentrations(crosslinking agent added after paste film formation)
2.3.5 胶原蛋白肠衣膜的FTIR 光谱加入戊二醛后,肠衣膜的—OH 峰发生了较为明显的蓝移(见图14)。当戊二醛质量浓度为50、100、200、400 mg/L时,肠衣膜的—OH 峰的位置分别为3 282.69、3 284.08、3 285.04、3 290.78 cm-1。其中,当戊二醛质量浓度为400 mg/L 时肠衣膜的—OH 峰蓝移最明显,相对于对照组肠衣膜的—OH 峰的位置 (3 280.90 cm-1)蓝移了约10 cm-1,这也从侧面说明相对于制胶时、成胶后2 种方法,在成膜后将肠衣膜浸入戊二醛溶液中的方法交联效率最高。
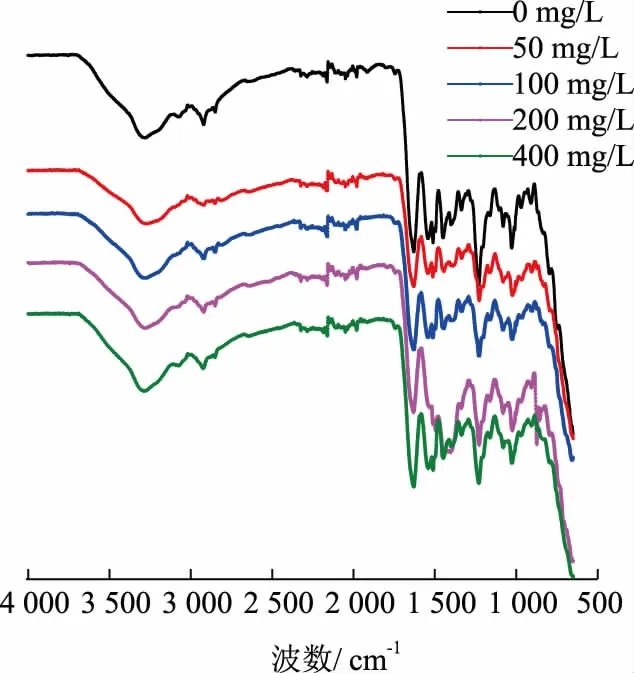
图14 不同质量浓度戊二醛交联肠衣膜的红外光谱(成膜后加入交联剂)Fig.14 FTIR spectrum of casing films crosslinked by glutaraldehyde with different mass concen -trations (crosslinking agent added after paste film formation)
2.3.6 胶原蛋白肠衣膜的变性温度对照组肠衣膜的变性温度为77.6 ℃,浸入了50、100、200、400 mg/L戊二醛溶液的肠衣膜变性温度分别为75.7、80.5、79.4、80.4 ℃(见图15)。当戊二醛质量浓度为50 mg/L时,肠衣膜的热稳定性有所下降,但不明显。当戊二醛质量浓度为100、200、400 mg/L 时,胶原蛋白肠衣膜的热稳定性有了一定改善。在成膜后浸入戊二醛溶液的交联方法对膜热稳定性的改善要优于在成胶后加入戊二醛的方法,但不如在制胶时加入戊二醛的方法。这可能与成胶时加入戊二醛的不均匀交联有关。
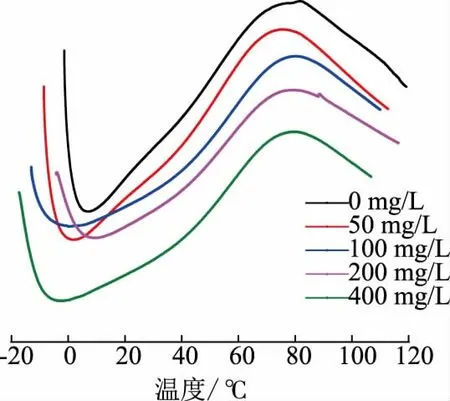
图15 不同质量浓度戊二醛交联肠衣膜的变性温度(成膜后加入交联剂)Fig.15 Denaturation temperature of casing films crosslinked by glutaraldehyde with different mass concentrations (crosslinking agent added after paste film formation)
3 结 语
确定了戊二醛的最佳加入方式:在成膜后浸入戊二醛溶液,交联效率最高,湿、煮态下肠衣膜抗拉强度明显增大,溶胀率、热收缩率下降,热稳定性提高。其次是在制胶时与酸液一同加入,这种交联方式可以缩短制备胶原蛋白肠衣的周期,同时节约生产车间的空间,进一步降低制备胶原蛋白肠衣膜的成本,具有很好的应用前景。
