发酵乳杆菌SS-31培养基及发酵条件的优化
2023-01-10秦雅莉于福田赵笑颍沈圆圆董诗瑜刘小玲
秦雅莉,于福田,赵笑颍,沈圆圆,董诗瑜,刘小玲*,2
(1.广西大学轻工与食品工程学院,广西 南宁 530004;2.广西水牛乳工程技术研究中心,广西 南宁 530004)
发酵乳杆菌(Lactobacillus fermentum)是常见的乳酸菌之一,广泛存在于各类发酵制品中,是异型发酵乳酸菌[1]。美国食品和药物管理局和欧洲食品安全局均将发酵乳杆菌评估为食品用微生物菌种,并且我国也将其列为《可用于食品的菌种名单》。近年来,随着研究深入,发酵乳杆菌的功能和益生特性不断被人们所证实。众多研究结果表明,发酵乳杆菌在胃肠道中具有高存活率[2]、对病原体的抗菌活性[3]、调节肠道菌群[4]以及抗氧化能力[5],此外还具有免疫调节能力[6]。
乳酸菌广泛存在于自然界,例如食品、植物、动物或人体肠道等多种生活环境中,是潜在的益生菌。作者所在课题组致力于挖掘柳州酸笋中乳酸菌资源,从酸笋中筛选得到一株具有较强降低RAW264.7 细胞分泌NO 能力的发酵乳杆菌SS-31[7]。该菌株具有较强耐酸能力、耐1 g/L 牛胆盐、耐人工胃肠液以及高黏附性等特性;此外还可以显著下调LPS 诱导的RAW264.7 细胞中炎症因子IL-1β、IL-6的含量。综上,该菌株具有优良生理特性和抗炎活性。而乳酸菌要在体内达到一定数量时,才能产生一定的益生效果。世界卫生组织规定,益生菌食品的益生菌活菌总数须超过1×107CFU/g 才可以有益生作用。但目前乳酸菌的较低发酵水平限制了其扩大应用。实现菌株低成本、高效率培养的核心是优化发酵培养基。乳酸菌的生长繁殖需要碳源、氮源、无机盐、营养因子等营养物质,并且生长过程中需要不断与外界进行物质、能量交换,受到外界环境(温度、pH 等)影响。与普通培养相比,低成本、高效率的培养既可以更快速提高菌体密度,缩短生产周期,又能降低生产成本[8-9]。吕秀明等通过单因素结合响应面实验和流加补料培养优化长双歧杆菌L80培养基,得到活菌数为1.21×1010CFU/mL[10]。Magdalena 等通过响应面法优化鼠李糖乳杆菌培养基,优化后菌体密度达到5 g/L,是相同条件下MRS培养基中菌体密度(1.9 g/L)的2.63 倍[11]。
以发酵乳杆菌SS-31 为研究对象,以活菌数为指标,通过单因素、响应面实验确定最佳培养基成分和含量。然后对其发酵培养条件(温度、接种体积分数、pH)进行优化,最后将优化得到的最佳条件应用于15 L 发酵罐,筛选中和剂以进行扩大培养,实现发酵乳杆菌低成本、高效率的发酵培养方式,并为开发以乳酸菌作为主要成分的功能性食品,以及使饲料中益生菌达到相应数量的工业化生产奠定基础。
1 材料与方法
1.1 实验材料
发酵乳杆菌SS-31(L.fermentumSS-31):分离自酸笋发酵液,保藏于中国普通微生物菌种保藏管理中心,保藏编号为CGMCC NO.24925。
MRS 基础培养基:每1 L 含葡萄糖20 g、胰蛋白胨20 g、磷酸氢二钾0.9 g、硫酸锰0.50 g、硫酸镁1.00 g、吐温80 1.00 g,调节pH 至6.5,115 ℃高压灭菌20 min。
1.2 主要试剂
葡萄糖、麦芽糖、蔗糖、乳糖、蛋白胨、牛肉浸粉、牛肉胨、胰蛋白胨(均为生物试剂):上海麦克林生化科技有限公司产品;氯化钾、磷酸氢二钾、磷酸二氢钾、柠檬酸铵、醋酸钠、氯化钠、硫酸镁、碳酸铵、氨水、碳酸钠(均为分析纯):北京索莱宝科技有限公司产品。
1.3 主要仪器
15 L 发酵罐:上海宝兴生物设备工程有限公司产品;GI80TW 立式自动压力蒸汽灭菌器:致微仪器有限公司产品;DZKW-D-1 电热恒温水浴锅:北京市光明医疗仪器有限公司产品;SW-CJ-2F 洁净工作台:苏州安泰空气技术有限公司产品;SQP 电子天平:赛多利斯科学仪器有限公司产品;Sherlock 微生物计数仪:美国MIDI 公司产品;DW25-560 恒温恒湿培养箱:上海知楚仪器有限公司产品;SUNRISE 酶标仪:帝肯(上海)贸易有限公司产品。
1.4 实验方法
1.4.1 发酵乳杆菌增殖培养基成分的优化以平板涂布法测定的活菌数为评价指标,在MRS 基础培养基上,替换培养基中碳源,添加量为20 g/L,探究不同种类碳源(葡萄糖、麦芽糖、乳糖、蔗糖)对发酵乳杆菌SS-31 生长的影响,筛选出最佳碳源。以蛋白胨、牛肉浸粉、牛肉胨、胰蛋白胨为氮源,替换上述已优化培养基中的氮源,以20 g/L 为添加量,筛选得到最优氮源。同样以磷酸氢二钾、磷酸二氢钾、柠檬酸铵、醋酸钠为无机盐,添加量为9 g/L,筛选出最优无机盐,以确定最佳增殖培养基成分。
1.4.2 发酵乳杆菌增殖培养基成分质量浓度的优化以平板涂布法测定的活菌数为评价指标,在上述最佳增殖培养基的基础上,选择碳源的添加量为5、10、15、20、25、30 g/L,探究其最适添加量。选取上述最适碳源添加量,设置氮源添加量为5、10、15、20、25、30 g/L,确定其最适添加量。选取最佳碳源和氮源添加量,设置无机盐添加量为3、5、7、9、11、13 g/L,确定其最适添加量。
1.4.3 响应面法优化发酵乳杆菌增殖培养基选择上述最佳碳源、氮源、无机盐进行响应面实验。碳源质量浓度为10、15、20 g/L;氮源质量浓度为15、20、25 g/L,无机盐质量浓度为7、9、11 g/L,采用三因素三水平(见表1),应用Design-Expert V 8.0.6进行Box-Behnken 实验设计,优化出增殖培养基最佳配方。
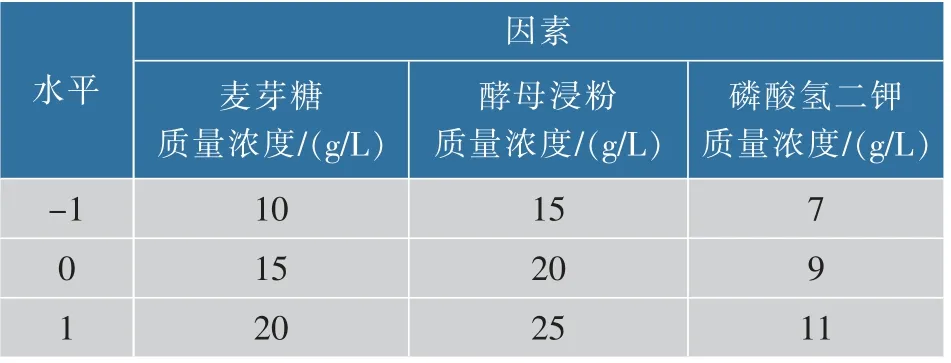
表1 Box-Behnken 实验设计因素及水平Table 1 Box-Behnken design test factors and levels
1.4.4 发酵乳杆菌SS-31 高密度培养条件的优化
1)接种体积分数的选择 将已活化3 代后的发酵乳杆菌SS-31 37 ℃恒温培养24 h 后,按接种体积分数1%、2%、3%、4%、5%,分别接种于增殖培养基中,调节初始pH 为6.8,置于37 ℃恒温箱内培养24 h,测定其活菌数,确定菌体最佳接种体积分数。
2)初始pH 的选择 调节增殖培养基初始pH为5.8、6.3、6.8、7.3、7.8,按最佳接种体积分数接种于增殖培养基中,置于37 ℃恒温培养24 h,测定其活菌数,确定增殖培养基最佳初始pH。
3)温度的选择 调节增殖培养基初始pH 至最佳,按最佳接种体积分数接种于增殖培养基中,分别置于31、34、37、40、43 ℃恒温箱内培养24 h,测定其活菌数,确定最佳培养温度。
4)中和剂的选择 为了更快测定菌体浓度,选用OD600为指标反映菌体浓度。选择常用的Na2CO3溶液和氨水为中和剂,质量浓度均为20 g/L,通过流加中和剂维持培养基pH 为6.8±0.02,以不流加中和剂作空白对照,每隔3 h 测定OD600,并利用平板记数法测定24 h 活菌数。利用15 L 全自动发酵罐,按最终确定的培养条件进行发酵并比较两种中和剂对发酵乳杆菌SS-31 高密度培养的影响。
1.5 数据处理与统计分析
数据采用SPSS 22.0 软件进行统计分析,实验结果以平均值±标准差表示,实验重复3 次。显著性(P<0.05)分析使用Duncan 检验。使用Origin 9.0 软件绘图。
2 结果与分析
2.1 培养基成分的确定
为了筛选出最佳碳源、氮源、无机盐,以MRS为基础培养基,采用平板涂布法测定活菌数,以确定最佳碳源、氮源、无机盐,结果见图1。在葡萄糖、蔗糖、乳糖、麦芽糖4 种碳源中,麦芽糖是L.fermentumSS-31 生长繁殖的最佳碳源,此时活菌数达到最大值1.64×109CFU/mL,而碳源为葡萄糖的MRS 基础培养基中活菌数仅为4.67×108CFU/mL。孙媛媛分析了7 种碳源对异型发酵乳杆菌FXJCJ6-1 生长的影响,发现其对单糖(葡萄糖)利用率最高[12]。张兴昌等发现以双糖 (蔗糖) 作为碳源时,Lactobacillus fermentumF6 菌体密度显著高于其他碳源[13]。但在该实验中,L.fermentumSS-31 对麦芽糖的利用程度显著高于其他碳源,说明不同菌株对碳源的利用有差异。
由图1(b)可知,在胰蛋白胨、牛肉胨、蛋白胨和酵母浸粉4 种氮源中,酵母浸粉是菌体生长繁殖的最佳氮源,此时活菌数达到最大值3.21×109CFU/mL。洪梅等对发酵乳杆菌BLF01 研究发现当酵母粉作为氮源时,获得的活菌数更高[14]。Gao 等发现酵母粉作为发酵乳杆菌的氮源时,对其菌体生长具有显著促进作用[15],这也与该实验研究结果相同。由于酵母浸粉中富含多种氨基酸,还含有较高的尼克酸、叶酸、钴胺酸,且它们在中、酸性环境中对热稳定[16],所以酵母浸粉对L.fermentumSS-31 生长有显著促进作用。
由图1(c)可知,在磷酸氢二钾、柠檬酸铵、醋酸钠、磷酸二氢钾4 种无机盐中,磷酸氢二钾是最适无机盐,此时活菌数达到最大值3.05×109CFU/mL。无机盐在一定范围内可中和菌体在生长过程中产生的酸性物质,并且参与细胞的合成代谢,调节渗透压稳定[17]。吕佳璐等研究4 种无机盐对干酪乳杆菌YQ336 生长的影响时,发现磷酸氢二钾最适宜该菌株的增殖培养[18],这与该实验结果相同。

图1 不同碳源、氮源、无机盐对发酵乳杆菌SS-31 生长的影响Fig.1 Effects of different carbon sources,nitrogen sources and inorganic salts on the growth of L.fermentum SS-31
2.2 碳源、氮源、无机盐质量浓度的确定
探究了不同质量浓度麦芽糖、酵母浸粉、磷酸氢二钾对发酵乳杆菌SS-31 活菌数的影响,结果见图2。碳源质量浓度对乳酸菌生长起到关键作用,随着麦芽糖由5 g/L 提高到25 g/L,L.fermentumSS-31活菌数呈现先上升后下降的趋势,并在15 g/L 时,活菌数达到最大值4.92×109CFU/mL。糖质量浓度过高时,菌株前期大量增殖生长,发酵产生大量酸,导致培养基环境偏酸性化,抑制菌株的生长代谢。因此选择15 g/L 作为麦芽糖的最适添加量。
氮源为菌体生长代谢提供必要元素,富含氨基酸、无机盐和维生素。从图2(b)可知,随着酵母浸粉由5 g/L 提高到25 g/L,L.fermentumSS-31 活菌数呈现先上升后下降的趋势,并在添加量为20 g/L时,活菌数达到最大值5.87×109CFU/mL。前人研究认为[19]氮源质量浓度过低时,培养基内营养物质不足,导致菌体生长缓慢;氮源质量浓度过高时,菌体生长过快,导致菌体老化、自溶[20]。因此选择20 g/L作为酵母浸粉的最适添加量。
无机盐也是菌体生长代谢的重要因素,能够构成细胞物质以及调节渗透压。从图2(c)可知,随着磷酸氢二钾由1 g/L 提高到11 g/L,活菌数呈现先上升后下降的趋势,并在9 g/L 时,L.fermentumSS-31活菌数达到最大值5.47×109CFU/mL。由于乳酸菌在生长代谢过程中分解糖类产生大量乳酸,随着时间延长,乳酸大量堆积导致培养基内pH 下降,乳酸菌生长受到抑制。无机盐可以调节培养基的pH,中和过量的酸,促进菌体的生长,并为其生长补充微量元素。因此选择9 g/L 作为磷酸氢二钾的最适添加量。

图2 不同质量浓度麦芽糖、酵母浸粉、磷酸氢二钾对发酵乳杆菌SS-31 生长的影响Fig.2 Effects of different concentrations of maltose,yeast extract powder and potassium hydrogen phosphate on the growth of L.fermentum SS-31
2.3 响应面实验结果
利用Design-Expert 10.0 软件对麦芽糖质量浓度(A)、酵母浸粉质量浓度(B)、磷酸氢二钾质量浓度(C)设计三因素三水平的Box-Behnken 实验。实验设计及结果见表2。
通过对表2的实验结果进行二次项拟合,以L.fermentumSS-31 活菌数作为响应值,对结果进行多元回归分析,得到回归方程:活菌数(×109CFU/mL)=6.920+0.559A-0.014B+0.532C+0.786AB+0.636AC-0.467BC-1.440A2-1.534B2-2.028C2。

表2 Box-Behnken 实验设计及结果Table 2 Box-Behnken design and its experimental results
由表3可知模型P<0.000 1,表明该模型建立成功;失拟项为0.148 6,大于0.05,说明失拟项不显著;模型的R2=0.977 0,Radj2=0.947 5,说明预测值和实验值的相关性高,可以解释94.75%的响应值变化。该模型变异系数(0.73%)小,具有较高精确度。综上,该回归模型可对L.fermentumSS-31 在培养基的生长情况进行有效分析和预测。3 个因素交互作用的响应曲面及等高线见图3。
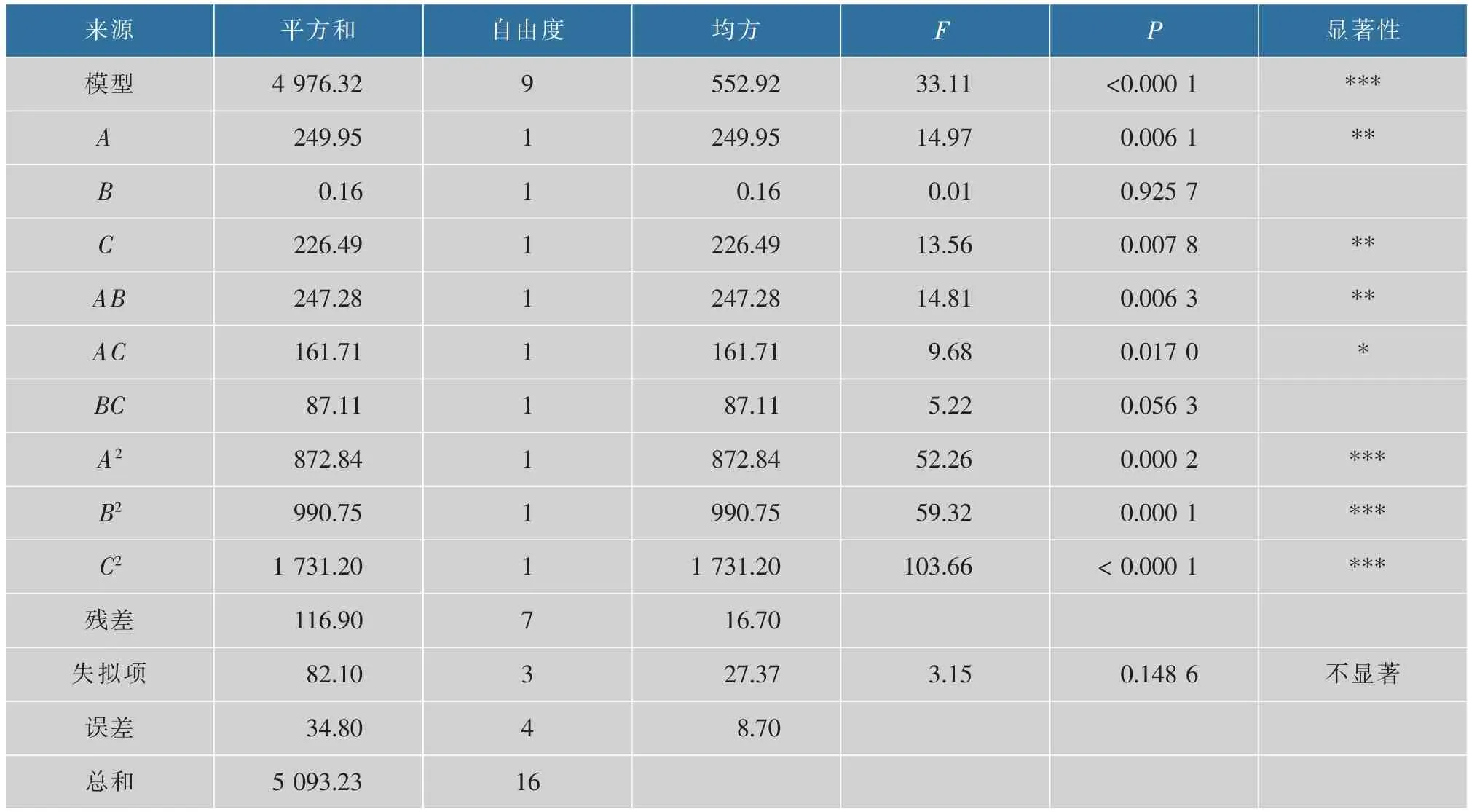
表3 RSM 回归方程方差分析Table 3 Variance analysis of RSM regression model
2.4 响应面实验结果的验证
回归模型得出Box-Behnken 实验设计的最优结果见表4。在麦芽糖16.20 g/L、酵母浸粉20.16 g/L、磷酸氢二钾9.33 g/L 时,在此优化条件下的活菌数预测值为7.03×109CFU/mL。为了验证模型所得优化结果的准确性,依照优化结果进行培养基的配制及发酵实验,测定24 h 时L.fermentumSS-31 的活菌数,3 次实验结果的平均值为6.51×109CFU/mL,和模型预测值接近,验证了此模型的准确性。

表4 Box-Benhnken 验证实验与结果Table 4 Box-Benhnken verification experiments and results
杨瑞冬等对Lactobacillus buchneriIMAU80233培养基中碳源、氮源、无机盐体系进行Box-Behnken实验,后经发酵培养条件优化后,菌体活菌数仅有3.81×109CFU/mL,约为优化前的1.59 倍[21];李纳对鼠李糖乳杆菌RG2 培养基成分及培养条件优化后,活菌数达到7.1×109CFU/mL,是未优化前活菌数的7 倍[22];高志敏采用正交法结合响应面法优化Lactobacillus fermentumIMAU 10129 的培养基,优化后活菌数为4.21×109CFU/mL,为优化前活菌数的6 倍[23]。而在该实验中,优化后L.fermentumSS-31活菌数为6.51×109CFU/mL,是优化前MRS 基础培养基活菌数(4.67×108CFU/mL)的13.94 倍,活菌数提升了一个数量级,高于目前文献已报道的活菌数水平,说明效果较好。
2.5 高密度培养条件的优化
2.5.1 接种体积分数的选择菌体接种体积分数的多少通常影响其生长到稳定期的时间以及浓度[24]。作者探究了不同接种体积分数对L.fermentumSS-31活菌数的影响,结果见图4。在接种体积分数为1%~5%时,L.fermentumSS-31 的活菌数随接种体积分数升高呈现先上升后下降的趋势,在接种体积分数为3%时,活菌数达到最大值6.83×109CFU/mL。这可能是初始接种体积分数过大,菌体大量繁殖消耗更多营养物质,导致后期培养基内营养物质不足,从而呈现下降趋势。综上,选择3%为L.fermentumSS-31 的接种体积分数。
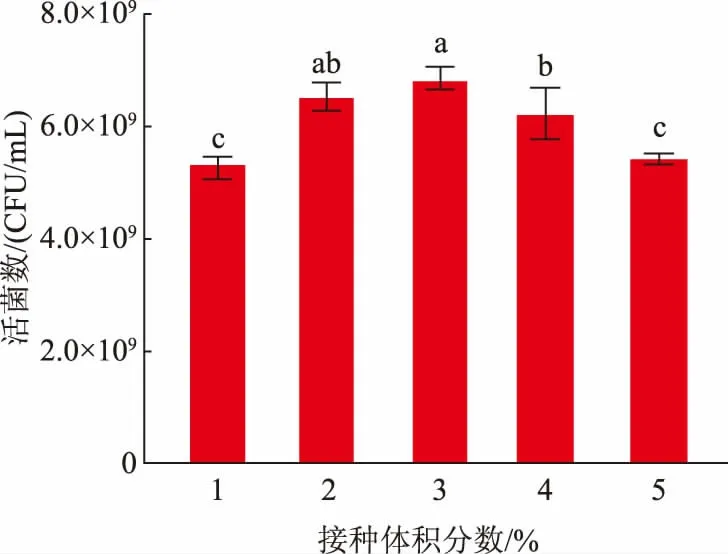
图4 接种体积分数对发酵乳杆菌SS-31 生长的影响Fig.4 Effects of inoculum on the growth of L.fermentum SS-31
2.5.2 初始pH 的选择乳酸菌的最适生长pH 一般为5.0~7.0,不同种类乳酸菌有不同的最适生长pH。作者探究了不同初始pH 对L.fermentumSS-31活菌数的影响,结果见图5。随着初始pH 的增加,L.fermentumSS-31 的活菌数呈现先增加后降低的趋势,在pH 为6.8 时,活菌数达到最大值7.30×109CFU/mL。在过酸的环境下,会破坏细胞膜渗透压平衡和干扰细胞内外酶的活性,限制乳酸菌的生长;当pH 过高时,也不利于其生长[25-26]。综上,选择pH 6.8 为初始pH。

图5 初始pH 对发酵乳杆菌SS-31 生长的影响Fig.5 Effects of initial pH on the growth of L.fermentum SS-31
2.5.3 温度的选择温度的变化对乳酸菌的影响较大,温度过高或过低均不利于其生长繁殖。作者探究了不同温度对L.fermentumSS-31 活菌数的影响,结果见图6。随着温度升高,L.fermentumSS-31的活菌数呈现显著增加后降低的趋势,在温度为37 ℃时,活菌数达到最大值8.15×109CFU/mL。这可能因为在低温条件下菌体失活,高温使其酶失活,从而影响其生长速度。综上,选择37 ℃为发酵乳杆菌SS-31 的最佳培养温度。
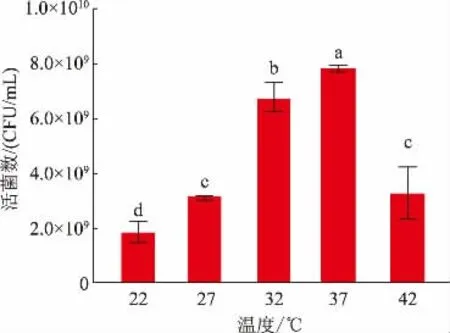
图6 温度对发酵乳杆菌SS-31 生长的影响Fig.6 Effects of temperature on the growth of L.fermentum SS-31
2.5.4 中和剂的选择分批培养菌体时,抑制菌体生长的主要原因是菌体自身代谢会产生较多的有机酸,大量有机酸的累积会形成酸抑制,从而使菌体生长较为缓慢。但是通过在发酵过程中加入中和剂调节pH,保持恒定pH 则可以解除酸抑制[27-28]。作者利用15 L 发酵罐探究了不同中和剂对L.fermentumSS-31 活菌数的影响,结果见图7。
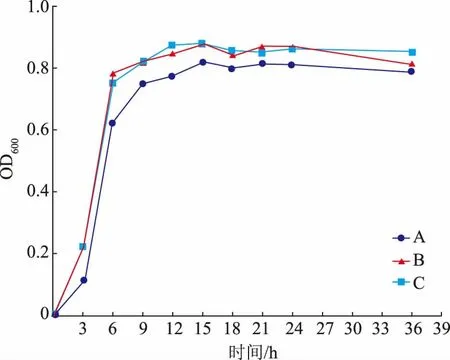
图7 中和剂对发酵乳杆菌SS-31 生长的影响Fig.7 Effects of neutralizer type on the growth of L.fermentum SS-31
如图7所示,与未添加中和剂组相比,当添加碳酸钠和氨水,使发酵液pH 恒定为6.8 后,L.fermentumSS-31 菌液OD600显著增加(P<0.05);但氨水和碳酸钠作为中和剂时,二者对L.fermentumSS-31 生长的影响无显著性差异 (P>0.05)。氨水作为中和剂时,既可以调节培养基内的pH,又可以为菌体生长提供氮源,用量比碳酸钠少,且氨水较为廉价,经济实惠。因此,选用氨水作为L.fermentumSS-31 高密度培养的中和剂,此时37 ℃培养24 h 后活菌数达到1.19×1010CFU/mL。
另外,孙媛媛对发酵乳杆菌FXJCJ6-1 最适生长pH 进行研究,结果显示在pH 恒定为6.0 并分批培养时,活菌数达到9.5×109CFU/mL,较初始MRS培养基中活菌数(1.7×109CFU/mL)提高了4.6 倍[27];李江等对发酵乳杆菌L1 高密度培养条件进行优化,结果显示通过流加中和剂NaOH,维持恒定pH,较分批培养时的活菌数(1.55×1010CFU/mL)显著提高18.52 倍[29];聂黔丽等采用单因素实验和正交实验对发酵乳杆菌LF-8001 进行高密度培养优化后,活菌数达到了1.08×1010CFU/mL,提高了5.32 倍[24]。作者对L.fermentumSS-31 进行培养基和培养条件优化后,活菌数达到1.19×1010CFU/mL,相比优化前活菌数(4.67×108CFU/mL)提高了25.48 倍,活菌数提升了两个数量级,高于目前大部分已报道的活菌数水平,说明效果良好。
3 结 语
实现乳酸菌高密度培养的核心是发酵培养基的优化,作者以活菌数为指标,通过对L.fermentiumSS-31 发酵培养基组成和发酵条件进行系统优化,最终确定最佳发酵培养基成分为:麦芽糖16.20 g/L、酵母浸粉20.16 g/L、磷酸氢二钾9.33 g/L、硫酸锰0.50 g/L、硫酸镁1.00 g/L、吐温80 1.00 g/L;最佳发酵条件为:接种体积分数3%、初始pH 6.8,期间添加氨水保持发酵液pH 稳定,在37 ℃下培养24 h后,活菌数可达到1.19×1010CFU/mL,是优化前4.67×108CFU/mL 的25.48 倍。发酵乳杆菌SS-31 菌体浓度显著提高,为今后大规模短期快速生产提供了技术支持。
