谷氨酸受体在帕金森病中的作用及其介导的帕金森病运动防治研究进展
2023-01-10李刚强周文辉
陈 平,李刚强,周文辉
(吉首大学 体育科学学院,湖南 吉首 416000)
帕金森病(Parkinson’s disease,PD)是世界上第二大常见的神经系统退行性疾病,影响1%~2%的65岁以上人群(Bove et al.,2020)。预计到2030年,全球约3%的65岁以上人群可能受到PD的影响(Li et al.,2021),PD病例数将超过1 200万人(MacMahon Copas et al.,2021)。PD在临床上以静止性震颤、动作迟缓及减少、肌张力增高、姿势不稳等为主要特征(陈平 等,2018,2020;刘晓莉 等,2018)。PD的这些主要运动症状是由中脑黑质致密部(substantia nigra pars compacta,SNpc)色素性多巴胺(dopamine,DA)能神经元变性丢失后,向基底神经节(basal ganglia,BG)的靶核团纹状体释放的DA大量减少所致的。在生理状态下,从SNpc投射到纹状体的DA能神经末梢释放的DA通过作用于DAI型受体和DAⅡ型受体,分别增加直接通路的功能活动和减少间接通路的功能活动。其净作用是抑制苍白球内侧部(globus pallidus internus,GPi)和黑质网状部(reticular part of substantia nigra,SNr)复合体(GPi/SNr)的电活动,进而使接受大脑底部BG投射的靶核团去抑制,从而易化运动的发生。对于PD患者,SNpc色素性DA能神经元选择性和进行性的丢失导致纹状体的DA传入降低,使得纹状体的γ-氨基丁酸(γ-aminobutyric acid,GABA)传入GPi/SNr复合体减少,并且纹状体GABA能传入苍白球外侧部的抑制活性降低。总的结果是维持运动的直接通路变为低兴奋状态,而抑制多余动作的间接通路过度兴奋,造成运动减少、僵直,并且难以维持进行的动作,最终导致运动迟缓、姿势不稳等PD相关行为功能障碍(刘晓莉 等,2020a,2020b)。尽管许多因素与PD风险增加有关,但PD的确切发病机制尚不明确。据报道,基因突变(Simon et al.,2020)、氧化应激(Li et al.,2020)、线粒体损伤(Rani et al.,2020)、神经营养因子缺乏(Bhardwaj et al.,2018)、免疫功能异常(Gorecki et al.,2021)、泛素-蛋白酶体系统失调(Kawahata et al.,2020)、铁蓄积(Bi et al.,2020)及自噬(Lu et al.,2020)等诸多因素均与PD风险增加及发生发展有关。迄今为止,临床上尚无有效的PD治愈手段,主要以药物和手术等方法控制病情的发展。DA替代疗法是PD治疗的基石,在疾病的早期阶段对症状的缓解具有积极的作用。但随着病情的加重其治疗效果逐渐降低,且容易使患者在疾病晚期出现运动并发症和精神异常等副作用,不能够阻止疾病的进展。手术疗法(如深部脑刺激)费用高昂,刺激参数设定及刺激靶点的选择不能因人而异,且只能针对有严重运动波动的PD患者,因而普及受限。因此,临床上亟需寻找能够有效缓解或防治PD的新药物与新手段。
近年来的研究表明,谷氨酸(glutamate,Glu)作为一种重要的中枢神经递质,在正常BG功能的破坏中发挥着核心作用(Li et al.,2021)。在PD患者或神经毒素诱导的PD模型动物中,黑质-纹状体DA的耗竭可引起皮质-纹状体Glu能通路的过度激活,突触前Glu的过度合成或释放和Glu再摄取的减少,导致突触间隙高浓度的Glu激活纹状体苍白球外侧部GABA能通路,进一步导致间接通路过度活跃(Wichmann et al.,2007)。因此,阻止皮层-纹状体通路突触前Glu的过度释放或抑制Glu功能效应的发挥,能够达到降低Glu能传导进而实现降低间接通路活性的目标。而这可以通过调节BG区Glu受体(glutamate receptor,GluR)的表达水平来实现(Vanle et al.,2018)。而运动疗法作为一种简单易行且无副作用的非药物辅助治疗手段,在PD的临床康复中已经得到了广泛的应用。流行病学调查以及临床研究结果表明,运动或体力活动可以降低PD发病风险,缓解PD相关行为功能障碍。动物实验结果表明,不同形式的运动干预可通过改变BG区GluR的表达水平介导PD相关运动功能障碍的改善。本文就GluR在PD中的作用及其介导的PD运动防治研究进行综述,以期为PD治疗药物的研发、病理生理机制的进一步探讨,为无创舒适的物理性疗法的改进和推广提供参考。
1 GluR
Glu作为中枢神经系统内一类重要的兴奋性神经递质,在记忆、学习和运动控制中发挥重要作用。而Glu发挥生物学效应是通过与其受体的结合来实现的。GluR分为含阳离子通道的离子型GluR(ionotropic glutamate receptors,iGluRs)和与G蛋白相偶联的代谢型GluR(metabotropic glutamate receptors,mGluRs)两大类。
iGluRs是一种含阳离子通道的跨膜配体门控型离子通道,其激活能够介导神经元膜电位去极化和快速兴奋性神经传递。iGlu受体包括N-甲基-d-天冬氨酸受体(N-methyl-D-aspartate receptors,NMDAR)、α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid,AMPA)受体和红藻氨酸(kainate,KA)受体,它们均具有相似的结构,但在氨基酸序列、亚基组合和激动剂的敏感性与选择性上有所不同。在拓扑学结构上,NMDAR形成异源四聚体离子通道蛋白,由7个亚基组成:GluN1、GluN2A、-B、-C 和-D,以及 GluN3A/B。GluN1是形成功能性NMDAR的必须亚基,GluN2A和GluN2B的组成决定离子通道的生物物理学特性。AMPA受体为突触后离子通道,是介导脊椎动物中枢神经系统中大多数快速兴奋性突触传递的主要iGluR。它们是阳离子选择性异构体,是由GluR1、-2、-3和-4亚基(或Glu-RA、-B、-C和-D)4个不同亚基组成的异四构体结构。KA受体也是配体门控通道,对阳离子具有通透性,由GluK1,-2,-3,-4,-5自由组合构成异源寡聚体(Olivero et al.,2020)。
mGluRs是G蛋白偶联受体超家族成员,是一种单肽类7次跨膜蛋白,在突触传递过程中起着重要的调节作用。基于信号转导途径、序列同源性以及受体药理学的不同,可将mGluRs分成3组8个亚型。I组mGluRs包括mGlu1和mGlu5,与Gq/11耦联并促进磷酸肌醇(inositide polyphospho,IP)水解。I组mGluRs在整个BG中高表达,并有突触前和突触后细胞定位(Masilamoni et al.,2018a)。Ⅱ组mGluRs包括mGlu2和mGlu3,主要定位于皮层-纹状体突触前末梢,以及SNpc DA能神经元和起源于丘脑底核的兴奋性终末(Spampinato et al.,2018)(图1A,图1B)。Ⅲ组mGluRs包括mGlu4、6、7和8,其与Gi/o相偶联,抑制环磷酸腺苷(cyclic adenosine monophosphate,cAMP)水平,能够抑制 Glu的释放(Dunn et al.,2019)。III组 mGluRs中,mGlu6局限于视网膜,而 mGluRs 4、7、8主要分布于BG的突触前。
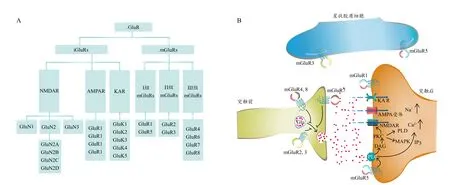
图1 GluR的分类(A)与分布(B)(Ambrosi et al.,2014)Figure 1.Classification(A)and Distribution(B)of GluR(Ambrosi et al.,2014)
2 PD中GluR的改变
在PD的病理生理过程中,BG特定位点的GluR存在调节性改变。
2.1 PD中iGluR的改变
研究表明,神经毒素6-羟基多巴胺(6-hydroxydopamine,6-OHDA)或 1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MTPT)诱导的黑质-纹状体系统损毁PD模型动物和左旋多巴(levodopa,L-DOPA)治疗的PD模型均会导致相应核团NMDAR复合物亚基组成的改变(Mellone et al.,2019)。例如,PD和左旋多巴诱导的异动症(levodopa-induced dyskinesia,LID)模型大鼠纹状体NMDAR的GluN2A/GluN2B亚基比率增高,且在PD患者和LID猴纹状体中得到证实(Mellone et al.,2015)。尽管NMDAR复合物亚基对DA耗竭的敏感性不同,但在6-OHDA单侧损毁的PD模型大鼠中,黑质-纹状体DA能通路被选择性毁损后,纹状体包含GluN2B或GluN2D的NMDAR表达水平显著下调,包含GluN2A的NMDAR表达水平不变(Sitzia et al.,2020)。另有研究表明,L-DOPA治疗的PD模型大鼠纹状体中GluN2D亚基表达水平显著上调(Mellone et al.,2019)。在PD模型动物和PD患者的组织中,纹状体和伏隔核中NMDAR敏感的Glu结合显著增加(Yeboah et al.,2018),这可能会加速神经退行性变的进程。此外,在单侧SNpc的6-OHDA毁损模型大鼠中,黑质-纹状体通路的变性增强了AMPA受体介导的吻内侧被盖核兴奋性传递,这与Glu释放增加和吻内侧被盖核中含GluR1亚单位的AMPA受体表达上调相关(Chang et al.,2019)。长期L-DOPA治疗的PD模型大鼠纹状体AMPA受体亚基p-ser845-GluA1的表达水平显著上调(Calabrese et al.,2020)。另有研究表明,与无运动并发症的PD患者相比,患有LID的晚期PD患者的外侧壳核AMPA受体表达水平显著上调(Duty,2012)。原代培养神经元parkin功能的丧失可导致GluK2蛋白在质膜中积累,增强KA受体电流并增加KA受体依赖性兴奋性毒性(Regoni et al.,2020)。
2.2 PD中mGluR的改变
近年来,关于mGluR及其亚单位在PD患者BG区表达水平变化的研究进一步阐明了其在PD生理病理状态下的作用。Yamasaki等(2016)对异常表达人α-synuclein基因的A53T转基因大鼠进行纵向正电子发射断层扫描(positron emission tomography,PET)成像研究发现,mGluR1在纹状体的表达随病理进展而动态变化。Farmer等(2020)对6-OHDA损毁PD模型小鼠研究发现,纹状体mGluR5蛋白的表达水平显著上调,而mGluR5的负向变构调节剂可改善PD模型小鼠的运动缺陷并促进神经恢复。Crabbé等(2018)利用[18F]-3-氟-5-[(吡啶-3-基)乙炔基]苯甲腈(FPEB)的PET和质子磁共振波谱法观察了PD模型大鼠脑内Glu和谷氨酰胺的变化,发现在双侧尾壳核、同侧运动皮层、体感皮层以及顶叶联合皮层,mGluR5的结合能力显著降低,在同侧尾壳核最为明显。Jia等(2017)研究表明,6-OHDA损伤PD模型大鼠纹状体mGluR2/3蛋白表达水平显著下调。Charvin等(2017)研究表明,MPTP诱导的PD模型猴纹状体mGluR4表达水平显著下调。此外,变构调节6-OHDA损毁模型大鼠黑质-纹状体mGluR4可减缓PD渐进性神经退变。
3 GluR与PD治疗
通过靶向GluR治疗PD可以从以下3个方面实现:1)改善PD运动症状;2)DA能药物抗PD效率的提高;3)黑质神经元的保护。
3.1 iGluRs与PD治疗
iGluRs广泛表达于BG区,直接介导纹状体、苍白球、丘脑底核、SNpc和SNr神经元的兴奋。而NMDAR是兴奋性iGluR家族的核心成员之一,一直是神经药理学领域的研究热点及药物靶点。研究表明,NMDAR拮抗剂可减轻DA受体拮抗剂在大鼠中引起的全身性僵直并抵抗PD强直,减缓单胺耗竭性啮齿动物的运动障碍和其他运动并发症(Melo-Thomas et al.,2018)。在艾芬地尔治疗的MPTP损伤绒猴模型中也显示出类似的效果。一些阈下剂量的NMDAR拮抗剂与L-DOPA和其他PD药物协同使用可增加抗PD效力,并可预防因长期L-DOPA治疗而诱发的LID(Bortolanza et al.,2016)。NMDAR在中枢神经系统中的分布和表达广泛,不具有特异性,因而在人体临床实验中,利用NMDAR拮抗剂因其会产生严重的认知功能障碍和拟精神病的副作用而受到限制(Dell’anno et al.,2013)。因此,筛选一系列NMDAR亚单位的选择性药物的研究越来越受到关注。NR2B被证实大量分布在纹状体和BG其他区域。研究表明,包含NR2B亚单位的NMDAR拮抗剂,可改善MPTP损毁的啮齿类动物和猴的PD症状,同时改善长期慢性L-DOPA治疗诱导的LID(Igarashi et al.,2015)。选择性GluN2B拮抗剂和A2A拮抗剂联合使用可以显著改善6-OHDA损伤的PD模型大鼠和MPTP损伤的PD模型猴的运动功能障碍(Michel et al.,2017)。
AMPA受体拮抗剂的抗PD作用已在不同的PD模型动物中进行了检验。一些研究表明,AMPA受体的选择性拮抗剂可以抑制单胺耗竭大鼠的肌肉僵硬,并显著改善MPTP损伤的老年恒河猴的运动缺陷。虽有动物模型研究指出,AMPA受体拮抗剂[6-硝基磺酰基苯并喹恶啉二酮和 1-(4-氨基苯基)-4-甲基-7,8-亚甲二氧基-5h-2,3-苯并二氮杂卓]单独应用时未显示出抗PD的活性(Slusher et al.,1995),但AMPA受体拮抗剂同L-DOPA协同使用可改善PD模型大鼠和猴运动功能障碍,表明AMPA受体拮抗剂可作为L-DOPA的佐剂,提高治疗效果(Löschmann et al.,1991;Megyeri et al.,2007)。
对于KA受体,尽管研究者已经知道该受体的存在,但缺乏选择性药物来帮助阐明这些条件下的复杂分子机制,其对PD病理的贡献以及在PD和PD-LID中作为治疗靶点的潜力有待探究。
3.2 mGluRs与PD治疗
mGluRs在BG区高表达且具有不同的调节作用,并被认为是纠正与神经退行性病变相关的GluR信号失调的有前景的治疗靶点。Crabbé等(2019)对mGluRs作为调节PD患者Glu高活性的靶点进行了大量研究,发现选择性mGlu1受体拮抗剂可使PD和PD-LID模型大鼠运动功能障碍得到部分改善,改变下游分子信号传导途径,并下调L-DOPA诱导的基因表达;然而,所需剂量会阻断L-DOPA的抗PD运动功能障碍作用,导致研究数据难以为使用mGlu1受体拮抗剂作为PD-LID的治疗方法提供支持。尽管使用mGlu5受体拮抗剂能够改善6-OHDA模型大鼠的运动功能障碍,但却没有观察到mGlu5受体拮抗剂治疗对氟哌啶醇诱导的肌肉强直的改善(Huang et al.,2018)。此外,mGlu5受体和腺苷A(2A)受体在纹状体D2神经元上共表达,并相互作用以调节mGlu5受体活性的下游效应(Masilamoni et al.,2018b)。
选择性III组mGluRs竞争性激动剂的临床前研究表明,其逆转了氟哌啶醇诱导的PD啮齿动物模型的运动不能和氟哌啶醇诱导的全身性僵直。同样,靶向mGlu4受体的正性变构调节剂(positive allosteric modulator,PAM)在PD动物模型中也显示出一定的抗PD活性。例如,N-苯基-7-(羟亚氨基)环丙酸[b]-色曼-1a-羧酰胺[N-Phenyl-7-(hydroxyimino)cyclopropa[b]chromen-1a-carboxamide,PHCCC]逆转了利培啶诱导的大鼠的运动障碍,并减少了MPTP处理的小鼠的纹状体DA神经元变性(Nuzzo et al.,2019)。然而,PHCCC的效价低、水溶性差,对mGlu1受体的拮抗作用与mGlu4受体的拮抗作用相似。因此,对mGlu4受体表现出更强效力和选择性的药物被用来阐明针对这种受体亚型的治疗潜力。其中,VU0155041在氟哌啶醇诱导的全身僵直和6-OHDA损伤大鼠中显示出抗帕金森活性(Vanle et al.,2018)。当与腺苷(2A)受体激动剂前体药物以及L-DOPA并用时,VU0155041也表现出协同作用,表明了L-DOPA潜在的保留机制。同样,5-甲基-N-(4-甲基嘧啶-2-基)-4-(1H-吡唑-4-基)噻唑-2-胺(ADX88178)是一种对mGlu4受体具有高生物利用度和特异性的PAM,具有抗PD活性,包括增强L-DOPA的作用而不增加LID(Le Poul et al.,2012)。使用PAM激活mGlu7受体,N,N'-二苯基乙烷-1,2-二胺二盐酸盐(AMN082)在PD的啮齿动物模型中也显示出抗PD病和抗运动功能障碍的活性。目前还没有针对mGlu8受体的合适的口服生物利用度药物和脑透性激动剂或PAMs。然而,脑室内注射mGlu8受体激动剂(S)-3,4-二羧基苯甘氨酸(DCPG)可以逆转PD大鼠的帕金森症状(Johnson et al.,2013)。但mGlu7和mGlu8缺乏高度的选择性和有效的配体,导致其使用受限。
Ⅱ组mGluR的选择性激动剂或正向变构调节剂通过降低突触前Glu释放参与PD的治疗。Wang等(2010)通过脑片全细胞记录技术研究发现,使用拮抗剂LY341495抑制丘脑底核-SNpc区mGlu2/3R增加了PD模型大鼠SNpc DA能神经元诱发的兴奋性突触后电流。Vernon等(2010)研究表明,mGlu2/3R激动剂 LY379268和(2R,4R)-4-氨基吡啶-2,4-二羧酸盐(2R,4R-APDC)可使6-OHDA损毁PD模型大鼠SNpc的DA能神经元阳性细胞数量以及纹状体DA能神经元阳性纤维终末含量丢失显著降低。Barbara等(2002)研究表明,选择性mGlu2和mGlu3受体激动剂可显著降低6-OHDA偏侧损毁PD模型大鼠皮层纹状体Glu传递。
4 运动与PD
4.1 运动与PD防治
运动是PD早期症状及临床的非药物疗法,具有非侵入性且无副作用,已被证实对多个器官系统有益。
4.1.1 运动防治PD的流行病学研究
早在20世纪末期,Sasco等(1992)就发表了关于PD发生与体育锻炼之间潜在相关性的长期纵向流行病学研究,研究发现,在大学期间进行规律体育锻炼与PD风险降低相关,提供了运动可能提供PD保护的科学证据。此后,几项大样本流行病学随访研究分析指出,中等至高强度体力活动的健康人群患PD的风险较低,表明成年早期体力活动可降低 PD风险(Crotty et al.,2020;Fang et al.,2018;Roos et al.,2018)。当然,这些研究不能排除 PD 易感人群体力活动较少的可能性。此外,一项低样本量研究发现体力活动与PD风险之间无相关性(Logroscino et al.,2006)。总之,大多数流行病学结果表明,成年早期体育锻炼可降低PD风险。
4.1.2 运动防治PD的临床研究
PD的主要运动症状包括运动迟缓、静止性震颤、肌强直、姿势步态障碍等。科学运动可在不同程度上改善各阶段PD患者的运动症状(Ellis et al.,2021)。
4.1.2.1 有氧运动与PD运动防治
不同项目的有氧运动在改善PD患者运动功能障碍方面均表现出积极效果。研究表明,中等强度功率自行车训练(30~60 min/次,1~2次/d,5 d/周,持续3~10周)可显著改善住院PD患者的步行参数(步态,步行距离,平衡,起立-行走计时)和临床症状(Segura et al.,2020);中等强度跑台训练(30~60 min/次,1次/d,2~5 d/周,持续4~10周)可显著改善轻、中、重度PD患者运动能力、平衡能力和步态冻结相关运动功能障碍,并显著提升其生活质量(Baizabal-carvallo et al.,2020);6个月中等强度乒乓球训练干预(6 h/次,1次/周)可使12名Hoehn&Yahr分级≤4期的PD患者的日常生活活动能力和运动症状显著改善(Inoue et al.,2021);研究表明,16周中等强度拳击训练(45 min/次,1次/d,4 d/周)可使PD患者运动能力和生活质量显著改善(Dawson et al.,2020);持续6个月的90 min快走运动(Mak et al.,2021)和持续8周的75 min越野走(Granziera et al.,2021)在改善轻中度PD患者的运动能力、步态表现、步行能力以及静态和动态平衡能力方面具有积极的效果;此外,探戈、华尔兹、桑巴舞等舞蹈运动(60~90 min/次,1次/d,2~5 d/周)也被认为是延缓PD运动功能障碍的一种有前景的疗法(Delabary et al.,2020;Krishnamurthi et al.,2020;Tillmann et al.,2020)。
4.1.2.2 身心运动与PD运动防治
身心运动已被证明是一种可行且可被PD患者广泛接受的辅助和替代疗法。太极拳、八段锦和五禽戏作为中国传统心身锻炼方法,在改善PD患者运动功能障碍方面均表现出积极的作用。研究表明,太极拳运动干预(30~60 min/次,1~2次/d,5 d/周,持续8~12周)可使轻、中度PD患者平衡能力、功能活动能力和运动能力显著改善(Zhu et al.,2020);八段锦气功运动(45 min/次,1次/d,4~5 d/周,持续6个月)可使轻、中度PD患者的步态表现、功能活动和睡眠质量显著改善,力量显著提高,跌倒次数显著降低(Xiao et al.,2016);五禽戏(30~60 min/次,1次/d,2~3 d/周,持续8~24周)可使轻、中度PD患者平衡能力、冻结步态显著改善,生活质量显著提高(韩文等,2021)。瑜伽是一种身心合一的运动,研究表明,瑜伽练习(45~60 min/次,1次/d,1~3 d/周,持续12~24周)可使轻中度PD患者平衡能力、跌倒自我效能水平和统一PD评分量表运动维度得分显著提高,并有利于减缓PD症状的发展(管细红 等,2017;Cherup et al.,2021)。
4.1.2.3 抗阻运动与PD运动防治
抗阻训练是一种力量锻炼计划,使用运动器械(如哑铃、杠铃、阻力器等)进行抗阻运动,使肌肉产生静态和动态收缩的结合,包括骨骼肌的缩短和延长。研究表明,渐进性抗阻训练或抗阻训练(60~90 min/次,1次/d,2~3 d/周,持续12周~24个月)可使早中期PD患者的肌肉力量、平衡能力、快速步行速度等显著提高,统一PD评分量表得分降低,冻结步态严重程度显著改善,对延缓PD病情进展和提升患者生活质量具有积极影响,可作为PD患者运动症状改善的辅助治疗手段(Barbalho et al.,2019)。但有研究表明,抗阻训练在改善PD患者平衡能力方面的作用不显著(Paul et al.,2014),这可能与平衡能力受视觉、前庭感觉、本体感觉、腿部和躯干肌肉力量、心理因素等多元影响有关(Canning et al.,2015;Schrag et al.,2017)。
综上,经常持续规律地参与不同类型的体力活动可显著改善PD相关运动功能障碍及日常活动表现和生活质量。目前,对于PD患者各阶段的最佳运动强度尚不明确,但较高强度的运动对运动症状的改善更为显著(Schenkman et al.,2018)。对于运动时间和频率,每日应进行>30 min的运动或组合运动(如有氧结合抗阻),至少2 d/周,持续4周以上。为了保持运动带来的长期效益,还需要持之以恒。
4.2 GluR介导的PD运动防治
尚且缺乏关于运动通过改变PD患者BG区GluR及其亚单位的表达水平来介导PD相关行为功能障碍改善的研究,而对PD模型动物的相关研究也还处于发展阶段。Chen等(2019)研究表明,4周中等强度跑台运动(11 m/min,30 min/d,5 d/周)干预可使6-OHDA单侧损毁PD模型大鼠纹状体mGluR3的mRNA和mGluR2/3蛋白表达水平显著上调,运动功能障碍显著改善,表现为在旷场中的总移动距离、总移动时间和平均移动速度均显著增加,爬杆实验的延迟时间显著降低,自主错步行为测试结果(如通过时间、前肢错步数、尾部滑落次数及潜伏期)显著改善。陈威等(2015)研究表明,4周中等强度跑台运动干预(11 m/min,30 min/d,5 d/周)可使PD模型大鼠纹状体AMPA受体亚基GluR2(对Ca2+不通透)及NMDAR1蛋白表达水平显著上调,mGluR1/5蛋白表达水平显著下调,阿扑吗啡诱导的旋转圈数显著降低,左侧前肢接触壁次数(圆桶试验)显著增加。Vanleeuwen等(2010)和Kintz等(2013)研究表明,4周大强度跑台运动干预使MPTP诱导的PD模型小鼠纹状体包含GluR2亚基的AMPARs mRNA和蛋白表达水平显著上调,GluR2丝氨酸880位点磷酸化程度显著增高,运动功能障碍显著改善。上述研究结果均表明,运动能够通过调节BG区GluR及其亚单位表达水平来介导PD相关行为功能改善。但是,GluR包括不同的类型,不同类型的GluR又是由不同亚单位组成,且均在PD神经可塑性中起着关键作用,如mGluR5正向变构调节剂或mGluR1/5拮抗剂可使神经毒素6-OHDA诱导的PD模型大鼠行为功能障碍显著改善,并抑制轴突变性(Zhang et al.,2021),mGluR4正向变构调节剂或mGluR4/7激动剂能够改善PD啮齿类模型动物肌肉僵直和运动不能等相关行为功能障碍,抑制纹状体苍白球突触传递过度激活,恢复BG运动回路平衡(Zhang et al.,2019)。因而,未来还需要就运动(包括不同运动类型、持续时间、强度和频率等)对PD相关脑区不同类型GluR及其不同亚单位的影响进行深入研究。
4.3 GluR介导PD运动防治的可能胞内分子机制
PD状态下,纹状体神经元细胞外Glu浓度显著升高(Kurt et al.,2018)。高浓度Glu持续激活突触后膜上的受体门控离子通道,使大量的Ca2+内流导致胞内Ca2+超载。而Ca2+又可以作为胞内第二信使,激活Ca2+依赖性蛋白酶,启动胞内一系列信号级联反应,导致细胞骨架蛋白的结构与功能改变,最终通过不同的方式导致神经元损伤。因而,降低突触前Glu释放水平或阻止Glu生物学效应的发挥是GluR介导PD运动防治的神经生物学机制之一。
4.3.1 运动通过GluR降低突触前Glu释放介导PD防治的胞内分子机制
在轴突中,Glu储存在突触囊泡中。在突触前膜充分去极化后,Glu通过电压门控Ca2+通道的突触Ca2+内流释放,从而导致突触Glu浓度显著升高。细胞外环境中Glu的过度积累会通过胱氨酸/Glu反向转运体(cystine/glutamate antiporter,System Xc-)抑制胱氨酸摄取,导致哺乳动物体内最主要的广谱抗氧化物细胞谷胱甘肽(Glutataione,GSH)的缺乏。Glu暴露后约6 h,线粒体复合体I增加。同时,12/15-脂氧合酶(12/15-lipoxygenase,12/15-LOX)被激活,12/15-LOX可直接损伤线粒体,使活性氧簇(reactive oxygen species,ROS)的产生呈指数上升。此外,12/15-LOX产生的12/15-羟二十碳四烯酸,可使鸟苷酸环化酶被激活,引起细胞内环单磷酸鸟苷(cyclic guanosinc monophosphate,cGMP)含量增加,随后cGMP打开L型电压依赖性钙通道,使Ca2+内流。Glu暴露约10~12 h后,ROS和细胞内Ca2+水平达到高峰,凋亡诱导因子(apoptosis-inducing factor,AIF)从线粒体转移到细胞核,诱导核凝固和神经元损伤(Wang et al.,2020)。研究表明,跑台训练可使PD模型大鼠纹状体mGluR3 mRNA和mGluR2/3蛋白表达水平显著上调(Shi et al.,2019)。mGluR2/3定位于皮层-纹状体突触前末梢,它们与Gi/o相偶联,激活或者上调mGluR2/3能够降低腺苷酸环化酶的功能活性,从而减少cAMP的生成,进而抑制蛋白激酶A/蛋白激酶C的活性(通过催化细胞膜Ca2+通道的磷酸化,促进Ca2+内流),最终使细胞膜Ca2+通道的磷酸化受到抑制,阻止胞外Ca2+内流,从而使神经元囊泡释放出的Glu水平降低。而胞外Glu浓度的降低,可阻止由于神经元胞外Glu浓度过高而导致的神经元损伤途径(图2A)。
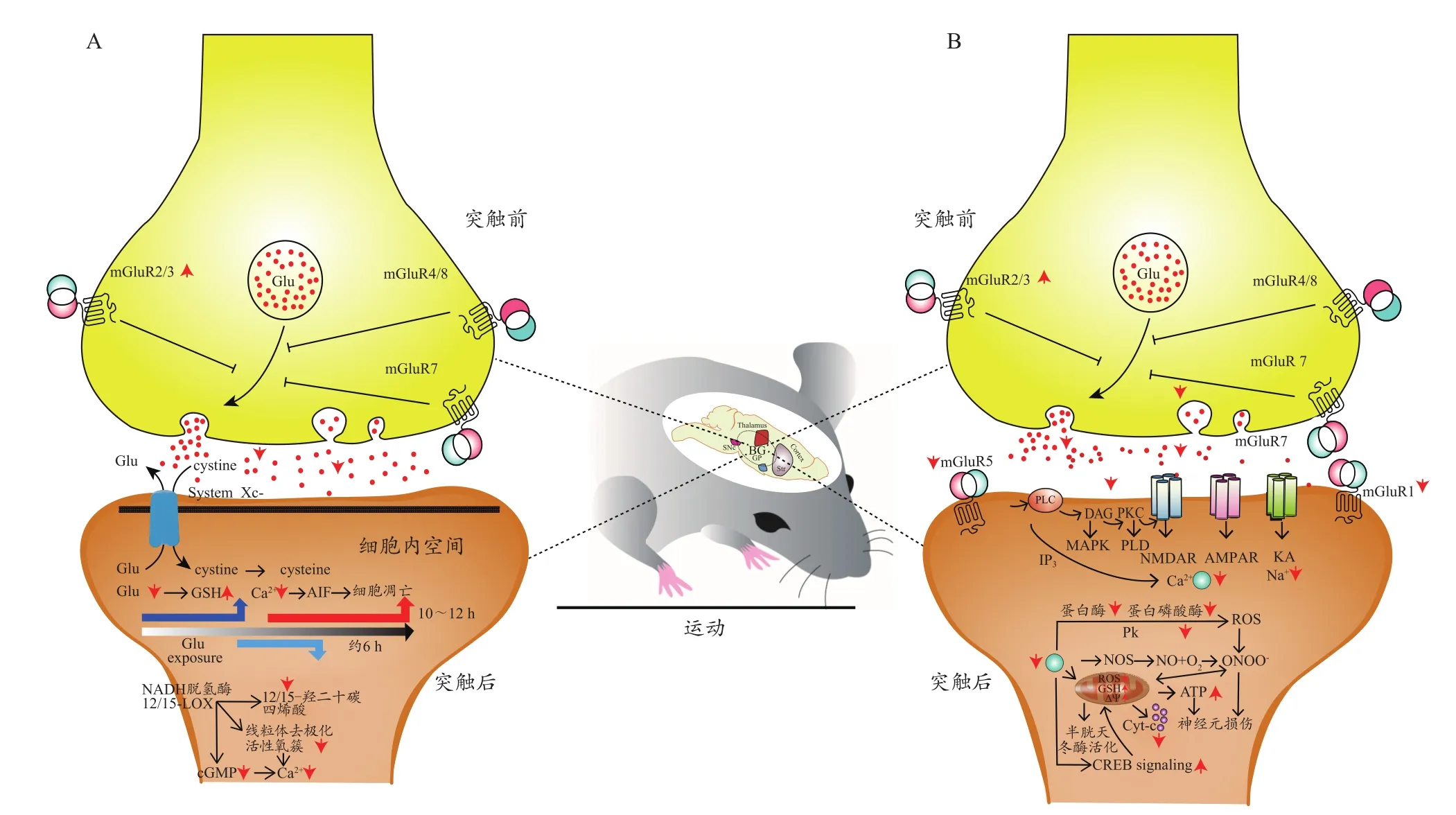
图2 GluR介导PD运动防治的可能胞内分子机制Figure 2.Possible Intracellular Molecular Mechanisms of Exercise Regulated GluR in Preventing and Treating PD
4.3.2 运动通过GluR降低Glu效应介导PD防治的胞内分子机制
Glu作为中枢神经系统中的主要兴奋性神经递质,主要通过与突触膜中的相应受体结合发挥生物学效应(Li et al.,2021)。Glu与AMPA受体和KA受体结合后,使其离子通道打开,导致突触后膜部分去极化,接着使NM-DAR通道开放,大量Ca2+内流。Ca2+内流增加一氧化氮合酶活性。通过这种酶,一氧化氮可与超氧自由基反应生成过氧化亚硝酸阴离子(speroxynitrite,ONOO-),从而对细胞内容物造成严重的氧化损伤。此外,线粒体受到氧化损伤,导致ATP耗竭和神经元损伤。NMDARs的过度激活还会导致cAMP应答元件结合蛋白(cAMP response element binding protein,CREB)信号降低,导致线粒体膜电位丢失和神经元损伤。并且,mGluR1/5分布于Glu能突触的突触后膜上,并位于突触后膜上的iGluRs的边缘,能够增强由iGluRs介导的神经元兴奋性。研究表明,中等强度跑台运动可使PD模型大鼠纹状体AMPA受体亚基GluR2(对Ca2+不通透)及NMDAR1蛋白表达水平显著上调,mGluR1/5蛋白表达水平显著下调(时凯旋,2017)。高强度跑台运动可使MTPT诱导的PD模型小鼠背侧纹状体GluR2 mRNA表达水平及其丝氨酸880位点磷酸化程度显著增高,包含GluR2亚基的AMPA受体蛋白表达水平显著上调(Anleeuwen et al.,2010;Kintz et al.,2013)。结合Glu发挥生物学效应的分子机制,运动对上述受体和亚基表达水平的改变能够阻止神经元细胞内Ca2+大量内流,从而使异常高水平胞内Ca2+激活催化酶(包括激酶、磷脂酶、一氧化氮合酶和蛋白酶等)、自由基(如超氧阴离子和ONOO-)的产生、CREB信号的降低以及线粒体氧化损伤等得到阻止(图2B)。
综上,运动干预一方面可能通过上调定位于皮层纹状体突触前末梢的Ⅱ组mGluRs和(或)Ⅲ组mGluRs的mRNA和蛋白表达水平降低PD纹状体神经元胞外Glu浓度;另一方面可能通过下调mGlu1/5和(或)上调GluR2和GluN1的mRNA和蛋白表达水平,降低Glu生物学效应的发挥,从而重建BG功能并最终改善PD相关行为功能障碍。
5 总结与展望
GluR及其亚单位在BG的表达水平随PD的进展而改变。在临床前PD模型中,NMDAR和AMPA受体拮抗剂在逆转PD相关运动症状和降低LID方面显示出有益作用。mGluRs的药理学调节具有微调神经传递的能力,表现出更多的PD治疗潜力。然而,在临床实践中,针对这些GluR的治疗却面临一些挑战,如认知和精神方面的副作用等。这可能与忽略了患者的疾病分期、缺乏精确复制发病机理的动物模型、药物剂量和结合位点的不确定性以及缺乏适当的临床试验方法等有关。未来仍需要进一步了解GluR在正常生理和病理生理条件下调节BG环路的精确作用,以及开发对某些亚型更具选择性的化合物,从而制定更合理的联合治疗方案。
运动作为一种简单易行且无副作用的非药物辅助治疗手段,在降低PD发病风险及缓解PD相关行为功能障碍方面具有积极的作用,这可能是运动通过调节BG不同类型GluR及其亚单位的表达水平来介导的。运动对PD相关脑区不同类型GluR及其不同亚单位的影响、对PD纹状体直接通路和间接通路不同类型GluR及其不同亚单位的影响差异,以及不同运动方式之间的对比和运动带来的长期影响有待进一步系统研究,这对阐释运动改善PD相关运动功能障碍的分子机制是极其重要的。
