八宝豆豉制曲过程中微生物多样性与蛋白酶活性的动态变化及其潜在相关性
2023-01-07张彦赠汤晓娟林祥娜纪艳青贺红军杨宏专刘云国
张彦赠,汤晓娟,林祥娜,纪艳青,贺红军,杨宏专,刘云国*
(1.临沂大学 生命科学学院,山东 临沂 276000;2.烟台大学 生命科学学院,山东 烟台 264005;3.临沂惟一斋酱园,山东 临沂 276000)
豆豉作为中国传统发酵豆制品之一,因其具有独特的风味和爽腻的口感,受到了众多人们的喜爱,被广泛用作调味品和开胃菜[1]。豆豉富含多种功能活性物质,具有抗氧化活性、抗糖尿病活性和降压活性等药用特性[2-3],成为了目前众多学者研究的热点。通常豆豉按照制曲阶段中主要发酵微生物的类型分为细菌型、毛霉型、曲霉型、根霉型豆豉,其中,细菌型豆豉是指在制曲过程中没有采用人工发酵菌种接种于煮熟后的大豆,而是以散落在室内空气中的微生物进行自然接种[4]。八宝豆豉就是细菌型豆豉的一种,是一种纯自发的、完全依靠本地特有的微生物进行发酵的产品。相传八宝豆豉起源于清朝,兴起于山东临沂,现已成为临沂当地一种地方特色食品,是当地人们必不可少的家常菜。简单来说八宝豆豉是集黑豆、茄子、鲜姜、花椒、紫苏叶、杏仁、白酒、香油八种原料为一体,制作时先将大豆进行初发酵,即所谓的制曲,同时将其他配料进行初步的加工和腌制,并按一定的配方,将这八种原料进行混合,在发酵缸中密封,进行露天发酵,即进入后发酵阶段,经过1年多的后发酵即可成熟。成熟的豆豉色泽亮丽,醇厚清香,食之开胃,去腻爽口。由于集齐八种原料进行发酵,故名八宝豆豉[5-6]。
就八宝豆豉制曲过程而言,利用当地特有的微生物在开放的曲房中对大豆初步分解,大豆中的营养物质如蛋白质、脂肪等进行初步降解,形成小分子物质,并产生各种酶类,为后发酵继续进行分解奠定基础,也是决定后发酵产生各种功能成分和风味优劣的关键[7]。因此,制曲过程极大的影响着八宝豆豉产品的质量。然而在这种开放制曲的环境中,各种复杂微生物都会参与该过程,包括有利于发酵的,不利于发酵的,甚至对人体有害的,且这种纯自发的方式,很容易受到来自气候条件、工人的生产经验、本地的微生物等条件影响[8],导致产品质量往往参差不齐,难以进行标准化、规范化、安全化生产,亟需改进传统工艺,筛选出益酵菌株,进行纯种发酵。因此,获得八宝豆豉制曲中的微生物群落演替信息具有重要的意义。李华等[9]采用传统培养方法对八宝豆豉中的优势菌进行分离和鉴定,结果显示优势菌全部为芽孢杆菌属(Bacillus)。然而传统培养法在全面揭示豆豉微生物信息上局限性比较大[10]。近几年,高通量测序技术被广泛应用于微生物菌群动态研究。如王娜等[11]利用高通量测序技术对贵州3种不同类型的细菌型豆豉进行研究,并鉴定出3类豆豉均以芽孢杆菌属为优势菌属;马上超等[12]同样利用高通量技术对5种淡豆豉的细菌群落结构及多样性进行研究,并鉴定出5种优势菌属。可见相较于传统培养,高通量测序技术研究微生物演替规律能够更加全面和成熟。然而,针对于八宝豆豉的有关微生物演替的研究却少有报道。
因此,本研究通过高通量测序技术对八宝豆豉制曲过程中的微生物群落演替规律进行研究,进而揭示制曲过程中的优势微生物。同时,由于制曲阶段微生物所产的蛋白酶对赋予豆豉良好口味和功能活性具有重要作用[13]。因此,对制曲期间的蛋白酶活性,包括酸性、中性、碱性蛋白酶活性进行动态测定,并通过皮尔森(Pearson)相关性分析探索与高产蛋白酶活相关的潜在优势菌属,旨在为探索符合制曲要求的优势菌属,以及筛选高产蛋白酶的菌种提供基础理论。
1 材料与方法
1.1 材料与试剂
豉曲:临沂市唯一斋酱园;E.Z.N.ATMMag-Bind Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit:上海索宝生物科技有限公司;Qubit3.0 DNA检测试剂盒:上海玉博生物科技有限公司;2×HieffRobust聚合酶链式反应(polymerase chain reaction,PCR)Master Mix、Hieff NGSTMDNA Selection Beads:上海翊圣生物科技有限公司;Folin试剂、磷酸二氢钠、三氯乙酸(均为分析纯):上海麦克林生化科技有限公司;无水碳酸钠、磷酸氢二钠(均为分析纯):天津市凯通化学试剂有限公司;干酪素、乳酸、硼砂(均为分析纯):天津市福晨化学试剂厂;酪氨酸(分析纯):天津市光复精细化工研究所;氢氧化钠(分析纯):天津市恒兴化学试剂制造有限公司;乳酸钠(分析纯):天津市鼎盛鑫有限公司。
1.2 仪器与设备
HWS-24电热恒温水浴锅:上海一恒科学仪器有限公司;Pico-21台式离心机:Thermo Fisher公司;GL-88B漩涡混合器:海门市其林贝尔仪器制造有限公司;TND03-H-H混匀型干式恒温器:深圳拓能达科技有限公司;DYY-6C电泳仪电源、DYCZ-21电泳槽:北京市六一仪器厂;FR-1000凝胶成像系统:上海复日科技有限公司;Q32866 Qubit3.0荧光计:Invitrogen;ETC 811 PCR仪:北京东胜创新生物科技有限公司。
1.3 方法
1.3.1 八宝豆豉曲的制作
由于豆豉的制作受季节的影响较大,需在每年的6~7月进行。制曲工艺流程[6]:
黑豆清洗→常压蒸煮→晾晒→曲房制曲→晾晒洗曲→豉曲
操作要点:
常压蒸煮:用清水进行常压蒸煮,料水比为1∶1(50 kg黑豆∶50 kg水),煮制黑豆八分熟,时间约30 min。
晾晒:将蒸煮完成的黑豆均匀摊晒在筛网上,在阳光下沥干水分。
曲房制曲:将晾晒好的黑豆均匀的分摊在曲池上,厚度约3 cm为宜,曲房温度控制在35~37 ℃,必要时进行加热升温或通风降温。发酵约5 d后,待黑豆上面布满密集的“黄毛”,即制曲完成。
晾晒洗曲:将发酵好的黑豆均匀摊晒在筛网上,在阳光下进行晾晒、翻动。待“黄毛”极易脱落,即晒至完成。后用筛网筛动黑豆、搓掉“黄毛”,用凉透的开水再洗去黑豆表面残余的“黄毛”,尽快捞出,晾晒干备用。即得豉曲。
1.3.2 八宝豆豉曲的取样
在曲房制曲中,从第一天进行取样,每隔24 h取一次样,直至制曲结束。每次取样时,分别取上、中、下位置,每个位置取3次,并充分混合,作为一个代表样本。共计5个样本,分别命名为D1、D2、D3、D4、D5,同时这些样本也代表了制曲阶段的5个不同时期。本实验所用的豉曲取自临沂市唯一斋酱园。
1.3.3 豉曲样品微生物菌群的高通量测序
基因组DNA的提取:称取3 g豆豉样品,加入液氮研磨至细粉,称取0.3 g细粉于样品管,在组织破碎仪中进行破碎,按照E.Z.N.ATMMag-Bind Soil DNA Kit提取试剂盒提取宏基因组DNA。采用2%琼脂糖凝胶电泳检测DNA完整性以及Qubit定量检测DNA样本浓度。
PCR扩增:以提取的基因组DNA为模板,选用正向引物341F(5'-CCTACGGGNGGCWGCAG-3)'和反向引物805R(5'-GACTACHVGGGTATCTAATCC-3)'对细菌16S rDNA的V3-V4区域基因序列进行PCR扩增。选用正向引物ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3)'和反向引物ITS2(5'-GCTGCGTTCTTCATCGATGC-3)'对真菌ITS1-ITS2区域基因序列进行PCR扩增。第一轮PCR扩增体系:2×HieffRobust PCR Master Mix 15 μL,正反向引物各1 μL,DNA模板25 ng,补双蒸水(ddH2O)至总体系30 μL;PCR扩增条件:94 ℃、3min;94 ℃、30 s,45℃、20 s,65 ℃、30 s,5个循环;94 ℃、20 s,55 ℃、20 s,72 ℃、30 s,20个循环;72 ℃、5 min。第二轮PCR扩增体系:2×HieffRobust PCR Master Mix 15 μL,正反向引物各1 μL,PCR扩增产物2 μL,补ddH2O至总体积30 μL;PCR扩增条件:95 ℃、3 min;94 ℃、20 s,55 ℃、20 s,72 ℃、30 s,5个循环;72 ℃、5 min。PCR扩增产物经2%琼脂糖凝胶电泳检测文库大小以及Qubit定量检测文库样本浓度。
高通量测序:将PCR扩增产物送至上海生工有限公司,采用Illumina MiseqTM平台进行二代测序。
1.3.4 蛋白酶活的测定
参照SB/T 10317—1999《蛋白酶活力测定法》[14]中的福林法测定蛋白酶活性。
1.3.5 数据处理
采用Illumina MiSeq PE300对高通量测序数据进行处理和分析,按照97%的相似性进行操作分类单元(operational taxonomic units,OTU)聚类分析、物种注释、Alpha多样性分析。细菌通过RDP数据库(http://rdp.cme.msu.edu/misc/resources.jsp)和GTDB数据库(https://gtdb.ecogenomic.org/)进行分类;真菌使用基本局部比对搜索工具(basic local alignment search tool,BLAST)比对UNITE(http://unite.ut.ee/index.php)数据库。采用R语言(V 4.0.0)绘制稀释曲线、香农指数曲线、主坐标和层级聚类图;采用Origin2021(v 9.8.0.200)绘制蛋白酶活变化曲线图;采用联川生物平台(https://www.omicstudio.cn/tool)绘制皮尔森相关性热图。
2 结果与分析
2.1 八宝豆豉制曲阶段微生物菌群高通量测序结果及Alpha多样性分析结果
为了解每个样本测序信息是否具有代表性,对样本的有效序列进行稀释曲线分析和香农曲线分析,结果见图1。
由图1可知,细菌和真菌菌群的稀释曲线和香农曲线都随着测序量的增大逐渐趋于平缓,细菌和真菌菌群的多样性也不会随着测序量的增加而变化[15-16],说明本次测序量合理,足够代表整个样本的微生物多样性信息,并可以进一步分析数据。对八宝豆豉制曲过程中5个不同时期的样品进行高通量测序后,按照97%以上的相似水平对所有序列进行OTU划分,并进行α-多样性分析,结果见表1。
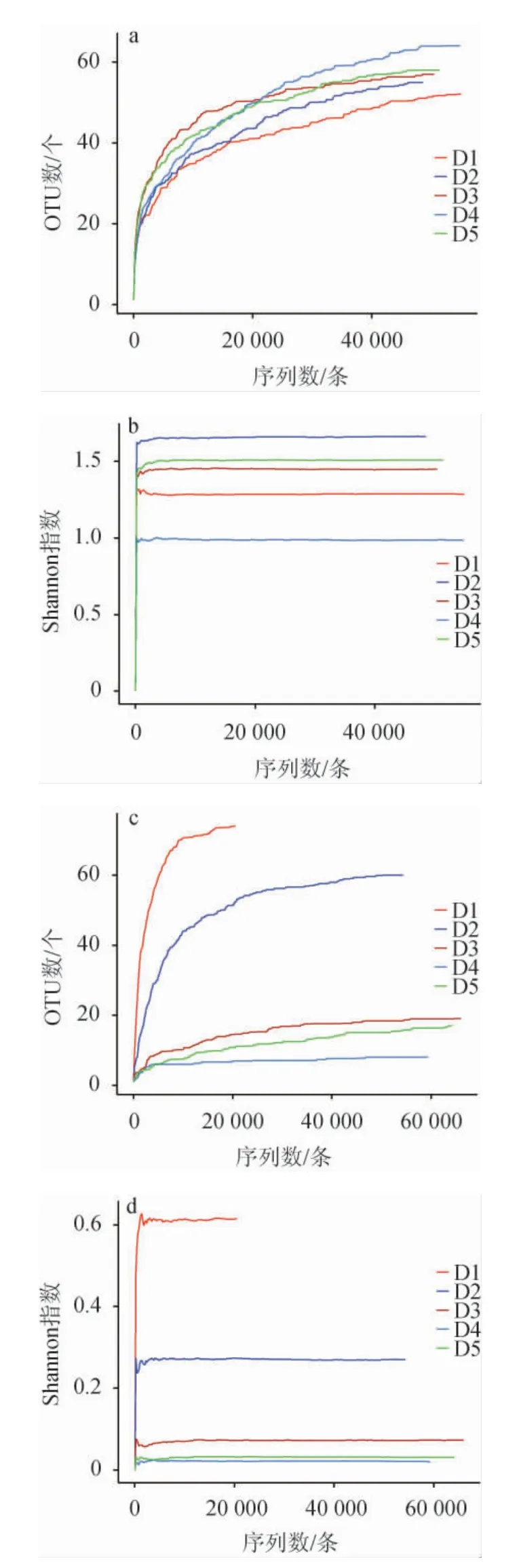
图1 八宝豆豉制曲阶段细菌及真菌菌群的稀释曲线(a、c)和香农曲线(b、d)Fig.1 Dilution curves (a,c) and Shannon curves (b,d) of bacterial and fungal flora during the koji-making process of Ba-bao Douchi
由表1可知,通过高通量测序共获得260 317条细菌、264 408条真菌序列,按照97%以上的相似水平对所有序列进行OTU划分,得到67个细菌OTUs和105个真菌OTUs。Chao1指数是用来衡量一个群落中物种丰度的指标,且与物种丰度变化呈正相关[17]。在整个制曲阶段,细菌菌群的Chao1指数以及OTUs整体呈现上升的趋势,并且整体变化较稳定。值得注意的是,在制曲第4天时,细菌群落达到最高的丰度,说明第4天的细菌菌群微生物丰度最高。而真菌菌群与细菌菌群相反,真菌菌群在第4天达到了最低的物种丰度。Shannon指数和Simpson指数是用来衡量群落多样性的指数,其中Shannon指数与群落多样性呈正比关系,而Simpson指数与群落多样性呈反比关系[18]。制曲期间,细菌菌群的Shannon指数远高于真菌菌群,说明在制曲阶段,细菌菌群的多样性高于真菌菌群的多样性[19]。同时值得注意的是,在制曲第4天,细菌和真菌菌群的多样性最低。总的来说,在整个制曲过程中,细菌和真菌菌群的丰度和多样性均发生了明显的变化。推测这可能是因为环境如发酵酸度及营养条件如水分等因素发生变化,以及某些微生物,与其自身及其他微生物存在一定的竞争作用等[20-21]。
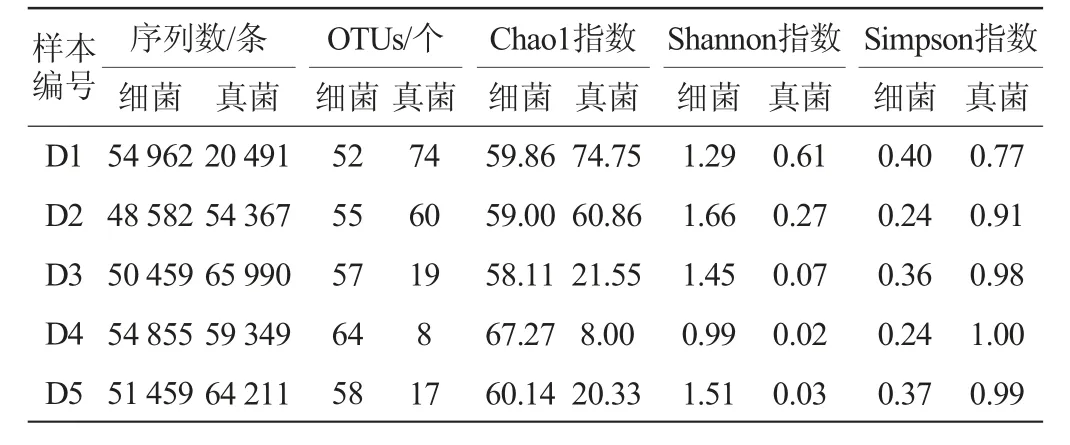
表1 八宝豆豉制曲阶段样品的高通量测序结果及Alpha多样性分析结果Table 1 Result of high-throughput sequencing and Alpha diversity analysis of Ba-bao Douchi samples during the koji-making process
2.2 基于属水平八宝豆豉制曲阶段微生物菌群结构分析
制曲阶段,豆豉样本中的微生物菌群在属水平上共注释到45个细菌属和83个真菌属,其中6个菌属被确定为优势细菌属(相对丰度>1%),3个菌属被确定为优势真菌属(相对丰度>1%)[22],结果见图2。
由图2可知,在制曲阶段,优势细菌属为芽孢杆菌属(Bacillus)、亚硝化单胞菌属(Streptophyta)、柠檬酸杆菌属(Citrobacter)、假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、葡萄球菌属(Staphylococcus),其中以芽孢杆菌属(Bacillus)为主,平均相对丰度为57.22%。芽孢杆菌可产生大量的酶,如蛋白酶、淀粉酶,可以加速豆豉的发酵过程,并提供其他细菌所需的物质[23],因此,芽孢杆菌属在制曲阶段对物质的分解和产酶方面具有关键的作用。另外其他优势细菌属的相对丰度也有明显的变化,如Streptophyta和Acinetobacter的相对丰度呈逐渐减少的趋势,推测可能是由于这两类菌属对制曲环境适应较弱的原因。Pseudomonas则整体呈现增加的趋势,至发酵结束时相对丰度达11.38%,该菌属也是以往对豆豉的研究中较为常见的菌属[24]。据报道,大部分Pseudomonas能产生更多种类的蛋白酶、脂肪酶和卵磷脂酶[25],因此,其对于豆豉品质的形成发挥着重要作用。
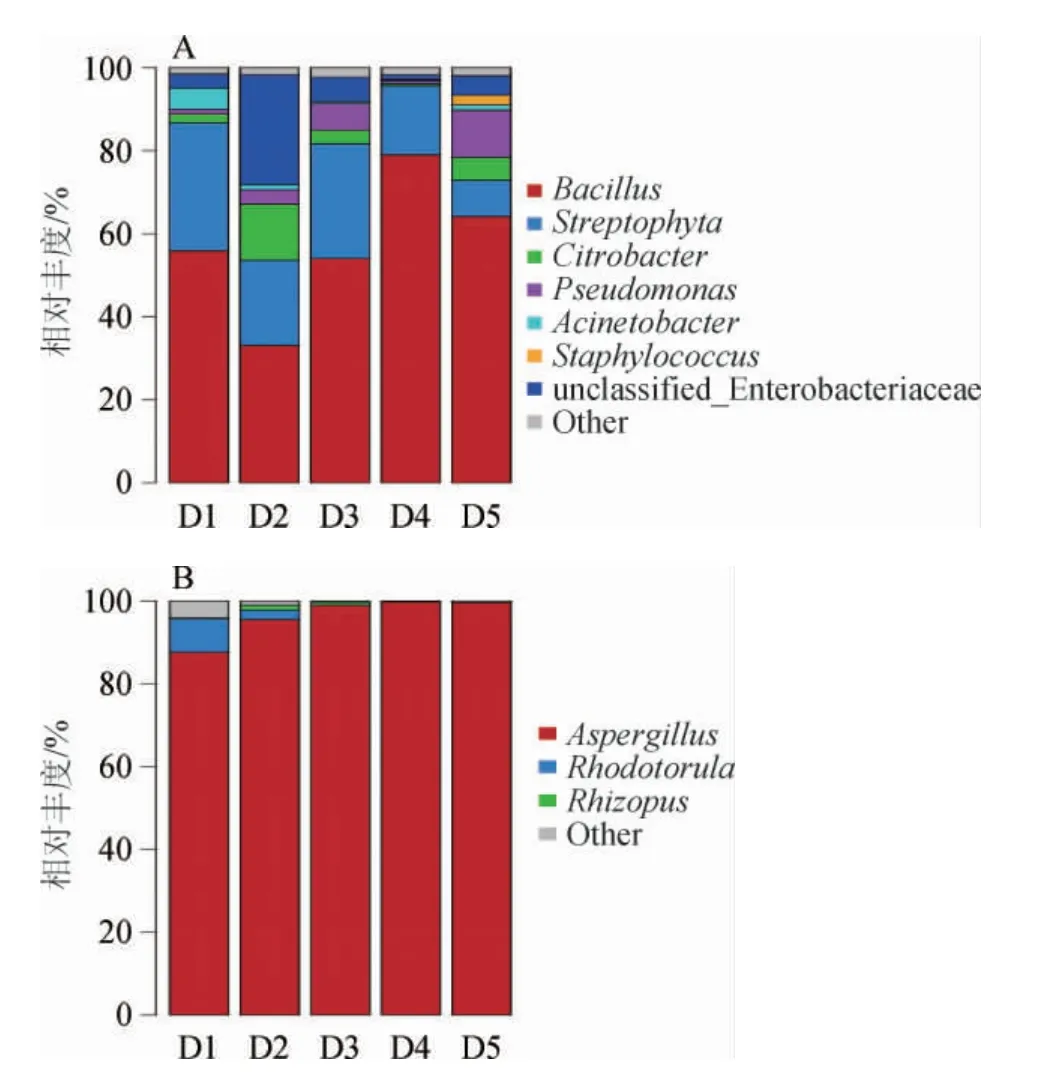
图2 基于属水平八宝豆豉制曲阶段细菌(A)和真菌(B)群落组成Fig.2 Community composition of bacteria (A) and fungi (B) during the koji-making process of Ba-bao Douchi based on genus level
由图2亦可知,在真菌微生物菌群组成中,菌属较为单一,优势真菌属包括曲霉属(Aspergillus)、红酵母属(Rhodotorula)、根霉属(Rhizopus),其中Aspergillus以绝对的优势占据了整个发酵过程,制曲结束时,相对丰度达到99.66%,说明该菌属是制曲阶段真菌微生物的主要优势菌属,同时推测八宝豆豉在制曲时黑豆上逐渐布满“黄毛”,这种“黄毛”的出现可能与该菌属存在密切的关系。据研究报道,真菌微生物,尤其是曲霉属,是蛋白酶的最重要来源,具有比较高的产蛋白酶活的能力,是导致发酵食品中蛋白质发生降解的主要因素[26]。
2.3 八宝豆豉制曲阶段微生物菌群结构差异分析
基于属水平,采用主坐标分析和层级聚类分析对八宝豆豉制曲过程中微生物群落结构的差异进行分析,结果见图3。
由图3a和3b可知,细菌菌群的PCoA1(52.08%)和PCoA2(27.08%)累计贡献率达79.16%,真菌菌群的PCoA1(94.8%)和PCoA2(5.12%)累计贡献率达99.92%,说明都可以较好的代表不同样本的微生物群落结构差异。细菌群落的主坐标分析中,样品D1和D3较为接近,样品D4与D5较为接近,D2样本则距离其他样本较远。而真菌群落的主坐标分析中,样品D1、D2、D3均距离彼此较远,分散于不同象限中,只有样品D4和D5位于同一象限,距离较为接近,说明这两个时期菌落结构较为相似。
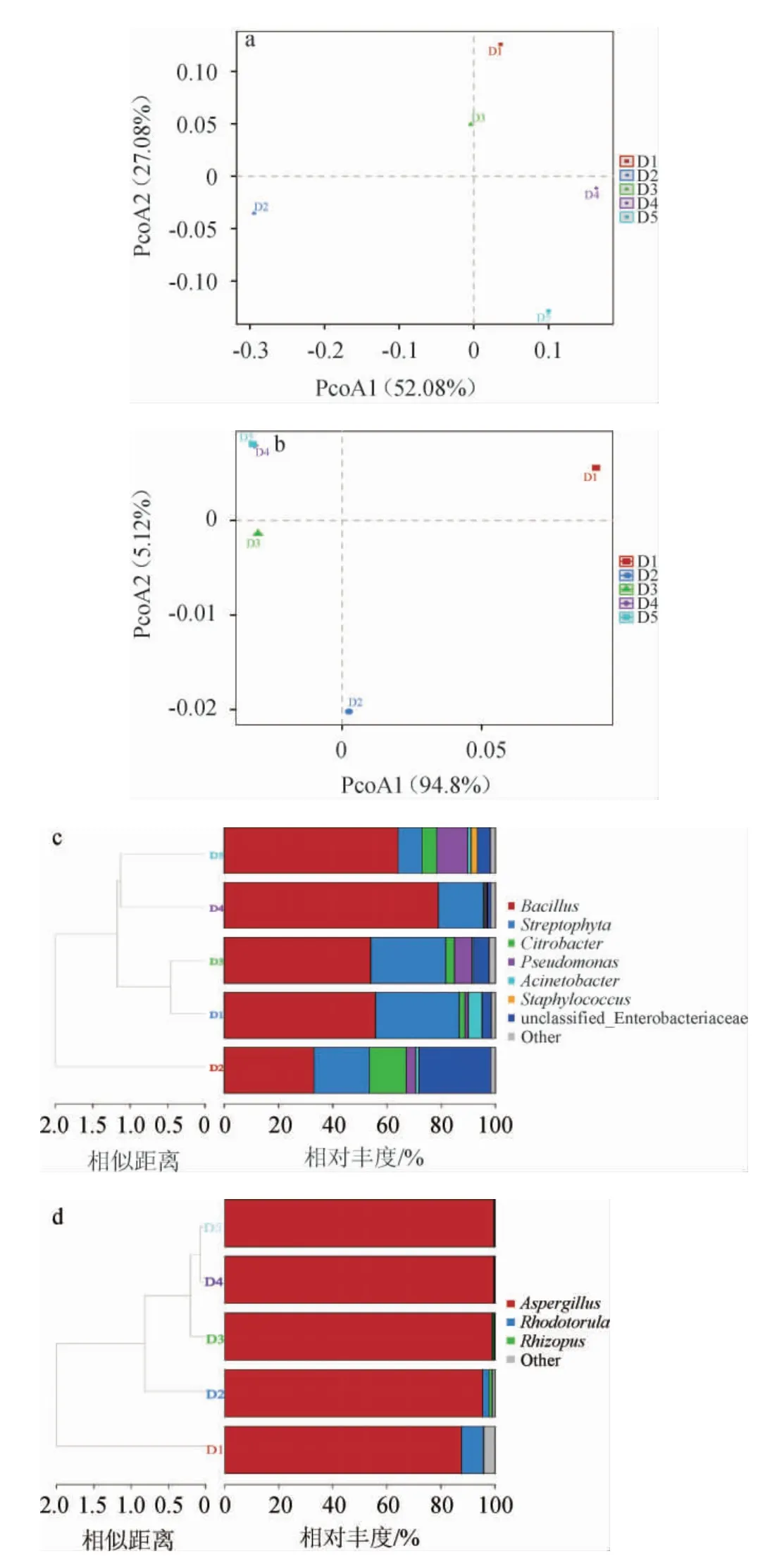
图3 八宝豆豉制曲阶段细菌及真菌菌群的主坐标分析(a、b)和层级聚类分析(c、d)结果Fig.3 Result of principal coordinate analysis (a,b) and hierarchical cluster analysis (c,d) of bacterial and fungal flora during the koji-making process of Ba-bao Douchi
由图3c可知,5个时期的样本被聚类成3个阶段,分别为D1和D3、D2、D4和D5,与主坐标分析一致。由图3d可知,样品D1、D2、D3均处于不同的分支,样品D4与D5处于同一分支,说明随着发酵的进行,每个时期的样本逐渐的发生变化,并在D4~D5时期趋向于稳定,这也与主坐标分析结果一致。
总体来说,随着制曲时间的变化,八宝豆豉的微生物菌群结构发生了明显的变化,尤其在前三个时期(D1、D2、D3)菌群结构变化差异明显,在后两个时期(D4和D5),菌群结构趋于稳定。
2.4 八宝豆豉制曲阶段蛋白酶活力动态变化
八宝豆豉制曲过程中,蛋白酶活力的变化趋势见图4。
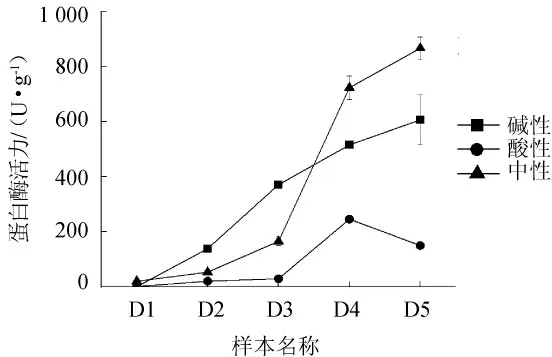
图4 八宝豆豉制曲阶段3种蛋白酶活力的变化Fig.4 Change of three kinds of proteases activity during the koji-making process of Ba-bao Douchi
由图4可知,在制曲过程中,中性蛋白酶在初期增长较缓慢,而后期增长较快,并在发酵5 d时达到最高,为(867.05)U/g。碱性蛋白酶在整个制曲过程中呈增长的趋势,并在发酵5 d时达到最高,为(606.46)U/g。而酸性蛋白酶活力则在前期增长较缓慢,在发酵3~4 d时快速增加,而后出现降低的趋势,推测出现降低的原因可能是由于后期产酸性蛋白酶的微生物不再适宜生长。总体来说,整个制曲阶段,碱性和中性蛋白酶是制曲阶段的主要酶,说明豉曲微生物主要以产中性和碱性蛋白酶的微生物为主。索化夷等[27]研究发现,永川豆豉制曲阶段的主要蛋白酶为中性和碱性蛋白酶,且永川豆豉也采用的是自然开放式制曲的方式,不同的是永川豆豉八宝豆豉的制曲工艺存在较大差异;代丽娇等[28]采用人工接种方式,将枯草芽孢杆菌和黑曲霉接种于蒸煮后的大豆进行制曲,结果发现,制曲过程中以中性蛋白酶活为主,且远高于酸性蛋白酶活。
据研究报道,蛋白酶活的种类会对豆豉的品质有重要影响,若豆豉中性蛋白酶活力高,则得到的豉曲更易被后期微生物进行降解,产生的风味和口感较好;若以碱性和酸性为主,则生产出的豆豉偏苦和偏酸[29]。因此,若生产出豆豉出现偏苦的口感时,极有可能是与碱性蛋白酶分泌旺盛有关。
2.5 八宝豆豉优势微生物属与蛋白酶活相关性分析
在利用高通量技术确定制曲阶段优势微生物属的基础上,结合蛋白酶活变化,利用皮尔森相关性分析建立了优势微生物属与蛋白酶活的关系[30-31],旨在探索与高产蛋白酶相关的菌属,结果见图5。
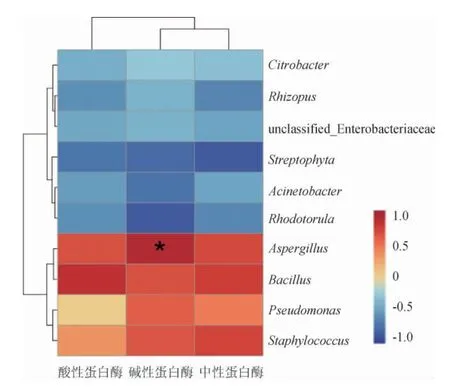
图5 八宝豆豉制曲阶段优势微生物属与蛋白酶活的皮尔森相关性分析热图Fig.5 Heat map of Pearson correlation analysis of dominant microbial genera and protease activity during the koji-making process of Ba-bao Douchi
由图5可知,中性蛋白酶活力主要与Bacillus、Aspergillus以及Staphylococcus呈现较强的正相关,说明在产中性蛋白酶活方面,这3种菌属可能具有一定的贡献。酸性蛋白酶主要与Bacillus和Aspergillus呈现正相关关系,尤其是Bacillus,作为环境中较常见的细菌属[32],该菌属可能在产酸性蛋白酶上具有一定的贡献。碱性蛋白酶与Aspergillus呈现较为显著的正相关(P<0.05),因此,推测该菌属可能在产碱性蛋白酶活方面要优于其他菌属。整体来说,3种蛋白酶活主要与4种菌属表现出正相关关系,分别是Bacillus、Aspergillus、Staphylococcus以及Pseudomonas,因此,推测这4种菌属可能在蛋白酶活的产生上有重要作用。另外其他菌属在制曲阶段中呈现出与3种蛋白酶活负相关的趋势,说明这些优势菌属可能在产蛋白酶活方面贡献较小,甚至是无关菌属。当然,上述所提到与蛋白酶活性有关的菌属是否具有确切的作用,仍然需要进一步的验证。
3 结论
本研究通过高通量测序技术研究了八宝豆豉制曲过程中的微生物菌群多样性,结果显示,制曲期间细菌菌群的多样性高于真菌菌群多样性,并且随着制曲的进行,微生物群落结构发生了较大的变化,发酵使得微生物演替较为剧烈。直到制曲阶段后期(D4~D5)达到平稳。在制曲阶段,共确定出9种优势微生物属(相对丰度>1%),包括6种细菌属,3种真菌属,其中Bacillus和Aspergillus是占主导地位的优势微生物属。蛋白酶活分析结果显示,在制曲阶段中,碱性和中性蛋白酶活均呈增加趋势,且在制曲结束时达到最高活力,为制曲阶段的主要蛋白酶活。优势微生物属与蛋白酶活的皮尔森相关性分析结果显示,Bacillus、Aspergillus、Staphylococcus以及Pseudomonas这4种优势菌属与蛋白酶活性呈现正相关,而其他优势微生物均与蛋白酶活的产生呈负相关关系。本研究为进一步筛选高产蛋白酶菌株以及揭示制曲阶段发酵机理提供了基础的理论,也为后期开发优良微生物资源、提高豆豉质量和食用安全性提供了一定的指导。
