一株耐盐产香鲁氏接合酵母FA-1的鉴定及其在酱油酿造中的应用
2023-01-07续丹丹王文平杨春晖
续丹丹,王文平,张 欣,高 航,张 建,杨春晖,鞠 岩
(北京食品科学研究院,北京 100068)
酱油起源于中国,传统酿造酱油有着两千多年的悠久发展历史,是我国劳动人民的智慧结晶[1]。酱油是由大豆或脱脂大豆等蛋白质原料、面粉或麸皮等淀粉原料与食盐、水等经众多微生物的长期发酵作用酿制而成[2]。这些微生物能够产生蛋白酶、淀粉酶等不同的酶类,催化发酵过程中原料的降解与特征化合物的形成,赋予酱油独特的风味和营养[3]。其中,以酱油制曲阶段的米曲霉和酱醪发酵阶段的耐盐性乳酸菌和耐盐性酵母菌为酿造过程中的关键微生物[4-6]。
鲁氏接合酵母(Zygosaccharomyces rouxii)是一种具有较强耐盐性的增香酵母,在酱油发酵过程中可以代谢产生多种醇类、酸类和酯类化合物,是酱油酿造过程中的核心微生物[2-3]。研究表明,鲁氏接合酵母可以提升乙醇、苯乙醇、2-甲基-1-丙醇等醇类物质以及4-乙基愈创木酚和多种醛酮类化合物的含量[7-9]。MENG Q等[10]研究发现,接种鲁氏接合酵母强化发酵日式酱油,酱油中某些特殊香味物质的含量要高于接种易变假丝酵母(Candida versatilis)。张倩等[11]从郫县豆瓣中分离筛选一株鲁氏接合酵母HJ-7Y.1,该菌株在高盐浓度下仍具有较好的产醇性能,且能代谢产生苯乙醇、乙酸乙酯、3-甲基丁醇和乙酸苯乙酯等多种香气成分。彭东等[12]从高盐稀态酱醪中分离筛选出一株耐盐生香酵母CS2.42,经鉴定为鲁氏接合酵母,添加该酵母发酵的酱油中酯类、醇类、醛类及酚类等挥发性风味物质含量均有提升。除了增香方面的研究,前期研究还较多集中在鲁氏接合酵母的基因和耐盐机制等[13-14],借助其耐盐特性,将一些关键的水解酶,例如蛋白酶、肽酶和谷氨酰胺酶等在鲁氏接合酵母上表达,以期在酱油发酵过程中产生充分的水解作用,提高酱油品质[15]。
本研究拟对酱油醪液中筛选的具有耐盐产香性能的酵母菌株进行形态观察、生理生化和分子生物学鉴定,分析其生长特性及耐受性,并将其应用于酱油酿造。采用顶空固相微萃取-气质联用(headspace solid phase microextraction coupled with gas chromatography-mass spectrometry,HS-SPME-GC-MS)技术分别检测其在不同NaCl浓度的酱油发酵液及酱油成品中的挥发性香气成分,探究菌株的产香性能,以期丰富功能酵母的菌种资源,提高酱油风味及品质,对酱油产业发展具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
菌株FA-1:北京市食品酿造研究所有限责任公司,自高盐稀态酱油醪液中分离筛选、保藏。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:葡萄糖20 g,酵母粉10 g,蛋白胨20 g,琼脂20 g,加蒸馏水补至1 000 mL。121 ℃灭菌15 min。
酱油发酵培养基(NaCl终含量为11%):生酱油(NaCl含量为18%)100 mL,NaCl 92 g,MgS O4·7H2O 0.5 g,酵母粉1g,CaCl20.075g,葡萄糖50g,KH2PO41g,加水补至1 000mL。121 ℃灭菌15 min。
酱油高盐培养基:在酱油发酵培养基的基础上调整NaCl含量分别为12%、15%、18%、20%、22%。
无碳源基础培养基:(NH4)2SO42 g,NaCl 1 g,KH2PO40.5 g,K2HPO40.5 g,MgSO4·7H2O 0.2 g,琼脂20 g,加蒸馏水补至1 000 mL。121 ℃灭菌15 min。
麦芽汁培养基:麦芽汁150 mL,琼脂3 g。121 ℃灭菌30 min。
1.1.3 试剂
DNeasy Plant Mini Kit试剂盒:德国QIAGEN公司;引物NL1和NL2:赛默飞世尔科技(中国)有限公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)MasterMix(含染料)、RNase-free水:天根生化科技(北京)有限公司;DL 20009(plus 100)、DL 500脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:宝生物工程(大连)有限公司;酵母粉、蛋白胨(均为生化试剂):英国Oxoid公司;琼脂(生化试剂):北京博奥拓达科技有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
Ecotron振荡培养箱:瑞士INFORS公司;LHS-250SC恒温恒湿生物培养箱:上海一恒科学仪器有限公司;Eppendorf 5417R冷冻离心机:艾本德(中国)有限公司;DYY-6C电泳仪:北京六一生物科技有限公司;T100梯度PCR仪:伯乐生命医学产品(上海)有限公司;UV-2802PC分光光度计:尤尼柯(上海)仪器有限公司;顶空固相微萃取装置DVB/CAR/PDMS萃取器:美国Supelco公司;7890A-5975C气相色谱-质谱联用(GC-MS)仪:美国Agilent公司。
1.3 方法
1.3.1 产香酵母的分离筛选
取10 g酱油发酵醪液至三角瓶中,加入90 mL无菌生理盐水,30 ℃、120 r/min振荡洗脱30 min,将洗脱得到的原液梯度稀释至10-1~10-6,吸取各梯度稀释液100 μL均匀涂布于含10%NaCl的YEPD固体培养基上,每个梯度3个平行,30 ℃静置培养48 h。挑取具有典型酵母菌菌落特征的单菌落进行反复划线分纯。纯化后菌株分别接种于麦芽汁培养基,30 ℃、120 r/min振荡培养48 h后进行嗅闻试验[16],得到一株产生浓郁酱香味的菌株,命名为FA-1。
1.3.2 菌株FA-1的鉴定
(1)菌株细胞显微形态观察
将活化后的菌株FA-1接种于酱油发酵固体培养基中,30 ℃恒温培养24 h,观察记录培养基上菌落的形态、质地、厚薄程度等特征。用接种环挑取典型菌落进行镜检,观察菌体形态。
(2)生理生化试验
参照《酵母菌的特征与鉴定手册》[17],测试菌株FA-1对碳源的发酵或同化能力。
(3)分子生物学鉴定
使用酵母基因组DNA提取试剂盒提取目的菌株的基因组DNA并采用通用引物NL1和NL2 对26S rDNA的D1/D2区进行特异性扩增。PCR扩增体系(50 μL):DNA模板2 μL、正反引物(10 μmol/L)2 μL、PremixSTAR HS(Takara)25 μL,无菌纯水补齐到50 μL。PCR扩增程序:98 ℃预变性3 min,98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸60 s,35个循环,72 ℃延伸10 min。取5 μL PCR反应产物在1%琼脂糖凝胶上进行电泳,凝胶成像系统观察结果并成像。PCR产物委托赛默飞世尔科技公司进行测序。将测序结果登录美国国家生物技术信息中心(national center of biotechnology information,NCBI)网站用GenBank数据库基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,选取同源性高的模式菌株序列,使用MEGA 5.0软件邻位连接法(neighbor-joining,NJ)构建系统发育树,进行1 000次的相似度重复计算,确定其系统发育学地位。
1.3.3 菌株FA-1耐受性及生长特性分析
(1)温度耐受性
将活化后的菌株FA-1按1%的接种量接种于酱油发酵培养基中,然后分别置于28 ℃、30 ℃、32 ℃、34 ℃、36 ℃、38 ℃、40 ℃和42 ℃条件下120 r/min振荡培养24 h,于600 nm波长处测定吸光度值(OD600nm值),考察菌株FA-1的温度耐受性。
(2)pH值耐受性
将活化后的菌株FA-1按1%的接种量接种于pH值分别为3.5、4.0、4.5、5.0、5.5和6.0的酱油发酵培养基中120 r/min、30 ℃振荡培养24 h,于600 nm波长处测定吸光度值,考察菌株FA-1的pH值耐受性。
(3)耐盐性
将活化后的菌株FA-1按1%的接种量接种于NaCl质量分数分别为12%、15%、18%、20%和22%的酱油高盐培养基中30 ℃静置培养48 h,于600 nm波长处测定吸光度值,考察菌株FA-1的耐盐性。
(4)生长曲线绘制
将活化后的菌株FA-1按1%的接种量接种于酱油发酵培养基中,30 ℃、120 r/min振荡培养48 h,每隔6 h于600 nm波长处测定吸光度值,绘制菌株FA-1的生长曲线。
1.3.4 不同NaCl浓度的酱油发酵液的制备及其挥发性风味物质分析
不同NaCl浓度的酱油发酵液的制备:将活化后的菌株FA-1在NaCl浓度分别为12%、15%、18%、20%和22%的酱油高盐培养基中30 ℃静置培养48 h,得到不同NaCl浓度的酱油发酵液。
取酱油发酵液10 mL,采用顶空固相微萃取-气相色谱质谱联用(HS-SPME-GC-MS)技术对其中的挥发性香气成分进行测定,以未添加酵母菌的酱油发酵培养基为空白对照。
样品预处理:吸取2 mL酱油至20 mL的萃取瓶中,加入0.5 g氯化钠调节离子强度,吸取100 μg/mL内标物3-辛醇溶液10 μL。在50 ℃条件下振荡40 min,萃取40 min后于气相色谱仪进样口解吸5 min,进行GC-MS分析。
气相色谱(GC)条件:HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm),载气为高纯度氦气(He),流速1 mL/min,采用不分流模式进样;进样口温度250 ℃。程序升温:40 ℃保持3 min,以5 ℃/min的速度升至100 ℃,然后以6 ℃/min的速度升至220 ℃并保持10 min。
质谱(MS)条件:电子离子(electronic ionization,EI)源,电子能量70 eV,离子源温度230 ℃,四级杆温度150 ℃,扫描模式为全扫描,扫描范围35~400 amu。
定性定量方法:化合物定性分析以美国国家标准技术研究所(national institute of standards and technology,NIST)08谱库检索结果进行确定,采用内标法(质量浓度为100μg/mL的3-辛醇溶液10 μL)计算各组分的含量。
1.3.5 菌株FA-1在酱油酿造中的应用
采用原池浇淋工艺,将菌株FA-1应用于天津某酱油厂进行生产实验。其工艺流程如下:
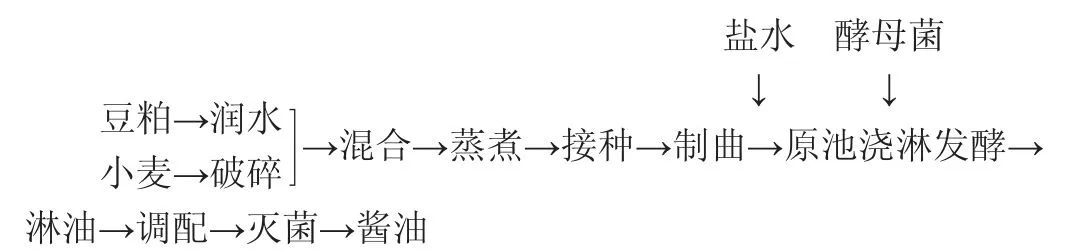
操作要点:豆粕与小麦质量比为6∶4,米曲霉沪酿3.042接种量为0.03%,32~34 ℃培养42 h制备成曲。曲料与18%盐水的比例为1.0∶2.5(kg∶L)进行发酵,每天浇淋一次,发酵10 d后添加酵母菌培养液(106CFU/mL,添加量100 mL/kg曲料),发酵温度为42 ℃,共发酵45 d。经淋油、调配、灭菌后,即得酱油。同时,以酱油厂原有酵母菌株As 1.039为对照,采用相同工艺制备酱油。
1.3.6 数据处理
采用SPSS 20.0软件进行数据处理,利用Origin 8.0和GraphPad Prism 7.0软件作图。
2 结果与分析
2.1 菌株FA-1的鉴定
2.1.1 菌株FA-1形态特征
菌株FA-1菌落平伏,呈白色奶油状,颜色均一且不透明,质地粘稠,表面湿润,边缘整齐。由图1可知,FA-1细胞近球形,出芽生殖,直径(3.5~8.5)μm,不形成假菌丝。

图1 菌株FA-1的细胞形态Fig.1 Cell morphology of strain FA-1
2.1.2 菌株FA-1生理生化特征
碳源是微生物生长繁殖的重要营养因素。不同的微生物因产生的酶系不同,所能利用的碳源也不相同。采用生长谱法测试菌株FA-1对不同碳源的发酵或同化能力,结果见表1。由表1可知,菌株FA-1可以发酵或同化D-葡萄糖、甘油、D-半乳糖、山梨醇等,不能发酵或同化利用D-棉子糖、L-阿拉伯糖、D-木糖、侧金盏花醇、木糖醇、肌醇、α-甲基-D-葡萄糖、N-乙酰葡糖胺、纤维二糖、D-乳糖(牛源)、D-麦芽糖、D-蔗糖、海藻糖、D-松三糖。

表1 菌株FA-1的碳源利用试验结果Table 1 Results of carbon source utilization tests of strain FA-1
2.1.3 菌株FA-1分子生物学鉴定
为进一步鉴定菌株FA-1的分类学地位,通过PCR扩增获得菌株FA-1的26S rDNA序列。将测序结果提交至NCBI,通过BLAST分析,采用MEGA 5.0构建系统发育树,结果见图2。由图2可知,菌株FA-1与鲁氏接合酵母(Zygosaccharomyces rouxii)聚于同一进化分支,其序列同源性为100%。综合对菌种的形态学观察、生理生化特性分析及基因序列的系统发育分析结果,菌株FA-1被鉴定为鲁氏接合酵母(Zygosaccharomyces rouxii)。
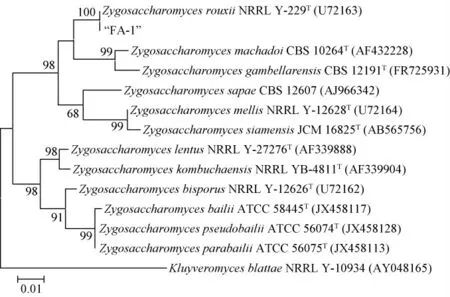
图2 基于26S rDNA序列菌株FA-1的系统发育树Fig.2 Phylogenetic tree of strain FA-1 based on 26S rDNA sequences
2.2 Z.rouxii FA-1生长特性及耐受性分析
菌株FA-1的生长特性和耐受性分析结果见图3。由图3-A可知,当培养温度在28~32 ℃时,Z.rouxiiFA-1的OD600nm值随着温度的升高而上升,当培养温度在32~42 ℃时,OD600nm值随着温度的升高而下降,且当温度升高至42 ℃,摇瓶发酵24 h时细胞浓度为0,菌株在此温度下可能出现延迟生长现象[18]。结果表明,Z.rouxiiFA-1的最适生长温度为32 ℃。
由图3-B可知,当pH值为3.5~4.0时,OD600nm值随pH值的增加逐渐升高,当pH值为4.0~6.0时,OD600nm值随pH值的增加而逐渐降低,结果表明,Z.rouxiiFA-1的最适生长pH值为4.0。酱油发酵过程中pH值在4.5~5.5之间,在此范围内Z.rouxiiFA-1均可正常生长。
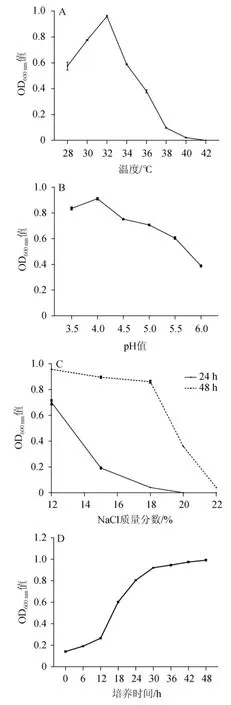
图3 菌株FA-1的生长特性和耐受性分析Fig.3 Growth characteristics and tolerance analysis of strain FA-1
由图3-C可知,在NaCl质量分数分别为12%~22%的酱油高盐培养基中,Z.rouxiiFA-1均能生长。随着NaCl质量分数的增加,Z.rouxiiFA-1的细胞浓度降低。随着发酵时间的延长,细胞浓度升高,菌株生长旺盛。当NaCl质量分数分别为20%和22%时,菌株发酵48 h的细胞浓度较发酵24 h时均有所升高,说明Z.rouxiiFA-1对高盐环境有一定的耐受性,可以在高盐发酵食品中生长,但细胞增殖速率受到一定程度的抑制,出现延迟生长现象。高盐稀态酱油的发酵周期为6个月,Z.rouxiiFA-1在高盐环境下的延迟生长现象并不会对酱油发酵造成影响。
由图3-D可知,培养0~12 h期间,OD600nm值增长较缓慢,Z.rouxiiFA-1处于延滞期,可能与酱油发酵培养基中较高的盐浓度(11%)有关;培养12~30 h期间,OD600nm值呈指数级增长,表明Z.rouxiiFA-1逐渐适应高盐环境后生长旺盛;培养30~48 h期间,OD600nm值趋于不变,表明Z.rouxiiFA-1生长稳定。
2.3 不同NaCl浓度的酱油发酵液中挥发性化合物分析
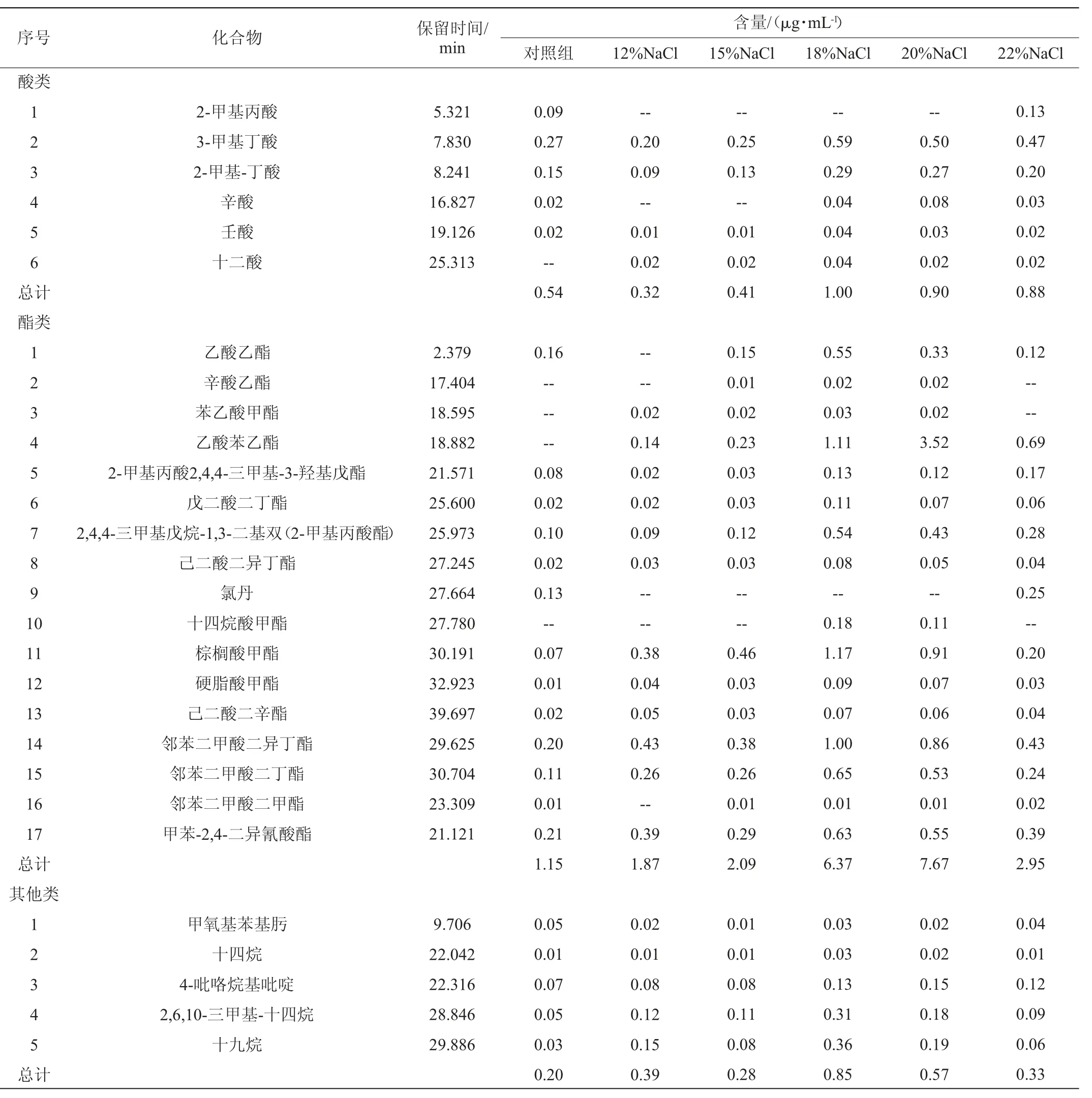
以未添加酵母菌的酱油发酵培养基为空白对照,采用HS-SPME-GC-MS对NaCl浓度分别为12%~22%的酱油发酵液中挥发性化合物进行检测,结果见表2。由表2可知,不同NaCl浓度的酱油发酵液中共检出56种挥发性化合物,包括醇类13种,酚类5种,醛酮类10种,酸类6种,酯类17种以及其他类5种。其中,NaCl质量分数为12%、15%、18%、20%和22%的酱油发酵液中分别检出45、48、50、51和50种挥发性化合物,对照组中共检出46种挥发性化合物。
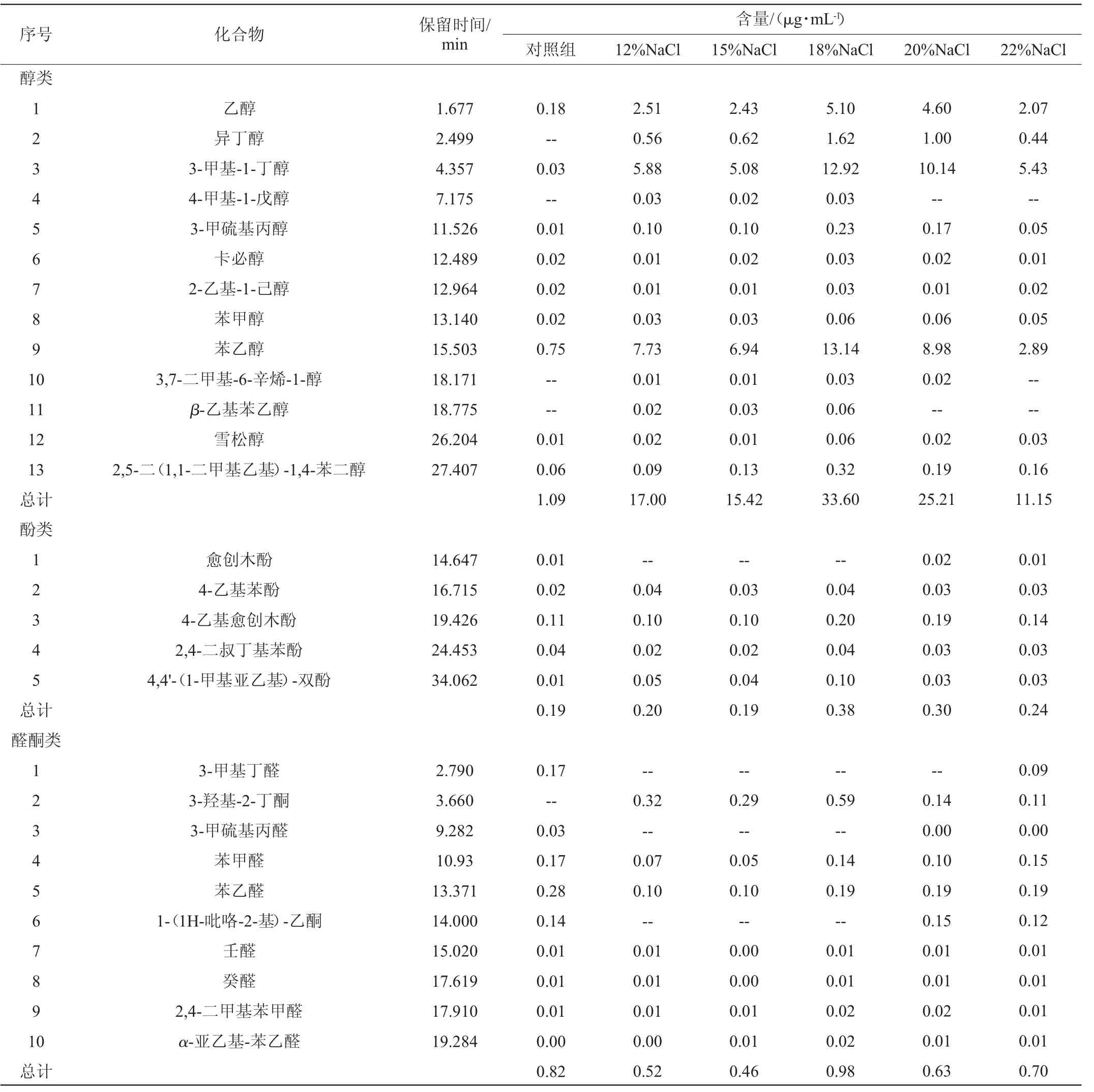
表2 不同NaCl浓度的酱油发酵液中挥发性化合物含量测定结果Table 2 Determination results of volatile compounds contents in soy sauce fermentation broth with different NaCl concentrations
续表
对酱油发酵液中各类挥发性化合物的含量进行分析,结果见图4。由图4可知,不同NaCl质量分数的酱油发酵液中醇类化合物的含量最高,且当NaCl质量分数为18%时更有利于醇类化合物的富集,其含量较未添加酵母菌的空白培养基提高了约30倍;当NaCl质量分数为20%时,酱油发酵液中醇类化合物的含量最高,同时含有较高的酯类化合物;当NaCl质量分数为22%时,醇类和酯类化合物的含量均有所降低。因此,将发酵液中NaCl质量分数调整为18%更有助于发挥Z.rouxiiFA-1产醇增香作用。
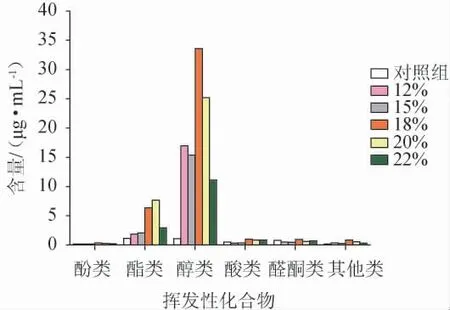
图4 不同NaCl浓度的酱油发酵液中各类别挥发性化合物含量分析结果Fig.4 Analysis results of different types of volatile compounds contents in soy sauce fermentation broth with different NaCl concentrations
由表2可知,当酱油发酵液中NaCl质量分数为18%时,醇类的含量为33.60 μg/mL,其中苯乙醇、3-甲基-1-丁醇、乙醇、异丁醇和3-甲硫基丙醇等为主,这些醇类形成了酱油的特征风味[19];研究表明,苯乙醇和3-甲硫基丙醇都是酱油中鲁氏接合酵母的关键风味代谢物[20]。Z.rouxiiFA-1发酵液中苯乙醇含量最高(39.11%),其具有特殊的玫瑰花香[21-22],适当提高酱油发酵醪液中苯乙醇的质量浓度,可以显著提升酱油醇香并改善口感[23]。姚婉婷等[24]通过在鲁氏接合酵母培养基中添加硫胺素,提高了苯乙醇的产量。Z.rouxiiFA-1发酵液中含有较高的3-甲基-1-丁醇(38.45%),3-甲基-1-丁醇具有水果和白兰地香气[25]。Z.rouxiiFA-1发酵液中乙醇含量为(15.18%),其不仅可以抑制细菌生长,还被认为是酱油醇香的主要来源,参与酱油中酯类物质的形成,共同构成了酱油的基础香气[26]。与对照组相比,Z.rouxiiFA-1可显著提升3-甲硫基丙醇的含量,ZHOU T等[27]研究表明,3-甲硫基丙醇可以有效提升酱油的鲜味。当酱油发酵液中NaCl浓度为18%时,酯类含量为6.37 μg/mL,且乙酸乙酯(8.63%)、乙酸苯乙酯(17.43%)和棕榈酸甲酯(18.37%)等含量较高。其中,乙酸乙酯具有明显的水果香气,高盐稀态酱油因发酵周期长,更有利于乙酸乙酯的积累[28]。酚类含量为0.38 μg/mL,其中4-乙基愈创木酚的含量最高(52.63%),是各种酒类(白酒、啤酒、葡萄酒)和酱油的重要呈香物质[29-30]。
综上,Z.rouxiiFA-1具有良好的产醇增香性能,可以应用于酱油生产过程中,改善产品风味和品质。
2.4 Z.rouxii FA-1在酱油酿造中的应用
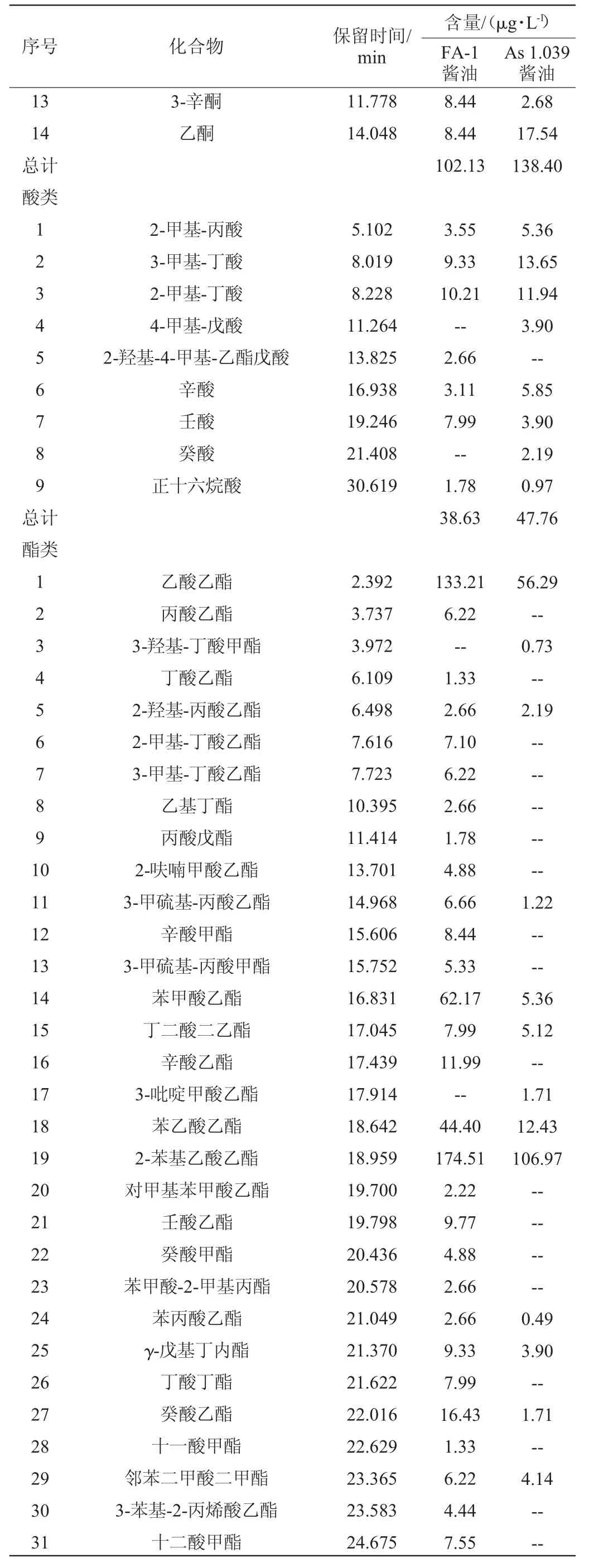
以酵母As 1.039为对照,采用Z.rouxiiFA-1酿造酱油。对两种酱油中的挥发性风味化合物进行GC-MS分析,结果见表3。由表3可知,两种酱油共检测出103种挥发性风味化合物,其中添加Z.rouxiiFA-1的酱油中共检测出92种挥发性化合物,总含量为3 174.95 μg/L,包括醇类19种(2 286.86 μg/L)、酚类3种(27.53 μg/L)、醛酮类11 种(102.13 μg/L)、酸类7种(38.63 μg/L)、酯类41种(663.41 μg/L)和其他类11种(56.39 μg/L);添加酵母As 1.039的对照组中共检测出71种挥发性化合物,总含量为1 468.32 μg/L,包括醇类17种(989.77 μg/L)、酚类4种(38.01 μg/L)、醛酮类13种(138.40 μg/L)、酸类8种(47.76 μg/L)、酯类21种(229.04 μg/L)和其他类8种(25.34 μg/L)。
结合表3可知,Z.rouxiiFA-1酿造酱油中醇类占72.03%,且醇类化合物的含量较对照组提高131.05%。醇类中苯乙醇、3-甲基-1-丁醇、乙醇的含量较高,这与Z.rouxiiFA-1在不同NaCl浓度的酱油发酵液中香气物质分析的结果一致,表明Z.rouxiiFA-1在复杂的酱油发酵过程中依然能发挥其优良的产醇特性。醇类物质可赋予酱油特有的醇香风味,同时作为酯化反应的前体物质在酱油长期发酵过程中与有机酸等形成酯类物质,是酱油香气成分的重要组成。
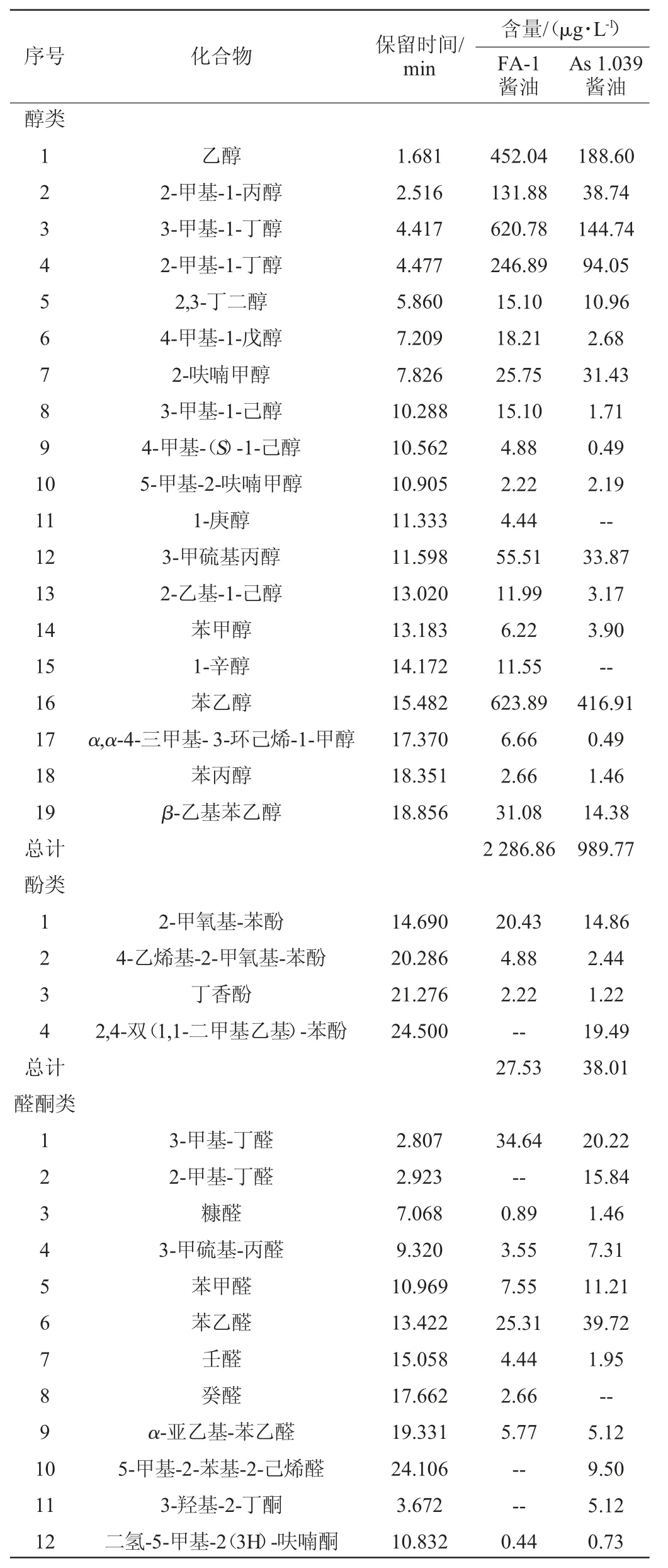
表3 两种酱油挥发性风味物质成分含量测定结果Table 3 Determination results of volatile compounds contents in two kinds of soy sauce
续表
除醇类之外,添加Z.rouxiiFA-1的实验组中酯类较对照组增加20种,含量增加189.65%。酯类是发酵食品中最重要的香气来源之一,具有良好的挥发性且人的嗅觉受体对其敏感度较高[31]。如有浓烈而甜的蜂蜜香气的苯乙酸乙酯,是酱油香味的主要贡献者之一[32-33];还有水果香的辛酸乙酯和苯甲酸乙酯;葡萄香的癸酸乙酯以及花果香的十二酸乙酯等酯类化合物有助于丰富酱油的香气成分[34]。因此,Z.rouxiiFA-1可作为产香酵母应用于酱油发酵领域。
3 结论
对酱醪中筛选的耐盐产香酵母菌FA-1进行鉴定,经形态观察、生理生化及分子生物学鉴定为鲁氏接合酵母(Zygosaccharomyces rouxii)。当NaCl质量分数为22%时Z.rouxiiFA-1仍能生长,表明此菌株对高盐环境有较好的耐受性,可以在高盐发酵食品中生长。Z.rouxiiFA-1在不同NaCl质量分数的酱油发酵液中共检出56种挥发性风味物质,且当NaCl质量分数为18%时,更有利于醇类化合物的富集。为验证Z.rouxiiFA-1在酱油发酵过程中对产品风味的改善,以添加酵母As 1.039为对照组进行酱油成品的制备,结果表明,添加Z.rouxiiFA-1的酱油成品中醇类物质占比最大(72.03%),其中苯乙醇、3-甲基-1-丁醇、乙醇的含量较高,且醇类和酯类化合物的含量分别较对照组提高131.05%和189.65%,有助于丰富酱油香气成分和改善产品品质。综上,Z.rouxiiFA-1具有良好的耐盐产香性能,适合在酱油酿造领域作为优良产香菌株应用。
